一种检测miRNA的生物探针及检测方法和用途与流程
本发明属于生物传感器技术领域,具体涉及一种检测mirna的生物探针和检测mirna的荧光生物传感器及其用途和mirna的检测方法。
背景技术:
microrna(mirna)是一类内源性的短非编码rna分子,长度为17-25个核苷酸,由两个rnaseiii酶(drosha和dicer)连续切割长的初级转录产物产生。mirna具有调控功能,广泛存在于真核生物中,多数mirna还具有高度保守性、时序性和组织特异性。到目前为止,在人类基因组中已发现超过1000种mirnas,因其具有抑制靶mrna转录、翻译或者能够剪切靶mrna并促进其降解的功能,所以在人类多种生物过程中起着至关重要的作用,如细胞生长、分化、凋亡和增殖等过程。越来越多的证据表明,mirna在人体组织或血液样本中的异常表达与各种疾病密切相关,如糖尿病、神经系统疾病,尤其是癌症。因此,准确的mirna定量分析对于疾病的发病机制和早期诊断的临床研究具有重要意义。
鉴于mirna定量分析的重要性,过去的几十年里已经开发了几种用于mirna分析的常规技术,如northern印迹、微阵列和逆转录聚合酶链反应(rt-pcr)等,这些方法准确度高、应用广泛,但也存在一些不足包括灵敏度不足,特异性差,样品制备繁琐,检测时间长等。
近年来,发展了许多新的mirna分析方法,如等温扩增策略应用于mirna的微量分析,具有简单、高灵敏度和高特异性的优势,包括杂交链式反应(hcr)、指数扩增反应(expar)、催化发夹组装(cha)、链置换扩增(sda)和滚环扩增(rca)。在这些策略中,expar由于其对短寡核苷酸的快速且有效的非线性扩增而在生物分析中受到越来越多的关注。由于使用具有链延伸特性的dna聚合酶和具有位点特异性dna切口活性的限制性核酸内切酶,expar具有等温、快速扩增动力学和高扩增效率的内在优点。因此,expar策略可以在恒温条件下几分钟内达到106~109倍的扩增,并且可以获得更低的检测限。如“sensitivedetectionofmicrornaincomplexbiologicalsamplesviaenzymaticsignalamplificationusingdnapolymerasecoupledwithnickingendonuclease”(bin-chengyin,yu-qiangliu,andbang-ceye*,[j].analchem,2013,85(23):11487-11492.)中公开的采用dna聚合酶与nicking核酸内切酶的信号放大反应用于mir-141的检测,最低检测限为1fm。然而,发明人发现上述文献中还存在一些不足,如其在方案1中,需要大量的分子信标和引物,提高了实验成本,实验设计较为复杂,且在两个循环过程中,仅是不断的打开分子信标,实现荧光发射,分子信标本身没有得到扩增,受到分子信标的浓度的限制,影响检测的灵敏度。
技术实现要素:
因此,本发明要解决的技术问题在于提供一种快速、简单、低成本、高检测灵敏度和特异性的用于检测mirna的生物探针和检测mirna的生物传感器及其用途和mirna的检测方法。
为此,本发明提供了以下技术方案:
一种检测mirna的生物探针,包括第一拱形探针和第二拱形探针;所述第一拱形探针和第二拱形探针均为两条单链线形分子的末端碱基互补杂交而成;
所述第一拱形探针包括靶mirna结合序列区,核酸内切酶识别序列区和dna聚合酶延伸序列区;所述第一拱形探针与靶mirna结合后经链延伸和剪切反应释放的寡核苷酸为二级引物;
所述第二拱形探针包括二级引物结合序列区,核酸内切酶识别序列区和dna聚合酶延伸报告序列区;所述第二拱形探针与二级引物结合后经链延伸和剪切反应释放报告序列。
在所述的检测mirna的生物探针中,所述第一拱形探针包括单链线形分子s1和s2,单链线形分子s1上沿着分子延伸方向依次包括靶mirna结合序列区(i),核酸内切酶识别序列区(ii)和dna聚合酶延伸序列区(iii);单链线形分子s2的末端分别与靶mirna结合序列区(i)和dna聚合酶延伸序列区(iii)部分互补杂交;和/或
所述第二拱形探针包括单链线形分子s3和s4,单链线形分子s3上沿着分子延伸方向依次包括二级引物结合序列区(i’),核酸内切酶识别序列区(ii’)和dna聚合酶延伸报告序列区(iii’);单链线形分子s4的末端分别与二级引物结合序列区(i’)和dna聚合酶延伸报告序列区(iii’)部分互补杂交。
一种检测mirna的生物传感器,包括所述的检测mirna的生物探针。
在所述的检测mirna的生物传感器中,包括a反应试剂和b反应试剂,所述a反应试剂包括:第一拱形探针、待测mirna和核酸内切酶缓冲液;所述b反应试剂包括:第二拱形探针、dna聚合酶、核酸内切酶、dntps、和rnase抑制剂。
优选的,所述b反应试剂还包括1×thermopol缓冲液
优选的,1×thermopol缓冲液为含20mm的tris-hno3,20mm的nh4no3,10mm的kno3,2mm的mg(no3)2,和体积百分比0.1%的tritonx-100的水溶液,ph8.8,25℃。
在所述的检测mirna的生物传感器中,还包括dna银纳米簇反应液:含有ag离子的缓冲液和/或nabh4水溶液。
优选的,含有ag离子的缓冲液为含有50-70μm的agno3的柠檬酸钠缓冲液,更优选的为含有60μm的agno3的柠檬酸钠缓冲液。所述的柠檬酸钠缓冲液为含有10mm柠檬酸钠和体积百分比0.05%tween20的水溶液,ph7.0,25℃。
优选的,nabh4的水溶液中,nabh4浓度为50-70μm,优选的为60μm。
优选的,所述第一拱形探针和第二拱形探针的摩尔比为(2-3):3;优选的,摩尔比为2:3。
在所述的检测mirna的生物传感器中,所述dna聚合酶为vent(exo-)dna聚合酶;所述核酸内切酶为nt.bstnbi核酸内切酶。
优选的,所述的核酸内切酶缓冲液为0.5×nt.bstnbi缓冲液,0.5×nt.bstnbi缓冲液为含25mm的tris-hno3,50mm的nano3,5mm的mg(no3)2,和0.5mm的dithiothreitol(二硫苏糖醇)的水溶液,ph7.9,25℃。
一种检测mirna的方法,包括利用所述的检测mirna的生物探针和/或所述的检测mirna的生物传感器进行检测。
所述的检测mirna的方法,包括如下步骤:
q1、将第一拱形探针、待测mirna和核酸内切酶缓冲液混合,孵育,然后冷却,使得靶mirna与第一拱形探针杂交;
q2、向q1中获得的反应液中加入第二拱形探针、dna聚合酶、核酸内切酶、dntps、rnase抑制剂和thermopol缓冲液,孵育;
q3、向q2中获得的反应液中加入含有ag离子的缓冲液,室温离心,收集上清液,第一次室温避光孵育,然后加入nabh4水溶液,第二次室温避光孵育,检测。
优选的,在q2步骤中,所述vent(exo-)dna聚合酶的量为1-3u,更优选的,为2.5u。
优选的,在q2步骤中,所述nt.bstnbi核酸内切酶的量为4-12u,更优选的,为10u。
优选的,在q2步骤中,所述dntps的浓度为400-600μm,更优选的,为500μm。
优选的,在q2步骤中,所述rnase抑制剂的量为12-17u,更优选的,为15u。
所述的检测mirna的方法,在所述q1步骤中,孵育时间为3-7min,孵育温度为93-97℃,然后冷却至50-60℃;优选的,孵育时间为5min,孵育温度为95℃,然后冷却至55℃。
所述的检测mirna的方法,在所述q2步骤中,孵育时间为40-90min,孵育温度为53-57℃;优选的,孵育时间为70min,孵育温度为55℃。
所述的检测mirna的方法,在所述q3步骤中,离心速率为11000-13000rpm,离心时间为4-6min;优选的,离心速率为12000rpm,离心时间为5min。
所述的检测mirna的方法,在所述q3步骤中,第一次室温避光孵育10-20min,第二次室温避光孵育50-70min;优选的,第一次室温避光孵育15min,第二次室温避光孵育60min。
所述的检测mirna的生物探针或所述的检测mirna的生物传感器在检测mirna中的用途。
本发明技术方案,具有如下优点:
1.本发明提供的一种检测mirna的生物探针,包括第一拱形探针和第二拱形探针;所述第一拱形探针和第二拱形探针均为两条单链线形分子的末端碱基互补杂交而成;所述第一拱形探针包括靶mirna结合序列区,核酸内切酶识别序列区和dna聚合酶延伸序列区;所述第一拱形探针与靶mirna结合后经链延伸和剪切反应释放的寡核苷酸为二级引物;所述第二拱形探针包括二级引物结合序列区,核酸内切酶识别序列区和dna聚合酶延伸报告序列区;所述第二拱形探针与二级引物结合后经链延伸和剪切反应释放报告序列;利用上述拱形探针即可进行mirna的检测,在检测的反应条件下,靶mirna与第一拱形探针结合形成杂交体后,经dna聚合酶和核酸内切酶的作用,经链延伸和剪切反应,释放放出二级引物和杂交体,杂交体继续经链延伸和剪切反应,继续释放二级引物和靶mirna与第一拱形探针的杂交体,形成一个循环,产生指数级的二级引物,产生的二级引物与第二拱形探针结合形成杂交体后,经dna聚合酶和核酸内切酶的作用,经链延伸和剪切反应,释放出报告序列和杂交体,杂交体继续经链延伸和剪切反应,继续释放报告序列和二级引物与第二拱形探针的杂交体,形成另一个循环,产生指数级的报告序列,该报告序列在agno3和nabh4存在下充当支架用于合成荧光银纳米簇,从而产生放大的荧光信号,检测灵敏度高,且上述检测过程中不需要分子信标,成本低,第一、二拱形探针设计简单,基于所述拱形探针介导的等温扩增方法简单,容易操作,经实验例验证,基于所述的检测mirna的生物探针介导的等温expar策略可以实现mirna的高灵敏度和高特异性检测。
2.本发明提供的检测mirna的生物传感器,包括a反应试剂和b反应试剂,所述a反应试剂包括:第一拱形探针、待测mirna和核酸内切酶缓冲液;所述b反应试剂包括:第二拱形探针、dna聚合酶、核酸内切酶、dntps和rnase抑制剂;取a反应试剂混合后可以先进行第一拱形探针与靶mirna的结合,然后取b反应试剂加入上述结合后的反应液中,可以进行释放二级引物的recyclei和释放报告序列的recycleii,实现快速的、低成本的、高灵敏度和特异性的检测mirna。
3.本发明提供的检测mirna的生物传感器,所述第一拱形探针和第二拱形探针的摩尔比为2:3,检测mirna具有更高的分析性能,包括提高灵敏度、特异性和检测效率等。
4.本发明提供的检测mirna的方法,包括如下步骤:q1、将第一拱形探针、待测mirna和核酸内切酶缓冲液混合,孵育,然后冷却,使得靶mirna与第一拱形探针杂交;q2、向q1中获得的反应液中加入第二拱形探针、dna聚合酶、核酸内切酶、dntps、rnase抑制剂和thermopol缓冲液,孵育;q3、向q2中获得的反应液中加入含有ag离子的缓冲液,室温离心,收集上清液,第一次室温避光孵育,然后加入nabh4水溶液,第二次室温避光孵育,检测;在上述步骤q1中,靶mirna与第一拱形探针杂交形成杂交体:在步骤q2中,步骤q1获得的杂交体,经链延伸和剪切反应,产生二级引物和靶mirna与第一拱形探的杂交体,所述杂交体继续经链延伸和剪切反应,形成recyclei,产生的指数级的二级引物触发recycleii,即二级引物与第二拱形探针杂交结合形成的杂交体,经链延伸和剪切反应,产生报告序列和二级引物与第二拱形探的杂交体,形成recycleii,产生的指数级的报告序列,在agno3和nabh4存在下充当支架用于合成荧光银纳米簇,从而产生放大的荧光信号,检测灵敏度高,检测限低至0.87fm,浓度检测范围为1fm至500fm,能够高特异性地区分同一mirna家族中的靶mirna和其它非靶mirna,且上述检测过程中不需要分子信标,成本低,基于所述拱形探针介导的等温扩增方法简单,容易操作。因此,本发明的检测mirna方法具有应用于生物分析和临床生物医学的巨大潜力。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
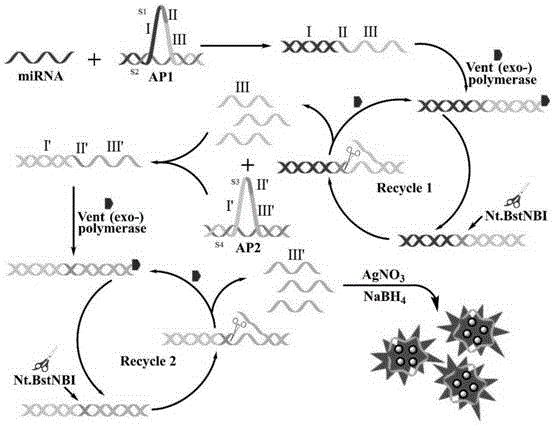
图1是本发明实施例1中的基于所述的检测mirna的生物探针介导的检测mirna的原理图;
图2是本发明实验例1中的基于第三拱形探针介导的检测mirna的原理图;
图3是本发明实验例1中方法a-e各自获得的反应产物的荧光强度检测结果;
图4是本发明实验例2中拱形探针ap1和ap2的浓度对本发明的检测mirna方法的分析性能的影响检测结果图;
图5是本发明实验例2中拱形探针ap2的浓度对本发明的检测mirna方法的分析性能的影响检测结果图;
图6是本发明实验例2中vent(exo-)dna聚合酶的量对本发明的检测mirna方法的分析性能的影响检测结果图;
图7是本发明实验例2中nt.bstnbi核酸内切酶的量对本发明的检测mirna方法的分析性能的影响检测结果图;
图8是本发明实验例2中扩增时间对本发明的检测mirna方法的分析性能的影响检测结果图;
图9是本发明实验例3中不同浓度mir-141的荧光强度检测结果图;
图10是本发明实验例3中本发明的检测mirna方法的检测灵敏度结果图;
图11是本发明实验例4中本发明的检测mirna方法的检测特异性结果图。
具体实施方式
下述实施例中涉及的材料和试剂均为市售产品,具体如下:
使用的hplc纯化的dna寡核苷酸(s1,s2,s3,s4,s5和s6)和hplc纯化的mirna(mir-141,mir-200a,mir-200b,mir-429和mir-199a)由南京金斯瑞生物科技有限公司(江苏,中国)合成。上述的寡核苷酸的序列列于下表1中,其中dna寡核苷酸s1和s2,s3和s4,及s5和s6均为基于mir-141设计的用于拱形探针的两条单链线形分子。第一拱形探针的制备:通过在1×thermopol缓冲液(为含20mmtris-hno3,20mmnh4no3,10mmkno3,2mmmg(no3)2,和体积百分比0.1%的tritonx-100的水溶液,ph8.8,25℃)中混合链s1和s2来制备第一拱形探针(ap1),95℃孵育10分钟,然后缓慢冷却至室温,即得。第二拱形探针(ap2)和第三拱形探针(ap3)采用探针ap1相同的方法制备。
表1使用的hplc纯化的寡核苷酸序列
核糖核酸酶(rnase)抑制剂购自生工生物工程股份有限公司(上海,中国)。vent(exo-)dna聚合酶、nt.bstnbi核酸内切酶和脱氧核苷酸三磷酸(dntps)购自纽英伦生物技术有限公司(北京,中国)。硝酸银(agno3)和硼氢化钠(nabh4)购自西格玛奥德里奇(上海)贸易有限公司(上海,中国)。其他化学品来自国药集团化学试剂有限公司(上海,中国),分析纯,使用前未经纯化。在使用前将所有mirna溶解于depc水中至适当浓度。
实施例1检测mirna的生物探针
本实施例提供了一种检测mirna的生物探针,包括第一拱形探针和第二拱形探针;所述第一拱形探针和第二拱形探针均为两条单链线形分子的末端碱基互补杂交而成;
所述第一拱形探针包括靶mirna结合序列区,核酸内切酶识别序列区和dna聚合酶延伸序列区;所述第一拱形探针与靶mirna结合后经链延伸和剪切反应释放的寡核苷酸为二级引物;
所述第二拱形探针包括二级引物结合序列区,核酸内切酶识别序列区和dna聚合酶延伸报告序列区;所述第二拱形探针与二级引物结合后经链延伸和剪切反应释放报告序列。
进一步的,所述第一拱形探针包括单链线形分子s1和s2(s1和s2的序列见表1或如seqidno.1-2所示),单链线形分子s1上沿着分子延伸方向依次包括靶mirna结合序列区(i)(表1中s1中带有单下划线的序列),核酸内切酶识别序列区(ii)(表1中s1中带有双下划线的序列)和dna聚合酶延伸序列区(iii)(表1中s1中带有点-短线下划线的序列);单链线形分子s2的末端分别与靶mirna结合序列区(i)和dna聚合酶延伸序列区(iii)部分互补杂交。
进一步的,所述第二拱形探针包括单链线形分子s3和s4(s3和s4的序列见表1或如seqidno.3-4所示),单链线形分子s3上沿着分子延伸方向依次包括二级引物结合序列区(i’)(表1中s3中带有波浪线的序列),核酸内切酶识别序列区(ii’)(表1中s3中带有双下滑线的序列)和dna聚合酶延伸报告序列区(iii’)(表1中s3中带有虚下滑线的序列);单链线形分子s4的末端分别与二级引物结合序列区(i’)和dna聚合酶延伸报告序列区(iii’)部分互补杂交。
基于上述检测mirna的生物探针介导的检测mirna的原理如图1所示:
第一拱形探针由单链线形分子s1和s2的末端碱基互补杂交而成。单链线形分子s1包括三个功能区:靶mirna结合序列区,核酸内切酶识别序列区和dna聚合酶延伸序列区。单链线形分子s2设计成单链线形分子s1的阻断剂,其两末端分别与单链线形分子s1的两末端部分碱基互补杂交,防止靶mirna与单链线形分子s1的杂交。
第二拱形探针与第一拱形探针的设计原理相同,第二拱形探针由单链线形分子s3和s4的末端碱基互补杂交而成。单链线形分子s3包括三个功能区:二级引物结合序列区,核酸内切酶识别序列区和dna聚合酶延伸序列区,二级引物为所述第一拱形探针与靶mirna结合后经链延伸和剪切反应释放的寡核苷酸为二级引物。单链线形分子s4设计成单链线形分子s3的阻断剂,其两末端分别与单链线形分子s3的两末端部分碱基互补杂交,防止二级引物与单链线形分子s3的杂交。
在检测的反应条件下,第一拱形探针接触靶mirna时,靶mirna会与第一拱形探针上的单链线形分子s2竞争性杂交,与单链s1特异性结合形成部分杂交的dna双链体。在vent(exo-)dna聚合酶和dntps的存在下,靶mirna沿着单链线形分子s1延伸形成完整的具有nt.bstnbi核酸内切酶特异性识别位点的dna双链体。然后,nt.bstnbi核酸内切酶识别dna双链体上的切割位点并切割上部dna单链,释放出的寡核苷酸作为二级引物,同时留下vent(exo-)dna聚合酶的新复制位点,在不断重复的链延伸和剪切反应(recyclei)下,产生大量的二级引物。二级引物与第二拱形探针上的单链线形分子s4竞争性杂交,与单链s3特异性结合形成部分杂交的dna双链体,在vent(exo-)dna聚合酶和dntps的辅助下启动新的链延伸反应,形成具有nt.bstnbi核酸内切酶特异性识别位点的dna双链体。得到的dna双链体又可被nt.bstnbi识别并切割,剪切后的部分dna双链体可作为模板进行下一轮的链延伸和剪切反应(recycleii),剪切后释放的短寡核苷酸可作为报告序列。上述机制,通过等温指数扩增反应产生指数级的报告序列,报告序列在agno3和nabh4存在下充当支架用于合成荧光银纳米簇,从而产生放大的荧光信号,实现mirna的高灵敏检测。
实施例2检测mirna的生物传感器
本实施例提供了一种检测mirna的生物传感器,包括实施例1制备的检测mirna的生物探针。
进一步的,包括a反应试剂和b反应试剂,所述a反应试剂包括:第一拱形探针,1000nm(nmol/l),5μl;
待测mirna,5μl;
核酸内切酶缓冲液,15μl;所述的核酸内切酶缓冲液为0.5×nt.bstnbi缓冲液,0.5×nt.bstnbi缓冲液为含25mm(mmol/l)的tris-hno3,50mm的nano3,5mm的mg(no3)2,和0.5mm的dithiothreitol(二硫苏糖醇)的水溶液,ph7.9,25℃;
所述b反应试剂包括:
第二拱形探针,1500nm,5μl;
dna聚合酶,1u/μl,2.5μl;所述dna聚合酶为vent(exo-)dna聚合酶
核酸内切酶,4u/μl,2.5μl;所述核酸内切酶为nt.bstnbi核酸内切酶;
dntps,5000μm,5μl;
rnase抑制剂,3u/μl,5μl;
1×thermopol缓冲液,5μl;所述的1×thermopol缓冲液为含20mm的tris-hno3,20mm的nh4no3,10mm的kno3,2mm的mg(no3)2和体积百分比0.1%tritonx-100的水溶液,ph8.8,25℃。
dna银纳米簇反应液:含有ag离子的缓冲液为含有60μm的agno3的柠檬酸钠缓冲液,25μl;所述的柠檬酸钠缓冲液为含有10mm柠檬酸钠和体积百分比0.05%tween20的水溶液,ph7.0,25℃;
nabh4的水溶液,60μm,25μl。
实施例3检测mirna的生物传感器
本实施例提供了一种检测mirna的生物传感器,包括实施例1制备的检测mirna的生物探针。
进一步的,包括a反应试剂和b反应试剂,所述a反应试剂包括:第一拱形探针,1500nm,5μl;
待测mirna,3μl;
核酸内切酶缓冲液,17μl;所述的核酸内切酶缓冲液为0.5×nt.bstnbi缓冲液,0.5×nt.bstnbi缓冲液为含25mm的tris-hno3,50mm的nano3,5mm的mg(no3)2,和0.5mm的dithiothreitol(二硫苏糖醇)的水溶液,ph7.9,25℃;
所述b反应试剂包括:
第二拱形探针,1500nm,5μl;
dna聚合酶,1u/μl,3μl;所述dna聚合酶为vent(exo-)dna聚合酶
核酸内切酶,6u/μl,2μl;所述核酸内切酶为nt.bstnbi核酸内切酶;
dntps,6000μm,5μl;
rnase抑制剂,4u/μl,3μl;
1×thermopol缓冲液,7μl;所述的1×thermopol缓冲液为含20mm的tris-hno3,20mm的nh4no3,10mm的kno3,2mm的mg(no3)2,和0.1%tritonx-100的水溶液,ph8.8,25℃。
dna银纳米簇反应液:含有ag离子的缓冲液为含有70μm的agno3的柠檬酸钠缓冲液,25μl;所述的柠檬酸钠缓冲液为含有10mm柠檬酸钠和0.05%tween20的水溶液,ph7.0,25℃;
nabh4的水溶液,70μm,25μl。
实施例4检测mirna的生物传感器
本实施例提供了一种检测mirna的生物传感器,包括实施例1制备的检测mirna的生物探针。
进一步的,包括a反应试剂和b反应试剂,所述a反应试剂包括:第一拱形探针,1000nm,5μl;
待测mirna,5μl;
核酸内切酶缓冲液,15μl;所述的核酸内切酶缓冲液为0.5×nt.bstnbi缓冲液,0.5×nt.bstnbi缓冲液为含25mm的tris-hno3,50mm的nano3,5mm的mg(no3)2,和0.5mm的dithiothreitol(二硫苏糖醇)的水溶液,ph7.9,25℃;
所述b反应试剂包括:
第二拱形探针,1500nm,5μl;
dna聚合酶,1u/μl,1μl;所述dna聚合酶为vent(exo-)dna聚合酶
核酸内切酶,4u/μl,1μl;所述核酸内切酶为nt.bstnbi核酸内切酶;
dntps,4000μm,5μl;
rnase抑制剂,8.5u/μl,2μl;
1×thermopol缓冲液,8.5μl;所述的1×thermopol缓冲液为含20mm的tris-hno3,20mm的nh4no3,10mm的kno3,2mm的mg(no3)2,和0.1%tritonx-100的水溶液,ph8.8,25℃。
dna银纳米簇反应液:含有ag离子的缓冲液为含有50μm的agno3的柠檬酸钠缓冲液,25μl;所述的柠檬酸钠缓冲液为含有10mm柠檬酸钠和0.05%tween20的水溶液,ph7.0,25℃;
nabh4的水溶液,50μm,25μl。
实施例5检测mirna的方法
本实施例提供了一种检测mirna的方法,利用实施例1制备的生物探针和实施例2制备的检测mirna的生物传感器,对待测mir-141进行检测,包括如下步骤:
(1)取实施例2中的a反应试剂,配制成反应混合物25μl,混合物中第一拱形探针200nm,然后置于95℃下孵育5min后缓慢冷却至55℃;
(2)向步骤(1)中获得的反应液中加入实施例2中的b反应试剂,配制得到总体积为50μl的混合液,其中含约100nm第一拱形探针(虽然步骤(1)中的反应液中存在第一拱形探针与靶mirna杂交,但由于靶mirna的量极低(0.87fm至500fm),与靶mirna杂交的第一拱形探针的量可以忽略不计,因此,上述配制的混合液中第一拱形探针的初始浓度约为100nm)、150nm第二拱形探针、2.5u的vent(exo-)dna聚合酶、10u的nt.bstnbi核酸内切酶、500μm的dntps、15u的rnase抑制剂、0.5×nt.bstnbi缓冲液15μl和1×thermopol缓冲液5μl,然后置于55℃下孵育70min后,终止等温指数扩增反应,将所得扩增产物4℃储存备用;
(3)将步骤(2)中得到的扩增产物与实施例2中的25μl含60μmagno3柠檬酸钠缓冲液混合,然后室温(25℃)12000rpm离心5分钟后,小心收集上清液并室温(25℃)避光孵育15分钟,然后向其中加入60μmnabh4的水溶液25μl得到总体积为100μl的溶液,室温(25℃)避光孵育60分钟,然后进行检测。
本实施例中使用如下方法对上述步骤(3)中获得的反应产物进行荧光检测,使用带黑色384孔微量滴定板(781209,greinerbio-one,frickenhausen,德国)的
实施例6检测mirna的方法
本实施例提供了一种检测mirna的方法,利用实施例1制备的生物探针和实施例3制备的检测mirna的生物传感器,对待测mir-141进行检测,包括如下步骤:
(1)取实施例3中的a反应试剂,配制成反应混合物25μl,混合物中第一拱形探针300nm,然后置于93℃下孵育3min后缓慢冷却至50℃;
(2)向步骤(1)中获得的反应液中加入实施例3中的b反应试剂,配制得到总体积为50μl的混合液,其中含约150nm第一拱形探针(虽然步骤(1)中的反应液中存在第一拱形探针与靶mirna杂交,但由于靶mirna的量极低(0.87fm至500fm),与靶mirna杂交的第一拱形探针的量可以忽略不计,因此,上述配制的混合液中第一拱形探针的初始浓度约为150nm)、150nm第二拱形探针、3u的vent(exo-)dna聚合酶、12u的nt.bstnbi核酸内切酶、600μm的dntps、12u的rnase抑制剂、0.5×nt.bstnbi缓冲液17μl和1×thermopol缓冲液7μl,然后置于53℃下孵育40min后,终止等温指数扩增反应,将所得扩增产物4℃储存备用;
(3)将步骤(2)中得到的扩增产物与实施例3中的25μl含50μmagno3柠檬酸钠缓冲液混合,然后室温(23℃)11000rpm离心4分钟后,小心收集上清液并室温(23℃)避光孵育10分钟,然后向其中加入50μmnabh4的水溶液25μl得到总体积为100μl的溶液,室温(23℃)避光孵育50分钟,然后进行检测。
本实施例中使用如下方法对上述步骤(3)中获得的反应产物进行荧光检测,使用带黑色384孔微量滴定板(781209,greinerbio-one,frickenhausen,德国)的
实施例7检测mirna的方法
本实施例提供了一种检测mirna的方法,利用实施例1制备的生物探针和实施例4制备的检测mirna的生物传感器,对待测mir-141进行检测,包括如下步骤:
(1)取实施例4中的a反应试剂,配制成反应混合物25μl,混合物中第一拱形探针200nm,然后置于97℃下孵育7min后缓慢冷却至60℃;
(2)向步骤(1)中获得的反应液中加入实施例4中的b反应试剂,配制得到总体积为50μl的混合液,其中含100nm第一拱形探针(虽然步骤(1)中的反应液中存在第一拱形探针与靶mirna杂交,但由于靶mirna的量极低(0.87fm至500fm),与靶mirna杂交的第一拱形探针的量可以忽略不计,因此,上述配制的混合液中第一拱形探针的初始浓度约为100nm)、100nm第二拱形探针、1u的vent(exo-)dna聚合酶、4u的nt.bstnbi核酸内切酶、400μm的dntps、17u的rnase抑制剂、0.5×nt.bstnbi缓冲液15μl和1×thermopol缓冲液8.5μl,然后置于57℃下孵育90min后,终止等温指数扩增反应,将所得扩增产物4℃储存备用;
(3)将步骤(2)中得到的扩增产物与实施例4中的25μl含70μmagno3柠檬酸钠缓冲液混合,然后室温(27℃)13000rpm离心6分钟后,小心收集上清液并室温(27℃)避光孵育20分钟,然后向其中加入70μmnabh4的水溶液25μl得到总体积为100μl的溶液,室温(27℃)避光孵育70分钟,然后进行检测。
本实施例中使用如下方法对上述步骤(3)中获得的反应产物进行荧光检测,使用带黑色384孔微量滴定板(781209,greinerbio-one,frickenhausen,德国)的
实验例1
1.样品和材料
待测样品:含有浓度为500fm的mir-141的水溶液。不含mir-141的水做空白对照品。
第三拱形探针ap3:包括单链线形分子s5和s6(s5和s6的序列见表1或如seqidno.5-6所示),单链线形分子s5上沿着分子延伸方向依次包括靶mirna结合序列区(i”)(表1中s5中带有单下划线的序列),核酸内切酶识别序列区(ii”)(表1中s5中带有双下划线的序列)和dna聚合酶延伸报告序列区(iii”)(表1中s5中带有点-短线下划线的序列);单链线形分子s6的末端分别与靶mirna结合序列区(i”)和dna聚合酶延伸报告序列区(iii”)部分互补杂交。
2.实验方法
取步骤1中的待测样品或空白对照品按照下述方法分别检测mir-141。下述方法中涉及的步骤(2)中的配制得到总体积为50μl的混合液中涉及的第一拱形探针ap1浓度约为100nm,第二拱形探针ap2浓度为100nm,第三拱形探针ap3的浓度为100nm。
方法a:与实施例5的方法基本相同,区别仅在于,待测的样品为空白对照品,同时步骤(2)中的反应混合物中未加入vent(exo-)和nt.bstnbi。
方法b:与实施例5的方法基本相同,区别仅在于,待测的样品为空白对照品,同时其中所使用的探针仅为第三拱形探针ap3。
方法c:与实施例5的方法基本相同,区别仅在于,待测的样品为空白对照品。
方法d:与实施例5的方法基本相同,区别仅在于,其中所使用的探针仅为第三拱形探针ap3。第三拱形探针ap3介导的等温扩增用于mirna检测的原理图如图2所示。
方法e:按照实施例5的方法实施。
3.实验结果
方法a-e各自获得的反应产物的荧光强度检测结果如图3所示:方法a中仅存在拱形探针ap1和ap2时,荧光强度几乎可以忽略不计(曲线a),表明初始状态下两探针间较低的亲和力。
比较曲线b、c和d可以发现,方法b中在没有靶mirna(mir-141)的情况下使用探针ap3、聚合酶和核酸内切酶检测获得的反应产物的荧光强度(曲线b)与方法c中在没有靶mirna的情况下使用探针ap1、探针ap2、聚合酶和核酸内切酶检测获得的反应产物的荧光强度(曲线c)相当,仅略高于方法a的荧光强度(曲线a),而方法d中在加入靶mirna的情况下使用探针ap3、聚合酶和核酸内切酶检测获得的反应产物的荧光强度显著(曲线d),表明不管是等温线性扩增反应还是等温指数扩增反应,反应的触发都依赖于引物靶mirna。方法d中荧光强度(曲线d)的显著增加主要是由于靶mir-141与拱形探针ap3的杂交引发了等温线性扩增反应并因此产生了大量报告序列,所产生的报告序列充当支架用于合成荧光银纳米簇,进而导致了荧光强度增加。
比较曲线d和e可以发现,相比方法d的荧光强度,方法e中在加入靶mirna的情况下使用探针ap1、ap2、聚合酶和核酸内切酶检测获得的反应产物的荧光强度更显著(曲线e),出现这一现象的主要原因是在于方法e采用了等温指数扩增策略,其通过核酸内切酶切割dna双链体可以产生大量的二级引物,这些二级引物可以参与更多的等温扩增循环,进而产生指数级报告序列,从而进一步地增加荧光强度。上述结果清晰地表明,本发明的检测mirna的方法可以大幅提高扩增效率,从而提高mirna的检测灵敏度。
实验例2
本发明的检测mirna的方法的分析性能很大程度上取决于拱形探针的浓度,vent(exo-)dna聚合酶和nt.bstnbi核酸内切酶的量以及扩增时间的综合影响。因此,本发明系统地研究了这些重要的实验参数对本发明的检测mirna的方法的分析性能的影响。
1、本实验例考察了拱形探针的浓度对本发明的检测mirna方法的分析性能的影响。
(1)拱形探针ap1和ap2浓度对分析性能的影响
取实验例1中的含mir-141的待测样品和空白对照品分别按照实施例5的方法进行mirna的检测,区别仅在于,步骤(2)中的配制得到的混合液中所使用的拱形探针ap1和ap2的浓度相同(由于靶mirna的量极低(0.87fm至500fm),与靶mirna杂交的第一拱形探针的量可以忽略不计,因此,将步骤(2)中的配制的混合液中第一拱形探针的初始浓度看作是与第二拱形探针的浓度相同的),两者的浓度依次选择为50nm、75nm、100nm、125nm和150nm。待测样品和空白对照品重复检测3次。荧光响应信号背景比f/f0值检测结果(其中f对应存在mir-141时的荧光强度,f0对应不存在mir-141时的荧光强度)如图4所示,从中可以看出,随着拱形探针浓度从50nm增加到150nm,f/f0值逐渐增加,荧光强度逐渐增加。这一现象与实验理论相符,即加入到反应中的拱形探针更多,就会发生更多的等温指数扩增循环反应,从而产生更多的荧光dna银纳米簇。然而,当拱形探针浓度超过100nm时,荧光强度逐渐降低。这种下降可能是由于高浓度的拱形探针引起的空间位阻增加导致,增加的空间位阻对expar产生了抑制。
(2)拱形探针ap2浓度对分析性能的影响
取实验例1中的含mir-141的待测样品和空白对照品分别按照实施例5的方法进行mirna的检测,区别仅在于,步骤(2)中的配制得到的混合液中,所使用的拱形探针ap1的浓度固定为100nm(由于靶mirna的量极低(0.87fm至500fm),与靶mirna杂交的第一拱形探针的量可以忽略不计,因此,将步骤(2)中的配制的混合液中第一拱形探针的初始浓度看作是100nm),ap2的浓度依次选择为75nm、100nm、125nm、150nm和175nm。重复检测3次。荧光响应信号背景比f/f0值检测结果如图5所示,从中可以看出,150nm的ap2显示出最高的信号背景比(f/f0),表明更好的检测性能。因此,ap1的浓度为100nm、ap2的浓度为150nm为最优选。
2、本实验例考察了聚合酶和核酸内切酶的量对本发明的检测mirna方法的分析性能的影响。
(1)vent(exo-)dna聚合酶的量
取实验例1中的含mir-141的待测样品按照实施例5的方法进行mirna的检测,区别仅在于,vent(exo-)dna聚合酶的量依次选择为1u、1.5u、2u、2.5u和3u。重复检测3次。荧光强度检测结果如图6所示,从中可以看出,当vent(exo-)dna聚合酶的量从1u增加到3u时,荧光强度相应增加,在2.5u后趋于平稳。因此,vent(exo-)dna聚合酶的量选择2.5u。
(2)nt.bstnbi核酸内切酶的量
取实验例1中的含mir-141的待测样品按照实施例5的方法进行mirna的检测,区别仅在于,nt.bstnbi核酸内切酶的量依次选择为4u、6u、8u、10u和12u。重复检测3次。荧光强度检测结果如图7所示,从中可以看出,nt.bstnbi核酸内切酶的量从4u梯度变化为12u,荧光信号变化不显著。因此,nt.bstnbi核酸内切酶的量选择为10u。
3、本实验例考察了扩增时间对本发明的检测mirna方法的分析性能的影响。
取实验例1中的含mir-141的待测样品按照实施例5的方法进行mirna的检测,区别仅在于,在步骤(2)中的孵育时间依次选择40min、50min、60min、70min、80min和90min。重复检测3次。荧光强度检测结果如图8所示,从中可以看出,荧光强度随着孵育时间从40到90分钟不断增加,并在70分钟达到饱和。因此,选择70分钟作为最佳的扩增反应时间。
实验例3
本实验例考察了本发明的检测mirna方法的检测灵敏度
配制不同浓度mir-141的水溶液样品,浓度依次为0,1fm,2fm,5fm,20fm,50fm,200fm和500fm,然后按照实施例5中相同的方法对上述不同浓度mir-141的样品进行检测。
荧光强度检测结果如图9所示,图中曲线a-h依次对应(a)0,(b)1fm,(c)2fm,(d)5fm,(e)20fm,(f)50fm,(g)200fm和(h)500fm,由图中可以看出,荧光强度随着靶mir-141浓度从0到500fm的增加而增加,表明荧光dna银纳米簇的量高度依赖于靶mirna的浓度,同时间接证实了只有通过靶mirna与拱形探针的相互作用才能触发等温expar,加入到反应中的mir-141浓度越高,expar循环次数越多,产生的荧光dna银纳米簇也就越多。图10为荧光强度(610nm)和mir-141浓度之间的指数关系,插图显示荧光强度与mir-141浓度的对数值的线性关系,由插图中可以看到,荧光强度和mir-141浓度的对数值之间具有良好的线性关系,线性范围为1fm至500fm,相关系数为0.9947,线性回归方程为f=447.86+611.16log10c,检测限为0.87fm,其中f和c分别为荧光强度和mir-141浓度。
利用上述本发明的检测mirna方法的检测灵敏度结果与其他报道的mirna测定方法进行了比较,详细的比较结果见下表2,通过比较发现,本发明的检测mirna方法的灵敏度优于等温expar辅助金纳米粒子(aunp)扩增比色法、发夹探针介导的expar结合催化发夹组装(cha)荧光法、发夹探针介导的级联expar化学发光法、与目标触发链置换扩增(sda)结合expar化学发光法的灵敏度相当。上述结果清楚地表明,本发明的拱形探针介导的等温expar策略能够高灵敏地检测mirna。综上,本发明检测mirna方法能够高灵敏度检测mirna。
表2.基于expar策略的不同mirna检测方法的比较
续表2
实验例4
本实验例考察了本发明的检测mirna方法的检测特异性
由于具有高度的序列同源性,高特异性地区分mirna家族成员之间的差异一直是具有挑战性的。mir-141属于mir-200家族,mir-200家族由五个高度相似的mirna组成,彼此间仅相差2-5个核苷酸,为评估mirna检测法的特异性提供了理想的模型。因此,选择mir-200家族的mir-200a,mir-200b和mir-429和mir-199a进行特异性分析。
按照本发明实施例5的方法对不同mirna的水溶液样品进行检测,其中mir-200a样品,mir-200b样品和mir-429样品和mir-199a样品中各自的mirna的浓度均为1pm,mir-141样品中的mir-141浓度为500fm。荧光强度检测结果如图11所示,可以看出,mir-141(浓度为500fm)的荧光强度比mir-429(五碱基错配)的荧光强度高约6.2倍,比mir-200b(四碱基错配)的荧光强度高5.6倍,比mir-200a(两碱基不匹配)高4.7倍。此外,与空白水溶液(不含mirna)相比,mir-199a显示出几乎相同的荧光响应。上述结果表明,本发明的检测mirna方法具有从同一mirna家族中区分靶mirna与其它非靶mirna的良好性能,拥有用于单核苷酸多态性分析的巨大潜力。
实验例5
本实验例考察了本发明的检测mirna方法检测人血清中的mir-141
样品:人血清由江苏省江原医院(江苏,中国)提供,收集自健康志愿者,使用前4℃保存。用20mmtris-hno3缓冲液(为含50mm的nano3,10mm的kno3,和2mm的mg(no3)2的水溶液,ph7.4,25℃)将人血清稀释50倍。在稀释的人血清中分别加入三种浓度的mir-141(5fm,50fm和500fm),同时准备等体积的未加入mir-141人血清作为对照。
采用本发明实施例5的方法对上述样品进行检测,进行回收率实验,结果见下表3,如表3所示,加入三种不同浓度mir-141的人血清样品的平均回收率分别为96.80%、102.46%和99.77%,相对标准偏差(rsd)分别为5.13%、5.76%和6.71%,证明了本发明的检测mirna方法在真实生物样品中测定mir-141的可行性。
表350倍稀释的人血清中mir-141的测定(n=3)
综上,本发明的基于拱形探针介导的等温expar结合dna银纳米簇的mirna检测法,该方法能够实现简单、免标记和超灵敏的mirna检测。通过使用设计的第一、二拱形探针及vent(exo-)dna聚合酶和nt.bstnbi核酸内切酶的辅助,靶mirna能够在等温条件下触发expar,几分钟内产生大量的报告序列。产生的报告序列充当支架用于合成荧光dna银纳米簇,所合成的dna银纳米簇作为免标记的信号指示剂进行信号输出。由于expar的高扩增效率,该方法对mir-141具有超高的检测灵敏度,检测限低至0.87fm,浓度检测范围为1fm至500fm。此外,该方法能够高特异性地区分同一mirna家族中的靶mirna和其它非靶mirna。上述的优势使得本发明的检测mirna方法具有应用于生物分析和临床生物医学的巨大潜力。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
sequencelisting
<110>江苏省原子医学研究所
<120>一种检测mirna的生物探针及检测方法和用途
<130>wxha201900076
<160>6
<170>patentinversion3.3
<210>1
<211>53
<212>dna
<213>人工合成
<400>1
tcaacatcatactgatatcctttcttgactcccatctttaccagacagtgtta53
<210>2
<211>42
<212>dna
<213>人工合成
<400>2
taacactgttttttttttttttttttttttttttgatgttga42
<210>3
<211>53
<212>dna
<213>人工合成
<400>3
gggaagggtgggtagggaaacatcttgactctcaacatcatactgatatcctt53
<210>4
<211>42
<212>dna
<213>人工合成
<400>4
aaggatatcttttttttttttttttttttttttacccttccc42
<210>5
<211>53
<212>dna
<213>人工合成
<400>5
gggaagggtgggtagggaaacatcttgactcccatctttaccagacagtgtta53
<210>6
<211>42
<212>dna
<213>人工合成
<400>6
taacactgtttttttttttttttttttttttttacccttccc42
- 还没有人留言评论。精彩留言会获得点赞!