一种肿瘤来源外泌体及其制备方法和用途与流程
本发明涉及免疫治疗技术领域,具体涉及采用外泌体进行免疫治疗,尤其涉及一种肿瘤来源外泌体及其制备方法和用途。
背景技术:
外泌体(exosome)是由细胞膜内陷后通过一系列复杂的机制形成多囊泡小体,然后多囊泡小体与细胞膜融合释放至细胞外得到的,大小为30~100nm。外泌体内含蛋白质、核酸以及脂类物质,其可以作为上述物质的运输及存储工具。外泌体存在于血液、尿液、唾液等多种体液中,在被靶细胞内吞后,内容物通过多种机制发挥功能。
肿瘤细胞能够分泌大量的外泌体(称为肿瘤外泌体),其所包含的肿瘤特异性抗原既可作为肿瘤诊断标志物进行早期临床诊断,还可用于肿瘤免疫治疗的疗效评估及预后判定,逐渐成为恶性肿瘤的诊断工具。早期研究发现,肿瘤外泌体在抗肿瘤免疫应答中具有促进作用,其可以作为一种抗原载体将肿瘤特异性抗原通过树突状细胞提呈给cd8+t细胞,从而引起肿瘤杀伤作用。相关研究表明,在小鼠体外实验中,肿瘤外泌体表面的肿瘤排斥性抗原可以促进mhcⅰ类限制性的t细胞增殖;而在小鼠体内实验中,肿瘤外泌体可以通过激活依赖t细胞的交叉保护作用来清除自体或同种异体的肿瘤。因此,肿瘤外泌体可以作为肿瘤排斥性抗原的来源用于肿瘤免疫治疗。
但是,在对恶性肿瘤晚期患者的研究中同时发现,外泌体也可能抑制肿瘤特异性的免疫应答。与肿瘤细胞产生的细胞因子类似,肿瘤外泌体能够调节肿瘤的发展、转移及血管的生成,例如:黑色素瘤外泌体可以诱导骨髓干细胞向促进肿瘤转移的表型分化,还可以通过诱导血管内皮细胞产生tnfβ,引起淋巴管内皮细胞介导的免疫耐受反应。同时,外泌体还可以把自身的瘤源性受体、蛋白质及rna传递给受体细胞而产生有利于肿瘤生长的微环境;肿瘤外泌体表面存在免疫抑制分子,这些分子可以通过多种途径负性调节免疫应答。
树突细胞(dcs)是专职抗原提呈细胞,具有处理抗原、提呈抗原和激活初始t淋巴细胞的功能。dcs存在于外周组织中,大部分为未成熟状态,dc可以摄取抗原并将其加工为小的多肽片段,然后激活未成熟的dc变为成熟的dc。
肿瘤微环境中,肿瘤外泌体可以降低dcs的分化和成熟。在小鼠模型中,肿瘤外泌体可降低骨髓前体细胞向dc分化,更易于诱导成骨髓来源的抑制性细胞(mdscs);在小鼠体内外实验中,乳腺癌细胞产生的外泌体作用于cd11b+的骨髓前体细胞能够抑制其向dc的分化;在人的体内实验中,肿瘤外泌体可以抑制单核细胞的分化及成熟。此外,肿瘤外泌体还会降低dcs的成熟和抗原提呈功能,相关研究发现,人胰腺癌细胞分泌的外泌体中的mir-212-3p可以引起mhcii的表达,诱导dcs的免疫耐受从而产生免疫抑制效应。也就是说,肿瘤外泌体可以通过调节dcs的分化、成熟和抗原提呈功能而产生免疫抑制效应,也就极大地限制了将肿瘤外泌体直接作为肿瘤抗原的应用。
因此,有必要提供一种外泌体,其能够直接作为dc细胞的肿瘤抗原、抑制肿瘤生长。
技术实现要素:
为了克服上述问题,本发明人进行了锐意研究,结果发现:将正常分泌的外泌体经过水浴加热处理或化学试剂处理,可以灭活外泌体,使得其丧失本身的促转移特性,解除对dc细胞的抑制作用;将灭活的外泌体与dc细胞制备成用于预防接种的药物组合物,能够显著抑制肿瘤的生长,增加瘤内浸润淋巴细胞的含量,尤其是杀伤性淋巴细胞的含量,增加所述药物组合物的效果,从而完成了本发明。
具体来说,本发明的目的在于提供以下方面:
第一方面,提供了一种肿瘤来源外泌体,其中,所述外泌体通过对正常分泌的外泌体进行灭活处理得到。
第二方面,提供了一种第一方面所述肿瘤来源外泌体的制备方法,其中,所述方法包括以下步骤:
步骤1,获取正常分泌的肿瘤来源外泌体;
步骤2,对步骤1获取的肿瘤来源外泌体进行检测;
步骤3,对步骤2检测后的肿瘤来源外泌体进行灭活处理。
第三方面,提供了一种第一方面所述的肿瘤来源外泌体或第二方面所述方法制备的肿瘤来源外泌体在制备治疗肿瘤药物方面的用途。
第四方面,提供了一种用于预防接种的药物组合物,其中,所述药物组合物包括dc细胞和第一方面所述的肿瘤来源外泌体或第二方面所述方法制备的肿瘤来源外泌体。
第五方面,提供了一种第四方面所述药物组合物的制备方法。
本发明所具有的有益效果包括:
(1)本发明所提供的肿瘤来源外泌体,丧失了本身的促转移特性,解除了其对dc细胞的抑制作用,能够直接作为dc处理的肿瘤抗原,激活免疫系统,抑制肿瘤的生长;
(2)本发明所提供的肿瘤来源外泌体的处理方法简单,易于实现,成本低廉,适合规模化应用;
(3)本发明所提供的用于预防接种的药物组合物,能够限制抑制肿瘤的生长,同时能够抑制肿瘤在肺脏的转移;
(4)本发明所提供的用于预防接种的药物组合物,可显著增加瘤内浸润淋巴细胞的含量,尤其是杀伤性淋巴细胞的含量。
附图说明
图1示出本发明一种优选实施方式的不同外泌体处理dc细胞后各细胞因子分泌量图;
图2示出本发明一种优选实施方式的不同温度处理的外泌体联合dc细胞应用对肿瘤大小的影响;
图3示出本发明一种优选实施方式的不同温度处理的外泌体联合dc细胞应用对肿瘤重量的影响;
图4示出本发明一种优选实施方式的不同温度处理的外泌体联合dc细胞应用对肿瘤肺转移灶的影响;
图5示出本发明一种优选实施方式的不同药物组合物对肿瘤大小的影响;
图6示出本发明一种优选实施方式的不同药物组合物处理的肿瘤解剖图;
图7示出本发明一种优选实施方式的不同药物组合物对肿瘤重量的影响;
图8示出本发明一种优选实施方式的不同药物组合物治疗过程中未长肿瘤老鼠的比例;
图9示出本发明一种优选实施方式的不同药物组合物对肿瘤肺转移灶的影响;
图10示出本发明一种优选实施方式的不同药物组合物治疗过程中的小鼠生存曲线;
图11示出本发明一种优选实施方式的不同药物组合物治疗过程中期脾脏淋巴细胞含量统计图;
图12示出本发明一种优选实施方式的不同药物组合物治疗结束后脾脏淋巴细胞含量流式图;
图13示出本发明一种优选实施方式的不同药物组合物治疗结束后脾脏淋巴细胞含量统计图;
图14示出本发明一种优选实施方式的不同药物组合物治疗结束后肿瘤浸润淋巴细胞含量流式图;
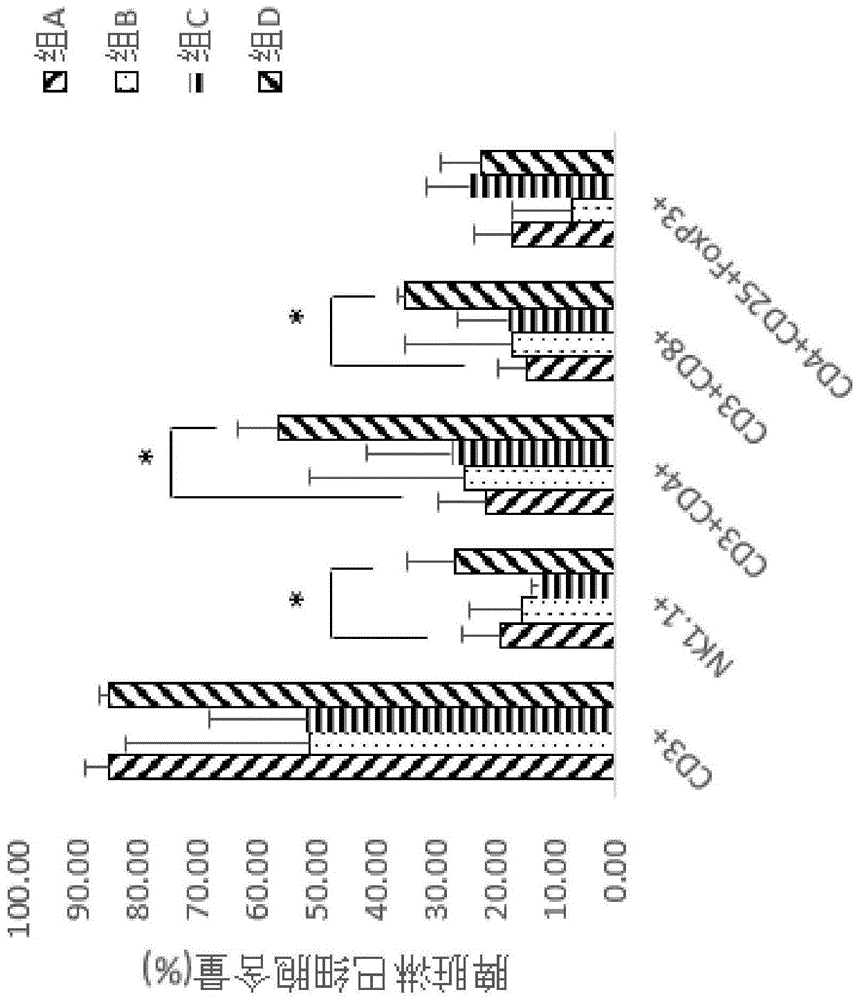
图15示出本发明一种优选实施方式的不同药物组合物治疗结束后肿瘤浸润淋巴细胞含量统计图。
具体实施方式
下面通过优选实施方式和实施例对本发明进一步详细说明。通过这些说明,本发明的特点和优点将变得更为清楚明确。
在这里专用的词“示例性”意为“用作例子、实施例或说明性”。这里作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。
本发明的第一方面,提供了一种外泌体,所述外泌体通过对正常分泌的外泌体进行灭活处理得到。
本发明人发现,肿瘤细胞可以通过自身分泌的外泌体帮助其逃逸转移到身体其他部位,因此,本发明中优选将外泌体进行灭活处理,使得其丧失本身的促转移特性,从而能够更好的称为肿瘤免疫治疗过程中的肿瘤抗原。
根据本发明一种优选的实施方式,所述正常分泌的外泌体为肿瘤来源外泌体。
其中,所述肿瘤来源外泌体可从患者腹水、尿液或血清等体液中分离制备,易于获得;分离得到的外泌体可长时间保持活性而不易降解,方便运输;携带丰富的肿瘤特异性抗原、rnas和蛋白质。
在进一步优选的实施方式中,所述肿瘤为实体瘤,包括但不限于黑色素瘤、肝脏肿瘤、肺部肿瘤和肾脏肿瘤。
根据本发明一种优选的实施方式,所述灭活处理包括水浴加热处理或化学试剂处理。
在本发明中,所述灭活处理指的是使外泌体丧失本身的促转移特性。
在进一步优选的实施方式中,所述水浴处理的温度为37℃~70℃,优选为42℃~65℃;
所述处理时间为0.25~3h,优选为0.5~2h。
本发明人研究发现,采用水浴处理的温度为37℃~70℃,优选为42℃~65℃时,对外泌体的灭活效果最佳,当温度低于37℃时,无法实现外泌体的灭活;当温度高于70℃时,将会破坏外泌体的包膜结构。
所述水浴处理时间小于0.25h时,外泌体灭活不彻底;所述水浴处理时间大于3h时,会引起外泌体中部分蛋白质的降解。
在更进一步优选的实施方式中,所述水浴处理的温度为42℃、56℃和65℃中的一个或多个的组合。
根据本发明一种优选的实施方式,所述水浴处理的温度为42℃,水浴处理的时间为1.5~2.5h,优选为2h;或
所述水浴处理的温度为56℃,水浴处理的时间为0.5~1.5h,优选为1h;或
所述水浴处理的温度为65℃,水浴处理的时间为0.25~0.75h,优选为0.5h。
根据本发明一种优选的实施方式,所述水浴处理为先42℃水浴处理0.5~1.5h,优选1h,再56℃水浴处理0.5~1.5h,优选1h;或
所述水浴处理为先42℃水浴处理0.75~2h,优选1.5h,再65℃水浴处理0.25~1h,优选0.5h;或
所述水浴处理为先56℃水浴处理0.25~1h,优选0.5h,再65℃水浴处理0.25~1h,优选0.5h。
本发明人研究发现,经过上述单独温度或温度组合的处理,肿瘤外泌体能够显著逆转其促转移的特性,解除了其对dc细胞的抑制作用,能够直接作为dc处理的肿瘤抗原,激活免疫系统,抑制肿瘤的生长。
根据本发明一种优选的实施方式,所述化学试剂包括β-丙内酯、甲醛、戊二醛和福尔马林中的一种或多种。
在进一步优选的实施方式中,所述化学试剂为β-丙内酯、甲醛、戊二醛和福尔马林中的一种或多种,优选为β-丙内酯。
在更进一步优选的实施方式中,所述β-丙内酯的终浓度为1:800~1:4500,优选为1:1000~1:4000。
在本发明中,所述β-丙内酯的终浓度为1:800~1:4500,优选为1:1000~1:4000,其具体含义为:将β-丙内酯按体积稀释800~4500倍,优选稀释1000~4000倍得到。
本发明人研究发现,选用上述终浓度时,对外泌体的灭活效果最佳,当终浓度低于1:800时,外泌体灭活不彻底;当终浓度高于1:4500时,过高的试剂浓度会存在后续残留,进一步影响外泌体的应用。
根据本发明一种优选的实施方式,所述化学试剂的处理时间为6~15h,优选为8~12h。
其中,当处理时间低于6h时,外泌体灭活不彻底;当处理时间高于15h时,会引起外泌体中部分蛋白质的降解,同时会破坏外泌体的包膜结构。
在进一步优选的实施方式中,所述化学试剂处理在温度为4℃下进行。
本发明的第二方面,提供了一种第一方面所述肿瘤来源外泌体的制备方法,所述方法包括以下步骤:
步骤1,获取正常分泌的肿瘤来源外泌体。
其中,所述肿瘤来源的外泌体按照以下步骤获取:
步骤1-1,预先培养肿瘤细胞。
在本发明中,所述肿瘤细胞优选为实体瘤细胞,如黑色素瘤细胞,在收集正常分泌的外泌体前,需要预先培养肿瘤细胞以调整其细胞状态,本发明中优选培养3~5代。
步骤1-2,细胞正常传代培养过程中,加入dmem培养基,培养,收集细胞上清。
其中,使细胞正常传代至培养皿中,优选直径为150mm的培养皿,使得细胞贴壁后的汇合度不超过30%。
根据本发明一种优选的实施方式,向细胞中加入dmem培养基,进行培养,待细胞汇合度达到90%时,收集细胞上清。
其中,所述dmem培养基一种含有各种氨基酸和葡萄糖的培养基,广泛应用于疫苗生产和各种初代病毒宿主细胞的细胞培养以及单一细胞培养。
在本发明中,可重复传代收集细胞上清,直至满足需求用量,将收集的细胞上清置于4℃保存备用。
在进一步优选的实施方式中,所述dmem为含有10%胎牛血清的培养基。
步骤1-3,将收集到的细胞上清进行多次离心,获得沉淀,对沉淀进行漂洗,重悬。
根据本发明一种优选的实施方式,所述多步离心包括三次离心,其中,
所述第一次离心的转速为3000~4000rpm,离心时间为6~12min,以出去残留细胞及大的颗粒物,优选地,第一次离心的转速为3500rpm,离心时间为10min;
所述第二次离心为将第一次离心获得的上清进行再次离心,以除去细胞碎片,所述第二次离心的转速为8000~12000g,离心时间为25~35min,优选第二次离心的转速为10000g,离心时间为30min;
所述第三次离心为对第二次离心的上清进行超速离心,所述第三次离心的转速为100000~150000g,离心时间为1.5~2.5h,优选第三次离心的转速为120000g,离心时间为2h。
其中,经过多次离心后,会在离心管的底部出现圆形瘢痕沉淀,小心弃掉上清后,进行漂洗。
根据本发明一种优选的实施方式,所述漂洗采用pbs溶液进行,优选漂洗2次。
在进一步优选的实施方式中,所述漂洗过的沉淀用生理盐水进行重悬。
其中,优选采用1ml生理盐水进行重悬。
步骤2,对步骤1获取的肿瘤来源外泌体进行检测。
其中,需要对收集的沉淀物进行鉴定,以确定是否为外泌体,在本发明中,优选采用westernblot检测外泌体标志蛋白cd63的表达情况。
根据本发明一种优选的实施方式,对鉴定为外泌体的沉淀物进行总蛋白定量,并根据定量结果,将外泌体用生理盐水稀释至1μg/ml。
在本发明中,采用现有技术中常用的bca蛋白定量法或bca蛋白定量试剂盒(如碧云天的bca蛋白定量试剂盒)对外泌体进行总蛋白定量。
在进一步优选的实施方式中,对稀释后的外泌体进行过滤除菌,所述除菌采用0.22μm的滤膜进行。
步骤3,对步骤2检测后的肿瘤来源外泌体进行灭活处理。
根据本发明一种优选的实施方式,所述灭活处理包括水浴加热处理或化学试剂处理。
在进一步优选的实施方式中,所述水浴处理的温度为37℃~70℃,优选为42℃~65℃;
所述处理时间为0.25~3h,优选为0.5~2h。
在更进一步优选的实施方式中,所述水浴处理的温度为42℃、56℃和65℃中的一个或多个的组合。
根据本发明一种优选的实施方式,所述水浴处理的温度为42℃,水浴处理的时间为1.5~2.5h,优选为2h;或
所述水浴处理的温度为56℃,水浴处理的时间为0.5~1.5h,优选为1h;或
所述水浴处理的温度为65℃,水浴处理的时间为0.25~0.75h,优选为0.5h。
根据本发明一种优选的实施方式,所述水浴处理为先42℃水浴处理0.5~1.5h,优选1h,再56℃水浴处理0.5~1.5h,优选1h;或
所述水浴处理为先42℃水浴处理0.75~2h,优选1.5h,再65℃水浴处理0.25~1h,优选0.5h;或
所述水浴处理为先56℃水浴处理0.25~1h,优选0.5h,再65℃水浴处理0.25~1h,优选0.5h。
在本发明中,所述水浴处理后的外泌体均迅速置于冰上冷却,再次用0.22μm滤膜过滤除菌备用。
根据本发明一种优选的实施方式,所述化学试剂包括β-丙内酯、甲醛、戊二醛和福尔马林中的一种或多种。
在进一步优选的实施方式中,所述化学试剂为β-丙内酯、甲醛、戊二醛和福尔马林中的一种或多种,优选为β-丙内酯。
在更进一步优选的实施方式中,所述β-丙内酯的终浓度为1:800~1:4500,优选为1:1000~1:4000。根据本发明一种优选的实施方式,所述化学试剂的处理时间为6~15h,优选为8~12h。
在进一步优选的实施方式中,所述化学试剂处理在温度为4℃下进行。
本发明的第三方面,提供了一种第一方面所述的肿瘤来源外泌体或第二方面所述方法制备的肿瘤来源外泌体在制备治疗肿瘤药物方面的用途。
在本发明中,所述肿瘤优选为实体瘤,如黑色素瘤、肝脏肿瘤、肺部肿瘤和肾脏肿瘤。
本发明的第四方面,提供了一种用于预防接种的药物组合物,所述药物组合物用于激活免疫系统,抑制肿瘤增长,其包括dc细胞和第一方面所述的肿瘤来源外泌体或第二方面所述方法制备的肿瘤来源外泌体,所述药物组合物通过将dc细胞和外泌体共培养得到。
其中,树突状细胞(dendriticcells,dcs)是目前发现的功能最强大的抗原递呈细胞(antigenpresentingcell,apc),也是唯一能激活初始型t细胞的apc。dc通过摄取肿瘤抗原,发育成熟后在膜上高表达mhci、ii类分子,并递呈大量的肿瘤抗原给t细胞受体,同时,dc提高协同刺激分子b7-1、b7-2和cd40等的表达,并激活t细胞,而且dc与t细胞结合后分泌大量il-12,il-12可强烈诱导t细胞、nk细胞、lak细胞产生大量tnf-γ、穿孔素和颗粒酶,增强ctl细胞和nk细胞对靶细胞的溶解作用。
由于肿瘤来源的外泌体中几乎含有肿瘤的全部信息,主要包括肿瘤细胞的蛋白质、rna和dna,将肿瘤来源的外泌体作为肿瘤疫苗的抗原要比肿瘤细胞裂解或者单纯合成的多肽抗原哈rna抗原效果好,能够将更多的肿瘤信息提呈给dc细胞。
因此,本发明中优选将灭活的肿瘤来源外泌体负载在dc细胞上,解除肿瘤来源的正常分泌的外泌体对dc细胞的抑制作用,以显著增加dc疫苗效果。
根据本发明一种优选的实施方式,所述dc细胞为骨髓细胞来源dc细胞和/或淋巴细胞来源的dc细胞,优选为骨髓细胞来源dc细胞。
本发明的第五方面,提供了一种第四方面所述药物组合物的制备方法,所述方法包括以下步骤:
步骤i,获取dc细胞。
在本发明中,所述dc细胞优选为骨髓细胞来源的dc细胞,其中,所述步骤1包括以下子步骤:
步骤i-1,分离骨髓细胞。
在本发明中,优选分离小鼠的骨髓细胞,所述分离按照以下操作进行:将6-8周龄小鼠颈椎脱臼法处死,手术取出所有股骨和胫骨,并用剪刀和镊子将骨周围的肌肉组织尽量去除干净,用盛有70%酒精的无菌培养皿浸泡2-5min,以消毒灭菌,然后用无菌的pbs洗2次。将骨移入另一个盛有pbs的新培养皿中,用剪刀剪去骨两端,再用注射器抽取pbs,针头分别从骨两端插入骨髓腔,反复冲洗出骨髓至培养皿中,直至骨完全变白。收集骨髓悬液,用200目尼龙网滤去小碎片和肌肉组织;过滤液1200rpm离心5min,弃上清。
步骤i-2,对骨髓细胞进行诱导培养,获得所述dc细胞。
其中,步骤i-2包括以下子步骤:
步骤i-2-1,对获得的骨髓细胞计数,然后调整细胞浓度,再加入诱导因子一,进行初步培养。
根据本发明一种优选的实施方式,采用含10%fbs的rpmi1640完全培养液调整细胞浓度。
在进一步优选的实施方式中,所述调整后的细胞浓度为0.5×106~1.5×106个,优选为1×106个。
根据本发明一种优选的实施方式,所述诱导因子一为gm-csf(粒细胞-巨噬细胞集落刺激因子)和il-4(白细胞介素-4),
所述gm-csf的浓度为20~60μg/ml,优选为30~50μg/ml,如40μg/ml;
所述il-4的浓度为5~15μg/ml,优选为8~12μg/ml,如10μg/ml。
本发明人研究发现,采用上述浓度的诱导因子,能够显著减少分离的单个核细胞向巨噬细胞分化,增加未成熟dc细胞的数量。
在进一步优选的实施方式中,所述加入的gm-csf和il-4的体积比为1:(0.7~1.4),优选为1:(0.8~1.2),如1:1。
在本发明中,优选所述初步培养在37℃、5%co2的培养箱中进行。
在更进一步优选的实施方式中,所述加入的诱导因子一的体积与细胞体积的比为(8~15):10000,优选为10:10000。
在本发明中,优选将调整好浓度的细胞铺至100mm的细菌培养皿中,每皿10ml细胞,然后加入10μl诱导因子一。
步骤i-2-2,再次加入诱导因子一,培养一段时间后进行换液处理,得到所述dc细胞。
根据本发明一种优选的实施方式,在加入诱导因子一后的第3天,再次加入含诱导因子一的完全培养液,所述完全培养液的体积与初次加入的诱导因子一的体积比为10000:10。
其中,所述完全培养液是指在基本培养液中加入一些富含氨基酸、维生素和碱基之类的天然物质,以满足细胞生长需要。本发明中完全培养液中加入的诱导因子一的浓度和体积与初次加入的诱导因子一的浓度和体积相同。
在进一步优选的实施方式中,自初次加入诱导因子一开始,培养至第6天和第8天时,分别进行半量换液处理。
其中,所述半量换液为收集旧的培养液,离心后用含诱导因子一的完全培养液重悬细胞沉淀,然后将细胞悬液放回原容器。
步骤ii,负载外泌体,获得所述药物组合物。
在本发明中,所述外泌体为第一方面所述的外泌体或第二方面所述方法制备的外泌体,即经过灭活处理的外泌体。
其中,所述步骤ii包括以下子步骤:
步骤ii-1,向dc细胞中添加外泌体,共培养一段时间后收集细胞。
根据本发明一种优选的实施方式,自初次加入诱导因子一开始,培养至第8天时,将外泌体加入dc细胞,
其中,所述外泌体的添加量为每1×107个细胞添加0.8~1.2μg,优选为1μg。
在进一步优选的实施方式中,所述共培养的时间为1~3天,优选为2天。
其中,所述共培养的时间为1~3天,优选为2天,即自初次加入诱导因子一开始,培养至第10天时,可以收集细胞。所述收集为用移液器轻轻吹打收集悬浮细胞。
在本发明中,优选每个培养皿平均可获取9.2×106个细胞。
步骤ii-2,对收集的细胞进行离心,重悬细胞沉淀,加入诱导因子二,继续培养。
根据本发明一种优选的实施方式,所述离心为在1000~1500rpm下室温离心3~8min,优选在1200rpm下室温离心5min。
在进一步优选的实施方式中,用rpmi1640完全培养液重悬细胞沉淀。
根据本发明一种优选的实施方式,所述诱导因子二包括gm-csf、il-4和lps(脂多糖),其中,
所述gm-csf的浓度为20~60μg/ml,优选为30~50μg/ml,如40μg/ml;
所述il-4的浓度为5~15μg/ml,优选为8~12μg/ml,如10μg/ml;
所述lps的浓度为0.5~1.5mg/ml,优选为0.8~1.2mg/ml,如1mg/ml。
本发明人研究发现,采用上述浓度的诱导因子,能够显著减少分离的单个核细胞向巨噬细胞分化,增加诱导成熟dc细胞的数量。
在进一步优选的实施方式中,所述gm-csf、il-4和lps的体积比为(2~3):(2~3):10,优选为2.5:2.5:10。
在更进一步优选的实施方式中,所述诱导因子二的体积与rpmi1640完全培养液的体积的比为(10~20):10000,优选为15:10000。
优选地,加入诱导因子二后,于37℃、5%co2的条件下继续培养1~2天。
步骤ii-3,收集细胞,离心后洗涤沉淀,再离心后重悬,调整浓度。
其中,采用细胞刮刀收集细胞,将收集得到的细胞悬液进行离心,所述离心速度为1300rpm~1800rpm,优选为1600rpm;所述离心时间为7~15min,优选为10min。
在本发明中,所述洗涤采用生理盐水进行,优选洗涤2次,然后按照上述离心条件离心,再对获得的细胞沉淀重悬。
最后进行细胞计数,并调整浓度至2×106个/ml,备用。
实施例
以下通过具体实例进一步描述本发明,不过这些实例仅仅是范例性的,并不对本发明的保护范围构成任何限制。
实施例1
制备灭活肿瘤来源外泌体:
(1)小鼠来源的黑色素瘤b16f10细胞(购自atcc公司)培养在含有10%胎牛血清(fbs,购自bioind公司)的dmem培养基中;在收集外泌体前,b16f10细胞需要额外培养3-5代调整细胞状态;准备收集外泌体时,细胞正常传代至150mm培养皿中(细胞贴壁后的汇合度不可超30%),加入20ml含有10%胎牛血清(fbs,购自bioind公司)的dmem培养基,进行培养,待细胞汇合度达90%时,收集细胞上清,4℃保存备用,重复传代收集细胞上清,直至满足需求用量;
将收集得到的细胞上清,首先用3500rpm离心10分钟除去残留细胞及大的颗粒物,然后将离心收集的上清用10000g离心30分钟除去细胞碎片,最后将离心后的上清用120000g超速离心2小时,在超速离心管的底部出现一片圆形瘢痕沉淀,小心弃掉上清,然后用pbs轻柔漂洗2次,最后用1ml生理盐水重悬沉淀,4℃保存备用。
(2)将收集得到的外泌体用westernblot检测外泌体标志cd63的表达情况,经鉴定收集得到的沉淀物是为外泌体;然后采用bca蛋白定量试剂盒(碧云天公司的bca蛋白定量试剂盒)进行总蛋白定量,根据定量结果,将外泌体用生理盐水稀释为1ug/ml,然后用0.22um滤膜过滤除菌备用。
(3)将上述准备好的外泌体置于65℃水浴中持续处理0.5h,然后迅速置于冰上冷却,再次用0.22μm滤膜过滤除菌备用。
实施例2
本实施例所用方法与实施例1相似,区别在于,步骤(3)中外泌体置于42℃水浴中持续处理2h。
实施例3
本实施例所用方法与实施例1相似,区别在于,步骤(3)中外泌体置于56℃水浴中持续处理1h。
实施例4
本实施例所用方法与实施例1相似,区别在于,步骤(3)中外泌体先置于42℃水浴中持续处理1h,然后再置于56℃水浴处理1h。
实施例5
本实施例所用方法与实施例1相似,区别在于,步骤(3)中外泌体先置于42℃水浴中持续处理1.5h,然后再置于65℃水浴处理0.5h。
实施例6
本实施例所用方法与实施例1相似,区别在于,步骤(3)中外泌体先置于56℃水浴中持续处理0.5h,然后再置于65℃水浴处理0.5h。
实施例7
本实施例所用方法与实施例1相似,区别在于,步骤(3)中外泌体用终浓度为1:2000的β-丙内酯4℃处理10h。
实施例8
本实施例所用方法与实施例1相似,区别在于,步骤(3)中外泌体用终浓度为1:1000的β-丙内酯4℃处理12h。
实施例9
本实施例所用方法与实施例1相似,区别在于,步骤(3)中外泌体用终浓度为1:4000的β-丙内酯4℃处理8h。
实施例10
本实施例所用方法与实施例1相似,区别在于,步骤(3)中外泌体用终浓度为1:2000的甲醛4℃处理10h。
实施例11
制备用于预防接种的药物组合物:
(1)将6-8周龄小鼠颈椎脱臼法处死,手术取出所有股骨和胫骨,并剪刀和镊子将骨周围的肌肉组织尽量去除干净,用盛有70%酒精的无菌培养皿浸泡2-5min,以消毒灭菌,然后用无菌的pbs洗2次;将骨移入另一个盛有pbs的新培养皿中,用剪刀剪去骨两端,再用注射器抽取pbs,针头分别从骨两端插入骨髓腔,反复冲洗出骨髓至培养皿中,直至骨完全变白;收集骨髓悬液,用200目尼龙网滤去小碎片和肌肉组织;过滤液1200rpm离心5min,弃上清。
(2)将获得的小鼠骨髓细胞计数后用含10%fbs的rpmi1640完全培养液(购自:gibco公司)调整细胞浓度为1×106个/ml,铺至100mm细菌培养皿中,每皿10ml细胞,同时加入重组鼠源因子gm-csf5ul(40ug/ml)和il-45ul(10ug/ml)(均购自peprotech公司),37℃,5%co2培养箱培养;第3天时,向培养皿中再加入10ml含重组鼠源因子gm-csf5ul(40ug/ml)和il-45ul(10ug/ml)的完全培养液;第6天和第8天分别半量换液,即收集旧培养液,离心后用含重组鼠源因子gm-csf5ul(40ug/ml)和il-45ul(10ug/ml)的完全培养液重悬细胞沉淀,然后再将细胞悬液放回原皿。
(3)第8天时,将实施例1制备的肿瘤来源外泌体按照每1×107个细胞添加1ug的量,将外泌体直接加入到培养皿中,然后继续培养;第10天时可收集细胞,即为bmdc,每皿平均可收获9.2×106个细胞;
培养第10天的dc用移液器轻轻吹打收集悬浮细胞,1200rpm室温离心5min,然后弃上清,用10mlrpmi1640完全培养液重悬细胞沉淀,然后铺于100mm细胞培养板,加入重组鼠源因子gm-csf2.5ul(40ug/ml)和il-42.5ul(10ug/ml)和lps10ul(1mg/ml)(购自sigma公司),37℃,5%co2培养箱继续培养1-2天;最后用细胞刮刀收集细胞,将收集得到的细胞悬液用1600rpm离心10分钟,弃上清,然后用生理盐水对细胞洗涤2次,离心条件同上,将获得的细胞沉淀重悬,细胞计数,重新调整浓度为2×106个/ml备用。
实施例12
本实施例所用方法与实施例11相似,区别在于,步骤(3)中采用的是实施例2制备的外泌体。
实施例13
本实施例所用方法与实施例11相似,区别在于,步骤(3)中采用的是实施例3制备的外泌体。
实施例14
本实施例所用方法与实施例11相似,区别在于,步骤(3)中采用的是实施例4制备的外泌体。
实施例15
本实施例所用方法与实施例11相似,区别在于,步骤(3)中采用的是实施例5制备的外泌体。
实施例16
本实施例所用方法与实施例11相似,区别在于,步骤(3)中采用的是实施例6制备的外泌体。
对比例
对比例1
本对比例所用方法与实施例1相似,区别在于,正常收集的肿瘤来源外泌体不进行灭活处理。
对比例2
本对比例所用方法与实施例11相似,区别在于,步骤(3)中dc细胞负载的是对比例1中所述的未经过灭活处理的肿瘤来源外泌体。
对比例3
本对比例所用方法与实施例11相似,区别在于,dc细胞未负载外泌体。
实验例
实验例1
采用实施例1和对比例1制备的外泌体分别孵育小鼠骨髓来源的dc细胞(如实施例11中所述),在小鼠dc细胞培养至第8天时,每1×106个dc细胞加入0.1ug外泌体,37℃孵育24小时,然后分别收集细胞上清,12000g离心10分钟去除细胞。
离心得到的上清用来检测dc细胞分泌tnf-α、il-6、ifn-γ和il-12的表达,具体操作按照相应鼠源因子的elisa试剂盒操作(均购自欣博盛生物科技有限公司),结果如图1所示。
由图1可知,实施例1制备的外泌体可以显著增加小鼠dc细胞tnf-α和il-6的分泌量,但对ifn-γ和il-12的分泌量没有影响,说明增加了dc细胞对抗原的加工处理和提成能力。
实验例2
选取80只6-8周龄的雄性c57bl/6小鼠(购自斯贝福(北京)生物科技有限公司),将小鼠b16f10黑色素瘤细胞复苏后,用pbs清洗两遍,皮下注射至小鼠中,培养3周后处死小鼠,剥离肿瘤,无菌条件下剪碎,用70目无菌细胞筛网轻轻研磨组织,将收集的细胞用pbs清洗、计数、离心,按5×105个/100μl重悬,注射到小鼠右腋皮下,再将小鼠随机分为8组,记为组1~组8,每组10只小鼠。
在接种肿瘤后的第5天,各组小鼠分别给予不同细胞治疗,其中,组1为对照组,给予生理盐水治疗;组2给予对比例2制备的药物组合物治疗;组3给予实施例12制备的药物组合物治疗;组4给予实施例13制备的药物组合物治疗;组5给予实施例11制备的药物组合物治疗;组6给予实施例14制备的药物组合物治疗;组7给予实施例15制备的药物组合物治疗;组8给予实施例16制备的药物组合物治疗。
各组给药方式均为尾静脉注射,所有组均要求上午给药。
给药时间:组2~组8要求每7天注射一次细胞,一共给予3次细胞。
对照组(组1):每只小鼠每次注射100μl生理盐水,尾静脉注射。
组2~组8:每只小鼠每次注射量为2×106细胞/100ul,每7天一次,尾静脉注射。
造模起,小鼠隔天称重。肿瘤长出后,每周测量小鼠肿瘤两次,用游标卡尺测量肿瘤的长度和宽度,肿瘤体积计算方法为长度×宽度×宽度/2。在造模第32天,小鼠脱颈处死,立即解剖,称量小鼠体重和肿瘤重量,统计小鼠处死前自然死亡小鼠数量,结果如图2、3和表1所示。
表1
由图2、图3和表1可以得出,组5(给予实施例11制备的药物组合物治疗)中用65℃处理外泌体0.5h后,联合dc细胞应用能够更加的抑制小鼠肿瘤的生长,在32天处死前自然死亡老鼠的数量相对少于其他组。
剖取肺脏,4%多聚甲醛固定,然后检测转移情况,结果如图4所示。
由图4可知,组5(给予实施例11制备的药物组合物治疗)中用65℃处理外泌体0.5h后,联合dc细胞应用能够显著抑制小鼠肿瘤在肺部的转移,其转移灶数量显著减少。
实验例3
选取120只6-8周龄的雄性c57bl/6(购自斯贝福(北京)生物科技有限公司),将小鼠b16f10黑色素瘤细胞复苏后,用pbs清洗两遍,皮下注射至小鼠中,培养3周后处死小鼠,剥离肿瘤,无菌条件下剪碎,用70目无菌细胞筛网轻轻研磨组织,将收集的细胞用pbs清洗、计数、离心,按5×105个/100μl重悬,注射到小鼠右腋皮下,再将小鼠随机分为4组,记为组a~组d,每组30只小鼠。
在接种肿瘤后的第5天,各组小鼠分别给予不同细胞治疗,其中,组a为对照组,给予生理盐水治疗;组b给予对比例3所述的未负载外泌体的dc细胞治疗;组c给予对比例2所述的负载未经灭活处理的外泌体的药物组合物治疗;组d给予实施例11制备的药物组合物治疗。
给药时间:组b~组d要求每7天注射一次细胞,一共给予3次细胞。
对照组(组a):每只小鼠每次注射100μl生理盐水,尾静脉注射。
细胞:每只小鼠每次注射量为2×106细胞/100ul,每7天一次,尾静脉注射。
造模起,小鼠隔天称重。肿瘤长出后,每天用游标卡尺测量肿瘤的长度和宽度,肿瘤体积计算方法为长度×宽度×宽度/2。在造模第20天和30天,分别取10只小鼠脱颈处死,立即解剖,称量小鼠体重和肿瘤重量,统计小鼠肿瘤大小、治疗过程中未长肿瘤老鼠的比例,结果如图5~8所示。
由图5~7可以看出,组d给予实施例11制备的药物组合物治疗的小鼠的肿瘤生长得到了显著抑制,由图8可以看出,组d给予实施例11制备的药物组合物治疗的实验组在治疗过程中未长肿瘤老鼠的比例较高。
剖取肺脏,4%多聚甲醛固定,检测转移情况,结果如图9所示;然后剩余10只小鼠,正常统计小鼠的生存曲线,统计时长为6周,结果如图10所示。
由图9和图10可知,经过灭活处理的外泌体可以显著抑制黑色素瘤在肺脏的转移,延长肿瘤小鼠的生存期。
实验例4
解剖实验例3中治疗后的小鼠,称重取1g左右大小的肿瘤组织和完整的脾脏,用10ml注射器塞研磨并过70μm筛网,细胞悬液800g离心5分钟,去上清,然后根据小鼠脏器淋巴细胞分离试剂盒(购自天津灏洋生物科技有限公司)进行淋巴细胞分离,简单操作如下:将离心所得的细胞用样本稀释液重悬,然后将细胞悬液用样本分离液进行分离,800g离心20分钟,然后吸取白膜层,将分离得到的2×106个肿瘤浸润淋巴细胞用pbs洗两次,转入流式管中,按照需求分别加入抗cd3、cd4、cd8和nk1.1小鼠流式抗体,按照抗体说明书给予抗体用量,用pbs将体系调整到100ul,室温避光孵育30min,孵育完成后用pbs洗两次,最后用400ulpbs重悬上机检测。treg检测根据小鼠treg细胞染色试剂盒(购自ebioscience)进行标记。
采用流式细胞仪(型号为:beckmanas28118)进行检测,分别统计治疗中期和治疗结束后脾脏淋巴细胞含量和肿瘤浸润淋巴细胞含量,结果如图11~图15所示。
由图11至图15可知,对比肿瘤内部浸润淋巴细胞含量和脾脏淋巴细胞含量,实施例11制备的药物组合物(负载灭活的外泌体的dc细胞)可显著增加瘤内浸润淋巴细胞的含量,特别是杀伤性淋巴细胞含量。
以上结合具体实施方式和范例性实例对本发明进行了详细说明,不过这些说明并不能理解为对本发明的限制。本领域技术人员理解,在不偏离本发明精神和范围的情况下,可以对本发明技术方案及其实施方式进行多种等价替换、修饰或改进,这些均落入本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!