一种含有内酯基团的医用聚氨酯材料及其制备方法和医用导管与流程
本发明属于生物医用聚氨酯材料技术领域,尤其涉及一种含有内酯基团的医用聚氨酯材料及其制备方法和医用导管。
背景技术:
医用导管是指在疾病治疗过程中用于往体内输送气体、液体以及固体的高端精密医疗器械,经过几十年的发展,医用介入导管在当今医疗领域的各类疾病的治疗过程中扮演的角色越来越重要。除了必须具备良好的生物相容性之外,制备医用导管的原材料还必须拥有特殊的机械力学性能。
以静脉留置针导管为例,为了减少导管尖端对人体组织产生的机械刺激强度,降低介入位点炎症、疼痛、血栓以及药液渗透等并发症的发生几率,它要求导管在血管内留置时具有足够的柔软度。与此同时,为了保证导管在穿刺过程中可以顺利进入人体血管,保障导管在穿刺过程中不发生回缩、弯折和提高一次性介入成功率,还要求制造导管的材料具有较高的刚性(与弹性模量成正比)。
根据医用导管临床应用特点,人们已经公开了多种制备手段,如公开号为us4950257的美国专利提出了一种软尖端和刚性主体相结合的复合介入导管,该导管的特点在于导管主体采用有利于穿刺的硬质聚合物材料制备,保证导管介入过程中有良好的力传导性;尖端则使用柔性较高的尼龙弹性体制备,目的是减少导管对人体组织的机械刺激程度。但是,这种介入导管必须分别制备柔性尖端管路和刚性主体管路,再将二者粘合在一起,在使用过程中,有可能出现导管尖端和主体分离的情况,增加了导管的断裂风险。此外,对于直径较小的管路,这种软/硬管路相粘合的工艺通常难以实施。另一种解决手段是采用弹性模量在体内敏感的聚氨酯材料制备医用介入导管,如公开号为us4883699和us5102401的美国专利在聚氨酯分子结构中引入了亲水性的基团,所制备的医用导管在干燥环境中保存时具有很高的弹性模量,保证穿刺时具有足够的刚性,进入人体后,亲水基团促使聚氨酯材料快速地吸收水分子,水分子一方面对聚氨酯起到增塑剂的作用,另一方面破坏了聚氨酯硬段的分子内氢键,促使聚氨酯材料的弹性模量大幅度地降低,最终大幅减小导管对人体组织的机械刺激强度。这类导管的缺点是吸水后导管内径显著减小,导致药液输入流量的降低,不利于疾病的快速治疗,而且聚氨酯材料的熔融挤出过程中对水极为敏感,亲水性基团的引入,增加了聚氨酯材料干燥工艺的难度。公开号为us5281677的美国专利和授权号为zl201310302169.8的中国专利分别提出了采用聚氨酯共混物制备医用介入导管的方法,它们采用不同的技术路线,制备得到的共混物加工成为导管后,在室温条件下放置时,具有利于穿刺的刚性,进入人体后,弹性模量可下降70-88%,而且不会发生吸水溶胀现象,从而明显减少了导管对组织的机械刺激程度,但是这种方法相对于亲水性聚氨酯材料在体内的软化程度有所不足。公开号为us4156067的美国专利采用六碳糖酸内酯制备碱水溶性聚氨酯材料,但是这种材料中的六碳糖酸内酯含有两个以上的羟基基团,所得的聚氨酯材料具有交联结构,不具备热塑性加工性。
技术实现要素:
有鉴于此,本发明的目的在于提供一种含有内酯基团的医用聚氨酯材料及其制备方法和医用导管,该医用聚氨酯材料在存储时具有疏水性,利于干燥,在水相环境中或在体内时具有可控的亲水性,利于增加其在体内的柔性。
本发明提供了一种含有内酯基团的医用聚氨酯材料,由以下原料缩聚制得:
所述原料包括4,4`-二苯基甲烷二异氰酸酯、丁二醇、聚四氢呋喃和含丁内酯基团的物质;所述含丁内酯基团的物质中至少含两个羟基基团;
丁内酯基团在所述医用聚氨酯材料中的摩尔质量浓度为5~20mmol/g。
优选地,所述含丁内酯基团的物质选自2-乙氧基-4-(1,2-二羟基乙基)-丁烯内酯;
或由3-羟基丁内酯、4,4`-二苯基甲烷二异氰酸酯和3-氨基-1,2-丙二醇反应制备的内酯多元醇。
优选地,所述4,4`-二苯基甲烷二异氰酸酯和丁二醇的总质量在医用聚氨酯材料中的质量百分比为50~65%。
本发明提供了一种上述技术方案所述医用聚氨酯材料的制备方法,包括以下步骤:
将4,4`-二苯基甲烷二异氰酸酯、丁二醇、聚四氢呋喃、含丁内酯基团的物质和润滑剂混合均匀后进行挤出造粒,得到含丁内酯基团的医用聚氨酯材料;
优选地,所述挤出造粒的温度为200~220℃。
本发明提供了一种医用导管,由上述技术方案所述医用聚氨酯材料或上述技术方案所述制备方法制备的医用聚氨酯材料挤出制得。
优选地,所述医用导管的外径为0.6~2.2mm;所述医用导管的管壁厚为0.08~0.2mm。
本发明提供的医用聚氨酯材料在干燥状态下内酯基团是闭环状态,可保持聚氨酯的疏水性和不影响聚氨酯材料的挤出成型,在水相环境中或者在体内时,内酯基团发生水解开环反应,增加聚氨酯材料的亲水性,显著降低聚氨酯材料的弹性模量。实验结果表明:上述医用聚氨酯材料按照gb/t1040制成5b型样条后,23℃下的弹性模量为1040~1318mpa;37℃的磷酸盐缓冲溶液(ph7.4)中24h后的吸水率为3.9%~7.0%,弹性模量下降为62~154mpa,下降率为87.5~95.3%。同样的,由本发明提供的医用聚氨酯材料所制备的医用导管,兼有体外高刚性和体内高柔软度的特点;将本发明制备的聚氨酯材料精密挤出成导管,所得导管在干燥条件下具有较高的刚性,在37℃的水中浸泡24h后,刚性显著降低,表现为导管的压缩载荷下降85~92.5%。
附图说明
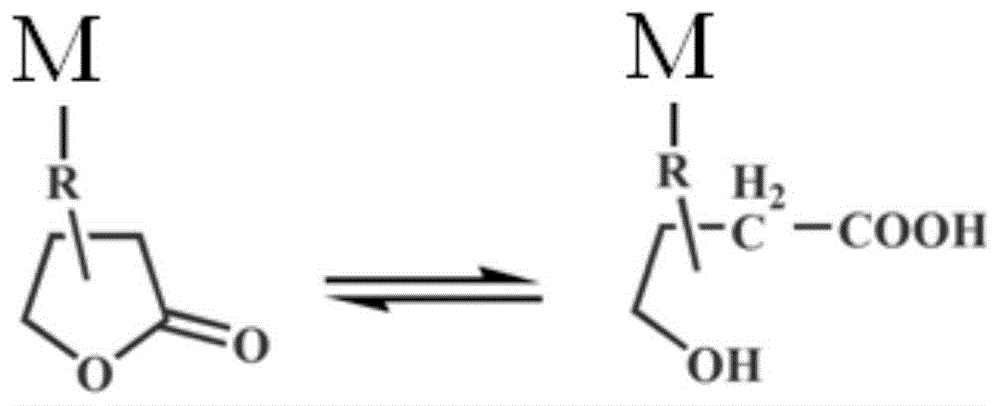
图1为内酯功能化医用聚氨酯材料的亲疏水变化原理示意图。
具体实施方式
本发明提供了一种含有内酯基团的医用聚氨酯材料,由以下原料缩聚制得:
所述原料包括4,4`-二苯基甲烷二异氰酸酯、丁二醇、聚四氢呋喃和含丁内酯基团的物质;所述含丁内酯基团的物质中至少含两个羟基基团;
丁内酯基团在医用聚氨酯材料中的摩尔质量浓度为5~20mmol/g。
本发明提供的医用聚氨酯材料在干燥状态下内酯基团是闭环状态,可保持聚氨酯的疏水性和不影响聚氨酯材料的挤出成型,在水相环境中或者在体内时,内酯基团发生水解开环反应,增加聚氨酯材料的亲水性,显著降低医用聚氨酯材料的弹性模量。
在所述4,4`-二苯基甲烷二异氰酸酯、丁二醇的总质量在所述医用聚氨酯材料中的质量百分比为50~65%。
在具体实施例中,所述聚四氢呋喃的分子量为1000g/mol,聚四氢呋喃占医用聚氨酯材料的质量百分比优选为35~50%。
在本发明中,所述原料包括含丁内酯基团的物质;所述含丁内酯基团的物质中至少含两个羟基基团;所述含丁内酯基团的物质选自2-乙氧基-4-(1,2-二羟基乙基)-丁烯内酯(ebl);或由3-羟基丁内酯、4,4`-二苯基甲烷二异氰酸酯和3-氨基-1,2-丙二醇反应制备的内酯多元醇。丁内酯基团在医用聚氨酯材料中的摩尔质量浓度为5~20mmol/g,优选为9~15mmol/g。医用聚氨酯材料中含有5~20mmol/g的丁内酯基团,其在血管内的水相环境中,丁内酯基团逐步水解开环成羟基羧酸,显著增加水吸收率,破坏了聚氨酯分子间的氢键相互作用,使聚氨酯材料显著软化,最终减小导管尖端对血管壁的机械刺激。在干燥状态下,该医用聚氨酯材料中的内酯官能团保持其内酯结构,具有较高的疏水性,从而易于干燥和挤出加工。
由3-羟基丁内酯、4,4`-二苯基甲烷二异氰酸酯和3-氨基-1,2-丙二醇反应制备的内酯多元醇的具体过程包括:
将3-羟基丁内酯滴加到4,4`-二苯基甲烷二异氰酸酯中,反应后再滴加3-氨基-1,2-丙二醇,继续反应后得到内酯多元醇。
更具体地,在80℃下,将3-羟基丁内酯滴加到4,4`-二苯基甲烷二异氰酸酯中,反应2h后再滴加3-氨基-1,2-丙二醇,继续反应2h后得到内酯多元醇。
所述3-羟基丁内酯、4,4`-二苯基甲烷二异氰酸酯和3-氨基-1,2-丙二醇的物质的量比为1:1:1。
在本发明一个具体实施例中,医用聚氨酯材料中的内酯含量为9.2mmol/g、硬段含量为57.5wt%;在本发明另一个具体实施例中,医用聚氨酯材料中的内酯含量为11.8mmol/g、硬段含量为52.4wt%;在本发明一个具体实施例中,医用聚氨酯材料中的内酯含量为15.0mmol/g、硬段含量为59.2wt%。
图1为内酯功能化医用聚氨酯材料的亲疏水变化原理示意图,其中,m表示聚氨酯分子主链,r表示内酯基团与聚氨酯分子主链相连接的化学基团;医用聚氨酯材料在水相环境中或者在体内时,内酯基团发生水解开环反应。在具体实施例中,所述r为4,4`-二苯基甲烷二氨基甲酸酯基团。
本发明提供了一种上述技术方案所述医用聚氨酯材料的制备方法,包括以下步骤:
将4,4`-二苯基甲烷二异氰酸酯、丁二醇、聚四氢呋喃、含丁内酯基团的物质和润滑剂混合均匀后进行挤出造粒,得到含丁内酯基团的医用聚氨酯材料;
在本发明中,所述润滑剂选自乙撑双硬脂酰胺。
本发明优选采用长径比为44/1的双螺杆挤出机进行挤出造粒。在本发明中,所述挤出造粒的温度优选为200~220℃,更优选为205~215℃;具体实施例中,挤出造粒的温度为210℃。
本发明提供了一种医用导管,由上述技术方案所述医用聚氨酯材料或上述技术方案所述制备方法制备的医用聚氨酯材料挤出制得。
在本发明中,所述医用导管的外径优选为0.6~2.2mm;所述医用导管的壁厚优选为0.08~0.2mm。在具体实施例中,所述医用导管的外径为1.10±0.03mm,壁厚为0.15±0.01mm。
本发明优选将医用聚氨酯材料压制成厚度为0.45mm的片材,按照gb/t1040裁切成5b型样条,测试其弹性模量。采用37℃的磷酸盐缓冲溶液(ph值为7.4)测试其吸水率。
优选将医用聚氨酯材料精密挤出为外径1.10±0.03mm、壁厚0.15±0.01mm的导管,导管与导管座组装后,通过垂直施压法(外加力的方向与导管的轴向垂直)测试导管的最大压缩载荷。
为了进一步说明本发明,下面结合实施例对本发明提供的一种含有内酯基团的医用聚氨酯材料及其制备方法和医用导管进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
实施例1
在80℃的条件下将0.5mol(51.0g)的3-羟基丁内酯缓慢加入到0.5mol(125.1g)的4,4`-二苯基甲烷二异氰酸酯(mdi)中,反应2h后,往其中缓慢滴加0.5mol(45.5g)的3-氨基-1,2-丙二醇(apd),继续反应2h,得到0.5mol(221.6g)的内酯多元醇。在100℃的反应釜中,将10mol(2502.4g)的mdi与2mol(2000g)的分子量为1000g/mol的聚四氢呋喃(ptmo)反应20min,之后在剧烈搅拌下往其中加入7.5mol(675.5g)的丁二醇与0.5mol(221.6g)的内酯多元醇的混合溶液,以及16.2g乙撑双硬脂酰胺,快速混合均匀后通过长径比为44/1的双螺杆挤出机在210℃下挤出造粒。得到内酯含量为9.2mmol/g、硬段含量为57.5wt%的医用聚氨酯材料。将该聚氨酯材料压制成厚度为0.45mm的片材,按照gb/t1040裁切成5b型样条,在23℃测试得其弹性模量为1225mpa;将其放于磷酸盐缓冲溶液(ph7.4)中24h,测试其吸水率为3.9%,在37℃测试得其弹性模量为154mpa,模量下降87.5%。
本发明将实施例1制备的医用聚氨酯材料采用精密挤出制得医用导管,设定挤出机、熔体泵和模具的温度为215~220℃,拉伸比为9:1,得到外径为1.10±0.03mm,壁厚为0.15±0.01mm的医用导管。将导管与导管座通过机械配合进行组装,于23℃下干燥保持24h,然后导管以水平朝向固定于水平夹台上,在距离导管/导管座接口位置10mm的位置,采用万能试验机以50mm/min的速度施加一个垂直向下的力,测得最大压缩载荷为52.0gf。将导管在37℃下,浸入水中24h,取出后在37℃的烘箱中预热5min,之后在37℃下测得最大压缩载荷为7.8gf,压缩载荷下降85%。
实施例2
在80℃的条件下将0.7mol(71.4g)的3-羟基丁内酯缓慢加入到0.7mol(175.1g)的4,4`-二苯基甲烷二异氰酸酯(mdi)中,反应2h后,往其中缓慢滴加0.7mol(63.7g)的3-氨基-1,2-丙二醇(apd),继续反应2h,得到1.0mol(310.2g)的内酯多元醇。在100℃的反应釜中,将10mol(2502.4g)的mdi与2.5mol(2500g)的分子量为1000g/mol的聚四氢呋喃(ptmo)反应20min,之后在剧烈搅拌下往其中加入6.8mol(612.8g)的丁二醇与0.7mol(310.2g)的内酯多元醇的混合溶液,以及16.2g乙撑双硬脂酰胺,快速混合均匀后通过长径比为44/1的双螺杆挤出机在210℃下挤出造粒,得到内酯含量为11.8mmol/g、硬段含量为52.4wt%的医用聚氨酯材料。将该聚氨酯材料压制成厚度为0.45mm的片材,按照gb/t1040裁切成5b型样条,在23℃测试得其弹性模量为1040mpa;将其放于37℃的磷酸盐缓冲溶液(ph7.4)中24h,测试其吸水率为5.4%,在37℃测试得其弹性模量为100mpa,模量下降90.3%。
本发明将实施例2制备的医用聚氨酯材料采用精密挤出制得医用导管,设定挤出机、熔体泵和模具的温度为215~220℃,拉伸比为9:1,得到外径为1.10±0.03mm,壁厚为0.15±0.01mm的医用导管。将导管与导管座通过机械配合进行组装,于23℃下干燥保持24h,然后导管以水平朝向固定于水平夹台上,在距离导管/导管座接口位置10mm的位置,采用万能试验机以50mm/min的速度施加一个垂直向下的力,测得最大压缩载荷为45.7gf。将导管在37℃下,浸入水中24h,取出后在37℃的烘箱中预热5min,之后在37℃下测得最大压缩载荷为5.4gf,压缩载荷下降88.2%。
实施例3
将10mol(2502.4g)的4,4`-二苯基甲烷二异氰酸酯(mdi)中、2mol(2000g)的分子量为1000g/mol的聚四氢呋喃(ptmo)和0.8mol(150.5g)2-乙氧基-4-(1,2-二羟基乙基)-丁烯内酯(ebl)在120℃搅拌反应20min,之后通过失重式计量秤以3115.3g/h的喂料速度加入到长径比为44/1双螺杆挤出机中。与此同时,采用失重式计量秤以443.1g/h的喂料速度加入7.2mol(648.5g)的丁二醇与16.2g超细乙撑双硬脂酰胺的混合液,在210℃下挤出造粒,得到内酯含量为15.0mmol/g、硬段含量为59.2wt%的医用聚氨酯材料。将该聚氨酯材料压制成厚度为0.45mm的片材,按照gb/t1040裁切成5b型样条,在23℃测试得其弹性模量为1318mpa;将其放于37℃的磷酸盐缓冲溶液(ph7.4)中24h,测试其吸水率为7.0%,在37℃测试得其弹性模量为62mpa,模量下降95.3%。
本发明将实施例3制备的医用聚氨酯材料采用精密挤出制得医用导管,设定挤出机、熔体泵和模具的温度为215~220℃,拉伸比为9:1,得到外径为1.10±0.03mm,壁厚为0.15±0.01mm的医用导管。将导管与导管座通过机械配合进行组装,于23℃下干燥保持24h,然后导管以水平朝向固定于水平夹台上,在距离导管/导管座接口位置10mm的位置,采用万能试验机以50mm/min的速度施加一个垂直向下的力,测得最大压缩载荷为58.5gf。将导管在37℃下,浸入水中24h,取出后在37℃的烘箱中预热5min,之后在37℃下测得最大压缩载荷为4.4gf,压缩载荷下降92.5%。
比较例1:
5467.8在100℃的反应釜中,将10mol(2502.4g)的mdi与2.25mol(2250g)的分子量为1000g/mol的聚四氢呋喃(ptmo)反应20min,之后在剧烈搅拌下往其中加入7.75mol(699.2g)的丁二醇以及16.2g乙撑双硬脂酰胺,快速混合均匀后通过长径比为44/1的双螺杆挤出机在210℃下挤出造粒,得到硬段含量为58.5wt%的医用聚氨酯材料。将该聚氨酯材料压制成厚度为0.45mm的片材,按照gbt1040裁切成5b型样条,在23℃测试得其弹性模量为1120mpa;将其放于37℃的磷酸盐缓冲溶液(ph7.4)中24h,测试其吸水率为1.9%,在37℃测试得其弹性模量为635mpa,模量下降43.3%。
本发明将比较例1制备的医用聚氨酯材料采用精密挤出制得医用导管,设定挤出机、熔体泵和模具的温度为215~220℃,拉伸比为9:1,得到外径为1.10±0.03mm,壁厚为0.15±0.01mm的医用导管。将导管与导管座通过机械配合进行组装,于23℃下干燥保持24h,然后导管以水平朝向固定于水平夹台上,在距离导管/导管座接口位置10mm的位置,采用万能试验机以50mm/min的速度施加一个垂直向下的力,测得最大压缩载荷为47.0gf。将导管在37℃下,浸入水中24h,取出后在37℃的烘箱中预热5min,之后在37℃下测得最大压缩载荷为20.5gf,压缩载荷下降56.4%。
由以上实施例可知,本发明提供了一种含有内酯基团的医用聚氨酯材料,由以下原料缩聚制得:所述原料包括4,4`-二苯基甲烷二异氰酸酯、丁二醇、聚四氢呋喃和含丁内酯基团的物质;所述含丁内酯基团的物质中至少含两个羟基基团;丁内酯基团在医用聚氨酯材料中的摩尔质量浓度为5~20mmol/g。本发明提供的医用聚氨酯材料在干燥状态下内酯基团是闭环状态,可保持聚氨酯的疏水性,从而不影响聚氨酯材料的挤出成型;在水相环境中或者在体内时,内酯基团发生水解开环反应,增加聚氨酯材料的亲水性,降低聚氨酯材料的弹性模量。实验结果表明:上述医用聚氨酯材料按照gb/t1040制成5b型样条后,23℃下的弹性模量为1040~1318mpa;37℃的磷酸盐缓冲溶液(ph7.4)中24h后的吸水率为3.9%~7.0%,弹性模量下降为62~154mpa,下降率为87.5~95.3%。将本发明制备的聚氨酯材料精密挤出成导管,所得导管在干燥条件下具有较高的刚性,在37℃的水中浸泡24h后,刚性显著降低,表现为导管的压缩载荷下降85~92.5%。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!