一种高分辨率熔解曲线鉴定耳念珠菌的方法与流程
本发明涉及菌种鉴定领域,特别涉及一种高分辨率熔解曲线鉴定耳念珠菌的方法。
背景技术:
耳念珠菌是新发多重耐药真菌,于2009年首次报道于日本,美国首例耳念珠菌报道于2013年。但自2016年以来,美国监测发现耳念珠菌在纽约、新泽西、芝加哥等地发生率快速升高,并出现大量院感暴发案例。其次,在美国发现的耳念珠菌,除对经典抗真菌药物——氟康唑高度耐药以外,50%以上的菌株对伏立康唑耐药,约1/3的菌株对两性霉素b耐药。其中特别是对两性霉素b耐药,在临床常见的念珠菌菌种中十分少见,使得该菌更受关注。随后在英国、印度等多个国家地区发现了高度耐药耳念珠菌,以及耳念珠菌引起院感暴发的案例,使该种病原获得了全球的关注。美国疾病控制与预防中心已将耳念珠菌列入“紧急威胁”名单。在耳念珠菌引起的真菌血症中,30天死亡率达39%、90天死亡率达58%。我国首例耳念珠菌感染于2018年6月在北京报道,截止目前我国共报道耳念珠菌感染18例。对耳念珠菌的准确鉴定对临床诊断、治疗和感染控制十分重要。
然而,传统临床实验室鉴定方法无法将其准确鉴定,或可能发生错误鉴定。使用聚合酶链式反应(pcr)对菌种核糖体dna转录间区进行扩增及核酸序列测定是物种鉴定的“金标准”,但操作复杂、耗时较长。
技术实现要素:
为解决现有技术中存在的问题,本发明提供一种用于非诊断和治疗目的高分辨率熔解曲线鉴定耳念珠菌的方法,可以明确鉴定耳念珠菌并与相近菌株的进行区分,方法操作简单,准确高效。
一种高分辨率熔解曲线鉴定耳念珠菌的方法,包括如下步骤:
步骤一、准备待鉴定菌株包括耳念珠菌和对照菌株的dna模板;
步骤二、设计上下游引物;
步骤三、利用高分辨率溶解曲线技术hrm,获取各菌株高分辨溶解曲线图,具体为利用real-timepcr技术,通过实时检测dna熔解过程中荧光信号值的变化获取各菌株高分辨溶解曲线图;
步骤四、利用分析软件分析鉴定待鉴定菌株的具体类型;
步骤五、测定步骤三中结果为阳性菌株的核苷酸序列;
步骤六、验证鉴定方法的灵敏度。
高分辨溶解曲线技术hrm的基本原理:双链核苷酸(doublestranddna,dsdna)的热稳定性受其长度和碱基组成的影响,序列变化会导致升温过程中dsdna解链行为的改变。因为所用的荧光染料只能嵌入并结合到dsdna上,因此利用实时pcr技术,通过实时检测dsdna熔解过程中荧光信号值的变化,就能以生成不同形状熔解曲线的方式将pcr产物中存在的差异直观地展示出来。同时,借助于专业性的分析软件就可以对测试群体实现基于不同形状熔解曲线的基因分型或归类。
优选的是,步骤一中对照菌株为近似同源物种希木龙念珠菌菌种复合体中各物种及变种,包括:candidahaemulonii-希木龙念珠菌,candidahaemuloniivar.vulnera-希木龙念珠菌vulnera变种,candidaduobushaemulonii-伪希木龙念珠菌,candidapseudohaemulonii-假希木龙念珠菌;
其他念珠菌物种:candidakrusei-克柔念珠菌,candidatropicalis-热带念珠菌,candidaalbicans-白念珠菌,candidanivariensis-尼瓦利亚念珠菌,candidabracarensis-布加拉念珠菌,candidaglabrata-光滑念珠菌,candidametapsilosis-似平滑念珠菌,candidaorthopsilosis-拟平滑念珠菌,candidaparapsilosis-近平滑念珠菌;
其他真菌物种:aspergillussydowii-聚多曲霉,aspergillusflavus-黄曲霉,alternariaalternate-链格孢菌,cladosporiumsphaerospermum-球孢枝孢菌,curvularialunata-月状弯孢菌,fusariumsolani-茄病镰刀菌,hortaeawerneckii-威尼克外瓶霉,kodamaeaohmeri-奥默柯达菌,talaromycesfuniculosus-绳状篮状菌,trichophytonrubrum-红色毛癣菌;
对照菌株选取上述菌中的部分菌株或全部菌株。
在上述任一方案中优选的是,步骤二中
上游引物为5'-cgtagtatgacttgcagacg-3',
下游引物为5'-gcgggtagtcctacctgat-3'。
在上述任一方案中优选的是,步骤二中上下游引物使用primer3引物设计软件进行设计,产物长度为200bp。
在上述任一方案中优选的是,步骤三中real-timepcr反应体系包括2×taqmanqpcrmix(takara)15μl、上,下游引物各0.9μl、roxreferencedyeⅱ(100×)0.3μl、evagreen,20×inwater1.5μl、dna模板2μl,用灭菌纯水补足体系至30μl。
在上述任一方案中优选的是,步骤三中real-timepcr反应条件为预变性:95℃10min;95℃15s,62℃40s,35个循环,升降温速度1.6℃/s。
在上述任一方案中优选的是,步骤三中高分辨溶解曲线技术hrm程序为:95℃10s,60℃1min,(0.025℃/s升温至)95℃15s,60℃15s,以1.6℃/s速率升降温,连续检测荧光强度。
在上述任一方案中优选的是,步骤四中利用high-resolutionmeltinganalysis软件进行结果分析。
在上述任一方案中优选的是,步骤五中鉴定出的阳性结果菌株candidaduobushaemulonii-伪希木龙念珠菌核苷酸序列如seqidno:1所示。
在上述任一方案中优选的是,步骤五中鉴定出的阳性结果菌株candidahaemulonii-希木龙念珠菌核苷酸序列如seqidno:2所示。
在上述任一方案中优选的是,步骤五中鉴定出的阳性结果菌株candidahaemuloniivar.vulnera-希木龙念珠菌vulnera变种核苷酸序列如seqidno:3所示。
在上述任一方案中优选的是,步骤五中鉴定出的阳性结果菌株candidapseudohaemulonii-假希木龙念珠菌核苷酸序列如seqidno:4所示。
在上述任一方案中优选的是,步骤五中鉴定出的阳性结果菌株candidaauris-耳念珠菌核苷酸序列如seqidno:5所示。
在上述任一方案中优选的是,步骤六中以10倍稀释耳念珠菌dna模板,验证鉴定方法的灵敏度,验证得出其最低检测限为7×10-5ng/ul。
本发明提供高分辨率熔解曲线鉴定耳念珠菌的方法,可以明确鉴定耳念珠菌并与相近的菌株进行区分,方法操作简单,准确高效。
附图说明
图1为按照本发明实施例1pcr扩增δrn与cycle关系图;
图2为按照本发明的图1所示实施例1的hrm测定的荧光值与温度曲线图;
图3为hrm测定的candidaauris-耳念珠菌与candidaduobushaemulonii-伪希木龙念珠菌荧光值与温度曲线对比图;
图4为hrm测定的candidaauris-耳念珠菌与candidahaemuloniivar.vulnera-希木龙念珠菌vulnera变种荧光值与温度曲线对比图;
图5为hrm测定的candidaauris-耳念珠菌与candidahaemulonii-希木龙念珠菌荧光值与温度曲线对比图;
图6为hrm测定的candidaauris-耳念珠菌与candidapseudohaemulonii-假希木龙念珠菌荧光值与温度曲线对比图;
图7为按照本发明的图1所示实施例1的灵敏度验证结果图。
具体实施方式
下面结合具体实施例对本发明作进一步说明,但本发明并不限于以下实施例。
实施例1
下述实施例中,如无特殊说明,均为常规方法。
准备实验菌株为candidaauris-耳念珠菌(c.auris);
对照菌株为近似同源物种希木龙念珠菌菌种复合体中各物种及变种,包括:candidahaemulonii(c.haemulonii)-希木龙念珠菌,candidahaemuloniivar.vulnera(c.haemuloniivar.vulnera)-希木龙念珠菌vulnera变种,candidaduobushaemulonii(c.duobushaemulonii)-伪希木龙念珠菌,candidapseudohaemulonii(c.pseudohaemulonii)-假希木龙念珠菌;
其他念珠菌物种:candidakrusei-克柔念珠菌,candidatropicalis-热带念珠菌,candidaalbicans-白念珠菌,candidanivariensis-尼瓦利亚念珠菌,candidabracarensis-布加拉念珠菌,candidaglabrata-光滑念珠菌,candidametapsilosis-似平滑念珠菌,candidaorthopsilosis-拟平滑念珠菌,candidaparapsilosis-近平滑念珠菌;
其他真菌物种:aspergillussydowii-聚多曲霉,aspergillusflavus-黄曲霉,alternariaalternate-链格孢菌,cladosporiumsphaerospermum-球孢枝孢菌,curvularialunata-月状弯孢菌,fusariumsolani-茄病镰刀菌,hortaeawerneckii-威尼克外瓶霉,kodamaeaohmeri-奥默柯达菌,talaromycesfuniculosus-绳状篮状菌,trichophytonrubrum-红色毛癣菌。
实验菌株和对照菌株均来自中国医院侵袭性真菌病监测网(chif-net)研究,模板dna是从实验菌株和对照菌株提取的基因组dna。基因组dna提取,使用qiaampdnaminikit(qiagen公司,货号51306),相关操作遵从说明书执行。
引物设计:上下游引物使用primer3引物设计软件进行设计,产物长度200bp
上游引物为5'-cgtagtatgacttgcagacg-3',
下游引物为5'-gcgggtagtcctacctgat-3'。
实时pcr(real-timepcr)反应体系与条件:
real-timepcr反应体系:包括2×taqmanqpcrmix(takara)15μl、上,下游引物各0.9μl、roxreferencedyeⅱ(100×)0.3μl、evagreen,20×inwater1.5μl、dna模板2μl,用灭菌纯水补足体系至30μl。
real-timepcr反应条件为:预变性:95℃10min;95℃15s,62℃40s,35个循环,升降温速度1.6℃/s。hrm程序为:95℃10s,60℃1min,(0.025℃/s升温至)95℃15s,60℃15s,以1.6℃/s速率升降温,连续检测荧光强度。
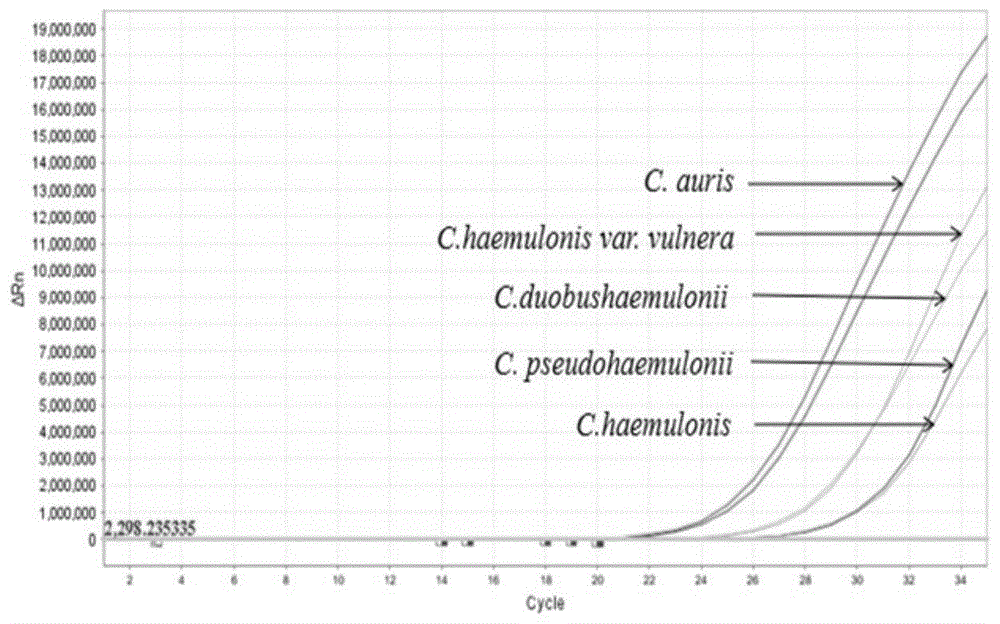
使用abiquantstudio6flex荧光定量pcr仪测定,high-resolutionmeltinganalysis软件进行结果分析,如图1-图6所示。
图1所示结果表明所设计引物pcr扩增耳念珠菌及耳念珠菌近似同源物种—希木龙念珠菌菌种复合体各物种,结果阳性。其他念珠菌物种、其他真菌物种扩增阴性。
一代测序双脱氧核苷酸终止法测定阳性pcr产物,测序所需引物即为本研究设计的引物序列。
鉴定出的阳性结果菌株candidaduobushaemulonii-伪希木龙念珠菌核苷酸序列如seqidno:1所示。
鉴定出的阳性结果菌株candidahaemulonis-希木龙念珠菌核苷酸序列如seqidno:2所示。
鉴定出的阳性结果菌株candidahaemuloniivar.vulnera-希木龙念珠菌变种核苷酸序列如seqidno:3所示。
鉴定出的阳性结果菌株candidapseudohaemulonii-假希木龙念珠菌核苷酸序列如seqidno:4所示。
鉴定出的阳性结果菌株candidaauris-耳念珠菌核苷酸序列如seqidno:5所示。
熔解曲线是指随温度升高dna的双螺旋结构降解程度的曲线。熔解曲线分析可以用来确定不同的反应产物,包括非特异性产物。总的dna双螺旋结构降解一半的温度称为熔解温度(tm),不同序列的dna,tm值不同。dna中g-c含量越高,tm值越高,成正比关系。扩增反应完成后,通过逐渐增加温度同时监测每一步的荧光信号来产生熔解曲线,熔解温度上有一特征峰(tm,dna双链解链50%的温度),用这个特征峰就可以将特异产物与其它产物如引物二聚体区分开。
进行hrm分析结果如图2所示,耳念珠菌及耳念珠菌近似同源物种—希木龙念珠菌菌种复合体各物种有熔解曲线,且均为单峰型;但不同菌种有不同的熔解曲线。其他念珠菌物种、其他真菌物种未出现熔解曲线。其中,candidaauris的tm值为84.390℃,candidahaemulonii的tm值为83.601℃,candidahaemuloniivar.vulnera的tm值为83.656℃,candidaduobushaemulonii的tm值为85.044℃,candidapseudohaemulonii的tm值为84.853℃。
耳念珠菌与希木龙念珠菌菌种复合体各物种hrm可明显区分,见图3-图6。
灵敏度验证
用qubit测定原始质粒的浓度,采用公式:拷贝数/微升=(6.02×1023)×(ng/μl×10-9)/(dna长度×660),将其单位转换为拷贝数/微升。用超纯水对模板进行10倍梯度稀释,使其终浓度依次为7ng/ul、7×10-1ng/ul、7×10-2ng/ul、7×10-3ng/ul、7×10-4ng/ul、7×10-5ng/ul。以10倍稀释耳念珠菌dna模板对上述实验方法进行灵敏度验证,其最低检测限为7×10-5ng/ul。结果如图7所示。
实施例2
下述实施例中,如无特殊说明,均为常规方法。
准备实验菌株为candidaauris-耳念珠菌(c.auris);
对照菌株为近似同源物种希木龙念珠菌菌种复合体中各物种及变种,包括:candidahaemulonii(c.haemulonii)-希木龙念珠菌,candidahaemuloniivar.vulnera(c.haemuloniivar.vulnera)-希木龙念珠菌vulnera变种,candidaduobushaemulonii(c.duobushaemulonii)-伪希木龙念珠菌,candidapseudohaemulonii(c.pseudohaemulonii)-假希木龙念珠菌;
其他念珠菌物种:选取实施1中的部分菌种:candidakrusei-克柔念珠菌,candidatropicalis-热带念珠菌,candidaalbicans-白念珠菌,candidanivariensis-尼瓦利亚念珠菌,candidabracarensis-布加拉念珠菌;
其他真菌物种:选取实施1中的部分菌种:aspergillussydowii-聚多曲霉,aspergillusflavus-黄曲霉,alternariaalternate-链格孢菌,cladosporiumsphaerospermum-球孢枝孢菌,curvularialunata-月状弯孢菌。
实验菌株和对照菌株均来自中国医院侵袭性真菌病监测网(chif-net)研究,模板dna是从实验菌株和对照菌株提取的基因组dna。基因组dna提取,使用qiaampdnaminikit(qiagen公司,货号51306),相关操作遵从说明书执行。
引物设计:上下游引物使用primer3引物设计软件进行设计,产物长度200bp
上游引物为5'-cgtagtatgacttgcagacg-3',
下游引物为5'-gcgggtagtcctacctgat-3'。
实时pcr(real-timepcr)反应体系与条件:
real-timepcr反应体系:包括2×taqmanqpcrmix(takara)15μl、上,下游引物各0.9μl、roxreferencedyeⅱ(100×)0.3μl、evagreen,20×inwater1.5μl、dna模板2μl,用灭菌纯水补足体系至30μl。
real-timepcr反应条件为:预变性:95℃10min;95℃15s,62℃40s,35个循环,升降温速度1.6℃/s。hrm程序为:95℃10s,60℃1min,(0.025℃/s升温至)95℃15s,60℃15s,以1.6℃/s速率升降温,连续检测荧光强度。
使用abiquantstudio6flex荧光定量pcr仪测定,high-resolutionmeltinganalysis软件进行结果分析。
灵敏度验证
用qubit测定原始质粒的浓度,采用公式:拷贝数/微升=(6.02×1023)×(ng/μl×10-9)/(dna长度×660),将其单位转换为拷贝数/微升。用超纯水对模板进行10倍梯度稀释,使其终浓度依次为7ng/ul、7×10-1ng/ul、7×10-2ng/ul、7×10-3ng/ul、7×10-4ng/ul、7×10-5ng/ul,按照上述体系及反应条件下进行灵敏度验证,其最低检测限为7×10-5ng/ul。以10倍稀释耳念珠菌dna模板对上述实验方法进行灵敏度验证。
实施例3
下述实施例中,如无特殊说明,均为常规方法。
准备实验菌株为candidaauris-耳念珠菌(c.auris);
对照菌株为近似同源物种希木龙念珠菌菌种复合体中各物种及变种,包括:candidahaemulonii(c.haemulonii)-希木龙念珠菌,candidahaemuloniivar.vulnera(c.haemuloniivar.vulnera)-希木龙念珠菌vulnera变种,candidaduobushaemulonii(c.duobushaemulonii)-伪希木龙念珠菌,candidapseudohaemulonii(c.pseudohaemulonii)-假希木龙念珠菌;
其他念珠菌物种:选取实施1中的部分菌种:candidaglabrata-光滑念珠菌,candidametapsilosis-似平滑念珠菌,candidaorthopsilosis-拟平滑念珠菌,candidaparapsilosis-近平滑念珠菌;
其他真菌物种:选取实施1中的部分菌种:fusariumsolani-茄病镰刀菌,hortaeawerneckii-威尼克外瓶霉,kodamaeaohmeri-奥默柯达菌,talaromycesfuniculosus-绳状篮状菌,trichophytonrubrum-红色毛癣菌。
其他步骤同实施例1。
本领域技术人员不难理解,本发明的一种高分辨率熔解曲线鉴定耳念珠菌的方法包括上述发明说明书的发明内容和具体实施方式部分的任意组合,限于篇幅并为使说明书简明而没有将这些组合构成的方案一一描述。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
sequencelisting
<110>中国医学科学院北京协和医院
<120>一种高分辨率熔解曲线鉴定耳念珠菌的方法
<130>2019
<160>5
<170>patentinversion3.5
<210>1
<211>358
<212>dna
<213>candidaduobushaemulonii伪希木龙念珠菌
<400>1
taaactttaccaaacctgttttagatttataaaacccaccagttaagttcaattaaacaa60
aatataaaactttcaacaacggatctcttggttctcgcatcgatgaagaacgcagcgaaa120
tgcgatacgtagtatgacttgcagacgtgaatcatcgaatctttgaacgcacattgcgcc180
ttggggcattctccaaggcatgcctgtttgagcgtgatttcttctcaccgcccaggtggt240
tttgcatccgctaaataacatatccgcagcgaagtctacgctttcactgcaccatgctat300
ttcctcaaatcaggtaggactacccgctgaacttaagcatatcaataagcggaggaac358
<210>2
<211>348
<212>dna
<213>candidahaemulonii希木龙念珠菌
<400>2
aaaaaacttttttcaaactttgttttgattaaaagcaaccaccgttaagttcaaaaatct60
aaaacaaaactttcaacaacggatctcttggttctcgcatcgatgaagaacgcagcgaat120
tgcgatacgtagtatgacttgcagacgtgaatcatcgaatctttgaacgcatattgcgcc180
ttggggcattccccaaggcatgcctgtttgagcgtgatatcttctcaccgttggtggatt240
tgtttctaaatatcatgccacagtgaagtctacgctttcactgctttttcccctcaaatc300
aggtaggactacccgctgaacttaagcatatcaataagcggaggaata348
<210>3
<211>352
<212>dna
<213>candidahaemuloniivar.vulnera希木龙念珠菌vulnera变种
<400>3
ttttaatacttttttaaacttttggtttacgttaaaaaaccctcctgttatgttcaaaaa60
tctataaagaaaactttcaacaacggatctcttggttctcgcatcgatgaagaacgcagc120
gaattgcgatacgtagtatgacttgcagacgtgaatcatcgaatctttgaacgcatattg180
cgccttggggcattccccaaggcatgcctgtttgagcgtgatatcttctcacccttggtg240
gatttgtttctaaatatcatgccacagtgaagtctacgctttcactgctttttcccctca300
aatcaggtaggactacccgctgaacttaagcatatcaataagcggaggaaag352
<210>4
<211>299
<212>dna
<213>candidapseudohaemulonii假希木龙念珠菌
<400>4
tacccctttctttcatacaaacggattctcttggttctcgcatcgatgaagaacgcagcg60
aaatgcgatacgtagtatgacttgcagacgtgaatcatcgaatctttgaacgcacattgc120
gccttggagcattctccaaggcatgcctgtttgagcgtgatttcttctcaccgcacggtg180
gttttgcatccgctaaatatcattccagcagcgaagtctacgctttcactgctccatgct240
atttcctcaaatcaggtaggactacccgctgaacttaagcatatcaataagcggaggaa299
<210>5
<211>347
<212>dna
<213>candidaauris耳念珠菌
<400>5
taataaacctaaaaccccaaccgttaagttcaactaaaacaaaaacataaaactttcaac60
aacggatctcttggttctcgcatcgatgaagaacgcagcgaaatgcgatacgtagtatga120
cttgcagacgtgaatcatcgaatctttgaacgcacattgcgccttggggtattccccaag180
gcatgcctgtttgagcgtgatgtcttctcaccaatcttcgcggtggcgttgcattcacaa240
aattacagcttgcacgaaaaaaatctacgctttttttttcgttttgttgtcgcctcaaat300
caggtaggactacccgctgaacttaagcatatcaataagcggaggaa347
- 还没有人留言评论。精彩留言会获得点赞!