一种利用低熔点琼脂糖观察小鼠卵母细胞动态变化的方法与流程
本发明属于生物技术领域,具体涉及一种利用低熔点琼脂糖观察小鼠卵母细胞动态变化的方法。
背景技术:
卵母细胞是两性生殖细胞中的一种。在父本精子与母本卵子受精的时候,父本精子仅仅提供遗传物质dna,而受精卵的其他一切的营养物质、能量物质、结构组织以及一半的遗传物质dna等都来源于母本卵子。因此,卵母细胞质量对后期能否成功受精,或受精以后受精卵以及早期胚胎的质量具有重要的影响。另外,从人口统计学和流行性病理学中我们已经广泛认识到,当女性年龄达到35周岁以后,随着女性年龄的增加,其卵母细胞质量越来越差。因此,能够准确了解高龄卵母细胞发育过程与青年的相比,有何种差别以及在不同处理条件下它们有何种动态变化,具有非常重要的意义。小鼠作为一个很好的实验模型,为人类疾病的诊治以及基因的功能探索提供理论水平和分子水平上的借鉴。
传统方法研究小鼠卵母细胞的内在机制都是在失活的小鼠卵母细胞中进行。随着科学技术的发展,人们借助显微镜和成像系统,能够体外实时观察小鼠卵母细胞的动态变化。但是,由于小鼠卵母细胞处于存活状态,会运动,而且常常移动到显微镜视野以外,导致图像丢失。为了试验的需要,人们常常在活细胞工作站的小培养箱中安装灌流装置,灌流装置类似于中国已公开的两篇专利申请中(cn201626959u,cn201626960u)的装置。但是,这种装置操作和安装都比较复杂。活细胞工作站一般都在公共平台上,安装一个灌流装置在小培养箱中会影响其他人做实验。如果使用完后就拆掉装置,需要用时就安装上去,整个过程会比较繁琐。此外,运用此装置处理卵母细胞时药品和培养液均较多,残留的液体也比较多。
技术实现要素:
有鉴于此,本发明提供了一种利用低熔点琼脂糖观察小鼠卵母细胞实时动态变化的方法,利用低熔点琼脂糖的30℃成胶特性,稳定和培养卵母细胞,有利于活细胞实时成像观察更加广泛的应用,简化了不同处理条件下多枚单一小鼠卵母细胞实时成像观察。
本发明提供了一种利用低熔点琼脂糖观察小鼠卵母细胞动态变化的方法,包括如下步骤:
s1.将低熔点琼脂糖粉末放入培养液中,在70℃下充分溶解,配置质量体积浓度为1%的低熔点琼脂糖溶液;
s2.培养皿中滴入培养液液滴,将小鼠的卵母细胞放入所述培养液液滴,得到活细胞培养液滴;
s3.将步骤s1制备得到的质量体积浓度为1%的低熔点琼脂糖溶液覆盖到所述活细胞培养液滴上,得到质量体积浓度为0.67%的含有活细胞的低熔点琼脂糖溶液;
s4.将步骤s3制备得到的含有活细胞的低熔点琼脂糖溶液室温冷却,得到活细胞琼脂糖凝胶;
s5.将观察液加入到装有所述活细胞琼脂糖凝胶的培养皿中,然后放置到活细胞工作站的观察箱中进行实时观察,所述观察箱的条件为37℃,5%co2。
优选的,所述步骤s5还包括通过移液枪更换观察液,以实现不同液体环境下小鼠卵母细胞的观察。
优选的,所述培养液为ksom溶液。
优选的,所述小鼠卵母细胞可以为生发泡时期卵母细胞、第一次减数分裂中期卵母细胞和第二次减数分裂中期卵母细胞中的一种。
优选的,步骤s2中所述活细胞培养液滴中卵母细胞在同一水平面上。
优选的,步骤s2中所述培养液液滴的量为10μl。
优选的,步骤s3中质量体积浓度为1%的低熔点琼脂糖溶液的量为20μl。
本发明利用低熔点琼脂糖30℃成胶特点,稳定和培养卵母细胞,并进行实时动态观察,与现有技术相比具有以下技术效果:本发明利用了低熔点琼脂糖价格低廉、无毒性、高筛过性和高透明性等特性,以一种操作和装置均简单的方法实现了不同处理条件下多枚小鼠卵母细胞实时动态变化的观察,解决了以往不同处理条件下实时观察多枚小鼠卵母细胞的仪器装置和操作的复杂性,避免了换液和实时监测过程中由于小鼠卵母细胞移动到显微镜视野以外而导致图像丢失的问题。
附图说明
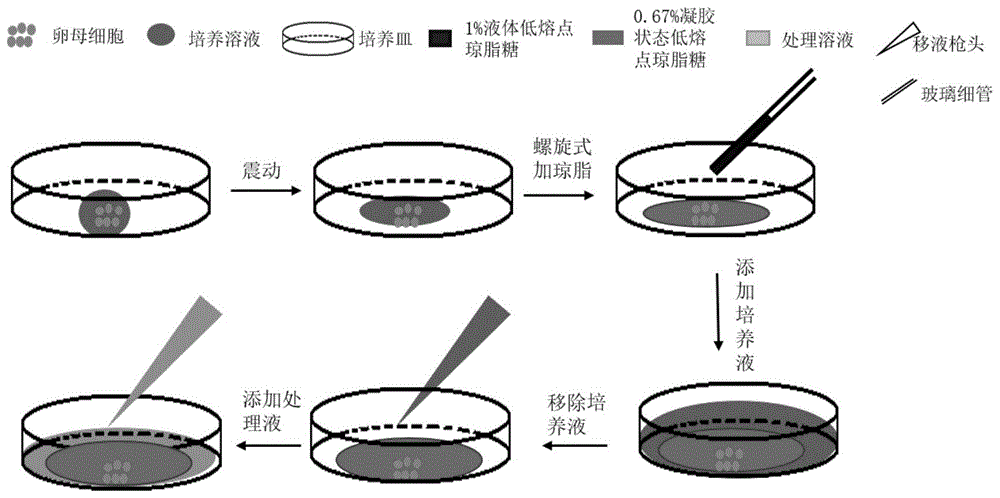
图1为本发明实施例提供的利用低熔点琼脂糖观察小鼠卵母细胞动态变化的操作流程示意图。
图2为本发明实施例中,不同处理液条件下小鼠生发泡期卵母细胞内ph值的动态变化图。
图3为本发明实施例中,不同处理液条件下小鼠第一次减数分裂期卵母细胞内ph值的动态变化图。
图4为本发明实施例中,不同处理液条件下小鼠第二次减数分裂期卵母细胞内ph值的动态变化图。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的的所有其他实施例,都属于本发明保护的范围。
如图1所示,本发明提供了一种利用低熔点琼脂糖观察小鼠卵母细胞实时动态变化的方法,包括以下步骤:
s1.将低熔点琼脂糖粉末放入培养溶液中,在70℃下充分溶解,配置质量体积浓度为1%的低熔点琼脂糖溶液;
s2.取培养液液滴,放入小鼠的卵母细胞,得到活细胞培养液滴;
s3.将步骤s1制备得到的质量体积浓度为1%的低熔点琼脂糖溶液覆盖到所述活细胞培养液滴上,得到质量体积浓度为0.67%的含有活细胞的低熔点琼脂糖溶液;
s4.将步骤s3制备得到的含有活细胞的低熔点琼脂糖溶液室温冷却,得到活细胞琼脂糖凝胶;
s5.将观察液加入到装有所述活细胞琼脂糖凝胶的培养皿中,然后放置到活细胞工作站的观察箱中进行实时观察,所述观察箱的条件为37℃,5%co2。
步骤s1中,本发明首先将低熔点琼脂糖粉末放入培养液中,混合均匀后,在70℃下充分溶解,溶解时间优选2h,配置成质量体积浓度为1%的低熔点琼脂糖溶液;本发明对低熔点琼脂糖粉的来源没有特殊限制,采用本领域人员所熟知的市售商品即可。
步骤s2中,本发明将多枚活小鼠卵母细胞放入到培养液液滴中,轻微振动装有培养液液滴的培养皿使培养液滴与培养皿的接触面积增大,液滴高度变矮。本发明中培养液液滴的量优选为10μl,这样有利于在稍微震动时,增加液滴与培养皿的接触表面积,另外有利于培养皿在移动过程中,卵母细胞不易被晃动。
步骤s3中,本发明将制备得到的质量体积浓度为1%的低熔点琼脂糖溶液覆盖到所述活细胞培养液滴上,具体覆盖的方式优选为将低熔点琼脂糖溶液通过比较粗的细玻管,以多枚小鼠卵母细胞为中心,画圆螺旋覆盖到活细胞培养液滴上。由于活细胞培养液滴会稀释质量体积浓度为1%的低熔点琼脂糖溶液,因此加入的质量体积浓度为1%的低熔点琼脂糖溶液的量控制在使低熔点琼脂糖溶液的浓度为0.67%g/ml,即20μl。另外,添加量为20μl还可以减少在不同处理条件下残留液体对小鼠卵母细胞动态变化的影响以及观察液到达卵母细胞的时间。相比于其他浓度的低熔点琼脂糖溶液,质量体积浓度为0.67%的低熔点琼脂糖溶液具有高筛过性,减少不同处理条件下液体覆盖多枚小鼠卵母细胞的时间。另外,质量体积浓度为0.67%的低熔点琼脂糖溶液得到的凝胶透明好,不影响小鼠卵母细胞成像的清晰度。
步骤s4中,本发明将步骤s3得到的质量体积浓度为0.67%的含有活细胞的低熔点琼脂糖溶液在室温下冷却,冷却时间优选为10min,冷却后得到含有活细胞的琼脂糖凝胶。
步骤s5中,将观察液加入到步骤s4的活细胞琼脂糖凝胶的培养皿中,然后放置到活细胞工作站观察箱中进行实时观察,所述观察箱的条件为37℃,5%co2。
本发明中观察液是指根据实验观察需要处理之后的ksom培养溶液。本发明中培养箱选择共聚焦显微镜的活细胞观察箱(37℃,5%co2),调好共聚焦一系列参数以及捕获多枚小鼠卵母细胞实时动态变化的图像。由于活细胞在固定琼脂糖凝胶中,因此,本发明实施例还包括移液枪更换观察液,以实现不同液体环境的观察。
实施例1
称量0.1克低熔点琼脂糖粉末放入到10ml的ksom培养溶液中,混合均匀后70℃水溶2小时,让其充分溶解。
将预先孵育20minph值敏感染料bcecf-am的多枚小鼠生发泡期卵母细胞放入到10μl的ksom培养液滴中,通过轻微震动培养皿使ksom培养液滴与培养皿的接触面积增大,液滴高度变矮。然后将配置好的20μl37℃液体状态下1%低熔点琼脂通过比较粗的口吸管以多枚小鼠生发泡期卵母细胞为中心画圆螺旋覆盖到上述准备好的ksom培养液滴上,由于ksom培养液会稀释1%低熔点琼脂糖,使其浓度降到0.67%左右。室温冷却10min,等琼脂糖凝胶后向细胞培养皿中加入37℃ksom培养溶液。
将细胞培养皿放入共聚焦显微镜的活细胞观察箱中(37℃,5%co2),设置好共聚焦显微镜一系列参数,在显微镜下找到多枚小鼠生发泡期卵母细胞的焦平面,并在成像系统上显示多枚小鼠生发泡期卵母细胞的图像。利用490nm激发波长和525nm释放波长,以及440nm激发波长和525释放波长来记录多枚小鼠生发泡期卵母细胞内ph值的实时动态变化。在系统时间一栏中设置1min采集图像一次,连续采集10min①。通过200μl的移液枪将ksom培养溶液移除,然后加入氯离子移除的ksom培养溶液,1min采集图像一次,连续采集15min②。随后通过200μl的移液枪将氯离子移除的ksom培养溶液移除,加入含有500μmdids的ksom培养溶液,1min采集图像一次,连续采集10min③。通过200μl移液枪将含有500μmdids的ksom培养溶液移除,然后加入ksom培养溶液,1min采集图像一次,连续采集15min④。
通过上述采集的图像,换算成小鼠生发泡时期多枚卵母细胞内的平均ph值,如图2所示。
图2说明小鼠生发泡时期卵母细胞膜上的cl-/hco3-交换器活率比较高,同时这种交换器活率能够被dids试剂所抑制。根据图2可以发现在不同处理液条件下,生发泡时期卵母细胞内ph值的发生较大的变化。
实施例2
称量0.1克低熔点琼脂糖粉末放入到10ml的ksom培养溶液中,混合均匀后70℃水溶2小时,让其充分溶解。
将预先孵育20minph值敏感染料bcecf-am的多枚小鼠第一次减数分裂中期(mi)卵母细胞放入到10μl的ksom培养液滴中,通过轻微震动培养皿使ksom培养液滴与培养皿的接触面积增大,液滴高度变矮。然后将配置好的20μl37℃液体状态下1%低熔点琼脂通过比较粗的口吸管以多枚小鼠mi期卵母细胞为中心画圆螺旋覆盖到上述准备好的ksom培养液滴上,由于ksom培养液会稀释1%低熔点琼脂糖,使其浓度降到0.67%左右。室温冷却10min,等琼脂糖凝胶后向细胞培养皿中加入37℃ksom培养溶液。
将细胞培养皿放入共聚焦显微镜的活细胞观察箱中(37℃,5%co2),设置好共聚焦显微镜一系列参数,在显微镜下找到多枚小鼠mi期卵母细胞的焦平面,并在成像系统上显示多枚小鼠mi期卵母细胞的图像。利用490nm激发波长和525nm释放波长,以及440nm激发波长和525释放波长来记录多枚小鼠mi期卵母细胞内ph值的实时动态变化。在系统时间一栏中设置1min采集图像一次,连续采集10min⑤。通过200μl的移液枪将ksom培养溶液移除,然后加入氯离子移除的ksom培养溶液,1min采集图像一次,连续采集15min⑥。随后通过200μl的移液枪将氯离子移除的ksom培养溶液移除,加入含有500μmdids的ksom培养溶液,1min采集图像一次,连续采集10min⑦。通过200μl移液枪将含有500μmdids的ksom培养溶液移除,然后加入ksom培养溶液,1min采集图像一次,连续采集15min⑧。
通过上述采集的图像,换算成小鼠mi期时期多枚卵母细胞内的平均ph值,如图3。
图3说明小鼠mi时期卵母细胞膜上的cl-/hco3-交换器活率一般,同时这种交换器活率能够被dids试剂所抑制。根据图3可以发现,在不同处理液条件下,mi时期卵母细胞内ph值的发生了一些变化。
实施例3
称量0.1克低熔点琼脂糖粉末放入到10ml的ksom培养溶液中,混合均匀后70℃水溶2小时,让其充分溶解。
将预先孵育20minph值敏感染料bcecf-am的多枚小鼠第二次减数分裂中期(mii)卵母细胞放入到10μl的ksom培养液滴中,通过轻微震动培养皿使ksom培养液滴与培养皿的接触面积增大,液滴高度变矮。然后将配置好的20μl37℃液体状态下1%低熔点琼脂通过比较粗的口吸管以多枚小鼠mii期卵母细胞为中心画圆螺旋覆盖到上述准备好的ksom培养液滴上,由于ksom培养液会稀释1%低熔点琼脂糖,使其浓度降到0.67%左右。室温冷却10min,等琼脂糖凝胶后向细胞培养皿中加入37℃ksom培养溶液。
将细胞培养皿放入共聚焦显微镜的活细胞观察箱中(37℃,5%co2),设置好共聚焦显微镜一系列参数,在显微镜下找到多枚小鼠mii期卵母细胞的焦平面,并在成像系统上显示多枚小鼠mii期卵母细胞的图像。利用490nm激发波长和525nm释放波长,以及440nm激发波长和525释放波长来记录多枚小鼠mii期卵母细胞内ph值的实时动态变化。在系统时间一栏中设置1min采集图像一次,连续采集10min⑨。通过200μl的移液枪将ksom培养溶液移除,然后加入氯离子移除的ksom培养溶液,1min采集图像一次,连续采集15min⑩。随后通过200μl的移液枪将氯离子移除的ksom培养溶液移除,加入含有500μmdids的ksom培养溶液,1min采集图像一次,连续采集10min⑾。通过200μl移液枪将含有500μmdids的ksom培养溶液移除,然后加入ksom培养溶液,1min采集图像一次,连续采集15min⑿。
通过上述采集的图像,换算成小鼠mii期时期多枚卵母细胞内的平均ph值,如图4。
图4说明小鼠mii时期卵母细胞膜上的cl-/hco3-交换器活率几乎为0。根据图4可以发现,在不同处理液条件下,mii时期卵母细胞内ph值的变化比较小。
综合图2-图3,可以发现,采用本发明方法不仅可以固定活细胞有利于活细胞实时成像观察,而且不影响小鼠卵母细胞成像的清晰度,另外,采用本发明方法还可以实现不同液体环境下的活细胞实施成像观察,不同处理条件下残留液体对小鼠卵母细胞动态变化的影响较小。
本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的技术方案及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!