一种肉制品中PCR反应检测鼠源性成分的体系及方法与流程
本发明涉及动物源性成分检测
技术领域:
,更具体地说,涉及一种肉制品中pcr反应检测鼠源性成分的体系及方法。
背景技术:
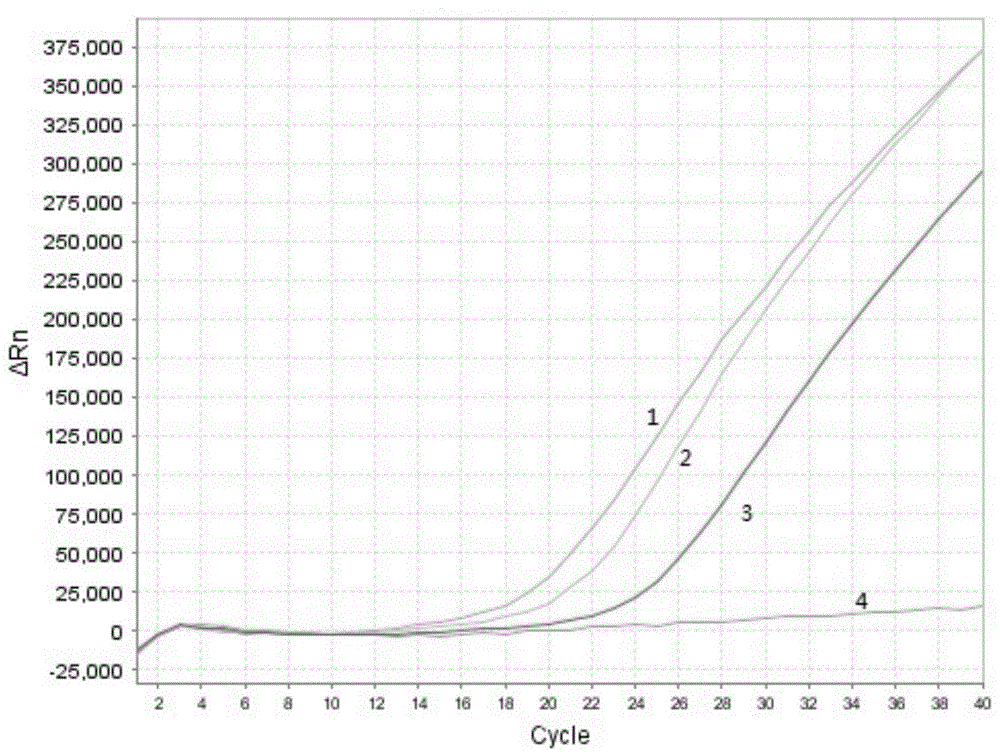
:目前,我国对动物源性成分的检测普遍采用pcr扩增这种分子生物学方法,针对包括鼠源性成分的动物源性成分检测的专利和文章也都是针对细胞色素b设计引物探针,再进行pcr扩增。而16srrna基因在结构与功能上具有高度的保守性,由于大小适中,能利用测序技术较容易地得到其序列,被分类学家所接受,但少有用于动物源性成分检测的报道,未见应用于鼠源性成分检测。我们根据鼠细胞线粒体中16srrna基因设计引物探针,对食品中鼠源性成分进行检测,为快速检测鼠源性成分提供了新的途径。技术实现要素:本发明要解决的技术问题在于,提供一种灵敏度高、检测方便快捷的肉制品中pcr反应检测鼠源性成分的体系及方法。本发明解决其技术问题所采用的技术方案是:构造一种肉制品中pcr反应检测鼠源性成分的方法,包括以下步骤:s1、提取待测样品dna;s2、设计引物和荧光标记探针:以16srrna基因为参考,从genbank中获取基因序列作为模板,合成引物和荧光标记探针;上游引物f的碱基序列:5’-tccaggtcggtttctatc-3’;下游引物r的碱基序列:5’-tctgccaccctaataacc-3’荧光标记探针序列p的碱基序列:5’-fam-agtacgaaaggaca-mgb-3’;s3、建立实时荧光pcr反应体系:将步骤s1提取的待测样品dna作为模板;将实时荧光pcr反应混合液、所述dna模板、所述上游引物、所述下游引物、所述荧光标记探针、rox参比染料混合并采用双蒸水补足,建立所述实时荧光pcr反应体系;s4、pcr扩增反应:将所述实时荧光pcr反应体系置于95℃的温度条件下进行预变性反应;再将置于95℃的温度条件下进行变性反应,并于60℃的温度条件下退火,依次循环30~45次,于60℃收集荧光信号;s5、分析鼠源性成分:测定并计算实时荧光pcr反应物的平均ct值,并判断待测样品中是否含有鼠源性成分;当ct值≤35.0,则判定为待测样品含有鼠源性成分;当ct值≥40.0,则判定为待测样品不含有鼠源性成分;当35.0<ct值<40.0,则重复步骤s1~s4,当再次扩增后ct值仍为<40.0,则判定待测样品含有鼠源性成分;当再次扩增后ct值≥40.0,则判定为待测样品不含有鼠源性成分。优选地,所述s1步骤包括以下步骤:取待测样品于离心管中,加入裂解液,进行离心反应并于离心后取其上清液;加入溶剂混匀;加入沉淀剂以形成沉淀,去除上清液,并对所述沉淀进行洗涤,晾干;加入溶剂溶解所述沉淀,制成dna溶液并于-20℃保存待用;或者,所述s1步骤包括采用dna提取试剂盒,提取待测样品的组织中的基因组dna。优选地,所述dna溶液的浓度为10μg/ml~100μg/ml,且a260/a280吸光值比在1.7~1.9之间。优选地,在所述s3步骤中,所述上游引物的浓度为10μmol/l。优选地,在所述s3步骤中,所述下游引物的浓度为10μmol/l;优选地,在所述s3步骤中,所述荧光标记探针的浓度为10μmol/l。优选地,在所述s3步骤中,所述上游引物与所述荧光标记探针的用量比例可以为1:1;所述下游引物与所述荧光标记探针的用量比例可以为1:1。优选地,在所述s3步骤中,各组分的体积比为:实时荧光pcr反应混合液:50%;上游引物:4%;下游引物:4%;荧光标记探针:4%;待测样品dna模板:4%;rox参比染料:1%双蒸水:余量。优选地,在所述s4步骤中,通过将所述实时荧光pcr反应体系置于荧光pcr仪上并设定对应参数以进行pcr扩增。本发明肉制品中pcr反应检测鼠源性成分的体系,应用于本发明所述的肉制品中pcr反应检测鼠源性成分的方法,包括实时荧光pcr反应混合液、上游引物、下游引物、荧光标记探针、待测样品dna模板、rox参比染料、双蒸水;其中,上游引物f的碱基序列:5’-tccaggtcggtttctatc-3’;下游引物r的碱基序列:5’-tctgccaccctaataacc-3’荧光标记探针序列p的碱基序列:5’-fam-agtacgaaaggaca-mgb-3’。实施本发明的一种检测食品中鼠源性成分的荧光pcr反应体系及方法,具有以下有益效果:该肉制品中pcr反应检测鼠源性成分的方法,其首先通过提取待测样品dna,其次,以16srrna基因为参考,将上游引物f的碱基序列设计为5’-tccaggtcggtttctatc-3’,将下游引物r的碱基序列设计为5’-tctgccaccctaataacc-3’,将荧光标记探针序列p的碱基序列设计为5’-fam-agtacgaaaggaca-mgb-3’;接着,将实时荧光pcr反应混合液、rox参比染料与上述物质混合并采用双蒸水补足,建立实时荧光pcr反应体系,并进行pcr扩增反应和鼠源性成分分析,从而实现对食品中鼠源性成分进行检测。该肉制品中pcr反应检测鼠源性成分的方法具有操作简便、检测灵敏度和检测精度高、成本低且省时省力的优点,规范了鼠源性成分荧光pcr检测方法中特异性和灵敏性的验证和评估。本发明的检测食品中鼠源性成分的实时荧光pcr反应体系,其可用于本发明的肉制品中pcr反应检测鼠源性成分的方法,其由实时荧光pcr反应混合液、待测样品的dna模板、f的碱基序列为5’-tccaggtcggtttctatc-3’的上游引物、r的碱基序列为5’-tctgccaccctaataacc-3’的下游引物、p的碱基序列为:5’-fam-agtacgaaaggaca-mgb-3’的荧光标记探针、的rox参比染料混合制得,其具有检测结果可靠、灵敏度高的优点。附图说明下面将结合附图及实施例对本发明作进一步说明,附图中:图1是本发明检测食品中鼠源性成分的实时荧光pcr反应体系的引物和探针的扩增图;图2示出了本发明肉制品中pcr反应检测鼠源性成分的方法的流程图;图3是本发明实施例1肉制品中pcr反应检测鼠源性成分的方法特异性实验的扩增图;图4是本发明实施例2用本发明肉制品中pcr反应检测鼠源性成分的方法检测黄胸鼠灵敏度实验的扩增图;图5是本发明实施例2用本发明肉制品中pcr反应检测鼠源性成分的方法检测小家鼠的灵敏度实验的扩增图;图6是本发明实施例2用本发明肉制品中pcr反应检测鼠源性成分的方法检测褐家鼠的灵敏度实验的扩增图;图7是本发明实施例3用本发明肉制品中pcr反应检测鼠源性成分的方法检测黄胸鼠的重复性实验的扩增图;图8是本发明实施例3用本发明肉制品中pcr反应检测鼠源性成分的方法检测小家鼠的重复性实验的扩增图;图9是本发明实施例3用本发明肉制品中pcr反应检测鼠源性成分的方法检测褐家鼠的重复性实验的扩增图;图10是本发明实施例4用本发明肉制品中pcr反应检测鼠源性成分的方法检测食品中鼠源性成分模拟混合肉样的鼠源性成分的扩增图。具体实施方式为了对本发明的技术特征、目的和效果有更加清楚的理解,现对照附图详细说明本发明的具体实施方式。本发明的肉制品中pcr反应检测鼠源性成分的体系,其可用于检测肉制品中鼠源性成分,其包括实时荧光pcr反应混合液(premixextaq(probeqpcr))、上游引物、下游引物、荧光标记探针、待测样品dna模板、rox参比染料(roxreferencedye∥)以及双蒸水。该实时荧光pcr反应体系其通过将上述组分充分混合均匀,并进行瞬时离心制得。其中,实时荧光pcr反应混合液(premixextaq(probeqpcr))为可通过市购获得的常规产品,其占该实时荧光pcr反应体系总体积的50%。其中,上游引物f的碱基序列为5’-tccaggtcggtttctatc-3’,下游引物r的碱基序列为5’-tctgccaccctaataacc-3’,荧光标记探针序列p的碱基序列为5’-fam-agtacgaaaggaca-mgb-3’;该上游引物与该荧光标记探针的用量比例可以为1:1;该下游引物与该荧光标记探针的用量比例可以为1:1;该上游引物、下游引物及其荧光标记的探针均占该实时荧光pcr反应体系总体积的4%。优选地,该上游引物的浓度为10μmol/l、下游引物的浓度为10μmol/l、荧光标记探针的浓度为10μmol/l。该引物所对应的16srrna序列是通过对不同鼠种进行全基因组比对找到的,并且目前是第一次被用于鼠源性成分鉴定,其一级结构具有相对保守性,二级结构又具有螺旋差异性,因此16srrna被认为是进化速度比较适中的基因,可用于对动物源性成分检测。图1为肉制品中pcr反应检测鼠源性成分的体系的建立。当引物和探针的比例为1:1时,在保证检测的灵敏度的前提下,1:1的比例更早形成扩增曲线,同时节约探针用量,因此荧光pcr反应体系中引物和探针的比例确定为1:1,即引物和探针的终浓度分别为0.4μmol/l,检测结果如图1所示。图1中,1-3:引物与探针比例分别为2:1、1:1和2:3;4:空白对照。该上游引物、下游引物及其荧光标记的探针均可从ncbi上搜索黄胸鼠、小家鼠、褐家鼠的全基因组信息,从genbank中获取基因序列作为模板设计出,本次实验的靶基因是根据genbank收录的16srrna基因参考序列而设计出,其中靶基因在genbank登录号及位置分别是:褐家鼠nc_001665.2,1094-2664;黄胸鼠nc_011638.1,1094-2659;小家鼠nc_005089.1,1094-2675。该待测样品的dna模板,其可从待测样品中提取出,其浓度为10μg/ml~100μg/ml,且a260/a280吸光值比在1.7~1.9之间,因此其适宜pcr扩增,在本实施例中,其可浓度可以优选为10μg/ml~60μg/ml,且其占该实时荧光pcr反应体系总体积的4%。rox参比染料(roxreferencedye∥)占该实时荧光pcr反应体系总体积的1%;双蒸水可用来补足该实时荧光pcr反应体系总体积,其为余量。参照takara公司生产的试剂盒进行配制,每份检测样品的食品中鼠源性成分实时荧光pcr体系(25μl)如下:组分体积(μl)premixextaq(probeqpcr)(2×)12.5上游引物(10μmol/l)1.0下游引物(10μmol/l)1.0荧光标记探针(10μmol/l)1.0模板dna1.0roxreferencedye‖(50×)0.25灭菌双蒸水8.25总体积25图2示出了本发明肉制品中pcr反应检测鼠源性成分的方法:包括以下步骤:s1、提取待测样品dna,具体地,称取待测样品,并取待测样品置于离心管中,加入裂解液,进行离心反应;离心反应后取其上清液;加入溶剂混匀;加入沉淀剂以形成沉淀,去除上清液,并对该沉淀进行洗涤,晾干;加入溶解剂溶解沉淀,制成dna溶液,并于-20℃保存待用。其中,裂解液的量可以为600ul~800ul,加入裂解液后还可以置于恒温水浴中进行裂解反应30min;离心反应后取其上清液加入的溶剂可以为三氯甲烷和异戊醇的混合溶剂,其比例可以为三氯甲烷/异戊醇24:1;当然,可以理解地,在其他一些实施例中,不限于三氯甲烷和异戊醇的混合溶剂;其中,沉淀剂可以为预冷的异丙醇;可以理解地,在其他一些实施例中,不限于预冷的异丙醇;其中,溶解沉淀的溶解剂可以为乙醇,可以理解地,在其他一些实施例中,该溶剂不限于乙醇。当然,可以理解地,在其他一些实施例中也可以采用dna提取盒提取样品dna;该dna提取盒提取待测样品dna等效上述待测dna提取过程。s2、设计引物和荧光标记探针,以16srrna基因为参考,该上游引物、下游引物及其荧光标记的探针均可从ncbi上搜索黄胸鼠、小家鼠、褐家鼠的全基因组信息,这三种鼠16srrna基因序列如下:黄胸鼠:2493ctgagttcagaccggagcaatccaggtcggtttctatctattcacaatttctcccagtac25522553gaaaggacaagagaaatggagccaccttacc-ataagtgctcccaaaccaatttatgaaa26112612aaaactcaataaaatatgtatgtacaacaaattcacctagaccaggttattagggtggca26712672gagccaggtaattgcgtaagacttaaaaccttgttcccagaggttcaaatcctctcccta2731小家鼠:2492taaagtcctacgtgatctgagttcagaccggagcaatccaggtcggtttctatctattta25512552cgatttctcccagtacgaaaggacaagagaaatagagccaccttacaaataagcgctctc26112612aacttaatttatgaataaaatctaaataaaatatatacgtacaccctcta-acctagaga26702671aggttattagggtggcagagccaggaaattgcgtaagacttaaaaccttgttcccagagg2730褐家鼠:2513gcaatccaggtcggtttctatctatttacaatttctcccagtacgaaaggacaagagaaa25722573tggagcctccttaccataagtgctccc-aaccaatttatgaaaaaaatctcaataaagta26312632tatatgtacaataaattaaacctagcccaggttattagggtggcagagccaggtaattgc2691在本实施例中,该上游引物f的碱基序列为5’-tccaggtcggtttctatc-3’、下游引物r的碱基序列为5’-tctgccaccctaataacc-3’、荧光标记探针序列p的碱基序列为5’-fam-agtacgaaaggaca-mgb-3’。s3、建立实时荧光pcr反应体系。将实时荧光pcr反应混合液(premixextaq(probeqpcr))、上游引物、下游引物、荧光标记探针、待测样品dna模板、rox参比染料(roxreferencedye∥)混匀,并采用双蒸水补足,并通过离心反应制得。s4、pcr扩增反应,具体地,将步骤s3建立的实时荧光反应体系置于荧光pcr仪上,设置pcr仪的参数,将该实时荧光pcr反应体系置于95℃的温度条件下进行预变性反应,预变性反应的时间可以为20秒,再将其置于95℃的温度条件下进行变性反应,变性的时间可以为3秒,当然,其可以根据时间情况延长变性时间;将变性后的实时荧光反应体系置于60℃的温度条件下退火,退火的时间为30秒,并依次循环30~45次,优选为,循环40次,然后在60℃的温度条件下收集荧光信号。s5、分析鼠源性成分,具体地,通过采用荧光pcr仪,测定并计算出实时荧光pcr反应物的平均ct值,并判断出待测样品中是否含有鼠源性成分。在本实施例中,当ct值≤35.0,则判定为待测样品含有鼠源性成分(阳性);当ct值≥40.0,则判定为待测样品不含有鼠源性成分(阴性);当35.0<ct值<40.0,则重复步骤s1~s4,当再次扩增后ct值仍为<40.0,则判定待测样品含有鼠源性成分(阳性);当再次扩增后ct值≥40.0,则判定为待测样品不含有鼠源性成分(阴性)。现通过具体实施例并结合附图来对本发明肉制品中pcr反应检测鼠源性成分的方法做进一步陈述。材料及仪器试剂实施例中,takarapremixextaqtm试剂盒购自宝生物工程(大连)有限公司、引物和探针均由宝生物工程(大连)有限公司合成;ctab裂解液、三氯甲烷、异戊醇、异丙醇、75%乙醇、双蒸水以及其它常规化学试剂购自深圳埃斯特公司。仪器实施例中,采用的仪器有abi7500fast荧光pcr仪、eppendorf5415d离心机、台式离心机、振荡器、nanodrop超微量分光光度计、恒温水浴锅。样品实施例中所用黄胸鼠、小家鼠、褐家鼠由深圳出入境检验检疫局保健中心惠赠,绵羊、山羊、鱼、牛、鸭、猪、鸡、鹅、驴、马、兔、鹿、狗十六种动物的肌肉样品购自市场,并经验证。上述动物肌肉样品均经粉碎处理后,再提取基因组dna。实施例1:肉制品中pcr反应检测鼠源性成分的方法特异性实验。应用以上建立的肉制品中pcr反应检测鼠源性成分的方法,检测黄胸鼠、小家鼠、褐家鼠、绵羊、山羊、鱼、牛、鸭、猪、鸡、鹅、驴、马、兔、鹿、狗十六种动物中提取的dna,以检测建立实验的特异性。s1、提取待测样品dna。具体地,称取上述混匀样品0.2g于1.5ml离心管中,加入600μl~800μl裂解液,置于65℃恒温水浴锅中反应30min,期间每隔10min振荡混匀;置于离心机中进行离心反应,离心机的转速为12000r/min且离心时间为5min;并将离心后的混合溶液转移上清液于洁净离心管中,加400μl三氯甲烷/异戊醇(24:1),混匀;再次置于离心机中进行离心反应,离心机的转速为12000r/min且离心时间为5min;将离心后的混合溶液静置,取其上清液;向该上清液加0.8倍体积预冷的异丙醇,以形成沉淀;再次置于离心机中进行离心反应,离心机的转速为12000r/min,且离心时间为5min;将离心后的混合溶液静置,弃其上清液;向离心管中加入75%乙醇洗涤一次并晾干;再向离心管中加入50μl双蒸水溶解沉淀,制成dna溶液,置于-20℃的温度条件下保存待用。s2、设计引物和荧光标记探针。上游引物f:5’-tccaggtcggtttctatc-3’下游引物r:5’-tctgccaccctaataacc-3’探针序列p:5’-fam-agtacgaaaggaca-mgb-3’探针5’端和3’端分别标记fam、mgb,或者可以选择标记其它荧光基团及其相应的淬灭基团。s3、实时荧光pcr反应体系的建立与优化。反应体系:总体积为25μl。包括实时荧光pcr反应混合液12.5μl、模板dna(100±50ngdna)1μl、引物对(10μm)各1μl、探针(10μm)分别按照1.5μl、1μl和0.5μl加入到反应体系中、补足双蒸水至总体积25μl。实时荧光pcr反应混合液也可采用商业化的实时荧光pcr反应母液。s4、pcr扩增反应。建立的实时荧光反应体系置于荧光pcr仪上,将该实时荧光pcr反应体系置于95℃的温度条件下进行预变性反应20秒,再将其置于95℃的温度条件下进行变性3秒;将变性后的实时荧光反应体系置于60℃的温度条件下退火,退火的时间为30秒,并依次循环40次,然后在60℃的温度条件下收集荧光信号。s5、分析鼠源性成分。如图3所示,采用食品中鼠源性成分实时荧光pcr方法,检测黄胸鼠、小家鼠、褐家鼠≥40.0,为阳性,其它样品ct值≤35.0,无扩增信号,为阴性,表明所建立的实时荧光pcr检测体系具有良好的特异性。图2中,1:黄胸鼠;2:小家鼠;3:褐家鼠;4-13:绵羊、山羊、鱼、牛、鸭、猪、鸡、鹅、驴、马、兔、鹿、狗;14:空白对照。实施例2:肉制品中pcr反应检测鼠源性成分的方法灵敏度实验。将黄胸鼠、小家鼠、褐家鼠的dna样分别作100、10-1、10-2、10-3、10-4、10-5、10-6稀释,检测所设计引物和探针的灵敏度。s1、提取待测样品dna。具体地,称取上述混匀样品0.2g于1.5ml离心管中,加入600μl~800μl裂解液,置于65℃恒温水浴锅中反应30min,期间每隔10min振荡混匀;置于离心机中进行离心反应,离心机的转速为12000r/min且离心时间为5min;并将离心后的混合溶液转移上清液于洁净离心管中,加400μl三氯甲烷/异戊醇(24:1),混匀;再次置于离心机中进行离心反应,离心机的转速为12000r/min且离心时间为5min;将离心后的混合溶液静置,取其上清液;向该上清液加0.8倍体积预冷的异丙醇,以形成沉淀;再次置于离心机中进行离心反应,离心机的转速为12000r/min,且离心时间为5min;将离心后的混合溶液静置,弃其上清液;向离心管中加入75%乙醇洗涤一次并晾干;再向离心管中加入50μl双蒸水溶解沉淀,制成dna溶液,置于-20℃的温度条件下保存待用。采用nanodrop超微量分光光度计对已提取的黄胸鼠、小家鼠和褐家鼠的dna进行浓度测试,测得的结果分别为50.1ng/μl、48.5ng/μl和52.3ng/μl。用超纯水10倍梯度稀释三种鼠肉dna,直至10-6。s2、设计引物和荧光标记探针。上游引物f:5’-tccaggtcggtttctatc-3’下游引物r:5’-tctgccaccctaataacc-3’探针序列p:5’-fam-agtacgaaaggaca-mgb-3’探针5’端和3’端分别标记fam、mgb,或者可以选择标记其它荧光基团及其相应的淬灭基团。s3、实时荧光pcr反应体系的建立与优化。反应体系:总体积为25μl。包括实时荧光pcr反应混合液12.5μl、模板dna(100±50ngdna)1μl、引物对(10μm)各1μl、探针(10μm)分别按照1.5μl、1μl和0.5μl加入到反应体系中、补足双蒸水至总体积25μl。实时荧光pcr反应混合液也可采用商业化的实时荧光pcr反应母液。s4、pcr扩增反应。建立的实时荧光反应体系置于荧光pcr仪上,将该实时荧光pcr反应体系置于95℃的温度条件下进行预变性反应20秒,再将其置于95℃的温度条件下进行变性3秒;将变性后的实时荧光反应体系置于60℃的温度条件下退火,退火的时间为30秒,并依次循环40次,然后在60℃的温度条件下收集荧光信号。s5、分析鼠源性成分。图4为用本发明的肉制品中pcr反应检测鼠源性成分的方法检测黄胸鼠的灵敏度,图5为用本发明的肉制品中pcr反应检测鼠源性成分的方法检测小家鼠的灵敏度;图6为用本发明的肉制品中pcr反应检测鼠源性成分的方法检测褐家鼠的灵敏度;其中a-h曲线分别表示不同浓度的dna溶液;a:100,b:10-1,c:10-2,d:10-3,e:10-4,f:10-5,g:10-6,h:空白对照。由如图4至图6所示,dna浓度在100~10-6之间时,其ct值≤35.0,则可检测到待测样品含有鼠源性成分(为阳性)。本方法检测极限至少可达10-5鼠肉样品dna浓度,说明所建立的方法的检测灵敏度可达到皮克级。实施例3:检测食品中鼠源性成分实时荧光pcr方法的重复性实验。荧光pcr方法对黄胸鼠、小家鼠、褐家鼠的dna样品进行三次检测,每个样品每次做8个重复管。s1、提取待测样品dna。具体地,称取上述混匀样品0.2g于1.5ml离心管中,加入600μl~800μl裂解液,置于65℃恒温水浴锅中反应30min,期间每隔10min振荡混匀;置于离心机中进行离心反应,离心机的转速为12000r/min且离心时间为5min;并将离心后的混合溶液转移上清液于洁净离心管中,加400μl三氯甲烷/异戊醇(24:1),混匀;再次置于离心机中进行离心反应,离心机的转速为12000r/min且离心时间为5min;将离心后的混合溶液静置,取其上清液;向该上清液加0.8倍体积预冷的异丙醇,以形成沉淀;再次置于离心机中进行离心反应,离心机的转速为12000r/min,且离心时间为5min;将离心后的混合溶液静置,弃其上清液;向离心管中加入75%乙醇洗涤一次并晾干;再向离心管中加入50μl双蒸水溶解沉淀,制成dna溶液,置于-20℃的温度条件下保存待用。采用nanodrop超微量分光光度计对已提取的黄胸鼠、小家鼠和褐家鼠的dna进行浓度测试,测得的结果分别为50.1ng/μl、48.5ng/μl和52.3ng/μl。用超纯水10倍梯度稀释三种鼠肉dna,直至10-6。s2、设计引物和荧光标记探针。上游引物f:5’-tccaggtcggtttctatc-3’下游引物r:5’-tctgccaccctaataacc-3’探针序列p:5’-fam-agtacgaaaggaca-mgb-3’探针5’端和3’端分别标记fam、mgb,或者可以选择标记其它荧光基团及其相应的淬灭基团。s3、实时荧光pcr反应体系的建立与优化。反应体系:总体积为25μl。包括实时荧光pcr反应混合液12.5μl、模板dna(100±50ngdna)1μl、引物对(10μm)各1μl、探针(10μm)分别按照1.5μl、1μl和0.5μl加入到反应体系中、补足双蒸水至总体积25μl。实时荧光pcr反应混合液也可采用商业化的实时荧光pcr反应母液。s4、pcr扩增反应。建立的实时荧光反应体系置于荧光pcr仪上,将该实时荧光pcr反应体系置于95℃的温度条件下进行预变性反应20秒,再将其置于95℃的温度条件下进行变性3秒;将变性后的实时荧光反应体系置于60℃的温度条件下退火,退火的时间为30秒,并依次循环40次,然后在60℃的温度条件下收集荧光信号。s5、分析鼠源性成分。图7是用本发明的肉制品中pcr反应检测鼠源性成分的方法检测黄胸鼠的重复性实验的扩增图,其中,a~h均为黄胸鼠;i:空白对照;图8是用本发明的肉制品中pcr反应检测鼠源性成分的方法检测小家鼠的重复性实验的扩增图,其中,a~h均为小家鼠;i:空白对照;图9是用本发明肉制品中pcr反应检测鼠源性成分的方法检测褐家鼠的重复性实验的扩增图,其中,a~h均为褐家鼠;i:空白对照。如图7至图9所示,3种样品各8次检测结果之间的cv值都分别小于5%,该方法具有很好的重复性。实施例4:检测食品中鼠源性成分模拟混合肉样的鼠源性成分。为进一步验证鼠源性成分荧光pcr方法的特异性和灵敏性,将鼠肉以不同的比例添加到兔肉中制备模拟混合肉样,模拟混合肉样中鼠肉所占的质量百分百比分别为10%、1%、0.5%。多模拟混合肉样中所提取的dna进行实时荧光pcr检测,以验证该方法多模拟混合肉样中鼠源性成分的抗干扰检测能力。s1、提取待测样品dna。具体地,称取上述混匀样品0.2g于1.5ml离心管中,加入600μl~800μl裂解液,置于65℃恒温水浴锅中反应30min,期间每隔10min振荡混匀;置于离心机中进行离心反应,离心机的转速为12000r/min且离心时间为5min;并将离心后的混合溶液转移上清液于洁净离心管中,加400μl三氯甲烷/异戊醇(24:1),混匀;再次置于离心机中进行离心反应,离心机的转速为12000r/min且离心时间为5min;将离心后的混合溶液静置,取其上清液;向该上清液加0.8倍体积预冷的异丙醇,以形成沉淀;再次置于离心机中进行离心反应,离心机的转速为12000r/min,且离心时间为5min;将离心后的混合溶液静置,弃其上清液;向离心管中加入75%乙醇洗涤一次并晾干;再向离心管中加入50μl双蒸水溶解沉淀,制成dna溶液,置于-20℃的温度条件下保存待用。采用nanodrop超微量分光光度计对已提取的黄胸鼠、小家鼠和褐家鼠的dna进行浓度测试,测得的结果分别为50.1ng/μl、48.5ng/μl和52.3ng/μl。用超纯水10倍梯度稀释三种鼠肉dna,直至10-6。s2、设计引物和荧光标记探针。上游引物f:5’-tccaggtcggtttctatc-3’下游引物r:5’-tctgccaccctaataacc-3’探针序列p:5’-fam-agtacgaaaggaca-mgb-3’探针5’端和3’端分别标记fam、mgb,或者可以选择标记其它荧光基团及其相应的淬灭基团。s3、实时荧光pcr反应体系的建立与优化。反应体系:总体积为25μl。包括实时荧光pcr反应混合液12.5μl、模板dna(100±50ngdna)1μl、引物对(10μm)各1μl、探针(10μm)分别按照1.5μl、1μl和0.5μl加入到反应体系中、补足双蒸水至总体积25μl。实时荧光pcr反应混合液也可采用商业化的实时荧光pcr反应母液。s4、pcr扩增反应。建立的实时荧光反应体系置于荧光pcr仪上,将该实时荧光pcr反应体系置于95℃的温度条件下进行预变性反应20秒,再将其置于95℃的温度条件下进行变性3秒;将变性后的实时荧光反应体系置于60℃的温度条件下退火,退火的时间为30秒,并依次循环40次,然后在60℃的温度条件下收集荧光信号。s5、分析鼠源性成分。图10示出了模拟混合肉样中鼠源性成分的实时荧光pcr检测结果。其中,曲线a~e为不同鼠肉含量的模拟混合肉样;a:鼠肉含量为1.0%的模拟混合肉样;b:鼠肉含量为0.5%的模拟混合肉样;c:鼠肉含量为0.1%的模拟混合肉样;d:兔肉;e:空白对照。如图10所示,鼠肉含量在0.1%、0.5%、1.0%的ct值均≤35.0,由此检测出模拟混合肉样中存在鼠源性成分,兔肉、空白对照中的ct值≥40.0,其中检测出其不含鼠源性成分,因此,与实际相符合。另外,结果显示随着混合模拟肉样中鼠肉成分含量的降低,荧光pcr结果图中ct值也逐渐增大,与样品中目的dna的含量的递减呈相关关系。鼠肉成分含量最低的模拟混合样品(0.1%)中的目的成分也得到良好的扩增,证实所建立的检测体系的在检测目的成分时具有较强的抗干扰能力。对比例为进一步验证鼠源性成分荧光pcr方法的特异性和灵敏性,将鼠肉以不同的比例添加到兔肉中制备模拟混合肉样,模拟混合肉样中鼠肉所占的质量百分百比分别为10%、1%、0.5%。多模拟混合肉样中所提取的dna进行实时荧光pcr检测,以验证该方法多模拟混合肉样中鼠源性成分的抗干扰检测能力。s1、提取待测样品细胞中常规的dna。具体地,称取上述混匀样品0.2g于1.5ml离心管中,加入600μl~800μl裂解液,置于65℃恒温水浴锅中反应30min,期间每隔10min振荡混匀;置于离心机中进行离心反应,离心机的转速为12000r/min且离心时间为5min;并将离心后的混合溶液转移上清液于洁净离心管中,加400μl三氯甲烷/异戊醇(24:1),混匀;再次置于离心机中进行离心反应,离心机的转速为12000r/min且离心时间为5min;将离心后的混合溶液静置,取其上清液;向该上清液加0.8倍体积预冷的异丙醇,以形成沉淀;再次置于离心机中进行离心反应,离心机的转速为12000r/min,且离心时间为5min;将离心后的混合溶液静置,弃其上清液;向离心管中加入75%乙醇洗涤一次并晾干;再向离心管中加入50μl双蒸水溶解沉淀,制成dna溶液,置于-20℃的温度条件下保存待用。采用nanodrop超微量分光光度计对已提取的黄胸鼠、小家鼠和褐家鼠的dna进行浓度测试,测得的结果分别为50.1ng/μl、48.5ng/μl和52.3ng/μl。用超纯水10倍梯度稀释三种鼠肉dna,直至10-6。s2、设计引物和荧光标记探针。上游引物f:5’-cctacttactgttccaatattc-3’;下游引物r:5’-gatgctatggttaggattatg-3’;探针序列p:5’-fam-aactcagcaacaacaatcaacaca-tamra-3’。探针5’端和3’端分别标记fam、mgb,或者可以选择标记其它荧光基团及其相应的淬灭基团。s3、实时荧光pcr反应体系的建立与优化。反应体系:总体积为25μl。包括实时荧光pcr反应混合液12.5μl、模板dna(100±50ngdna)1μl、引物对(10μm)各1μl、探针(10μm)分别按照1.5μl、1μl和0.5μl加入到反应体系中、补足双蒸水至总体积25μl。实时荧光pcr反应混合液也可采用商业化的实时荧光pcr反应母液。s4、pcr扩增反应。建立的实时荧光反应体系置于荧光pcr仪上,将该实时荧光pcr反应体系置于95℃的温度条件下进行预变性反应20秒,再将其置于95℃的温度条件下进行变性3秒;将变性后的实时荧光反应体系置于60℃的温度条件下退火,退火的时间为30秒,并依次循环40次,然后在60℃的温度条件下收集荧光信号。s5、分析鼠源性成分。经检测,鼠肉含量为1.0%的模拟混合肉样的cp值均≤35.0、鼠肉含量为0.5%的模拟混合肉样、鼠肉含量为0.1%的模拟混合肉样、兔肉、空白对照等的cp值均≥40.0,因此在含量最低的模拟混合样品(0.1%)中的目的成分扩增效果较差,证实所建立的检测体系的在检测目的成分时容易受到干扰,并且无法区分不同的鼠样本。可以理解的,以上实施例仅表达了本发明的优选实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制;应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,可以对上述技术特点进行自由组合,还可以做出若干变形和改进,这些都属于本发明的保护范围;因此,凡跟本发明权利要求范围所做的等同变换与修饰,均应属于本发明权利要求的涵盖范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1