一种催化法制备苯并硒吩类化合物的工艺的制作方法
本申请涉及一种催化法制备苯并硒吩类化合物的工艺,属于杂环化合物制备
技术领域:
。
背景技术:
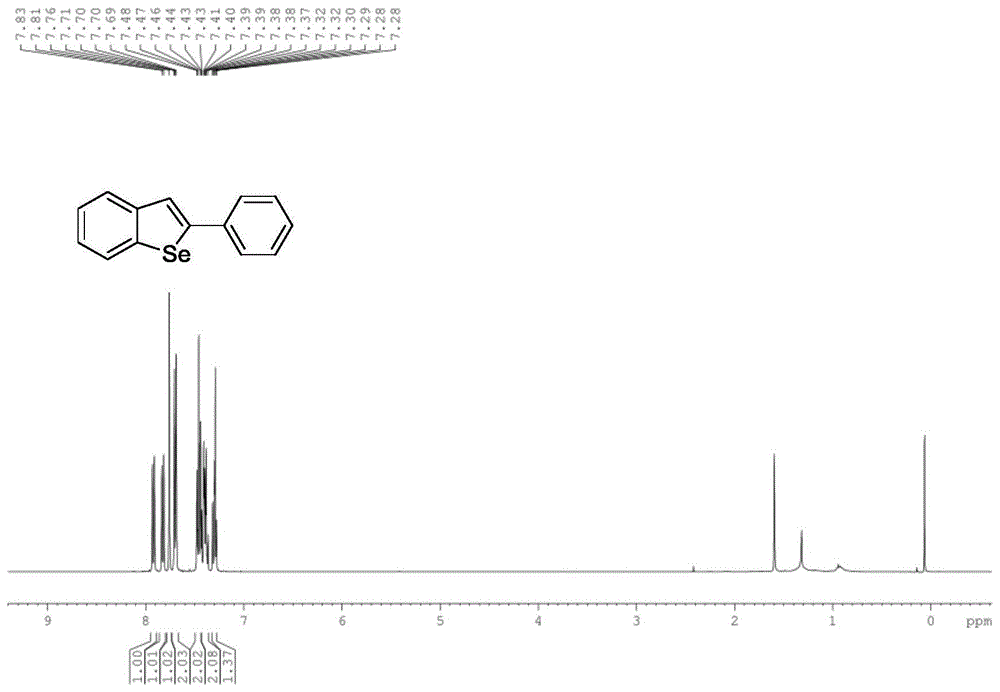
:硒吩作为最简单的五元芳香杂环之一,在有机合成、导电材料和非线性光学材料等方面有着重要的应用。苯并硒吩作为硒吩的一类重要衍生物,在合成液晶聚合物、超导等新材料方面有着良好的应用前景。本发明报道了以2-乙炔基苯甲硒醚衍生物为原料,合成苯并硒吩类化合物的新方法。目前,以该化合物为原料的常用制备方法有以下几种:(1)以2-乙炔基苯甲硒醚衍生物为原料,二氯甲烷或者氯仿为溶剂,与卤素(溴或碘)经过亲电环化得到硒吩环。该法收率可达90%以上,且适用底物广,但是i2、br2用量大,会产生大量含卤素废液,不符合绿色化学的理念,且针对部分底物,反应条件较苛刻。(2)以2-乙炔基苯甲硒醚衍生物为原料,乙醇为溶剂,在卤化钠盐和五水硫酸铜的作用下,亲电环化反应制备苯并硒吩化合物,过柱提纯得产物。该方法具有以下几个优点:环保溶剂,反应条件温和,符合绿色化学的理念;但是所得产物结构单一,均为如式(1)所示结构的含卤化合物,存在一定限制性。(3)以2-乙炔基苯甲硒醚衍生物为原料,甲苯为溶剂,ptcl2为催化剂,在室温下,经环化反应制备苯并硒吩类化合物。该法收率可达99%,条件温和,但是催化剂昂贵,反应中i2、br2用量大,不符合绿色化学理念,难以推广。(4)以2-乙炔基苯甲硒醚衍生物和r4seser4为原料,二氯甲烷为溶剂,六水合氯化铁为催化剂,在回流状态下,制备苯并硒吩类化合物。该法所用催化剂为铁盐,价廉易得,但是含se化合物价格昂贵,成本高,且反应收率不高。技术实现要素:有鉴于此,本申请提供一种氧化银催化进行苯并硒吩类化合物的制备方法,以克服上述现有技术所存在的缺陷。具体的,本申请以2-乙炔基苯甲硒醚衍生物为原料,简洁、价廉、高效的苯并硒吩类化合物合成新方法,化合物结构如(i)所示:制备上述化合物所采取的技术方案如下:在酸性溶剂存在下,以氧化银为催化剂,2-乙炔基苯甲硒醚衍生物为原料,于(10-40)℃一步反应完全,再经中和、萃取、旋干得粗品,过柱分离,得精品苯并硒吩类化合物(i)。上述反应的方程式可表达如下:其中,r为苯基、对甲基苯基、对氟苯基中的任一种。上述方案中,借助于氧化银作为催化剂,在酸性溶剂的存在下,有效提高了原料的活性,不仅可以在低温条件下完成苯并硒吩类化合物的合成,反应条件温和,也可以在3h左右反应完全,反应结束后中和、萃取、旋干、过柱得精品,其收率可保证在(90-96)%,部分情况下甚至更高。与常规制备方法相比,催化剂仅需要氧化银一种,其构成简单、易获取,单纯催化剂这一块就可以很大幅度的降低苯并硒吩类化合物的制备成本,产业化和推广更容易。在上述方案基础上,我们对催化剂的添加量做了进一步的研究,并确定优选的催化剂添加量满足:氧化银的添加量为投料总质量的(1-10)mol%,催化剂在该范围时,既能保证反应活性良好、原料反应速率和转化率均在85%以上,又能很好的控制成本。在实验过程中,我们发现:当催化剂添加量为(5-8)mol%时催化效果最佳,此时,反应速度快且反应稳定,转化效率在90%以上。在上述方案基础上,我们对酸性溶剂做了进一步的研究,并确定优选的酸性溶剂满足:酸性溶剂选用盐酸、硫酸、甲酸、丙酸、特戊酸、醋酸、三氟乙酸中的任一种,反应保持在弱酸性条件下进行,氧化银与原料得以充分接触,并有效控制反应速度和反应方向,保证了成品得率。特别是当采用醋酸或三氟乙酸时,对转化速率和反应方向的控制效果最佳。在上述方案基础上,我们对反应温度做了系统研究,并确定优选的反应参数满足:在40℃以下的低温反应段中,当反应温度为室温(15℃-30℃)时,也能保证成品得率在90-92%范围内,温度过高并不能显著提高得率,相反还额外增加了能耗,不利于成本控制,温度过低则反应活性不佳,反应得率会降低到60%以下,因此,综合考量下,反应温度为(15-30)℃,特别是当反应温度选择在25℃的室温时,反应效果最佳;在上述温度优选范围内,我们对反应时间做了进一步的研究,并确定40℃以下的中低温条件下,反应充分进行需要(2-4)h;当反应在(15-30)℃温度段进行时,最佳状态下反应时间为1.5h时,反应就可充分完成。确定了基本的反应条件后,我们对精制过程进行了研究,并确定优选的精制工艺为:中和采用无机碱中和,优选价廉易得的氢氧化钠,氢氧化钠溶液浓度为1mol/l;萃取采用二氯甲烷;过柱为石油醚:乙酸乙酯=50:1。本申请的有益效果如下:(1)本申请通过酸性溶剂的控制,借助于催化剂氧化银的催化作用,实现了一步反应制备苯并硒吩类化合物,这为该类化合物的制备提供了新方法,该方法反应步骤少,为常温反应,不仅反应温和、反应周期短,且参与反应的原、辅料均为构成简单易得,降低了合成成本。(2)本申请操作简单,适用底物广,在上述催化剂、酸性溶剂以及碱均为常规试剂,反应过程没有特别苛刻的外在要求,具有良好的拓展性,骨架结构上的取代基r具有很好的反应活性,成品收率均可控制在90%以上。(3)上述方法制备得到的苯并硒吩类化合物,为后续导电材料、非线性光学材料等方面的研究提供先导化合物。下面结合具体实施方式对本申请作进一步说明。附图说明图1a-1b依次为2-苯基苯并硒吩(a1)的1h谱图、13c谱图;图2a-2b依次为2-(4-甲基苯基)苯并硒吩(a2)的1h谱图、13c谱图;图3a-3c依次为2-(4-氟苯基)苯并硒吩(a3)的1h谱图、13c谱图、19f谱图。具体实施方式本实施例中使用的分析仪器与设备:核磁共振仪,avancedmxⅱⅰ400m(tms内标,bruker公司);高效液相色谱仪:agilenttechnologies1200series。实施例1:不同催化剂添加量对合成效果的影响在制备过程中,我们尝试了很多种催化剂,并最终确定氧化银的催化效果最佳,采用该催化剂,不仅实现了原料反应活性的改善,还很好的促进了反应的正向进行;随后我们又对催化剂的添加比例进行了实验,具体参见表1。表1不同催化剂添加量对合成效果的影响序号ag2o,mol%收率,%反应状态100不反应20.525反应进行缓慢30.755反应效率偏低4175合成速度低,反应缓慢5380合成稳定,3h内反应充分6590合成稳定,2-3h内反应充分7694合成稳定,2-2.5h内反应充分8895合成稳定,1-2h内反应充分9995合成稳定,1-2h内反应充分101095.8合成稳定,1-2h内反应充分111196反应稳定,但合成不稳定121296反应剧烈,合成不稳定在原料为2-(苯乙炔基)苯甲硒醚(2mmol),以氧化银为催化剂,溶剂为醋酸(20ml)存在下,室温(25℃)搅拌1.5h,随后向反应体系中加入50ml1m的氢氧化钠溶液,用2x30ml二氯甲烷萃取,合并有机相,无水硫酸钠或无水硫酸镁干燥过夜,旋干,用石油醚:乙酸乙酯=50:1过柱,得到目标化合物白色固体;其中催化剂按照表1添加量进行添加,结果表明:当催化剂量偏低(参见表1中的序号1、2、3)时,由于催化剂远远不能满足反应活性需要,反应速率较慢,反应几乎没有进行;增加催化剂量,当催化剂量超过0.5mol%时,反应速率逐渐提高,相应的收率也逐渐提高到75%附近,该收率已经超过了常规制备方法中苯并硒吩类化合物的收率,然而于本方案而言,仍然没有达到较优状态;继续增大催化剂量,我们发现:催化剂量在(5-8)mol%时,反应速率较高,合成物较为稳定,反应持续沿着正向进行,并表现为收率在90%以上;在这个时候,继续增加催化剂量,则由于原料有限,催化效果并不显著,且当催化剂量过量时,由于反应热无法及时释放,还伴随有物料飞溅等反应剧烈现象。综合反应稳定性与合成效率等多因素考虑,适宜将催化剂添加量控制在(1-10)mol%,并优选在(5-8)mol%。实施例2:不同酸性溶剂对合成效果的影响在前期的研究中,我们初步将溶剂定性为酸性溶剂,酸性溶剂可以很好的引导反应正向进行(即2-乙炔基苯甲硒醚衍生物→苯并硒吩类化合物);在进一步的试验中,我们采用相同的原辅料和反应时间,在不同酸构成的溶剂体系中分别进行实验,并综合考虑不同体系中反应终点出现时间、合成物稳定性、合成物纯度等指标,结合表2,结果表明:采用醋酸和三氟乙酸对反应的引导效果最佳,此时,反应保持在中酸性条件下进行,氧化银与原料得以充分接触。表2不同酸性溶剂对合成效果的影响序号酸性溶剂收率(%)1盐酸442硫酸503甲酸534丙酸585特戊酸606三氟乙酸927醋酸96由表1可见:醋酸和三氟乙酸的反应效果好、收率高,故反应溶剂优选醋酸和三氟乙酸。本发明制备的苯并硒吩类化合物如表3所示。表3苯并硒吩类化合物的结构上述结构苯并硒吩类化合物可采用如下制备方法进行具体制备,具体参见实施例3-实施例5。实施例3:2-(苯乙炔基)苯并硒吩(a1)的制备25ml圆底烧瓶中依次加入2-(苯乙炔基)苯甲硒醚(542.4mg,2mmol),氧化银(23.1mg,0.1mmol),醋酸(20ml),室温下(25℃)搅拌反应1.5小时,随后向反应体系中加入50ml1m的氢氧化钠溶液,用2x30ml二氯甲烷萃取,合并有机相,无水硫酸钠或无水硫酸镁干燥过夜,旋干,用石油醚:乙酸乙酯=50:1过柱,得到目标化合物473.2mg,白色固体,收率92%。产物结构为:其1h谱图、13c谱图参见图1a、1b。2-phenylbenzo[b]selenophene1hnmr(400mhz,cdcl3)δ7.92(dd,j=7.9,1.2hz,1h),7.82(dd,j=7.9,1.2hz,1h),7.76(s,1h),7.72–7.66(m,2h),7.48–7.44(m,2h),7.43–7.38(m,2h),7.33–7.26(m,1h);13cnmr(101mhz,cdcl3)δ147.72,143.28,140.96,136.22,128.98,128.29,126.90,125.44,125.41,124.88,124.54,123.07.实施例4:2-(4-甲基苯乙炔基)苯并硒吩(a2)的制备25ml圆底烧瓶中依次加入2-(4-甲基苯乙炔基)苯甲硒醚(570.4mg,2mmol),氧化银(23.1mg,0.1mmol),醋酸(20ml),室温下(25℃)搅拌反应1.5小时,随后向反应体系中加入50ml1m的氢氧化钠溶液,用2x30ml二氯甲烷萃取,合并有机相,无水硫酸钠或无水硫酸镁干燥过夜,旋干,用石油醚:乙酸乙酯=50:1过柱,得到目标化合物520.7mg,白色固体,收率96%。产物结构为:其1h谱图、13c谱图参见图2a-2b。2-(p-tolyl)benzo[b]selenophene1hnmr(400mhz,cdcl3)δ7.92(dd,j=8.1,1.2hz,1h),7.81(dd,j=8.1,1.2hz,1h),7.72(s,1h),7.66–7.55(m,2h),7.42(td,j=7.5,1.2hz,1h),7.35–7.20(m,3h),2.45(s,3h);13cnmr(101mhz,cdcl3)δ147.89,143.41,140.78,138.33,133.45,129.67,126.78,125.43,125.26,124.84,124.37,122.45,21.29.实施例5:2-(4-氟苯乙炔基)苯并硒吩(a3)的制备25ml圆底烧瓶中依次加入2-(4-氟苯乙炔基)苯甲硒醚(578.4mg,2mmol),氧化银(23.1mg,0.1mmol),醋酸(20ml),室温下(25℃)搅拌反应1.5小时,随后向反应体系中加入50ml1m的氢氧化钠溶液,用2x30ml二氯甲烷萃取,合并有机相,无水硫酸钠或无水硫酸镁干燥过夜,旋干,用石油醚:乙酸乙酯=50:1过柱,得到目标化合物495.4mg,白色固体,收率90%。产物结构为:其1h谱图、13c谱图、19f谱图参见图3a-3c。2-(4-fluorophenyl)benzo[b]selenophene1hnmr(400mhz,cdcl3)δ7.90(dd,j=7.9,1.0hz,1h),7.81(dd,j=7.9,1.0hz,1h),7.68–7.60(m,3h),7.41(td,j=7.6,1.1hz,1h),7.33–7.26(m,1h),7.18–7.10(m,2h);13cnmr(101mhz,cdcl3)δ162.77(d,j=248.2hz),146.38,143.22,140.97,132.51(d,j=3.1hz),128.51(d,j=8.1hz),125.40(d,j=2.4hz),124.97,124.60,123.10(d,j=1.2hz),116.05,115.83;19fnmr(376mhz,cdcl3)δ-113.41.当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1