UOX基因敲除小鼠模型及其构建方法与流程
uox基因敲除小鼠模型及其构建方法
技术领域
[0001]
本发明涉及一种基因敲除小鼠模型及其构建方法,属于动物模型及其应用领域。
背景技术:
[0002]
高尿酸血症是由嘌呤代谢紊乱,尿酸排泄障碍引起的血尿酸异常为临床表现的异质性疾病。高尿酸血症易引起痛风、关节变形、慢性间质肾炎,严重影响患者生活质量及行动能力。并且,高尿酸血症易引发并发症。目前尚未有根治高尿酸血症和痛风的药物,新型降尿酸药物开发需要利用高尿酸动物模型进行降尿酸药物药效及药理筛选。故建立稳定性好,更接近患者发病特征的高尿酸动物模型,能提高新型降尿酸药物开发效率及成药性,深化高尿酸血症和痛风发病机制研究,及优化高尿酸血症和痛风治疗格局。
[0003]
现有技术中,如中国专利申请号:cn201811154393,公开了一种痛风性关节炎动物模型的构建方法,该发明选择spf鸡作为实验动物,通过高蛋白高钙饲料喂养建立高尿酸血症模型,将尿酸盐晶体混悬液注入高尿酸血症模型鸡的膝关节腔,包括以下步骤:(1)尿酸盐结晶混悬液的制备;(2)高尿酸血症基础动物模型的建立;(3)痛风性关节炎动物模型的建立。再如中国专利申请号:cn201711312406,公开了一种大鼠持续性高尿酸血症模型的复制方法。该方法步骤具体为将选取的健康大鼠于清洁级的动物饲养室进行适应性喂养1周,将形态特征正常的大鼠用于模型的建立;针对形态特征正常的大鼠,每天于室温下用腹腔注射给药的方式,给予500mg
·
kg-1的尿酸酶抑制剂氧嗪酸钾,同时24h不间断的给予10%的果糖饮水以及充足的饮食。每日连续对大鼠给药造模,持续给药3周。以上模型选择了鸡和大鼠,模型使用的操作难度大。而且,直接注入诱导剂至动物体内构建高尿酸模型的方法,构建的高尿酸模型耗时长,个体变异性大,主观干扰性强,易引起肾损伤及高尿酸模型维持不稳定持久等缺陷。采用高蛋白、高嘌呤、高糖等饮食调整诱发高尿酸动物模型,具有模型间变异性大,易引起并发症,耗时较长的缺点。因此以上问题亟待解决。
[0004]
近年来,crispr/cas9基因编辑技术凭借其简便性、特异性和高效性,在疾病动物模型构建领域应用日趋广泛和深入。crispr/cas9系统主要部件为rna引导的有规则间隔的短回文重复序列sgrna,sgrna能引导cas9酶切蛋白双链断裂目的基因特定位点。非同源性末端接合参与修复dna双链断裂产生突变等位基因。crispr/cas9系统用于基因敲除技术发展时间长,具有高效、专一和成熟等优点。故本发明采用crispr/cas9技术敲除小鼠体内的uox基因,以构建高尿酸血动物模型。小鼠uox基因表达的uox蛋白催化尿酸分解为尿囊素。人体内uox基因在进化过程中突变沉默,尿酸成为嘌呤代谢终末产物直接排泄。若成功基因敲除小鼠uox基因,可使尿酸累积形成高尿酸血模型。
技术实现要素:
[0005]
为解决现有技术存在的模型间变异性大,主观干扰性强,易引起并发症,建模耗时较长,使用有效时间短,操作不方便,生化特性与人差异大的缺陷。
[0006]
本发明提供一种uox基因敲除小鼠模型。
[0007]
本发明还提供一种uox基因敲除小鼠模型的构建方法。
[0008]
本发明还提供一种uox基因敲除小鼠模型在高尿酸血症及痛风疾病的应用。
[0009]
为达到上述目的,本发明采取如下技术手段:
[0010]
(1)选取uox基因(ncbi gene id:22262)编辑。根据uox基因第三号外显子功能域的前部和后部分别设计两条sgrna,设计pcr上游引物uox-sgrna-1、uox-sgrna-2,下游引物。分别将uox-sgrna-1、uox-sgrna-2和t7sg-r0混合,加入扩增试剂和质粒载体混合后进行两次pcr扩增两个sgrna模板。反应条件均为98℃预变性5min;按循环程序(98℃ 30s,60℃ 30s,72℃ 30s)进行35个循环;72℃延伸5min。反应产物进行琼脂糖凝胶电泳。回收纯化琼脂糖凝胶内dna。混合缓冲液、atp、ttp、ctp、gtp、sgrna模板、t7酶、无核酸酶水,37℃孵育2h体外转录,加dnase 1μl,37℃孵育15min;纯化得到sgrna。
[0011]
所述步骤(1)中引物为:
[0012]
uox-sgrna-1:5
’-
attgctagcgtggtttgtgc-3’[0013]
uox-sgrna-2:5
’-
gggctcaagggacctcacacgtc-3’[0014]
t7sg-r0:5
’-
aaaagcaccgactcggtgcc-3’[0015]
(2)用正向引物和反向引物通过pcr扩增cas9 dna。反应条件为98℃预变性5min;按循环程序(98℃30s,60℃30s,72℃30s)进行35个循环;72℃延伸5min。反应产物进行琼脂糖凝胶电泳。回收胶内cas9 dna。纯化、体外转录为cas9 mrna。纯化cas9 mrna。
[0016]
所述步骤(2)中引物为:
[0017]
正向引物:5
’-
ttaatacgactcactatagggagaatggactataaggaccacgac-3’[0018]
反向引物:5
’-
gcgagctctaggaattcttac-3’[0019]
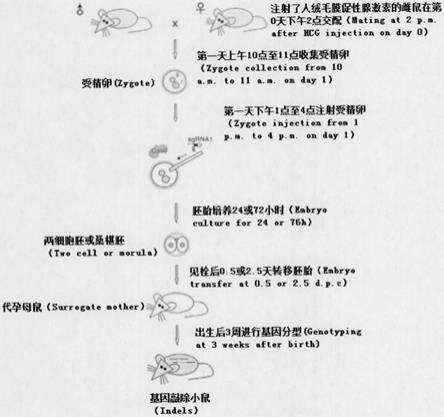
(3)若干只雌鼠超排促卵注射,与雄鼠合笼一夜。见栓雌鼠实施安乐死,手术从输卵管收集卵丘细胞复合体。卵丘细胞复合体用m2培养基洗涤培养原核胚。
[0020]
(4)在显微镜下用显微注射针向原核胚内注射cas9 mrna和sgrna,继续培养胚胎至两细胞胚或桑椹胚,观察胚胎的卵裂和囊胚发育情况。
[0021]
(5)结扎雄鼠与发情的雌鼠合笼,选取见栓后0.5天或2.5天雌鼠作为代孕母鼠,在显微镜下将胚胎移从输卵管移植入代孕母鼠子宫。
[0022]
(6)代孕母鼠生产f0代小鼠。出生后分开饲养雄鼠和雌鼠。取出生后3周f0代小鼠鼠尾dna,设计两个正向验证引物和一个反向验证,用pcr验证基因敲除情况。pcr反应条件为95℃预变性5min;按循环程序(95℃ 30s,60℃ 30s,68℃ 40s)进行30个循环;68℃延伸5min。纯化克隆pcr产物,反应产物测序分析。
[0023]
所述步骤(6)中引物为:
[0024]
uox-check-1f:aagccactccatctttgtcc
[0025]
uox-check-1r:caaaagacacctgccgact
[0026]
uox-check-2f:cgagacctttgcaatgaaca
[0027]
(7)将f0代的基因敲除小鼠与野生型小鼠交配获得后代f1,对f1代小鼠进行突变分析。选择突变的f1代杂合雌鼠和雄鼠交配获得后代f2,对f2代小鼠进行突变分析。对f2代中纯合小鼠进行交配,以构建uox小鼠品系。
[0028]
本发明的有益效果:
[0029]
本发明采用基因敲除小鼠uox基因的方式改造高尿酸模型,有益效果是更真实复
制人嘌呤代谢紊乱引起的高尿酸血症及痛风机制。构建模型的时间较短,模型变异性小,引起并发症可能性小。一次构建模型并得到纯合uox基因敲除小鼠后,后代可继续作为高尿酸血模型使用,模型有效时间增加。并且小鼠模型饲养简单、操作方便、与人同属哺乳动物,生理生化特性与人接近。
附图说明
[0030]
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
[0031]
图1是本发明技术手段(3)至(6)流程图;
[0032]
图2是本发明sgrna转录模板琼脂糖凝胶电泳结果;
[0033]
图3是本发明基因测序结果图;
[0034]
图4是本发明技术手段(7)流程图;
具体实施方式
[0035]
为更好的理解本发明,下面通过具体实施例进一步进行说明。
[0036]
实施例1:小鼠的选择及饲养
[0037]
实验动物为野生型c57bl/6雌鼠(spf级,3-4周龄);野生型雄性c57bl/6小鼠(spf级,6~8周龄),均来自常州卡文斯实验动物有限公司【scxk(苏)2016-0010】。以上小鼠健康及精神状况良好,未发生外伤及残疾。
[0038]
实验动物饲养地址为常州卡文斯实验动物有限公司。饲养环境spf级环境,12h交替昼夜,温度(22
±
4)℃,湿度(55
±
10)%。适应饲养时间1周,饲养期间给予小鼠标准饲料及洁净饮用水,每天更换饮水、垫料和饲料。
[0039]
实施例2:sgrna和cas9rna的获得
[0040]
1.1.引物设计
[0041]
在uox基因第三号外显子功能域的前部和后部分别设计两条sgrna,根据sgrna结构设计pcr上游引物uox-sgrna-1、uox-sgrna-2,下游引物t7sg-ro。引物序列具体如下:
[0042]
uox-sgrna-1:5
’-
attgctagcgtggtttgtgc-3’[0043]
uox-sgrna-2:5
’-
gggctcaagggacctcacacgtc-3’[0044]
t7sg-r0:5
’-
aaaagcaccgactcggtgcc-3’[0045]
1.2.制备转录模板
[0046]
分别将uox-sgrna-1、uox-sgrna-2和t7sg-r0混合,用加入扩增试剂和px330-sgrna载体(购自addgene公司)混合后进行两次pcr扩增sgrna模板。反应条件均为98℃预变性5min;按循环程序(98℃ 30s,60℃ 30s,72℃ 30s)进行35个循环;72℃延伸5min。反应产物进行2%琼脂糖凝胶电泳。回收纯化琼脂糖凝胶内dna。混合缓冲液、atp、ttp、ctp、gtp、sgrna模板、t7酶、无核酸酶水,37℃孵育2h体外转录,加dnase 1μl,37℃孵育15-20min;纯化得到sgrna。sgrna琼脂糖凝胶图见图2,确认两条sgrna序列片段大小符合设计bp大小。
[0047]
1.3.cas9 mrna的体外转录
[0048]
用正向引物和反向引物,加入扩增试剂和px330-cas9载体(购自addgene公司)通过pcr扩增cas9 dna。反应条件为98℃预变性5min;按循环程序(98℃30s,60℃30s,72℃
30s)进行35个循环;72℃延伸5min。反应产物进行2%琼脂糖凝胶电泳。用qiaquick pcr purification kit(购自qiagen公司)纯化胶内cas9pcr产物,用mmessage mmachine t7 kit试剂盒(购自life technologies公司)体外转录cas9 mrna。用megaclear kit(购白life technologies公司)纯化cas9 mrna,用无rsase水稀释。引物序列具体如下:
[0049]
正向引物:5
’-
ttaatacgactcactatagggagaatggactataaggaccacgac-3’[0050]
反向引物:5
’-
gcgagctctaggaattcttac-3’[0051]
实施例3:uox突变小鼠胚胎的获得及移植
[0052]
向若干只雌性c57bl/6小鼠注射10iu pmsg,第二天后注射10 iu hcg,与雄性c57bl/6小鼠合笼一夜。对见栓雌鼠实施安乐死,从输卵管收集卵丘细胞复合体。将卵丘细胞复合体在m2
+
透明质酸酶培养基中洗涤数次,置于35℃至38℃的ksom培养基中,在5%co2,培养箱中培养。
[0053]
用拉针仪和断针仪拉制、弯曲和固定显微注射针。在显微镜下用显微注射针向原核胚内注射cas9 mrna(100ng/μl)和sgrna(50ng/μl),在ksom培养基中继续培养胚胎24h至两细胞胚,观察胚胎的卵裂和囊胚发育情况。结果两细胞胚率为81.7%(58/71),显微注射了cas9蛋白和uox-sgrna的胚胎移植至58个两细胞胚。
[0054]
结扎雄鼠与发情的c57bl/6雌鼠合笼,次日选择见栓0.5天的雌鼠作为代孕母鼠。在体视显微镜下,从代孕母鼠背部找到输卵管,将胚胎移从输卵管移植入子宫。代孕母鼠手术缝合,放入培养间培养观察。将50个囊胚移植到2只代孕母鼠子宫,2只均怀孕,共生产17只小鼠,出生率为34.0%(17/50)。f0代小鼠外观正常,健康状态良好,均无外伤或感染发生。
[0055]
实施例4:uox基因敲除小鼠鉴定
[0056]
代孕母鼠3周后生产f0代小鼠。出生后3周雄性和雌性f0代小鼠分开饲养。取出生后3周f0代小鼠,剪去小鼠7mm左右尾尖,用dneasy blood and tissue kit提取基因组dna,用pcr验证基因敲除情况,两个正向验证引物和一个反向验证的序列如下:
[0057]
uox-check-1f:5
’-
aagccactccatctttgtcc-3’[0058]
uox-check-1r:5
’-
caaaagacacctgccgact-3’[0059]
uox-check-2f:5
’-
cgagacctttgcaatgaaca-3’[0060]
pcr反应条件为95℃预变性5min;按循环程序(95℃ 30s,60℃ 30s,68℃ 40s)进行30个循环;68℃延伸5min。用qiaquick pcr purification kit纯化pcr产物,用ta cloning kit克隆,反应产物测序。测序结果正确,uox基因第三外显子中“ttaaactagta”和“catcccgtccgtaacac”之间的片段被切除。
[0061]
实施例5:uox基因敲除小鼠纯合品系构建
[0062]
将f0代的基因敲除小鼠与野生型小鼠交配获得后代f1,对f1代小鼠进行突变分析。选择突变的f1代杂合雌鼠和雄鼠交配获得后代f2,对f2代小鼠进行突变分析。对f2代中纯合小鼠进行交配,构建得到uox基因敲除纯合小鼠品系。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1