HLA-A1101限制性ECM1特异性CTL表位肽及其制备方法与用途与流程
hla-a1101限制性ecm1特异性ctl表位肽及其制备方法与用途
技术领域
[0001]
本发明属于及肿瘤免疫治疗技术领域的多肽技术领域,其中涉及一种mhc-i类限制性抗肿瘤细胞毒性t淋巴细胞(ctl)优势表位肽及其在制备抗肿瘤药物中的应用。
背景技术:
[0002]
恶性肿瘤是世界最严重的公共卫生问题,在死亡的960万癌症患者中,亚洲则占了近60%,且发病率和死亡率均呈逐年递增趋势。免疫疗法一直备受关注,其中以树突状细胞(dc)负载抗原为基础构建治疗性dc免疫细胞介导的肿瘤免疫治疗研究,一直是肿瘤免疫疗法的热点。ecm1是与多种恶性肿瘤的发生发展密切相关的分泌型蛋白分子,hla-a1101(人类白细胞抗原)限制性ecm1特异性ctl表位肽能与人mhc-i类(主要组织相容性复合体)分子的结合位点进行结合、并激活特异性的ctl。
[0003]
本项目研发的ctl表位肽-dc免疫细胞疗法,是利用原创性发现的肿瘤相关抗原ctl表位肽修饰dc,使dc具有hla-a1101分子限制性诱导cd8
+ t细胞成为具有记忆和靶向杀伤肿瘤细胞的ctl,其可靶向杀伤表位肽源头蛋白高表达的肿瘤细胞。该项目具有良好的应用前景,对提高肿瘤癌患者的治愈率、生存期和生活质量具有重要的理论意义和临床实用价值,并有望为乳腺癌和肺癌患者提供新的安全有效的临床免疫治疗手段。
技术实现要素:
[0004]
本发明的第一目的在于提供能够有效激发 ctl 介导的特异性细胞免疫应答、从而发挥抗肿瘤效能的两种hla-a1101限制性ecm1特异性ctl表位肽qy-9和nk-9,氨基酸序列分别如seq no.1和seq no.2所示。
[0005]
本发明的第二目的在于提供hla-a1101限制性ecm1特异性ctl表位肽qy-9/ nk-9的制备方法,包括以下步骤:(1)表位肽粗品的制备按照表位肽序列使肽链从羧基端向氨基端延伸,合成后,选用tfa/dcm进行切割,表位肽收集液在常温下减压干燥,然后用预冷乙醚沉淀,抽滤后即得;(2)表位肽粗产品的纯化将表位肽粗品用dms0 溶解后,用水稀释后经 0.22um 纤维膜过滤,然后经hplc(高效液相色谱法)纯化并进行纯度分析和相对分子质量测定,得纯度均在95%以上表面肽;(3)表面肽的保存制得的表面肽经冻干处理后放于-70℃保存、备用。
[0006]
所述hplc纯化中,流动相选用含0.1%tfa水溶液和含0.1%tfa乙氰溶液,表面肽的纯化选用c18制备柱(美国waters公司,7.0um,100a,7.8mm
×
150mm)。
[0007]
所述纯度分析中,选用c18 分析柱(美国waters公司,5.0um,100a,3.9mm
×
150mm)。
[0008]
所述相对分子质量测定在api 2000型(美国waters公司)质谱仪上按常规方法进
行。
[0009]
本发明的第三目的在于提供所述表面肽qy-9和nk-9在制备抗肿瘤药物中的用途。
[0010]
所述抗肿瘤药物的剂型优选为注射剂。
[0011]
本发明的第四目的在于提供所述表面肽qy-9和nk-9在制备检测、预防肿瘤性疾病疫苗中的应用。
[0012]
所述的hla-a1101限制性ecm1特异性ctl表位肽qy-9和nk-9可通过人工合成、原核细胞或真核细胞表达出纯化而获得。
[0013]
本发明的有益效果在于:(1)本发明提供了hla-a1101限制性ecm1特异性ctl表位肽,该表位能够以高亲和力结合mhc-i类分子,其稳定复合物可诱导肽特异性的 ctl 免疫应答,并刺激肽特异性ctl 分泌高水平的 ifn-γ,从而对肿瘤细胞产生特异性杀伤效应。
[0014]
(2)本发明公开了肿瘤相关抗原的hla-a1101限定性 ctl 优势表位肽,该 ctl可刺激肽特异性ctl分泌高水平 ifn-γ,诱导特异性的ctl免疫应答,在肿瘤免疫治疗领域具有很好的应用前景。
[0015]
(3)本发明提供的hla-a1101限制性ecm1特异性ctl表位肽,根据表位肽与mhc-i类分子相互作用机理,并能激活特异性t淋巴细胞的特性而鉴定为有效的表位肽,同时两条表位肽长度分别仅为9个氨基酸序列,易于体外合成,方便于临床应用。
附图说明
[0016]
图1为qy-9的空间结构模拟图。
[0017]
图2为nk-9的空间结构模拟图。
[0018]
图3为qy-9和mhc-i分子结合的空间结构模拟图。
[0019]
图4为nk-9和mhc-i分子结合的空间结构模拟图。
[0020]
图5为qy-9的质谱分析图。
[0021]
图6为nk-9的质谱分析图。
[0022]
图7为qy-9的高效液相色谱法分析图。
[0023]
图8为nk-9的高效液相色谱法分析图。
[0024]
图9为qy-9和nk-9负载的dc诱导前后,t淋巴细胞的inf-γ分泌变化。
[0025]
图10为qy-9和nk-9负载dc诱导的ctl分泌inf-γ情况。
具体实施方式
[0026]
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0027]
需要说明的是:本发明中,如果没有特别的说明,本文所提到的所有实施方式以及优选实施方法可以相互组合形成新的技术方案;本发明中,如果没有特别的说明,本文所提到的所有技术特征以及优选特征可以相互组合形成新的技术方案;本发明中,除非另有说明,各个反应或操作步骤可以顺序进行,也可以按照顺序进行;优选地,本文中的反应方法是顺序进行的。除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的
意义相同;此外,任何与所记载内容相似或均等的方法或材料也可应用于本发明中。
[0028]
根据本发明的一个方面,提供了hla-a1101限制性ecm1特异性ctl表位肽,所述表位肽如下所示:(1)由seq id no.1所示的氨基酸序列组成的表面肽;(2)由seq id no.2所示的氨基酸序列组成的表面肽。
[0029]
其中,seq id no.1为gln val asn cys phe asn ile asn tyr;seq id no.2为asn ile ser ser thr ser glu pro lys。
[0030]
本发明通过生物信息学手段设计并合成了hla-a1101限制性ecm1特异性ctl表位肽,可以与人mhc-i类分子的结合位点进行结合,能够特异性激活细胞毒性t淋巴细胞,对肿瘤细胞具有较强的杀伤作用。
[0031]
所述的hla-a1101限制性ecm1特异性ctl表位肽可通过人工合成、原核细胞或真核细胞表达出纯化等方式获得。
[0032]
另外,本发明还提供了上述的hla-a1101限制性ecm1特异性ctl表位肽在制备预防和/或治疗肿瘤的产品中的应用。
[0033]
所述产品为疫苗或药物。
[0034]
在一些实施方式中,疫苗还包括佐剂;药物还包括药学上可接受的载体,药物的优选剂型为注射剂。
[0035]
本发明提供的hla-a1101限制性ecm1特异性ctl表位肽能够以高亲和力结合mhc-i类分子,其稳定复合物可诱导肽特异性的 ctl 免疫应答,并刺激肽特异性ctl 分泌高水平的 ifn-γ,从而对肿瘤细胞产生特异性杀伤效应,基于此,本发明提供的hla-a1101限制性ecm1特异性ctl表位肽可以用于研制靶向肿瘤细胞的治疗性肽疫苗,为恶性肿瘤精准免疫治疗提供新的技术方案,并能够特异性靶向恶性肿瘤细胞从根本上减少复发。
[0036]
本发明的基本原理是:应用iedb数据库预测了ecm1蛋白序列中可能存在的hla-a1101限定性ctl表位肽序列,并选取其中ic50<500mm的候选序列:hk-9、sk-9、qy-9、kk-9、nk-9。首先以重组ecm1蛋白致敏hla-a1101健康志愿者的外周血单个核细胞(pbmc),并使用候选表位肽对其进行激发,细胞内流式细胞术检测ifn-γ的分泌水平,其中发现在5个候选序列中以qy-9、nk-9的作用最为显著。
[0037]
下列实例可以有助于对本发明进行更多了解,但仅为了对本发明加以说明,本发明并不仅限于以下实例内容。
[0038]
实施例1 表位肽与人mhc-i类分子亲和力预测。
[0039]
通过使用iedb (免疫表位数据库, the immune epitope database)预测本发明所设计的多肽序列与mhc-i类分子结合。
[0040]
iedb是用于向科学界公众提供与免疫表位识别相关的已发表实验数据,它记录了在传染病,过敏,自身免疫和移植背景下在人类,非人灵长类动物和其他动物物种中研究的抗体和t细胞表位的实验数据。iedb还提供有助于预测和分析表位的工具。iedb作为公开而可靠的实验数据库可以用于预测适应性免疫受体对免疫表位的识别。
[0041]
通过应用iedb中所提供的mhc-i类分子结合预测分析软件,可以完成对多肽氨基酸序列的分析(http://tools.iedb.org/mhci/)。
[0042]
iedb预测表明ecm1来源的表位肽与hla-a1101分子具有很好的结合能力;表2为20
种氨基酸的缩写表。
[0043]
表1 iedb获得ecm1优势多肽氨基酸序列与hla-a1101 结合的评分名称123456789起始终止百分比排名ann法smm法qy-9qvncfniny4955031.4141.64266.87nk-9nisstsepk5305381.6195.72267.49表2 氨基酸缩写表中文名称英文名称符号与缩写中文名称英文名称符号与缩写丙氨酸alaninea或ala亮氨酸leucinel或leu精氨酸argininer或arg赖氨酸lysinek或lys天冬酰胺asparaginen或asn蛋氨酸methioninem或met天冬氨酸asparticacidd或asp苯丙氨酸phenylalaninef或phe半胱氨酸cysteinec或cys脯氨酸prolinep或pro谷氨酰胺glutamineq或gln丝氨酸serines或ser谷氨酸glutamicacide或glu苏氨酸threoninet或thr甘氨酸glycineg或gly色氨酸tryptophanw或trp组氨酸histidineh或his酪氨酸tyrosiney或tyr异亮氨酸isoleucinei或ile缬氨酸valinev或val计算机模拟表位肽与人 mhc 类分子的结合。
[0044]
对上述所得表位肽用 chemoffice软件包中的chemdraw ultra、 chemdraw 3d ultra分别建立表位肽的二维和三维结构;用 moe 软件对表位肽和和ha-a2.1的能量和结构进行修饰,模拟二者结合的三维结构,进行分子动力学结合模拟和生理活性和运用价值的预估,主要包括以下方法: (1)表位肽分子模型构建。运用chemoffice 软件包中的chemdraw ultra构建表位肽分子二维结构,再将表位肽的二维结构导入 chemdraw 3d ultra得到三维模型并保存为mol2格式,在对接模拟环节将三维结构导入moe软件件中,依次选择下拉菜单compute-minimize
-ꢀ
molecule,出现 minimize对话框进行多肽分子的能级优化,使之能级达到最小最适合与hla-a1101的复合物进行分子对接的能量和结构状态,然后将优化后的表位肽导出为mol2格式,以备和hla-a1101的结合槽凹槽进行三维对接。(2)hla-a1101的复合物进行分子动力学模拟前准备。hla-a1101的初始坐标来自于蛋白质晶体结构专属网站 http://www.rcsb.org/pdb/,将获得的hla-a1101结构数据导入moe 软件中,依次选择下拉菜单applications-docking suite
-ꢀ
docking ligands,出现 docking对话框,在filename栏的右边选择 define对hla-a1101结构进行对接前结构修饰(修复侧链,脱水加氢),结构修饰完成后分析获得 hla-a1101的结合槽凹槽三维信息,保存以备与表位肽进行对接。(3)对接模型的构建。在moe软件中依次打开 applications
-ꢀ
docking suite-docking ligands,出现docking对话框,在docking model和filename 栏选择获得的hla-a1101的结合槽凹槽三维信息,在ligand source栏中选择mole2 file 并选择mol2格式的各个已经优化并处于能级最低的表位肽数据,分别进行对接并最终得到对接模拟的评分,通过对接模拟的评分值对表位肽分子和 hla-a1101的结合力做预估,由于抗原肽与mhc分子之间主要通过疏水作用、h键、盐键等弱相互作用进行分子间的识别,这些次级键作用越强,结合则越紧密。计算机模拟结果显示,qy-9、nk-9与hla-a1101均能有很好的结合
(见图3,4)。
[0045]
实施例2 表位肽的合成、纯化及分子量测定。
[0046]
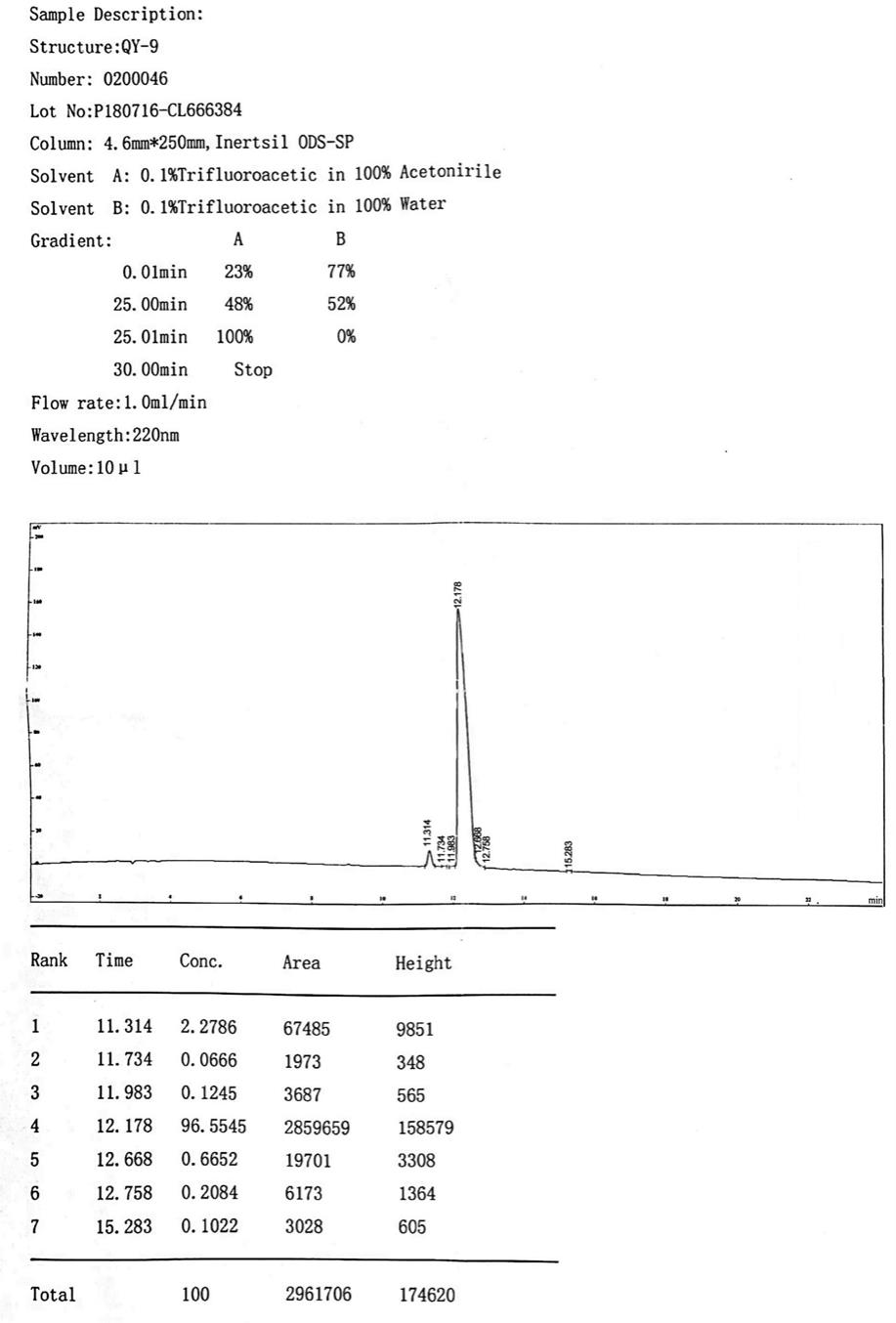
采用标准fmoc方案,应用美国pe公司生产的abi43ia型多肽合成仪进行多肽的合成,简述如下:按照多肽序列使肽链从羧基端向氨基端延伸,合成后,选用tfa/dcm进行切割,表位肽收集液在常温下减压干燥至1-2ml,然后用至少50ml预冷乙醚沉淀,然后抽滤,得到的多肽粗产品。将获得的表位肽粗品用少量 dms0 溶解后,用水稀释至所需体积,浓度为10mg/ml,经 0.22um 纤维膜过滤后,在美国waters公司产品delta600型hplc上纯化并进行纯度分析。流动相选用含0.1%tfa水溶液和含0.1%tfa乙氰溶液。各肽的纯化选用c18制备柱(美国waters公司,7.0um,100a,7.8mm
×
150mm),各肽的纯度分析选用c18 分析柱(美国waters公司,5.0um,100a,3.9mm
×
150mm)。各纯化后多肽的相对分子质量测定在api 2000型(美国waters公司)质谱仪上按常规方法进行,质谱分析图参见图5图6,hplc分析图参见图7图8,表明了该ctl优势表位肽的分子量理论值均与实测值相近,且在允许误差范围之内、纯度均在95%以上,说明合成效果好,可用于下一步实验。上述多肽经冻干处理后放于-70℃保存、备用。
[0047]
实施例3 本发明实施例2提供的表位肽负载dc细胞诱导的ctl的ifn-γ分泌情况。
[0048]
具体包括以下步骤:1、外周血单个核细胞的分离制备:将人淋巴细胞分离液加入离心管中,按1:2比例加入hla-a2阳性健康志愿者的浓缩白细胞,加入时应于人淋巴细胞分离液上方沿离心管管壁缓慢加。2300r离心15min,用1ml微量注射器吸取白膜层细胞于10ml离心管中,用pbs稀释后1400r离心5min,收集沉淀后将上述细胞用完全培养基重悬,放入37℃,5%co2饱和湿度的孵箱中培养。培养2小时后,吸取培养基上清及悬浮细胞,并用pbs洗去未贴壁细胞,收集未贴壁细胞记为淋巴细胞,贴壁细胞记为单核细胞。
[0049]
2、dc细胞的制备:将上述单核细胞用vivo-x培养基培养,并补充2%的胎牛血清,il-4,gm-csf。3天后,半量换液,补充il-4,gm-csf。于培养第7天补充il-4,gm-csf的同时,加入tnf-α,48小时后,即为诱导成熟的人dc细胞。
[0050]
3、淋巴细胞的制备:在t细胞扩增培养基中培养淋巴细胞,同时补充及抗cd3和抗cd28单抗,il-2以及il-7。
[0051]
4、表位肽负载dc细胞诱导效应t淋巴细胞:成熟的人dc,以pbs清洗后,无血清imdm培养基重悬,加 50ug/ml 表位肽。37℃孵育过夜后,按 30ug/ml的浓度加入丝裂霉素c,37℃孵育 30min。
[0052]
dc经冰pbs清洗、计数后,与淋巴细胞按1:20比例共培养,并加入il-2,以刺激pbmc中的t细胞。1周刺激1次,共2次,诱导pbmc中的t细胞成为ctl。
[0053]
5、t淋巴细胞分别于诱导前后,通过显微镜观察获得其细胞形态的变化过程,并对其拍照保存,显微镜的比例尺为200
×
,结果如图9所示。
[0054]
6、胞内流式细胞术检测表位肽负载dc诱导后,效应t细胞的ifn-γ分泌情况。首先制备细胞悬液,5
×
105/孔,表位肽负载dc再次刺激t淋巴细胞。激活剂激活细胞,37℃、5%co2条件下培养4~6h后,对细胞表面抗原cd3和cd8进行染色,接下来,4%多聚甲醛固定细胞,破膜后,加入ifn-γ-apc,室温避光孵育30min。流式细胞仪检测(图10)。
[0055]
如图9所示,通过倒置显微镜观察发现,诱导前,t淋巴细胞未发现聚集现象;qy-9,
nk-9负载的dc细胞诱导t淋巴细胞后,细胞明显聚集于dc细胞周围,细胞增殖明显。
[0056]
如图10所示,首先通过流式细胞仪选择cd8
+ t淋巴细胞。接下来,比较对照组,qy-9组,nk-9组中cd8
+ t淋巴细胞的ifn-γ分泌情况。结果显示,对照组ifn-γ分泌为46.7%,qy-9组ifn-γ分泌为70.54%,nk-9组ifn-γ分泌为72.74%。重复试验统计结果显示,qy-9组ifn-γ分泌是对照组的1.509倍,nk-9组的ifn-γ分泌是对照组的1.518倍。
[0057]
实验结果表明: hla-a1101限制性ctl表位肽qy-9和nk-9负载dc细胞诱导t淋巴细胞产生ctl,ifn-γ分泌增加,免疫效应增强。
[0058]
本发明通过对ecm1优势的多肽进行预测、筛选和鉴定,可以精准筛选得到能够与人mhc-i类分子的hla-a1101结合位点进行结合、可激活特异性的细胞毒性t淋巴细胞(ctl)的表位肽qy-9,nk-9、能够有效激活ctl免疫效应,从而达到治疗肿瘤和制备用于临床治疗检测肿瘤性疾病的疫苗等作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1