BCMA抗体的制作方法
bcma抗体
技术领域
[0001]
本申请涉及一种结合bcma蛋白的抗体及其应用。所述抗体可以特异性地识别和结合bcma蛋白,并且在结合细胞表面表达的bcma蛋白后介导内化。所述抗体可以抑制肿瘤或肿瘤细胞的生长和/或增殖。
背景技术:
[0002]
b细胞成熟抗原bcma(cd269或tnfrsf17)是肿瘤坏死因子超家族的成员,主要在浆细胞和一部分成熟的b细胞上表达,人bcma是由184个氨基酸残基组成的iii型跨膜蛋白。bcma能与增殖诱导配体(april)和b细胞激活因子(baff)特异性结合,激活nf-κb和mapk8/jnk信号通路;也能与多种traf家族成员结合,促进b细胞在不同发育阶段的存活,参与调节体液免疫、b细胞发育和稳态。
[0003]
据报道,bcma高表达于多种肿瘤细胞表面,如多发性骨髓瘤、霍奇金氏淋巴瘤、急性淋巴细胞性白血病(all),而在造血干细胞和其他正常组织细胞中不表达,因此是癌症靶向性治疗的理想靶点。
[0004]
鉴于bcma的治疗潜能,需要制备特异性结合bcma蛋白的抗体。
技术实现要素:
[0005]
本申请提供了一种结合bcma蛋白的抗体及其应用。本申请所述的抗体或其抗原结合片段具有下列性质中的一种或多种:1)以较高的亲和力特异性与bcma蛋白相结合;2)特异性识别在细胞表面表达的bcma蛋白;3)能够被细胞内化,尤其是肿瘤细胞的内化;4)抑制肿瘤或肿瘤细胞的生长和/或增殖;5)可用于构建免疫缀合物,且该免疫缀合物也可以抑制肿瘤或肿瘤细胞的生长和/或增殖。本申请还提供了所述抗体的制备方法和应用。
[0006]
一方面,本申请提供了一种抗体或其抗原结合片段,其包含抗体轻链可变区vl和抗体重链可变区vh,所述vl包含lcdr1,lcdr2和lcdr3中的任意一个,所述vh包含hcdr1,hcdr2和hcdr3中的任意一个,其中所述vl包含seq id no:7所示的氨基酸序列,所述vh包含seq id no:8所示的氨基酸序列。
[0007]
在某些实施方式中,所述抗体或其抗原结合片段具备选自下组的一种或多种性质:1)能够以1.8
×
10-9
m或更低的k
d
值结合bcma蛋白;2)能够特异性识别在细胞表面表达的bcma蛋白;3)能够被细胞内化;4)抑制肿瘤和/或肿瘤细胞增殖。
[0008]
在某些实施方式中,所述bcma蛋白为人bcma蛋白。
[0009]
在某些实施方式中,所述抗体选自下组:单克隆抗体、单链抗体、嵌合抗体、多特异性抗体、人源化抗体和全人源抗体。
[0010]
在某些实施方式中,所述抗原结合片段选自下组:fab、fab’、f(ab)2、f(ab’)2、fv和scfv片段。
[0011]
在某些实施方式中,所述的抗体或其抗原结合片段与参比抗体竞争结合所述bcma蛋白,其中所述参比抗体包含轻链可变区和重链可变区,所述参比抗体的轻链可变区包含
lcdr1、lcdr2和lcdr3,所述lcdr1包含seq id no:1所示的氨基酸序列;所述lcdr2包含seq id no:2所示的氨基酸序列;所述lcdr3包含seq id no:3所示的氨基酸序列;所述参比抗体的重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含seq id no:4所示的氨基酸序列;所述hcdr2包含seq id no:5所示的氨基酸序列;所述hcdr3包含seq id no:6所示的氨基酸序列。
[0012]
在某些实施方式中,所述参比抗体的轻链可变区包含seq id no:7所示的氨基酸序列,且所述参比抗体的重链可变区包含seq id no:8所示的氨基酸序列。在某些实施方式中,所述参比抗体的轻链包含seq id no:9所示的氨基酸序列;且所述参比抗体的重链包含seq id no:10所示的氨基酸序列。
[0013]
在某些实施方式中,所述参比抗体包括抗体sg1116。
[0014]
在某些实施方式中,所述抗体包含抗体轻链或其片段。在某些实施方式中,所述抗体轻链或其片段包含lcdr1,且所述lcdr1包含seq id no:1所示的氨基酸序列。在某些实施方式中,所述抗体轻链或其片段包含lcdr2,且所述lcdr2包含seq id no:2所示的氨基酸序列。在某些实施方式中,所述抗体轻链或其片段包含lcdr3,且所述lcdr3包含seq id no:3所示的氨基酸序列。
[0015]
在某些实施方式中,所述抗体轻链或其片段包含轻链可变区vl,且所述轻链可变区vl包含seq id no:7所示的氨基酸序列。
[0016]
在某些实施方式中,所述抗体轻链或其片段还包含人恒定区。在某些实施方式中,所述人恒定区包括人igκ恒定区。
[0017]
在某些实施方式中,所述抗体轻链或其片段包含seq id no:9所示的氨基酸序列。
[0018]
在某些实施方式中,所述抗体包含抗体重链或其片段。在某些实施方式中,所述抗体重链或其片段包含hcdr1,且所述hcdr1包含seq id no:4所示的氨基酸序列。在某些实施方式中,所述抗体重链或其片段包含hcdr2,且所述hcdr2包含seq id no:5所示的氨基酸序列。在某些实施方式中,所述抗体重链或其片段包含hcdr3,且所述hcdr3包含seq id no:6所示的氨基酸序列。
[0019]
在某些实施方式中,所述抗体重链或其片段包含重链可变区vh,且所述重链可变区vh包含seq id no:8所示的氨基酸序列。
[0020]
在某些实施方式中,所述抗体重链或其片段还包含人恒定区。在某些实施方式中,所述人恒定区包括人igg恒定区。在某些实施方式中,所述igg恒定区包含人igg1恒定区。
[0021]
在某些实施方式中,所述抗体重链或其片段包含如seq id no:10所示的氨基酸序列。
[0022]
在某些实施方式中,所述抗体包括抗体sg1116。
[0023]
另一方面,本申请提供了一种分离的一种或多种核酸分子,其编码所述的抗体或其抗原结合片段。
[0024]
另一方面,本申请提供了一种或多种载体,其包含所述的核酸分子。
[0025]
另一方面,本申请提供了一种细胞,其包含所述的核酸分子或所述的载体。
[0026]
另一方面,本申请提供了一种制备所述的抗体或其抗原结合片段的方法,所述方法包括在使得所述抗体或其抗原结合片段表达的条件下,培养所述的细胞。
[0027]
另一方面,本申请提供了一种免疫缀合物,其包含所述的抗体或其抗原结合片段。
[0028]
在某些实施方式中,所述的免疫缀合物还包含选自下组的至少一种其他试剂:化疗剂、放射性元素、细胞生长抑制剂和细胞毒性剂。在某些实施方式中,所述的免疫缀合物中所述抗体或其抗原结合片段与所述至少一种其他试剂直接或间接连接。在某些实施方式中,所述的免疫缀合物中所述间接连接包含通过连接分子连接,所述连接分子包括smcc连接子。
[0029]
在某些实施方式中,所述至少一种其他试剂包括美登素或其衍生物。在某些实施方式中,所述美登素衍生物包括美登素衍生物dm1。
[0030]
另一方面,本申请提供了一种药物组合物,其包含所述的抗体或其抗原结合片段,所述的免疫缀合物,或者所述的细胞,以及任选地药学上可接受的佐剂。
[0031]
另一方面,本申请提供了所述的抗体或其抗原结合片段,或者所述的免疫缀合物在制备药物中的用途,所述药物用于预防或治疗肿瘤。
[0032]
在某些实施方式中,所述肿瘤包括bcma阳性肿瘤。在某些实施方式中,所述肿瘤包括非实体瘤。在某些实施方式中,所述肿瘤包括选自下组的肿瘤:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0033]
另一方面,本申请提供了所述的抗体或其抗原结合片段,或者所述的免疫缀合物,其用于预防或治疗肿瘤。
[0034]
在某些实施方式中,所述肿瘤包括bcma阳性肿瘤。在某些实施方式中,所述肿瘤包括非实体瘤。在某些实施方式中,所述肿瘤包括选自下组的肿瘤:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0035]
另一方面,本申请提供了一种预防或治疗有需要的受试者中的肿瘤的方法,其包括向所述受试者施用所述的抗体或其抗原结合片段,所述的免疫缀合物,或者所述的药物组合物。
[0036]
在某些实施方式中,所述肿瘤包括bcma阳性肿瘤。在某些实施方式中,所述肿瘤包括非实体瘤。在某些实施方式中,所述肿瘤包括选自下组的肿瘤:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0037]
另一方面,本申请提供了根据所述的抗体或其抗原结合片段,其用于诊断与bcma蛋白的表达相关的疾病或病况。
[0038]
另一方面,本申请提供了所述的抗体或其抗原结合片段用于制备诊断剂的用途,其中所述诊断剂用于诊断与bcma蛋白的表达相关的疾病或病况。
[0039]
另一方面,本申请提供了一种判断受试者中与bcma蛋白的表达相关的疾病或病况的方法,所述方法包括:使源自所述受试者的样品与所述的抗体或其抗原结合片段接触,以及判断所述样品中能够特异性结合所述抗体或其抗原结合片段的物质的存在和/或含量。
[0040]
本领域技术人员能够从下文的详细描述中容易地洞察到本公开的其它方面和优势。下文的详细描述中仅显示和描述了本公开的示例性实施方式。如本领域技术人员将认识到的,本公开的内容使得本领域技术人员能够对所公开的具体实施方式进行改动而不脱离本申请所涉及发明的精神和范围。相应地,本申请的附图和说明书中的描述仅仅是示例性的,而非为限制性的。
附图说明
[0041]
本申请所涉及的发明的具体特征如所附权利要求书所显示。通过参考下文中详细描述的示例性实施方式和附图能够更好地理解本申请所涉及发明的特点和优势。对附图简要说明书如下:
[0042]
图1显示的是本申请所述抗体与bcma抗原的结合活性;
[0043]
图2显示的是本申请所述抗体特异性识别bcma抗原的能力;
[0044]
图3显示的是细胞表面bcma抗原的表达情况;
[0045]
图4a-4b显示的是本申请所述抗体识别肿瘤细胞表面抗原bcma的结果;
[0046]
图5a-5b显示的是本申请所述抗体对肿瘤细胞的内化活性的结果;
[0047]
图6a-6b显示的是本申请所述抗体体内抑制肿瘤活性的结果;
[0048]
图7显示的是本申请所述免疫缀合物体抑制肿瘤细胞增殖的结果;
[0049]
图8a-8b显示的是本申请所述免疫缀合物体内抑制肿瘤活性的结果。
具体实施方式
[0050]
以下由特定的具体实施例说明本申请发明的实施方式,熟悉此技术的人士可由本说明书所公开的内容容易地了解本申请发明的其他优点及效果。
[0051]
在本申请中,术语“抗体”通常指免疫球蛋白或其片段或其衍生物,涵盖包括抗原结合位点的任何多肽,无论其是在体外还是体内产生的。该术语包括但不限于多克隆的、单克隆的、单特异性的、多特异性的、非特异性的、人源化的、单链的、嵌合的、合成的、重组的、杂化的、突变的和移植的抗体。除非另外被术语“完整的”修饰,如在“完整的抗体”中,为了本发明的目的,术语“抗体”也包括抗体片段,比如fab、f(ab')2、fv、scfv、fd、dab和保持抗原结合功能(即,特异性结合例如ox40或pd-ll)的其它抗体片段。通常,这样的片段应当包括抗原结合结构域。基本的4链抗体单元是由两个相同的轻(l)链和两个相同的重(h)链组成的异四聚体糖蛋白。igm抗体由5个基本的异四聚体单元与另外一个称为j链的多肽组成,且含有10个抗原结合位点,而iga抗体包括2-5个可以与j链相结合聚合形成多价组合的基本4链单元。就igg而言,4链单元一般为约150,000道尔顿。每个l链通过一个共价二硫键与h链连接,而两个h链通过一个或多个取决于h链同种型的二硫键相互连接。每个h和l链还具有规则间隔的链内二硫化桥键。每个h链在n末端具有可变结构域(vh),对于α和γ链各自继之以三个恒定结构域(ch)、对于μ和ε同种型继之以四个ch结构域。每个l链在n末端具有可变结构域(vl),在其另一端具有恒定结构域。vl与vh对应,且cl与重链的第一恒定结构域(ch1)相对应。特定的氨基酸残基被认为在轻链和重链可变结构域之间形成界面。vh和vl配对一起形成单个抗原结合位点。对于不同类别抗体的结构和性质,参见例如basic and clinical immunology,8th edition,daniel p.sties,abba i.terr and tristram g.parsolw(eds),appleton&lange,norwalk,conn.,1994,第71页和第6章。来自任何脊椎动物物种的l链可以基于其恒定结构域的氨基酸序列被分为两种明显不同的类型中的一种,称为κ和λ。取决于其重链(ch)恒定结构域的氨基酸序列,可以将免疫球蛋白分为不同的类别或同种型。存在五类免疫球蛋白:iga、igd、ige、igg和igm,具有分别被命名为α、δ、ε、γ和μ的重链。基于ch序列和功能方面的相对小的差异,将γ和α类进一步分成亚类,例如,人表达下述亚类:igg1、igg2a、igg2b、igg3、igg4、iga1和igk1。
[0052]
在本申请中,术语“cdr”通常指抗体可变结构域的区域,其序列是高度可变的和/或形成结构定义环。通常,抗体包括六个cdr;在vh中三个(hcdr1、hcdr2、hcdr3),和在vl中三个(lcdr1、lcdr2、lcdr3)。在天然抗体中,hcdr3和lcdr3显示所述六个cdr的大多数多样性,并且特别地hcdr3被认为在赋予抗体的精细特异性方面起独特作用。参见,例如xu et al,immunity 13:37-45(2000);johnson and wu,in methods in molecular biology 248:1-25(lo,ed.,human press,totowa,n.j.,2003)。实际上,仅由重链组成的天然存在的骆驼抗体在缺乏轻链的情况功能正常且稳定。参见,例如,hamers-casterman et al.,nature 363:446-448(1993);sheriff et al,nature struct.biol.3:733-736(1996)。例如,在本申请中,所述ox40结合部分可以包含重链可变结构域vh1,vh1中可以包括3个cdr(例如,h1cdr1、h1cdr2和h1cdr3),其还可以包含轻链可变结构域vl1,vl1中可以包括3个cdr(例如,l1cdr1、l1cdr2和l1cdr3)。又例如,在本申请中,所述pd-l1结合部分可以包含重链可变结构域vh2,vh2中可以包括3个cdr(例如,h2cdr1、h2cdr2和h2cdr3)。
[0053]
在本领域中,可以通过多种方法来划分抗体的cdr,例如1)基于序列可变性的kabat定义规则(wu和kabat,j exp med 132:211-50,1970;kabat等人,sequences ofproteins of immunological interest,第5版,public health service,national institutes ofhealth,bethesda,md.,1991),2)基于结构环区域位置的chothia定义规则(a1-lazikani等人,jmol biol 273:927-48,1997),3)用oxford molecular的abm抗体模型软件权衡上述两种规则的abm定义规则,4)基于得到的复合物晶体结构分析的contact定义规则。这些标记cdr方法可总结如下表1。
[0054]
表1 cdr划分方法
[0055] ccg定义kabat定义abm定义chothia定义contact定义轻链cdr1l24-l34l24-l34l24-l34l24-l34l30-l36轻链cdr2l50-l56l50-l56l50-l56l50-l56l45-l55轻链cdr3l89-l97l89-l97l89-l97l89-l97l89-l96重链cdr1h26-h35h31-h35h26-h35h26-h32h30-h35重链cdr2h50-h65h50-h65h50-h58h52-h56h47-h58重链cdr3h95-h102h95-h102h95-h102h95-h102h93-h101
[0056]
其中,laa-lbb可以指从抗体轻链的n端开始,第aa位至第bb位的氨基酸序列;haa-hbb可以指从抗体重链的n端开始,第aa位至第bb位的氨基酸序列。例如,l24-l34可以指从抗体轻链n端开始,第24位至第34位的氨基酸序列;h26-h35可以指从抗体重链n端开始,第26位至第35位的氨基酸序列。在本申请中,使用kabat定义规则确定可变结构域序列和全长抗体序列中的氨基酸残基。
[0057]
在本申请中,术语“抗原结合片段”通常是指抗体中发挥特异性结合抗原功能的一个或多个片段。抗体的抗原结合功能可通过抗体的全长片段来实现。抗体的抗原结合功能也可通过以下来实现:包括fv、scfv、dsfv、fab、fab’或f(ab’)2的片段的重链,或者,包括fv、scfv、dsfv、fab、fab’或f(ab’)2的片段的轻链。(1)fab片段,即由vl、vh、cl和ch结构域组成的一价片段;(2)f(ab’)2片段,包含通过铰链区处的二硫键连接的两个fab片段的二价片段;(3)由vh和ch结构域组成的fd片段;(4)由抗体单臂的vl和vh结构域组成的fv片段;(5)由vh结构域组成的dab片段(ward等,(1989)nature 341:544-546);(6)分离的互补决定
区(cdr)和(7)可任选地通过接头连接的两个或以上分离的cdr的组合。此外,还可包括由vl和vh配对形成的一价单链分子fv(scfv)(参见bird等(1988)science 242:423-426;以及huston等(1988)proc.natl.acad.sci.85:5879-5883)。所述“抗原结合部分”还可包括包含免疫球蛋白的融合蛋白。例如,所述融合蛋白可包含选自以下的结合结构域:(1)与免疫球蛋白铰链区多肽融合的结合结构域多肽;(2)与铰链区融合的免疫球蛋白重链ch2恒定区;和/或(3)与ch2恒定区融合的免疫球蛋白重链ch3恒定区。
[0058]
在本申请中,术语“bcma”可与“cd269”、“bcm”“tnfrsf17”互换使用,通常是指b细胞成熟抗原。例如,人bcma是由994个核苷酸长的初级mrna转录物(nm_001192.2)编码的184个氨基酸长的蛋白质。人bcma的氨基酸序列用unipretkb登录号q02223表示。在本申请中,术语“bcma”可包括包含突变的蛋白质,例如可包括包含全长野生型bcma的点突变、片段、插入、缺失和剪接变体的蛋白质。在本申请中,术语“bcma”还可包括完整bcma蛋白的一部分,只要保留相关的生物活性即可。
[0059]
在本申请中,术语“k
d”可与“kd”互换使用,通常是指特定的抗体-抗原相互作用的解离平衡常数,单位为m(mol/l)。kd可通过物质ab和其解离得到的物质a和物质b的浓度来计算:kd=c(a)*c(b)/c(ab)。由该公式可知,kd值越大,说明解离越多,代表物质a、b之间的亲和力越弱;反之,kd值越小,说明解离越少,代表物质a、b之间的亲和力越强。
[0060]
在本申请中,术语“内化”通常是指一种外源物质(如蛋白质、核酸)与细胞结合,进入细胞内部,而不需要借助其他外部的试剂或条件(例如转染、电穿孔、微量注射、原生质体融合等)。在某些情形下,内化可以是抗体或其抗原结合片段或多肽与细胞表面的受体特异性结合,形成受体-抗体复合物,然后借助该受体介导的胞吞作用进入到细胞内的过程。此时这样的抗体或其抗原结合片段(如fab片段)可以成为内化抗体。所述内化抗体可以作为定向运载药物、酶或dna的载体。在某些情形下,所述内化可抑制肿瘤细胞的增殖。例如,所述内化抗体可用于偶联抗肿瘤的化疗剂、放射性元素、细胞生长抑制剂和细胞毒性剂,并作为肿瘤生物治疗的候选分子。
[0061]
在本申请中,术语“肿瘤”通常是指典型特征在于细胞增殖或存活失调的生理状况。所述肿瘤可以包括所有已知的癌症和肿瘤状况,无论其特征为恶性,良性,软组织或实性,以及包括转移前和转移后癌症在内的所有阶段和等级的癌症。所述肿瘤还可以包括一种或多种肿瘤细胞。
[0062]
在本申请中,术语“bcma阳性肿瘤”通常是指与bcma蛋白的表达相关,或者bcma蛋白的表达量显著提高的肿瘤。所述bcma阳性肿瘤可以是非实体瘤。所述bcma阳性肿瘤可以选自以下组:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。所述bcma阳性肿瘤可以包括一种或多种肿瘤细胞。在某些情形中,所述bcma阳性肿瘤可以是多发性骨髓瘤和淋巴细胞瘤。例如,所述肿瘤细胞可以包括骨髓瘤u266细胞、b淋巴细胞瘤ramos细胞、多发性骨髓瘤mm.1s细胞、骨髓瘤nci-h929细胞、骨髓瘤opm-2细胞及多发性骨髓瘤rpmi 8226细胞。
[0063]
在本申请中,术语“单克隆抗体”通常是指一群基本同源的抗体,即包含在该群内的各个抗体除了可能的以微量存在的天然发生的突变之外是相同的。单克隆抗体可以是高度特异性的,直接针对单个抗原性位点。所述单克隆抗体可以通过杂交瘤技术制备或者通过使用重组dna方法在细菌、真核动物或植物细胞中产生单克隆抗体也可以得自噬菌体抗体文库,使用例如clackson etal.,nature,352:624-628(1991)和marks et al.,
mol.biol.,222:581-597(1991)所述的技术进行。
[0064]
在本申请中,术语“单链抗体”(scfv)通常是指包含抗体重链可变区和轻链可变区的分子。例如,所述scfv可以由抗体重链可变区和轻链可变区通过连接分子(linker)(例如,连接肽)连接而成
[0065]
在本申请中,术语“嵌合抗体”通常是指这样的抗体,其中重链或轻链氨基酸序列的一部分与来自特定物种的抗体中相应氨基酸序列同源或者均属于某一类别,而该链的其他部分则与另一物种中的相应序列同源。例如,轻链和重链的可变区可以均来自一个动物物种(如小鼠、大鼠等)的抗体的可变区,而恒定部分则与来自另一物种(如人)的抗体序列同源。例如,为获得嵌合抗体,可利用非人源的b细胞或杂交瘤细胞产生可变区,而与其组合的恒定区则来自人。由于嵌合抗体的恒定区可来源于人类,因此嵌合抗体在注射时引发免疫应答的可能性会低于使用恒定区为非人来源的抗体。
[0066]
在本申请中,术语“人源化抗体”通常是指一种抗体,其含有较少的来自非人免疫球蛋白的序列,从而降低异种抗体引入到人类中时的免疫原性。例如,可以使用cdr移植(jones et al.,nature 321:522(1986))及其变体;包括“重塑”(reshaping),(verhoeyen,et al.,1988 science 239:1534-1536;riechmann,et al.,1988 nature 332:323-337;tempest,et al.,bio/technol 1991 9:266-271),“高度加成”(hyperchimerization),(queen,et al.,1989 proc natl acad sci usa 86:10029-10033;co,et al.,1991 proc natl acad sci usa 88:2869-2873;co,et al.,1992 j immunol 148:1149-1154)和“贴面”(veneering),(mark,et al.,“derivation of therapeutically active humanized and veneered anti-cd18 antibodies.”in:metcalf b w,dalton b j,eds.cellular adhesion:molecular definition to therapeutic potential.new york:plenum press,1994:291-312)、表面重建(美国专利us5639641)等技术手段,对非人源的结合域进行人源化。如果其他区域,例如铰链区和恒定区结构域也源自非人来源,则这些区域也可以被人源化。
[0067]
在本申请中,术语“全人源抗体”通常是指全人抗体,即抗体的恒定区和可变区均来源于人。所述全人源抗体可以通过噬菌体抗体库技术、转基因小鼠制备人源性抗体、核糖体展示技术、ebv转化b细胞克隆技术、单个b细胞克隆等技术来实现。
[0068]
在本申请中,术语“多特异性抗体”通常是指可以同时识别两个或两个以上抗原或者表位的抗体分子。所述多特异性抗体可以通过化学偶联法、杂交-杂交瘤法、基因工程抗体制备法等方法在真核表达系统或者在原核表达系统中获得。
[0069]
在本申请中,术语“免疫缀合物”通常是指所述其他试剂(例如,化疗剂、放射性元素、细胞生长抑制剂和细胞毒性剂)与所述抗体或其抗原结合片段连接而形成的缀合物。该连接可以通过共价键,或非共价相互作用,并且可以包括螯合作用。该缀合物可以通过所述抗体或其抗原结合片段与靶细胞上的抗原的特异性结合,将所述其他试剂递送至靶细胞(例如,肿瘤细胞)。然后所述免疫缀合物经所述内化,最终进入靶细胞内部(例如,进入溶酶体等泡囊体),此时所述免疫缀合物中的连接分子可以裂解,释放所述其他试剂从而发挥其细胞毒性效应。此外,所述抗原也可以由所述靶细胞分泌,并位于所述靶细胞外的间隙。可以使用多种本领域所知的连接分子以形成免疫缀合物。在本申请中,术语“连接分子”通常是指连接或联接两个分子的功能分子。例如,所述连接分子可以连接一个分子和另一个分
子(例如,一个分子为蛋白质分子,另一个分子也为蛋白质分子,或者可以为小分子药物)。所述连接分子可以用于所述免疫缀合物的构建中。在所述免疫缀合物中,所述连接分子可以具备两个功能特征:1、具有循环系统稳定性,在所述免疫缀合物到达靶细胞前在循环系统中不能发生裂解释放所述其他试剂,避免产生毒性作用;2、在进入靶细胞过后,所述连接分子需要快速有效地断裂,使所述其他试剂有效释放发挥应有的药理活性。所述连接分子可以由极性或非极性氨基酸组成。所述连接分子也可以为包含杂原子(如氮原子、硫原子等)的碳链。所述连接分子的长度可以为2至100个原子,例如为2至50个原子之间,也可以为3、5、10、15、20、25、30、35、40、45或50个原子;又例如,所述连接子的长度可以为20至26个(20、21、22、23、24、25或26个)原子。所述连接分子可以包括选自以下组的取代基取代:氢原子、烷基、烯基、炔基、氨基、烷基氨基、二烷基氨基、三烷基氨基、羟基、烷氧基、卤素、芳基、杂环、芳香族杂环、氰基、酰胺、氨基甲酰基、羧酸、酯、硫醚、烷基硫醚、巯基和脲基。此外,所述连接分子可以选自以下组:ph敏感连接分子、蛋白酶可切割连接分子、核酸酶敏感连接分子、脂肪酶敏感连接分子、糖苷酶连接分子、缺氧连接分子、光切割连接分子、热不稳定连接分子和超声敏感连接分子、肽连接子。示例性的连接分子可包括但不限于1,4-双(马来酰亚胺)丁烷、(1,4-双马来酰亚氨基-2,3-二羟基丁烷)、双(马来酰亚胺)己烷、双(马来酰亚胺)乙烷、1,4-二-[3
′-
(2
′-
吡啶基二硫代)丙酰胺基]丁烷、1,6-己烷-双-乙烯基砜、二硫代双马来酰亚胺乙烷、1,8-双马来酰亚氨基-二乙二醇和1,11-双马来酰亚氨基-三乙二醇。例如,可以是4-(n-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(smcc)。常见的肽连接子是本领域众所周知的(参见,例如,holliger等人(1993)proc.natl.acad.sci.usa 90:6444-6448;poljak等人(1994)structure 2:1121-1123)。例如,所述连接分子可以是4-(n-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(smcc)。
[0070]
在本申请中,术语“共价”通常是指共价键,即两个或多个原子存在共用电子对,达到电子饱和的状态从而形成比较稳定的化学结构。共价键的形成是相邻两个原子之间自旋方向相反的电子相互配对,此时原子轨道相互重叠,两核间的电子云密度相对地增大,从而增加对两核的引力。共价键可以具备饱和性与方向性。共价键可以分为非极性共价键、极性共价键和配价键。只含有共价键的化合物可称为共价化合物。
[0071]
在本申请中,术语“化疗剂”通常是指可以抑制肿瘤和/或肿瘤细胞增殖的化疗用试剂。所述化疗剂可以选自以下组:有丝分裂抑制剂、激酶抑制剂、烷基化试剂、抗代谢药、嵌入抗生素、生长因子抑制剂、细胞周期抑制剂、酶、拓扑异构酶抑制剂、组蛋白脱乙酰基酶抑制剂、抗存活剂、生物学应答调节剂、抗激素例如抗雄激素和抗血管生成剂。例如,所述化疗剂可以选自以下组:卡培他滨、柔红霉素、道诺霉素、放线菌素d、多柔比星、表柔比星、伊达比星、依索比星、博来霉素、马磷酰胺、异环磷酰胺、阿糖胞苷、双氯乙基亚硝脲、白消安、丝裂霉素c、放线菌素d、普卡霉素、泼尼松、羟孕酮、睾酮、他莫昔芬、达卡巴嗪、丙卡巴肼、六甲蜜胺、五甲蜜胺、米托蒽醌、安吖啶、苯丁酸氮芥、甲基环己基亚硝基脲、氮芥、美法仑、环磷酰胺、6-巯嘌呤、6-硫鸟嘌呤、阿糖胞苷(ca)、5-氮杂胞苷、羟基脲、脱氧助间型霉素、4-羟基过氧环磷酰胺、5-氟尿嘧啶(5-fu)、5-氟脱氧尿苷(5-fudr)、甲氨喋呤(mtx)、秋水仙碱、泰素(taxol)、长春新碱、长春碱、依托泊苷、三甲曲沙、替尼泊苷和/或己烯雌酚(des)。
[0072]
在本申请中,术语“放射性元素”通常是指可以抑制肿瘤和/或肿瘤细胞增殖的放疗用元素。所述放射性元素可以选自以下组:3h、
14
c、
15
n、
35
s、
90
y、
99
tc、
111
in、
125
i和/或
131
i。
[0073]
在本申请中,术语“细胞生长抑制剂”通常是指通过抑制促进肿瘤细胞生长和复制的生长因子从而抑制肿瘤的试剂。生长因子与在细胞表面的受体结合后激活了细胞内的信号通路,复杂的通路可能促使细胞失控生长,从而导致细胞过度的分裂并发展为肿瘤。所述细胞生长抑制剂能够抑制这些生长因子的作用。所述细胞生长抑制剂可以选自以下组:血管生成抑制因子、脱乙酰化酶(hdac)抑制因子、hedgehog信号通路阻滞剂、mtor抑制剂、p53/mdm2抑制剂、parp抑制剂、蛋白酶体抑制剂和/或酪氨酸激酶抑制剂。
[0074]
在本申请中,术语“细胞毒性剂”通常是指通过对作用的细胞产生毒素,抑制肿瘤和/或肿瘤细胞增殖的试剂。所述细胞毒性剂可以选自以下组:烷化剂,如白消安、六甲蜜胺、噻替派、环磷酰胺、氮芥、乌拉莫司汀、美法仑、苯丁酸氮芥、卡莫司汀、链脲霉素、达卡巴嗪、替莫唑胺、异环磷酰胺等;抗肿瘤剂,如丝裂霉素c等;抗代谢物,如甲氨蝶呤、咪唑硫嘌呤、巯基嘌呤、氟达拉滨、5-氟尿嘧啶等;含铂的抗癌剂,如顺铂、卡铂等;蒽环霉素,如柔红霉素、阿霉素、表柔比星、伊达比星、米托蒽醌等;植物生物碱和萜类化合物,如长春新碱、长春碱、长春瑞滨、长春地辛、鬼臼毒素、多西他赛等;拓扑异构酶抑制剂,如伊立替康、安吖啶、托泊替康、依托泊苷、替尼泊苷等;抗体类,如利妥昔单抗、曲妥珠单抗、贝伐珠单抗、厄洛替尼、更生霉素等;非那雄胺;芳香化酶抑制剂;他莫昔芬;戈舍瑞林;紫杉醇和/或甲磺酸伊马替尼。所述细胞毒性剂可以通过口服、注射等方式施用。
[0075]
在本申请中,术语“美登素”通常是指从美登木属植物分离得到(参见美国专利us3896111)的化合物,其属于一种抗有丝分裂细胞毒素,结构式为:
[0076][0077]
所述美登素的cas号为35846-53-8。美登素可以对各种肿瘤,如l-1210、p-388白血病、s-180、w-256、路易斯肺癌和体外鼻咽癌均有显著疗效。所述美登素衍生物可以包括具有美登素的环结构且其环上具有一个或一个以上取代基修饰的化合物,例如美登素衍生物dm1、dm4。
[0078]
在本申请中,术语“美登素衍生物dm1”通常是指具备以下结构式的化合物:
[0079][0080]
cas号为139504-50-0。所述美登素衍生物dm1可以为一种抗有丝分裂细胞毒素。
[0081]
在本申请中,术语“与bcma蛋白的表达相关的疾病或病况”通常是指与bcma蛋白的表达相关,或者bcma蛋白的表达上调会导致的疾病或病况。所述与bcma蛋白的表达相关的疾病或病况可以是与bcma蛋白的表达相关的增生性疾病、癌前状况、恶性肿瘤、非典型癌症和非癌相关适应症。例如,所述与bcma蛋白的表达相关的疾病或病况可以包括非实体瘤。例如,所述疾病或病况可以选自以下组:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0082]
在本申请中,术语“核酸分子”通常是指从其天然环境中分离的或人工合成的任何长度的分离形式的核苷酸、脱氧核糖核苷酸或核糖核苷酸或其类似物。
[0083]
在本申请中,术语“载体”通常是指能够在合适的宿主中自我复制的核酸分子,其将插入的核酸分子转移到宿主细胞中和/或宿主细胞之间。所述载体可包括主要用于将dna或rna插入细胞中的载体、主要用于复制dna或rna的载体,以及主要用于dna或rna的转录和/或翻译的表达的载体。所述载体还包括具有多种上述功能的载体。所述载体可以是当引入合适的宿主细胞时能够转录并翻译成多肽的多核苷酸。通常,通过培养包含所述载体的合适的宿主细胞,所述载体可以产生期望的表达产物。
[0084]
在本申请中,术语“细胞”通常是指可以或已经含有包括本申请所述的核酸分子的质粒或载体,或者能够表达本申请所述的抗体或其抗原结合片段的个体细胞,细胞系或细胞培养物。所述细胞可以包括单个细胞的子代。由于天然的,意外的或故意的突变,子代细胞与原始亲本细胞在形态上或在基因组上可能不一定完全相同,但能够表达本申请所述的抗体或其抗原结合片段即可。所述细胞可以通过使用本申请所述的载体体外转染细胞而得到。所述细胞可以是原核细胞(例如大肠杆菌),也可以是真核细胞(例如酵母细胞,例如cos细胞,中国仓鼠卵巢(cho)细胞,hela细胞,hek293细胞,cos-1细胞,ns0细胞或骨髓瘤细胞)。在一些实施方案中,所述细胞是哺乳动物细胞。例如,所述哺乳动物细胞可以是cho-k1细胞。在本申请中,术语“重组细胞”通常指在其中引入了重组表达载体的细胞。所述重组细胞不仅包括某种特定的细胞,还包括这些细胞的后代。
[0085]
在本申请中,术语“约”通常是指在指定数值以上或以下0.5%-10%的范围内变动,例如在指定数值以上或以下0.5%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%、或10%的范围内变动。
[0086]
在本申请中,术语“包括”通常是指包含、总括、含有或包涵的含义。在某些情况下,也表示“为”、“由
……
组成”的含义。
[0087]
抗体、其抗体结合片段或变体
[0088]
在一个方面,本申请提供了一种抗体或其抗原结合片段或变体,其以1.8
×
10-9
m以下(例如,所述kd值不高于约1.8
×
10-9
m、不高于约1.5
×
10-9
m、不高于约1
×
10-9
m、不高于约
5
×
10-10
m、不高于约4
×
10-10
m、不高于约3
×
10-10
m、不高于约2
×
10-10
m、不高于1.6
×
10-10
m、不高于1.5
×
10-10
m、不高于1.4
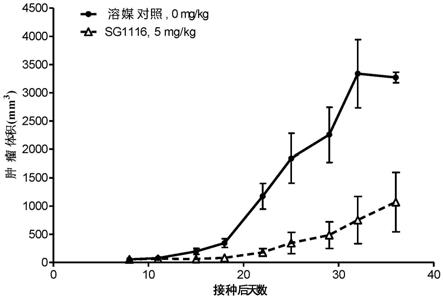
×
10-10
m、不高于1.3
×
10-10
m、不高于1.2
×
10-10
m、不高于1.1
×
10-10
m、不高于约1
×
10-10
m或不高于约1x10-11
m或以下)的kd值与bcma蛋白相结合。
[0089]
本申请所述的抗体或其抗原结合片段,可特异性识别在细胞表面表达的bcma蛋白。
[0090]
本申请所述的抗体或其抗原结合片段,可被细胞内化。例如,所述内化可以包括以下的步骤:当所述的抗体或其抗原结合片段可以结合到细胞(例如肿瘤细胞)的质膜上,或者,可以响应于细胞微环境(例如肿瘤细胞微环境)中的蛋白水解活性后在细胞内释放。从而,所述的抗体或其抗原结合片段可以被细胞膜吞没,并吸入该细胞中。在某些实施方式中,所述免疫缀合物中的所述抗体或其抗原结合片段,和/或与之缀合的所述其他试剂,也可以在所述抗体或其抗原结合片段结合到细胞的质膜上后,被细胞膜吞没,并吸入该细胞中。
[0091]
所述bcma蛋白可以包括bcma蛋白的变体。例如,所述变体可以为:1)在所述bcma蛋白的氨基酸序列中经过取代、缺失或添加一个或多个氨基酸的蛋白质或多肽;和2)与所述bcma蛋白具有至少约85%(例如,具有至少约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或更高的)序列同源性的蛋白质或多肽。
[0092]
在本申请中,所述细胞可以包括肿瘤细胞。例如,所述肿瘤可以为bcma阳性肿瘤。所述肿瘤可以为非实体瘤。例如,所述肿瘤可以包括选自下组的肿瘤:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0093]
在本申请中,所述细胞可以包括人的细胞。例如,所述细胞可以包括人骨髓瘤u266细胞人b淋巴细胞瘤ramos细胞,人多发性骨髓瘤mm.1s细胞、人骨髓瘤nci-h929细胞、人骨髓瘤opm-2细胞及人多发性骨髓瘤rpmi 8226细胞。
[0094]
本申请所述的抗体可选自下组:单克隆抗体、单链抗体、嵌合抗体、多特异性抗体、人源化抗体和全人源抗体。
[0095]
本申请所述的抗原结合片段可选自下组:fab,fab’,f(ab)2、fv和scfv片段。
[0096]
本申请所述的抗体或其抗原结合片段,可以与参比抗体竞争结合所述bcma蛋白。所述参比抗体可以包含轻链可变区和重链可变区。例如,所述参比抗体的轻链可变区可包含lcdr1、lcdr2和lcdr3,所述lcdr1包含seq id no:1所示的氨基酸序列;所述lcdr2包含seq id no:2所示的氨基酸序列;所述lcdr3包含seq id no:3所示的氨基酸序列。所述参比抗体的重链可变区可包含hcdr1、hcdr2和hcdr3,所述hcdr1包含seq id no:4所示的氨基酸序列;所述hcdr2包含seq id no:5所示的氨基酸序列;所述hcdr3包含seq id no:6所示的氨基酸序列。
[0097]
在本申请中,所述竞争性结合的能力可以通过测定所述抗体或其抗原结合片段的抗体-抗原相互作用的解离平衡常数来衡量。检测所述解离平衡常数的方法可以选自以下组:酶联免疫吸附法、表面等离振子共振(srp)法、电位滴定法、分光光度法、细管电泳法、荧光法和薄层色谱ph法。例如,所述抗体或其抗原结合片段可以经srp法(例如,使用生物大分子相互作用仪)检测。检测发现,本申请所述的抗体、其结合片段或变体可以以1.8
×
10-9
m或更低的kd值结合bcma蛋白。
[0098]
例如,所述参比抗体的轻链可变区可以包含seq id no:7所示的氨基酸序列,且所
述参比抗体的重链可变区可以包含seq id no:8所示的氨基酸序列。又例如,所述参比抗体的轻链的氨基酸序列可以包含seq id no:9所示的氨基酸序列;且所述参比抗体的重链可以包含seq id no:10所示的氨基酸序列。
[0099]
例如,本申请所述的抗体或其抗原结合片段与参比抗体竞争结合bcma蛋白。所述参比抗体可包含lcdr1-3和hcdr1-3,且其lcdr1可以包含seq id no:1所示的氨基酸序列;lcdr2可以包含seq id no:2所示的氨基酸序列;lcdr3可以包含seq id no:3所示的氨基酸序列;其hcdr1可以包含seq id no:4所示的氨基酸序列;hcdr2可以包含seq id no:5所示的氨基酸序列;hcdr3可以包含seq id no:6所示的氨基酸序列。在某些实施方式中,所述参比抗体可包括抗体sg1116或与其具有相同的lcdr1-3及hcdr1-3的抗体。又例如,所述参比抗体可包含轻链可变区和重链可变区,所述轻链可变区的氨基酸序列可以包含seq id no:7所示的氨基酸序列;且所述重链可变区可以包含seq id no:8所示的氨基酸序列。在某些实施方式中,该抗体或其抗原结合片段可包括抗体sg1116或与其具有相同的轻链可变区及重链可变区的抗体。又例如,所述参比抗体可包含轻链和重链,所述轻链的氨基酸序列可以包含seq id no:9所示的氨基酸序列;且所述重链的氨基酸序列可以包含seq id no:10所示的氨基酸序列。在某些实施方式中,该抗体或其抗原结合片段可包括抗体sg1116或与其具有相同的轻链可变区及重链可变区的抗体。
[0100]
在本申请中,所述抗体或其抗原结合片段具备结合特异性。例如,所述抗体或其抗原结合片段特异性地识别抗原——所述bcma蛋白,而不识别其他蛋白。例如,所述其他蛋白可以选自以下组:源自动物的蛋白质混合物、免疫细胞表面抗原分子cd家族、肿瘤标志物和tam受体等。例如,所述其他蛋白可以包括:牛奶、bsa、cd19、trop2、axl、cd47、cd38和gas6。在本申请中,所述抗体或其抗原结合片段的结合特异性可以通过elisa法进行检测。例如,本申请所述抗体或其抗原结合片段对所述bcma蛋白在450nm波长下的吸光度od值可以大于2.5,而对所述其他蛋白同一波长下的吸光度od值在0.5以下。
[0101]
本申请所述的抗体或其抗原结合片段可包含抗体轻链或其片段。
[0102]
例如,所述抗体轻链或其片段可包含lcdr1,且所述lcdr1可以包含seq id no:1所示的氨基酸序列。所述抗体轻链或其片段可包含lcdr2,且所述lcdr2可以包含seq id no:2所示的氨基酸序列。所述抗体轻链或其片段可包含lcdr3,且所述lcdr3可以包含seq id no:3所示的氨基酸序列。
[0103]
本申请所述抗体的轻链或其片段可包含轻链可变区vl,且所述轻链可变区vl的氨基酸序列可以包含seq id no:7所示的氨基酸序列。
[0104]
例如,所述抗体轻链或其片段可包括igκ恒定区,例如可包含人igκ恒定区。例如,所述人igκ恒定区可包含seq id no:11所示的氨基酸序列。
[0105]
在某些实施方式中,所述抗体轻链或其片段的氨基酸序列可以包含seq id no:9所示的氨基酸序列。
[0106]
本申请所述的抗体或其抗原结合片段可包含抗体重链或其片段。
[0107]
例如,所述抗体重链或其片段可包含hcdr1,且所述hcdr1可以包含seq id no:4所示的氨基酸序列。所述抗体重链或其片段可包含hcdr2,且所述hcdr2可以包含seq id no:5所示的氨基酸序列。又例如,所述抗体重链或其片段可包含hcdr3,且所述hcdr3可以包含seq id no:6所示的氨基酸序列。
[0108]
所述抗体重链或其片段可包含重链可变区vh,且所述重链可变区vh可以包含seq id no:8所示的氨基酸序列。
[0109]
例如,所述抗体重链或其片段还包含人恒定区。其中,所述人恒定区可包括人igg恒定区。例如,所述人igg恒定区可包含人igg1恒定区。例如,所述人igg1恒定区可包含seq id no:12所示的氨基酸序列。
[0110]
在某些实施方式中,所述抗体重链的氨基酸序列可以包含seq id no:10所示的氨基酸序列。
[0111]
在某些实施方式中,本申请所述的抗体或其抗原结合片段中lcdr1可以包含seq id no:1所示的氨基酸序列;lcdr2可以包含seq id no:2所示的氨基酸序列;lcdr3可以包含seq id no:3所示的氨基酸序列;且hcdr1可包含seq id no:4所示的氨基酸序列;hcdr2可以包含seq id no:5所示的氨基酸序列;hcdr3可以包含seq id no:6所示的氨基酸序列。例如,该抗体或其抗原结合片段可包括抗体sg1116或与其具有相同的lcdr1-3及hcdr1-3的抗体。在某些实施方式中,本申请所述的抗体或其抗原结合片段的轻链可包含轻链可变区,所述轻链可变区可以包含seq id no:7所示的氨基酸序列;且其中重链可包含重链可变区,所述重链可变区可以包含seq id no:8所示的氨基酸序列。例如,该抗体或其抗原结合片段可包括抗体sg1116或与其具有相同的轻链可变区及重链可变区的抗体。
[0112]
在某些实施方式中,本申请所述的抗体可以为sg1116。抗体sg1116的lcdr1-3的氨基酸序列可以依次如seq id no:1、seq id no:2和seq id no:3所示,且hcdr1-3的氨基酸序列可以依次如seq id no:4、seq id no:5和seq id no:6所示;vl的氨基酸序列可以如seq id no:7所示,且vh的氨基酸序列可以如seq id no:8所示。
[0113]
在本申请中涉及的蛋白质、多肽和/或氨基酸序列,还应理解为至少包含以下的范围:与该所述蛋白质或多肽具备相同或类似功能的变体或同源物。
[0114]
在本申请中,所述变体可以为,在所述蛋白质和/或所述多肽(例如,本申请所述抗体或其抗原结合片段)的氨基酸序列中经过取代、缺失或添加一个或多个氨基酸的蛋白质或多肽。例如,所述变体可包含已经通过至少1个,例如1-30个、1-20个或1-10个,又例如1个、2个、3个、4个或5个氨基酸取代、缺失和/或插入而具有氨基酸改变的蛋白质或多肽。所述功能性变体可基本上保持改变(例如取代、缺失或添加)之前的所述蛋白质或所述多肽的生物学特性。例如,所述功能性变体可保持改变之前的所述蛋白质或所述多肽的至少60%,70%,80%,90%,或100%的生物学活性(例如特异性结合bcma蛋白的能力)。
[0115]
在本申请中,所述同源物可以为,与所述蛋白质和/或所述多肽(例如,本申请所述抗体或其抗原结合片段)的氨基酸序列具有至少约80%(例如,具有至少约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或更高的)序列同源性的蛋白质或多肽。
[0116]
在本申请中,所述同源性通常是指两个或多个序列之间的相似性或关联的程度。可以通过以下方式计算“序列同源性百分比”:将两条待比对的序列在比较窗中进行比较,确定两条序列中存在相同核酸碱基(例如,a、t、c、g、i)或相同氨基酸残基(例如,ala、pro、ser、thr、gly、val、leu、ile、phe、tyr、trp、lys、arg、his、asp、glu、asn、gln、cys和met)的位置的数目以得到匹配位置的数目,将匹配位置的数目除以比较窗中的总位置数(即,窗大小),并且将结果乘以100,以产生序列同源性百分比。为了确定序列同源性百分数而进行的
比对,可以按本领域已知的多种方式实现,例如,使用可公开获得的计算机软件如blast、blast-2、align或megalign(dnastar)软件。本领域技术人员可以确定用于比对序列的适宜参数,包括为实现正在比较的全长序列范围内或目标序列区域内最大比对所需要的任何算法。所述同源性也可以通过以下的方法测定:fasta和blast。对fasta算法的描述可以参见w.r.pearson和d.j.lipman的“用于生物学序列比较的改进的工具”,美国国家科学院院刊(proc.natl.acad.sci.),85:2444-2448,1988;和d.j.lipman和w.r.pearson的“快速灵敏的蛋白质相似性搜索”,science,227:1435-1441,1989。对blast算法的描述可参见s.altschul、w.gish、w.miller、e.w.myers和d.lipman的“一种基本的局部对比(alignment)搜索工具”,分子生物学杂志,215:403-410,1990。
[0117]
核酸、载体、宿主细胞和制备方法
[0118]
在另一个方面,本申请还提供了分离的一种或多种核酸分子。所述一种或多种核酸分子可编码本申请所述的抗体或其抗原结合片段。例如,所述一种或多种核酸分子中的每一个核酸分子可以编码完整的所述抗体或其抗原结合片段,也可以编码其中的一部分(例如,hcdr1-3、lcdr1-3、vl、vh、轻链或重链中的一种或多种)。
[0119]
本申请所述的核酸分子可以是相互分离的,例如,其可以分别包含编码一种本申请所述抗体或其抗原结合片段或其一部分的核苷酸序列。本申请所述的核酸分子也可以同时包含多种编码本申请所述抗体或其抗原结合片段或其一部分的核苷酸序列。
[0120]
在本申请中,所述核酸分子可以通过本领域常规的方法合成。例如,其可以是通过以下方法产生或合成的:(i)在体外扩增的,例如通过聚合酶链式反应(pcr)扩增产生的,(ii)通过克隆重组产生的,(iii)纯化的,例如通过酶切和凝胶电泳分级分离,或者(iv)合成的,例如,可以通过化学合成。在某些情形下,所述的核酸分子可以通过重组dna技术制备。
[0121]
在本申请中,可以通过本领域已知的多种方法来制备编码所述的抗体或其抗原结合片段的核酸,这些方法包括但不限于,采用限制性片段操作或采用合成性寡核苷酸的重叠延伸pcr,具体操作可参见sambrook等人,molecular cloning,a laboratory manual,cold spring harbor laboratory press,cold spring harbor,n.y.,1989;和ausube等人current protocols in molecular biology,greene publishing and wiley-interscience,new york n.y.,1993。
[0122]
在另一个方面,本申请提供了一种或多种载体,其包含本申请所述的一种或多种核酸分子。每种载体中可包含一种或多种所述核酸分子。此外,所述载体中还可包含其他基因,例如允许在适当的宿主细胞中和在适当的条件下选择该载体的标记基因。此外,所述载体还可包含允许编码区在适当宿主中正确表达的表达控制元件。这样的控制元件为本领域技术人员所熟知的,例如,可包括启动子、核糖体结合位点、增强子和调节基因转录或mrna翻译的其他控制元件等。本申请所述的一种或多种核酸分子可以与所述表达控制元件可操作地连接。
[0123]
所述载体可以包括,例如质粒、粘粒、病毒、噬菌体或者在例如遗传工程中通常使用的其他载体。例如,所述载体为表达载体。
[0124]
在另一个方面,本申请提供了细胞,所述细胞可包含本申请所述的一种或多种核酸分子和/或本申请所述的一种或多种载体。例如,每种或每个细胞可包含一个或一种本申
请所述的核酸分子或载体。例如,每种或每个细胞可包含多个(例如,2个或以上)或多种(例如,2种或以上)本申请所述的核酸分子或载体。例如,可将本申请所述的载体引入所述细胞中,例如真核细胞,如来自植物的细胞、真菌或酵母细胞等。可通过本领域已知的方法将本申请所述的载体引入所述细胞中,例如电穿孔、lipofectine转染、lipofectamin转染等。例如,所述细胞可以为cho-s。
[0125]
在另一个方面,本申请提供了制备所述的抗体或其抗原结合片段的方法。所述方法可包括,在使得所述的抗体或其抗原结合片段表达的条件下,培养所述本申请所述的细胞。本例如,可通过使用适当的培养基、适当的温度和培养时间等,这些方法是本领域普通技术人员所了解的。本申请提供了使用噬菌体展示文库的方法制备所述抗体或抗原结合片段的方法,其包括步骤:在噬菌体上合成人抗体的文库,用bcma或其部分筛选文库,分离结合bcma的噬菌体;用噬菌体感染细菌,扩增培养后挑选特异性结合抗原的单克隆;测序得到编码抗体的重链可变区和轻链可变区序列;将可变区基因克隆进真核表达载体,例如,pcmv-163,转染至宿主细胞中表达抗体。
[0126]
在某些情形中,所述方法还可包括分离和/或纯化所述抗体或其抗原结合片段的步骤。例如,可以采用蛋白g-琼脂糖或蛋白a-琼脂糖进行亲和层析,还可通过凝胶电泳和/或高效液相色谱等来纯化和分离本申请所述的抗体或其抗原结合片段。例如,还可以使用protein a亲和纯化。
[0127]
免疫缀合物、药物组合物、应用
[0128]
另一方面,本申请提供了一种免疫缀合物,其包含所述的抗体或其抗原结合片段。
[0129]
例如,所述的免疫缀合物可以包含选自下组的至少一种其他试剂:化疗剂、放射性元素、细胞生长抑制剂和细胞毒性剂。在某些实施方式中,所述的免疫缀合物中所述抗体或其抗原结合片段可以与所述至少一种其他试剂直接或间接连接。例如,所述的免疫缀合物中所述抗体或其抗原结合片段可以与所述至少一种其他试剂通过连接分子连接,例如,通过smcc(4-(n-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯)连接子。
[0130]
在本申请中,所述至少一种其他试剂可以包括美登素(maytansine)或其衍生物。例如,所述美登素衍生物可以包括美登素衍生物dm1。
[0131]
另一方面,本申请提供了一种药物组合物,其包含所述的抗体或其抗原结合片段,所述的免疫缀合物,或者所述的细胞,以及任选地药学上可接受的佐剂。
[0132]
所述药学上可接受的佐剂可以包括缓冲剂、抗氧化剂、防腐剂、低分子量多肽、蛋白质、亲水聚合物、氨基酸、糖、螯合剂、反离子、金属复合物和/或非离子表面活性剂等。
[0133]
在本申请中,所述药物组合物可被配制用于口服给药,静脉内给药,肌肉内给药,在肿瘤部位的原位给药,吸入,直肠给药,阴道给药,经皮给药或通过皮下储存库给药。例如,对于注射制剂,药物组合物可以被制备成例如一次剂量的剂型的安瓿瓶或例如多剂量容器的单元型剂型。药物组合物还可以被制备成溶液,悬浮液,药片,药丸,胶囊和长效制剂。
[0134]
所述药物组合物可以用于抑制肿瘤(例如,bcma阳性肿瘤)生长。例如,本申请的药物组合物可以抑制或延缓疾病的发展或进展,可以减小肿瘤大小(甚至基本消除肿瘤),和/或可以减轻和/或稳定疾病状态。
[0135]
本申请所述的药物组合物可以包含治疗有效量的所述抗体或其抗原结合片段。所
述治疗有效量是能够预防和/或治疗(至少部分治疗)患有或具有发展风险的受试者中的病症或病症(例如癌症)和/或其任何并发症而所需的剂量。
[0136]
另一方面,本申请提供了所述的抗体或其抗原结合片段,或者所述的免疫缀合物在制备药物中的用途,所述药物用于预防或治疗肿瘤。
[0137]
在本申请中,所述肿瘤可以包括bcma阳性肿瘤。在某些实施方式中,所述肿瘤可以包括非实体瘤。在某些情形中,所述肿瘤可以是b细胞癌症、多发性骨髓瘤、恶性浆细胞肿瘤、卡勒氏病和骨髓瘤病;浆细胞白血病;浆细胞瘤;b细胞幼淋巴细胞白血病;毛细胞白血病;b细胞非霍奇金氏淋巴瘤(nhl);急性骨髓性白血病(aml);慢性骨髓性白血病(cml);急性淋巴细胞白血病(all);慢性淋巴细胞白血病(cll);滤泡性淋巴瘤(包括滤泡性非霍奇金氏淋巴瘤类型);伯基特氏淋巴瘤(地方性伯基特氏淋巴瘤;散发性伯基特氏淋巴瘤);边缘区淋巴瘤(粘膜相关淋巴组织;malt/maltoma;单核细胞样b细胞淋巴瘤;伴绒毛状淋巴细胞的脾淋巴瘤);套细胞淋巴瘤;大细胞淋巴瘤(弥漫性大细胞;弥漫性混合细胞;免疫母细胞性淋巴瘤;原发性纵隔b细胞淋巴瘤;血管中心性淋巴瘤-肺b细胞);小淋巴细胞淋巴瘤(sll);前体b-淋巴母细胞淋巴瘤;骨髓性白血病(粒细胞;骨髓性;急性骨髓性白血病;慢性骨髓性白血病;亚急性骨髓性白血病;髓细胞肉瘤;绿色瘤;粒细胞肉瘤;急性早幼粒细胞白血病;急性粒单核细胞白血病);瓦尔登斯特伦巨球蛋白血症或其它b细胞淋巴瘤。例如,所述肿瘤可以包括选自下组的肿瘤:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0138]
在本申请中,术语“淋巴瘤”通常是指由淋巴细胞病变造成的血液细胞瘤。淋巴瘤细胞表面通常呈bcma表达阳性。
[0139]
在本申请中,术语“骨髓瘤”通常是指以骨髓内浆细胞克隆性增殖为特征的肿瘤。在骨髓瘤细胞上,bcma的表达通常呈阳性。示例性骨髓瘤细胞包括但不限于,x63ag8、sp2/0、ns1、ns0、j558l、u266、u937、p3u1、xg-1、xg-2、xg-3、xg-4、xg-5、xg-6、xg-7、xg-8、xg-9、u266、rpm1-8226、lp1、l363、opm1、opm2、以及nclh929细胞或来源于这些细胞系的细胞系。
[0140]
在本申请中,术语“血液系统恶性肿瘤”通常是指指涉及细胞如白细胞、淋巴细胞、天然杀伤细胞、浆细胞和髓细胞如嗜中性粒细胞和单核细胞的造血作用过程中产生的癌症或过度增生性病症。血液系统恶性肿瘤可包括淋巴瘤、白血病、骨髓瘤或淋巴恶性肿瘤以及脾和淋巴结癌症,该术语还涵盖其它的血液学和/或b细胞或t细胞相关的癌症,但不包括上述多发性骨髓瘤和淋巴瘤。
[0141]
另一方面,本申请提供了所述的抗体或其抗原结合片段,或者所述的免疫缀合物,其用于预防或治疗肿瘤。
[0142]
在本申请中,所述肿瘤可以包括bcma阳性肿瘤。在某些实施方式中,所述肿瘤可以包括非实体瘤。例如,所述肿瘤可以包括选自下组的肿瘤:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0143]
另一方面,本申请提供了一种预防或治疗有需要的受试者中的肿瘤的方法,其包括向所述受试者施用所述的抗体或其抗原结合片段,所述的免疫缀合物,或者所述的药物组合物。
[0144]
在本申请中,所述肿瘤可以包括bcma阳性肿瘤。在某些实施方式中,所述肿瘤可以包括非实体瘤。例如,所述肿瘤可以包括选自下组的肿瘤:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0145]
另一方面,本申请提供了根据所述的抗体或其抗原结合片段,其用于诊断与bcma蛋白的表达相关的疾病或病况。
[0146]
在本申请中,所述与bcma蛋白的表达相关的疾病或病况可以选自以下组:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0147]
另一方面,本申请提供了根据所述的抗体或其抗原结合片段用于制备诊断剂的用途,其中所述诊断剂用于诊断与bcma蛋白的表达相关的疾病或病况。
[0148]
在本申请中,所述诊断剂可以单独使用或者可以与仪器、器具、设备或系统组合使用。在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,可以使用所述诊断剂对人体样本(例如,各种体液、细胞、组织样本等)进行体外检测。所述诊断剂可以选自以下组:试剂、试剂盒、校准品和质控品。
[0149]
所述体外检测的方法可以选自以下组:western blot、elisa和免疫组化法。例如,所述试剂可以包括能够测量所述bcma蛋白表达量的试剂。例如,所述试剂可以选自以下组:用以实施western blot的试剂、用以实施elisa的试剂和用以实施免疫组化法的试剂。
[0150]
在本申请中,所述与bcma蛋白的表达相关的疾病或病况可以选自以下组:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0151]
另一方面,本申请提供了一种诊断受试者中与bcma蛋白的表达相关的疾病或病况的方法,所述方法包括:使源自所述受试者的样品与所述的抗体或其抗原结合片段接触,以及判断所述样品中能够特异性结合所述抗体或其抗原结合片段的物质的存在和/或含量。
[0152]
在本申请中,所述与bcma蛋白的表达相关的疾病或病况可以选自以下组:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0153]
本申请还涉及如下实施方案:
[0154]
1.抗体或其抗原结合片段,其包含抗体轻链可变区vl和抗体重链可变区vh,所述vl包含lcdr1,lcdr2和lcdr3中的任意一个,所述vh包含hcdr1,hcdr2和hcdr3中的任意一个,其中所述vl包含seq id no:7所示的氨基酸序列,所述vh包含seq id no:8所示的氨基酸序列。
[0155]
2.如实施方案1所述的抗体或其抗原结合片段,其具备选自下组的一种或多种性质:
[0156]
1)能够以1.8
×
10-9
m或更低的kd值结合bcma蛋白;
[0157]
2)能够特异性识别在细胞表面表达的bcma蛋白;
[0158]
3)能够被细胞内化;和
[0159]
4)抑制肿瘤和/或肿瘤细胞增殖。
[0160]
3.如实施方案1-2中任一项所述的抗体或其抗原结合片段,其中所述bcma蛋白为人bcma蛋白。
[0161]
4.如实施方案1-3中任一项所述的抗体或其抗原结合片段,其中所述抗体选自下组:单克隆抗体、单链抗体、嵌合抗体、多特异性抗体、人源化抗体和全人源抗体。
[0162]
5.如实施方案1-3中任一项所述的抗体或其抗原结合片段,其中所述抗原结合片段选自下组:fab、fab’、f(ab)2、f(ab’)2、fv和scfv。
[0163]
6.如实施方案1-4中任一项所述的抗体或其抗原结合片段,其与参比抗体竞争结合所述bcma蛋白,其中所述参比抗体包含轻链可变区和重链可变区,所述参比抗体的轻链
可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含seq id no:1所示的氨基酸序列;所述lcdr2包含seq id no:2所示的氨基酸序列;所述lcdr3包含seq id no:3所示的氨基酸序列;所述参比抗体的重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含seq id no:4所示的氨基酸序列;所述hcdr2包含seq id no:5所示的氨基酸序列;所述hcdr3包含seq id no:6所示的氨基酸序列。
[0164]
7.如实施方案5所述的抗体或其抗原结合片段,其中所述参比抗体的轻链可变区包含seq id no:7所示的氨基酸序列,且所述参比抗体的重链可变区包含seq id no:8所示的氨基酸序列。
[0165]
8.如实施方案5-6中任一项所述的抗体或其抗原结合片段,其中所述参比抗体的轻链包含seq id no:9所示的氨基酸序列;且所述参比抗体的重链包含seq id no:10所示的氨基酸序列。
[0166]
9.如实施方案5-7中任一项所述的抗体或其抗原结合片段,其中所述参比抗体包括抗体sg1116。
[0167]
10.如实施方案1-8中任一项所述的抗体或其抗原结合片段,其中所述抗体包含抗体轻链或其片段。
[0168]
11.如实施方案9所述的抗体或其抗原结合片段,其中所述抗体轻链或其片段包含lcdr1,且所述lcdr1包含seq id no:1所示的氨基酸序列。
[0169]
12.如实施方案9-10中任一项所述的抗体或其抗原结合片段,其中所述抗体轻链或其片段包含lcdr2,且所述lcdr2包含seq id no:2所示的氨基酸序列。
[0170]
13.如实施方案9-11中任一项所述的抗体或其抗原结合片段,其中所述抗体轻链或其片段包含lcdr3,且所述lcdr3包含seq id no:3所示的氨基酸序列。
[0171]
14.如实施方案9-12中任一项所述的抗体或其抗原结合片段,其中所述抗体轻链或其片段包含轻链可变区vl,且所述轻链可变区vl包含seq id no:7所示的氨基酸序列。
[0172]
15.如实施方案9-13中任一项所述的抗体或其抗原结合片段,其中所述抗体轻链或其片段还包含人恒定区。
[0173]
16.如实施方案14所述的抗体或其抗原结合片段,其中所述人恒定区包括人igκ恒定区。
[0174]
17.如实施方案9-15中任一项所述的抗体或其抗原结合片段,其中所述抗体轻链或其片段包含seq id no:9所示的氨基酸序列。
[0175]
18.如实施方案1-16中任一项所述的抗体或其抗原结合片段,其中所述抗体包含抗体重链或其片段。
[0176]
19.如实施方案17所述的抗体或其抗原结合片段,其中所述抗体重链或其片段包含hcdr1,且所述hcdr1包含seq id no:4所示的氨基酸序列。
[0177]
20.如实施方案17-18中任一项所述的抗体或其抗原结合片段,其中所述抗体重链或其片段包含hcdr2,且所述hcdr2包含seq id no:5所示的氨基酸序列。
[0178]
21.如实施方案17-19中任一项所述的抗体或其抗原结合片段,其中所述抗体重链或其片段包含hcdr3,且所述hcdr3包含seq id no:6所示的氨基酸序列。
[0179]
22.如实施方案17-20中任一项所述的抗体或其抗原结合片段,其中,所述抗体重链或其片段包含重链可变区vh,且所述重链可变区vh包含seq id no:8所示的氨基酸序列。
[0180]
23.如实施方案17-21中任一项所述的抗体或其抗原结合片段,其中所述抗体重链或其片段还包含人恒定区。
[0181]
24.如实施方案22所述的抗体或其抗原结合片段,所述人恒定区包括人igg恒定区。
[0182]
25.如实施方案23所述的抗体或其抗原结合片段,其中所述人igg恒定区包含人igg1恒定区。
[0183]
26.如实施方案17-24中任一项所述的抗体或其抗原结合片段,其中,所述抗体重链包含seq id no:10所示的氨基酸序列。
[0184]
27.如实施方案1-25中任一项所述的抗体或其抗原结合片段,其中,所述抗体包括抗体sg1116。
[0185]
28.分离的一种或多种核酸分子,其编码实施方案1-26中任一项所述的抗体或其抗原结合片段。
[0186]
29.一种或多种载体,其包含实施方案27所述的核酸分子。
[0187]
30.细胞,其包含实施方案27所述的核酸分子或实施方案28所述的载体。
[0188]
31.制备实施方案1-26中任一项所述的抗体或其抗原结合片段的方法,所述方法包括在使得所述抗体或其抗原结合片段表达的条件下,培养实施方案29所述的细胞。
[0189]
32.免疫缀合物,其包含实施方案1-26中任一项所述的抗体或其抗原结合片段。
[0190]
33.如实施方案31所述的免疫缀合物,其还包含选自下组的至少一种其他试剂:化疗剂、放射性元素、细胞生长抑制剂和细胞毒性剂。
[0191]
34.如实施方案32所述的免疫缀合物,其中所述抗体或其抗原结合片段与所述至少一种其他试剂直接或间接连接。
[0192]
35.如实施方案33所述的免疫缀合物,其中所述间接连接包含通过连接分子连接,所述连接分子包括smcc连接子。
[0193]
36.如实施方案32-34中任一项所述的免疫缀合物,其中所述至少一种其他试剂包括美登素或其衍生物。
[0194]
37.如实施方案35所述的免疫缀合物,其中所述美登素衍生物包括美登素衍生物dm1。
[0195]
38.药物组合物,其包含实施方案1-26中任一项所述的抗体或其抗原结合片段,实施方案31-36中任一项所述的免疫缀合物,或者实施方案29所述的细胞,以及任选地药学上可接受的佐剂。
[0196]
39.实施方案1-26中任一项所述的抗体或其抗原结合片段,或者实施方案31-36中任一项所述的免疫缀合物在制备药物中的用途,所述药物用于预防或治疗肿瘤。
[0197]
40.如实施方案38所述的用途,其中所述肿瘤包括bcma阳性肿瘤。
[0198]
41.如实施方案38-39中任一项所述的用途,其中所述肿瘤包括非实体瘤。
[0199]
42.如实施方案38-40中任一项所述的用途,其中所述肿瘤包括选自下组的肿瘤:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0200]
43.实施方案1-26中任一项所述的抗体或其抗原结合片段,或者实施方案31-36中任一项所述的免疫缀合物,其用于预防或治疗肿瘤。
[0201]
44.如实施方案42所述的抗体或其抗原结合片段或者免疫缀合物,其中所述肿瘤
包括bcma阳性肿瘤。
[0202]
45.如实施方案42-43中任一项所述的抗体或其抗原结合片段或者免疫缀合物,其中所述肿瘤包括非实体瘤。
[0203]
46.如实施方案42-44中任一项所述的抗体或其抗原结合片段或者免疫缀合物,其中所述肿瘤包括选自下组的肿瘤:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0204]
47.预防或治疗有需要的受试者中的肿瘤的方法,其包括向所述受试者施用实施方案1-26中任一项所述的抗体或其抗原结合片段,实施方案31-36中任一项所述的免疫缀合物,或者实施方案37所述的药物组合物。
[0205]
48.如实施方案46所述的方法,其中所述肿瘤包括bcma阳性肿瘤。
[0206]
49.如实施方案46-47中任一项所述的方法,其中所述肿瘤包括非实体瘤。
[0207]
50.如实施方案46-48中任一项所述的方法,其中所述肿瘤包括选自下组的肿瘤:骨髓瘤、淋巴瘤和血液系统恶性肿瘤。
[0208]
51.如实施方案1-26中任一项所述的抗体或其抗原结合片段,其用于诊断与bcma蛋白的表达相关的疾病或病况。
[0209]
52.如实施方案1-26中任一项所述的抗体或其抗原结合片段用于制备诊断剂的用途,其中所述诊断剂用于诊断与bcma蛋白的表达相关的疾病或病况。
[0210]
53.判断受试者中与bcma蛋白的表达相关的疾病或病况的方法,所述方法包括:使源自所述受试者的样品与实施方案1-26中任一项所述的抗体或其抗原结合片段接触,以及判断所述样品中能够特异性结合所述抗体或其抗原结合片段的物质的存在和/或含量。
[0211]
不欲被任何理论所限,下文中的实施例仅仅是为了阐释本申请的装置、方法和系统的工作方式,而不用于限制本申请发明的范围。
[0212]
实施例
[0213]
实施例1抗体筛选
[0214]
利用淋巴细胞分离液分离116名成年健康人(男女各半)外周血淋巴细胞。trizol法提取总rna,反转录为cdna,常规pcr方法扩增不同抗体亚型的可变区基因,常规分子生物学技术将抗体可变区基因克隆入同样酶切处理的pdf载体中,电穿孔转化大肠杆菌xl1-blue(agilent technology)。经sb培养液扩大培养后,加1
×
10
13
pfu辅助病毒vcsm13(biovector ntcc inc.)感染,获得初级噬菌体抗体库,按比例(感染复数moi>200)混合初级抗体库和bs1365菌(biovector ntcc inc.),借助bs1365菌表达的cre重组酶介导loxp/loxp511重组,构建大容量抗体库。
[0215]
用5%脱脂奶粉封闭重组bcma-his(acro biosystems)包被的免疫试管(maxisorp免疫试管,thermo nunc)后,加入上述噬菌体抗体库,37℃下孵育2h;弃去未结合的噬菌体,tbs-t洗液洗涤5遍,充分洗去非特异吸附噬菌体;加入1ml洗脱缓冲液(0.1mol/l甘氨酸-hcl,ph=2.2)洗脱噬菌体并以40μl 2mol/l tris溶液中和;加入对数期xl1-blue菌(agilent technology)、sb培养基(sb培养液:胰蛋白胨30g,酵母提取物20g,mops 10g,溶于950ml去离子水中,氢氧化钠调ph值至7.0,定容至1l,高压灭菌)及辅助噬菌体vcsm13进行扩增富集;重复该过程3-4轮,将洗脱下来的噬菌体感染新鲜制备的对数期xl1-blue菌涂培养板,在37℃下过夜培养后,随机挑取单克隆至96孔深孔板(corning),扩大培养后进行phage-elisa检测与抗原的结合特性;共鉴定500个克隆,其中38个特异性结合bcma的克隆
中,sg1116结合活性最好(具体方法和试剂可以参考:《phage display》,humana press)。
[0216]
将sg1116克隆送测序,所获得的可变区基因经imgt(http://imgt.cines.fr/imgtvquest/vquest)在线分析,获得sg1116抗体的hcdr1-3的氨基酸序列依次如seq id no:4、seq id no:5和seq id no:6所示;lcdr1-3的氨基酸序列依次如seq id no:1、seq id no:2和seq id no:3所示;轻链可变区的氨基酸序列如seq id no:7所示,重链可变区的氨基酸序列如seq id no:8所示。
[0217]
实施例2抗体表达纯化
[0218]
将实施例1获得的sg1116克隆可变区基因克隆进含有人igg恒定区基因的真核表达载体pcmv-163中,构建全抗体表达载体。全抗体称为sg1116抗体。
[0219]
使用expichotm expression system试剂盒(购自thermo fisher scientific),将获得的编码抗体sg1116的真核表达载体转染至cho-s细胞中进行表达,收集含有目的蛋白的细胞培养上清,利用常规的protein a亲和纯化目标抗体。
[0220]
实施例3抗体与抗原的结合活性
[0221]
将靶抗原bcma-his包被elisa板条,1μg/ml,4℃过夜;pbst洗涤后,加入10%的胎牛血清,37℃封闭1小时;加入不同浓度的抗体sg1116,37℃反应1小时;pbst洗涤后,加入辣根过氧化物酶标记的羊抗人igg二抗(goat anti human(hrp),thermo fisher scientific),37℃反应30分钟;pbst重复洗板5遍,在吸水纸上尽量拍干残留液滴;每孔加入100μl tmb(ebioscience),室温(20
±
5℃)避光放置1.5min;每孔加入100μl 2n h2so4终止液终止底物反应,酶标仪450nm处读取od值,分析抗体与靶抗原bcma结合能力。结果如图1所示,抗体sg1116与抗原bcma的结合活性ec
50
值为56.5ng/ml。
[0222]
实施例4抗体亲和力测定
[0223]
采用biacore生物大分子相互作用仪(ge公司)分析抗体亲和力。在芯片上偶联抗人igg抗体(购自ge),利用抗人igg抗体捕获sg1116抗体,抗体浓度定为3μg/ml,进样时间为120秒;以抗原bcma为流动相,使用8个浓度梯度(0.15625、0.3125、0.625、1.25、2.5、5、10、20nm),结合时间为120秒;解离时间为300秒;各抗体均使用3m氯化镁(购自ge)进行再生,时间为30秒。结果显示sg1116抗体亲和力如表2所示。
[0224]
表2 sg1116抗体的亲和力测定
[0225]
抗体结合常数(1/ms)解离常数(1/s)解离平衡常数(m)sg11161.23e+071.71e-021.39e-09
[0226]
实施例5抗体特异性识别抗原
[0227]
将牛奶(北京博迈德生物技术有限公司)、bsa(bovogen)、cd19(北京义翘神州生物技术有限公司)、trop2(北京义翘神州科技有限公司)、bcma(acro biosystems)、cd47(北京义翘神州科技有限公司)、cd38(北京义翘神州科技有限公司)、gas6(r&d)等各蛋白以及axl(acro biosystems)分别包被elisa板条,1μg/ml,4℃过夜;pbst洗涤后,加入10%的胎牛血清,37℃封闭1小时;加入抗体sg1116,37℃反应1小时;pbst洗涤后,加入辣根过氧化物酶标记的羊抗人igg二抗(goat anti human(hrp),thermo fisher scientific),室温反应30分钟;pbst重复洗板5遍,在吸水纸上尽量拍干残留液滴;每孔加入100μl tmb(ebioscience,#85-00-420),室温(20
±
5℃)避光放置1.5min;每孔加入100μl 2n h2so4终止液终止底物反应,酶标仪450nm处读取od值,分析抗体与蛋白结合能力。
[0228]
结果如图2所示。结果显示,sg1116抗体能特异性识别靶抗原bcma,但与牛奶、cd19、trop2、axl、bsa、cd47、cd38、gas6等蛋白均无显著的结合反应。
[0229]
实施例6细胞表面bcma抗原的表达
[0230]
以人骨髓瘤u266细胞、人b淋巴细胞瘤ramos细胞,人多发性骨髓瘤mm.1s细胞、人骨髓瘤nci-h929细胞、人骨髓瘤opm-2细胞及人多发性骨髓瘤rpmi 8226细胞等多株肿瘤细胞为代表模型,流式分析肿瘤细胞表面bcma的表达。
[0231]
收集对数生长期细胞,调整细胞密度到5
×
106个细胞/ml,冰上预冷。取100μl细胞,加入apc抗人bcma抗体(biolegend),4℃避光反应20min。结束后,用含2%fbs预冷的生理盐水洗两次(6000rpm,45s)。用400μl 1%(v/v)多聚甲醛重悬细胞。流式细胞仪(bd calibur)分析细胞表面bcma抗原的表达情况。
[0232]
结果显示,人骨髓瘤u266细胞、人b淋巴细胞瘤ramos细胞,人多发性骨髓瘤mm.1s细胞、人骨髓瘤nci-h929细胞、人骨髓瘤opm-2细胞及人多发性骨髓瘤rpmi 8226细胞均表达bcma抗原,结果如图3所示。
[0233]
实施例7抗体特异性识别细胞表面抗原
[0234]
以人骨髓瘤u266细胞以及基因工程技术构建的稳定表达bcma的chos细胞(chos-bcma)为代表细胞模型,流式分析细胞表面bcma与sg1116的结合。收集对数生长期细胞,调整细胞密度到5
×
106细胞/ml,冰上预冷。含2%fbs预冷的生理盐水稀释sg1116抗体至20μg/ml。取100μl细胞,加入等体积前述稀释sg1116抗体,4℃避光反应30min。结束后,用含2%fbs预冷的生理盐水洗两次(6000rpm,45s)。用含2%fbs预冷的生理盐水按1:5稀释二抗pe小鼠抗人igg(bd pharmingen),取100μl重悬细胞,4℃避光反应30min。反应结束后,用含2%fbs预冷的生理盐水洗两次(6000rpm,45s)。用400μl 1%多聚甲醛重悬细胞。流式细胞仪(bd calibur)分析抗体与细胞表面抗原的结合能力。
[0235]
结果如图4a-4b所示。结果显示,sg1116抗体能特异性识别人骨髓瘤u266细胞(图4a)、基因工程技术构建的稳定表达bcma的chos细胞(chos-bcma,图4b)表面的bcma分子,且该识别活性呈剂量依赖性。与u266细胞结合的ec
50
值为4.294μg/ml,与chos-bcma细胞结合的ec
50
值为0.6221μg/ml。
[0236]
实施例8抗体内化活性
[0237]
以人骨髓瘤u266细胞以及基因工程技术构建的稳定表达bcma的chos细胞(chos-bcma)为代表细胞模型流式分析sg1116抗体识别bcma后介导的内化活性。收集对数生长期细胞,调整细胞密度到5
×
106细胞/ml,冰上预冷。含2%fbs预冷的生理盐水稀释sg1116抗体至不同浓度。取100μl细胞,加入等体积前述稀释sg1116抗体,4℃孵育30min。结束后,用含2%fbs预冷的生理盐水洗涤细胞三次。将细胞继续放置于4℃或37℃培养2小时后洗涤细胞两次。用含2%fbs预冷的生理盐水按1:5稀释二抗pe小鼠抗人igg(bd pharmingen),取100μl重悬细胞,4℃避光反应30min。反应结束后,洗涤细胞三次。用400μl 1%多聚甲醛重悬细胞。流式细胞仪(bd calibur)分析抗体在不同温度下培养细胞表面的荧光强度,并按照一下公式计算出抗体的内化效率。
[0238]
内化效率=【表面总mfi(4℃)-表面总mfi(37℃)】/表面总mfi(4℃)
×
100%。
[0239]
结果如图5a-5b所示。结果显示,sg1116抗体在人骨髓瘤u266细胞(图5a)、稳定表达bcma的chos细胞(chos-bcma,图5b)两个代表细胞模型上可以有效的内化,ec
50
分别为
0.1776μg/ml、0.00327μg/ml。
[0240]
实施例9抗体体内抑制肿瘤活性
[0241]
以nci-h929细胞为代表细胞,建立荷瘤动物模型,评价sg1116的体内抑制肿瘤活性。
[0242]
选择雌性、6-7周龄nod/scid小鼠(上海灵畅生物科技有限公司),nci-h929细胞培养在含10%胎牛血清的rpmi1640+0.05mmβ-me的培养液中。收集指数生长期的nci-h929细胞,pbs重悬至适合浓度并与基底膜基质(matrigel)1:1混合后用于小鼠右侧背部皮下肿瘤接种。接种后,待肿瘤平均体积54mm3时,根据肿瘤大小随机分为2组(设溶媒对照组及sg1116组),每组6只,腹腔注射给药,每次给药剂量5mg/kg,每周给药一次,共给药四周。末次给药后一周结束实验,单只小鼠肿瘤体积超过3000mm3时进行安乐处理。给药期间观察小鼠肿瘤生长情况,根据相对肿瘤抑制率(tgi)进行疗效评价,根据动物体重变化和死亡情况进行安全性评价。tgi(%)相对肿瘤抑制率,计算公式如下:tgi%=(1-t/c)
×
100%。(t和c分别为治疗组和对照组在某一特定时间点的相对肿瘤体积(rtv)或瘤重(tw))。
[0243]
结果如图6a-6b所示。测试药物sg1116组(5mg/kg)在分组后第十七天(给药三次)表现出明显的抑瘤作用,相对肿瘤抑制率tgi(%)为81.35%,相对溶媒对照组统计学上有显著性差异(p值<0.01)。
[0244]
溶媒对照组小鼠在分组后第二十八天有4只小鼠因肿瘤体积超过3000mm3而安乐,对存活小鼠进行统计学分析:sg1116组(5mg/kg)表现出明显的抑瘤作用,相对肿瘤抑制率tgi(%)为67.31%,相对溶媒对照组统计学上有显著性差异(p值<0.05)。
[0245]
治疗期间均无动物死亡,没有表现明显的药物毒性,耐受良好。
[0246]
实施例10抗体偶联小分子药物抑制肿瘤细胞的增殖
[0247]
以smcc作为本申请所述免疫缀合物中的所述连接分子;并且以dm1作为本申请所述免疫缀合物中的所述其他试剂,构建免疫缀合物sg1116-dm1,以人骨髓瘤u266细胞为代表细胞模型,评价免疫缀合物生物学活性,从而进一步分析sg1116抗体构建抗体小分子偶联药物(adc)等免疫缀合物的潜力。
[0248]
在96孔培养板中接种一定数量的对数生长期细胞(人骨髓瘤u266细胞),贴壁生长24小时后,加入不同浓度的药物作用72小时。药物作用结束后,将cck-8(dojindo,日本同仁化学研究所)以每孔10μl加至培养板,37℃、5%二氧化碳培养箱中培养3~5小时。酶标仪450nm波长下测定od值,以下列公式计算细胞生长抑制率:
[0249]
抑制率=(od值对照孔-od值给药孔)/od值对照孔
×
100%
[0250]
根据各浓度抑制率,计算半数抑制浓度ic
50
。
[0251]
结果如图7所示。结果显示,sg1116抗体偶联美登素衍生物dm1(sg1116dm1)后对bcma阳性的骨髓瘤细胞u266显示出显著的增殖抑制作用,ic
50
为0.3473nm,t-dm1(kadcyla
tm
)的ic
50
为3.951nm。
[0252]
实施例11抗体偶联美登素衍生物dm1体内抑制肿瘤活性
[0253]
以nci-h929细胞为代表细胞,建立荷瘤动物模型,评价sg1116-dm1的体内抑制肿瘤活性。
[0254]
选择雌性、6-7周龄nod/scid小鼠(上海灵畅生物科技有限公司),nci-h929细胞培养在含10%胎牛血清的rpmi1640+0.05mmβ-me的培养液中。收集指数生长期的nci-h929细
胞,pbs重悬至适合浓度并与matrigel 1:1混合后用于小鼠右侧背部皮下肿瘤接种。接种后,待肿瘤平均体积54mm3时,根据肿瘤大小随机分为3组(设溶媒对照组及sg1116-dm1高剂量组、sg1116-dm1低剂量组),每组6只,腹腔注射给药,高剂量组每次给药剂量5mg/kg,低剂量组每次给药剂量2mg/kg,每两周给药一次,共给药两次。末次给药后两周结束实验,单只小鼠肿瘤体积超过3000mm3时进行安乐处理。给药期间观察小鼠肿瘤生长情况,根据相对肿瘤抑制率(tgi)进行疗效评价,根据动物体重变化和死亡情况进行安全性评价。tgi(%)相对肿瘤抑制率,计算公式如下:tgi%=(1-t/c)
×
100%。(t和c分别为治疗组和对照组在某一特定时间点的相对肿瘤体积(rtv)或瘤重(tw))。
[0255]
结果如图8a-8b所示。sg1116-dm1高低剂量治疗组(5mg/kg,2mg/kg)在分组后第十七天均表现出明显的抑瘤作用,相对肿瘤抑制率tgi(%)分别为70.13%和34.06%,其中高剂量组(5mg/kg)相对溶媒对照组统计学上有显著性差异(p值<0.05),低剂量组(2mg/kg)相对溶媒对照组统计学上没有显著性差异。
[0256]
分组后第二十八天(溶媒对照组、sg1116-dm1高剂量组、sg1116-dm1低剂量组分别有4只、1只、2只小鼠因肿瘤体积超过3000mm3而安乐,对存活小鼠进行统计学分析):sg1116-dm1高剂量组(5mg/kg)平均肿瘤体积为857.74mm3,相对肿瘤抑制率tgi(%)为73.78%,相较对照组统计学上有显著性差异(p<0.01)。sg1116
--
dm1低剂量组(2mg/kg)平均肿瘤体积为1727.89mm3,相对肿瘤抑制率tgi(%)为47.18%,相较对照组统计学上没有显著性差异。
[0257]
sg1116-dm1治疗组抑瘤作用显著且具有剂量依赖性。
[0258]
治疗期间均无动物死亡,没有表现明显的药物毒性,耐受良好。
[0259]
前述详细说明是以解释和举例的方式提供的,并非要限制所附权利要求的范围。目前本文所列举的实施方式的多种变化对本领域普通技术人员来说是显而易见的,且保留在所附的权利要求和其等同方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1