一种细胞表面展示果胶酶的酿酒酵母工程菌、用途和催化剂的制作方法
本发明涉及基因工程技术领域,更具体地,涉及一种一种细胞表面展示果胶酶的酿酒酵母工程菌、用途和催化剂。
背景技术:
果胶主要是由d-半乳糖醛酸残基以α-1,4糖苷键连接而形成的复合多聚糖,广泛存在于植物细胞壁中,是仅次于纤维素但又未获得充分利用的可再生资源。果胶酶是能够降解果胶的一类酶的总称(主要包括果胶水解酶、果胶裂解酶、果胶酯酶),是目前世界四大酶制剂之一,被广泛应用于食品、饲料、医药等工业领域。随着我国消费需求多样性的快速增长,对果胶酶的需求越来越大,但目前使用的果胶酶大部分都是从国外进口的高价酶。主要原因是国内菌种产酶能力和活力比较低,而且纯度不高,大多为粗酶制剂,不适合食品、医药工业的应用,而且酶的制作和储藏技术也不完善。虽然目前国内也在致力于果胶酶工程菌株的构建和改造,但大多数工程菌株为细胞内或分泌游离酶,其产酶效率低,分离纯化比较困难,因而造成产酶成本增加,不利于大规模生产和应用。
酶的固定化一般都是通过物理或化学的方法将游离酶固定于特殊的载上,不仅增强酶的稳定性,同时又能使酶与作用底物分离,达到重复利用,降低成本的目的。但是,传统的物理或化学固定化方法,增加的酶固定化操作会导致酶活性和回收率的损失;另外,固定化需用特殊的载体材料,且对固定化技术要求比较高,因而增加了载体制作和固定化操作的成本费用,被固定的酶需要分离纯化同样增加了生产成本。而近些年发展起来的微生物细胞表面展示技术为酶的固定化提供了一种全新的基于基因重组技术的生物学方法。酿酒酵母一直被认为是安全的模式生物(gras)而广泛应用于食品和医药工业,也是目前常见的用于酵母表面展示的宿主细胞。利用细胞表面展示技术将具有高催化活性的酶展示表达于酿酒酵母细胞表面就形成了全细胞催化剂,与传统的细胞内酶和外分泌酶不同,表面展示的酶是以共价或非共价的方式固定于细胞外表面,这种独特的空间定位使其相对游离酶而言有许多优良的特性,如温度、有机溶剂稳定性、可多次重复利用等,这些特点与传统的固定化酶技术类似,但无需额外制备载体及固定化、酶蛋白分离纯化等复杂操作,有着巨大的应用前景。然而,异源蛋白过量表达却会导致生长胁迫压力引起未折叠蛋白效应(upr),导致果胶酶的产量不能进一步提高,一定程度上限制了果胶酶的工业化生产。
技术实现要素:
针对现有技术存在的果胶酶生产过程中产酶效率低等技术问题,本发明提出了一种细胞表面展示果胶酶的酿酒酵母工程菌、用途和催化剂,使果胶酶在生产的同时实现固定化,果胶酶的空间结构未受其他物理或化学因素破坏,制得的固定化酶活力和产量均显著提高。
为实现上述目的,本发明是通过以下技术方案实现的:
本发明的第一个目的是提供一种细胞表面展示果胶酶的酿酒酵母工程菌,其构建过程包括以下步骤:
(1)获得成熟的果胶酶基因;
(2)连接成熟的果胶酶基因与酿酒酵母表面展示表达载体,得到重组载体;
(3)将步骤(2)得到的重组载体转化入宿主菌株酿酒酵母eby100中,得到细胞表面展示果胶酶的酿酒酵母工程菌。
进一步地,所述成熟的果胶酶基因选自黑曲霉sc323果胶酶基因pgaa。
更进一步地,所述成熟的果胶酶基因的cdna序列如seqidno:6所示。通过优选特定的果胶酶基因并将该基因表面展示在酿酒酵母细胞表面,可以使该果胶酶分泌性能极大提高,酶学性质明显提升。
进一步地,所述重组载体构建具体包括如下步骤:
(1)去掉成熟pgaa基因的信号肽序列和taa终止子,将回收后的基因同pyd1载体质粒一起进行bamhi/ecori双酶切,然后用t4dnaligase连接酶切后的pgaa基因和质粒pyd1;
(2)连接产物转化e.colidh5α大肠杆菌,对转化子进行质粒提取获得阳性克隆子pyd1-pgaa质粒。
本发明的第二个目的是提出上述任一项所述的的细胞表面展示果胶酶的酿酒酵母工程菌在全细胞催化制备果胶酶的用途。
本发明的第三个目的是提出一种细胞表面展示果胶酶的酿酒酵母全细胞催化剂,使用的酿酒酵母工程菌为上述任一项所述的细胞表面展示果胶酶的酿酒酵母工程菌。
进一步地,全细胞催化剂制备过程包括以下步骤:
(1)先将权利要求1-4中任意一项所述的工程菌接种至ypd液体培养基中培养,再以1%的接种量转接到新鲜mdl培养基中培养,然后离心得到菌体,菌体转入mdl培养基中培养,用半乳糖诱导产酶;
(2)收集发酵液,离心,取菌体沉淀,用双蒸水洗涤,加保护剂,通过真空冷冻干燥得到全细胞催化剂干粉。
与现有技术相比,本发明具有以下有益的技术效果:
本发明通过基因重组的方法构建了一株细胞表面展示果胶酶的酿酒酵母工程菌,该重组酿酒酵母将特定的果胶酶基因片段转化至酿酒酵母eby100中进行诱导表达,宿主菌株就能合成表面展示果胶酶的菌液,一步实现果胶酶的固定化生产。该方法具有以下优势:
(1)通过优选特定的果胶酶基因并将该基因表面展示在酿酒酵母细胞表面,可以使该果胶酶分泌性能极大提高,酶学性质明显提升。
(2)果胶酶在生产的同时实现固定化,遗传操作方便,能对表达的外源蛋白进行折叠、糖基化等翻译后修饰,避免了物理或化学载体对酶量和酶活性的损耗。
(3)在廉价的培养基中培养达到很高的细胞密度,避免了制备载体和果胶酶的分离纯化及固定化操作。
(4)酿酒酵母表面展示的果胶酶连接在载体外部,更能充分有效地与底物接触,最大限度地催化底物。
(5)本申请为果胶酶的固定化提供了一种全新的基于基因重组技术的生物学方法,有别于传统的物理或化学固定化方法。同时展示果胶酶的酿酒酵母可以通过大规模发酵获得,大大提高了果胶酶商业应用的可能性。
附图说明
图1为实施例1中表示黑曲霉sc323基因组dna的琼脂糖凝胶电泳照片,其中m表示15000bpdnamarker,1、2均表示黑曲霉sc323总dna。
图2为实施例1中表示pcr扩增产物及酶切验证的琼脂糖凝胶电泳照片,其中m表示2000bpdnamarker,1表示果胶酶基因pgaa的前200bpdna片段,2表示后800bp片段,3表示重叠pcr后成熟pgaa的cdna序列,4表示连接有果胶酶基因(pgaa)的质粒pmd19-t-pgaa,5表示bamhi和hindⅲ酶切pmd19-t-pgaa后的dna片段。
图3为实施例2中酿酒酵母a-凝集素表面展示系统模型。
图4为实施例2中果胶酶pgaa基因展示表达载体的构建流程图。
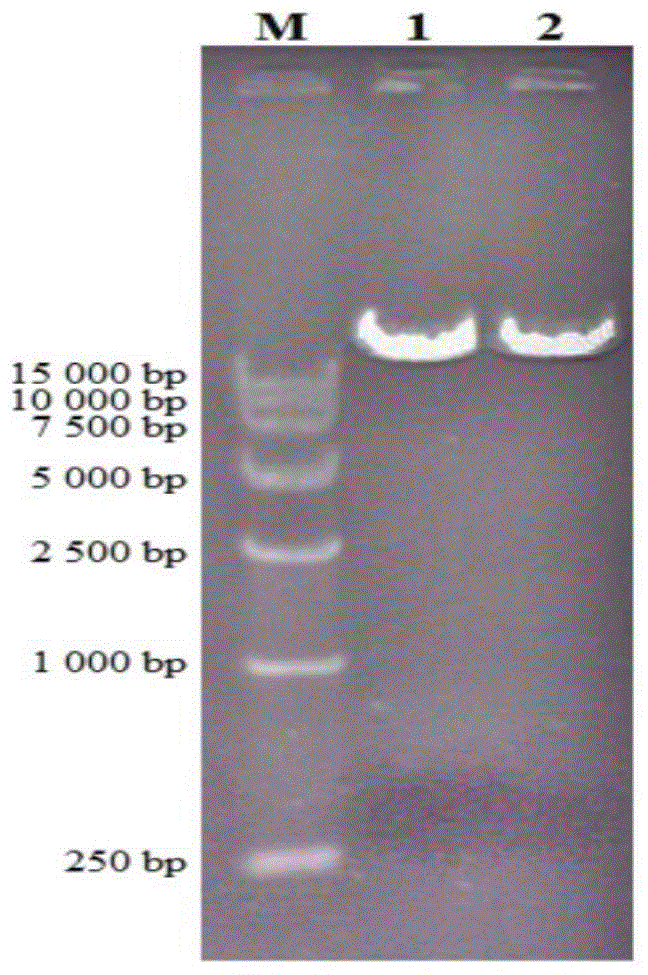
图5为实施例2中果胶酶pgaa基因展示表达载体构建后阳性克隆子的的琼脂糖凝胶电泳照片,其中m表示5000bpdnamarker,1表示pyd1-pgaa质粒,2表示pyd1-pgaa质粒双酶切。
图6为实施例3中携带pgaa基因的酵母菌液pcr的琼脂糖凝胶电泳照片,m表示2000bpdnamarker,1-3均表示携带pgaa基因的酵母菌液pcr。
图7为实施例4中表示重组酿酒酵母pgaa基因表达蛋白的细胞定位结果的免疫荧光检测图,其中图7a为白光下的酿酒酵母eby100,图7b为fitc绿色荧光下的酿酒酵母eby100,图7c为白光下的含有pyd-1-pgaa的eby100酵母细胞,图7d为fitc绿色荧光下的含有pyd-1-pgaa的eby100酵母细胞。
图8为实施例4中d-半乳糖醛酸含量标准曲线。
图9为不同温度对游离酶和全细胞展示pgaa酶活性的影响结果示意图。
图10为不同ph对游离酶和全细胞展示pgaa酶活性的影响结果示意图。
具体实施方式
展示一下实例来具体说明本发明的某些实施例,且不应解释为限制本发明的范围。对本发明公开的内容可以同时从材料、方法和反应条件进行改进,所有这些改进,均应落入本发明的的精神和范围之内。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版,j.萨姆布鲁克著)一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行;所述试剂和生物材料,如无特殊说明,均可从商业途径获得。
实验材料和试剂:
1、菌株与载体:酿酒酵母eby100、表面展示表达载体pyd1、e.colidh5α大肠杆菌购自invitrogen公司;黑曲霉sc323购自四川省微生物菌种保藏中心。
2、果胶及其他生化试剂:橘类果胶、多聚半乳糖醛酸、半乳糖醛酸购自sigma公司,其他都为国产试剂。
3、pcr纯化回收试剂盒:购自北京biomed生物技术有限公司。
4、培养基
(1)黑曲霉产果胶酶培养基(g/l):果胶2g,nano33g,k2hpo41g,mgso4·7h2o0.5g,kcl0.5g,feso40.01g,琼脂20g,ph自然。
(2)大肠杆菌培养基lb:1%蛋白胨、0.5%酵母提取物、1%nacl,ph7.0
(3)ypd酵母培养基:1%酵母提取物,2%蛋白胨,2%葡萄糖,平板加入2%琼脂
(4)mdl筛选培养基:0.67%ynb,2%葡萄糖,0.01%亮氨酸,平板加入2%琼脂。
实施例1:黑曲霉sc323果胶酶编码基因pgaa的克隆
1、提取黑曲霉sc323果胶酶编码基因pgaa
(1)将28℃液体培养4天的菌丝体无菌过滤收集于研钵中,加入液氮迅速研磨2min,然后将加入500μl37℃孵育的te溶液混匀;
(2)加入30μl10%sds,3μl20mg/ml蛋白酶k混匀,37℃孵育1h;
(3)加入100μl5mol/lnacl混匀,再加入80μlctab/nacl溶液,65℃孵育20min;
(4)加入等体积酚:氯仿:异戊醇(25:24:1,v/v/v)混匀,5000rpm离心10min,取上清液;
(5)加入0.6倍体积的异丙醇,轻轻颠倒混合,室温下静10min,沉淀dna;
(6)丢弃上清液,用1ml70%(v/v)乙醇漂洗沉淀两次,离心弃上清,干燥15min;
(7)将沉淀重溶于30μlddh2o中,并加入3μl10mg/mlrnase酶置于37℃水浴30min,置于-20℃备用。
2、根据黑曲霉果胶酶基因pgaa的保守序列设计pcr扩增引物(见表1),pgaa-f1、pgaa-r1、pgaa-f2、pgaa-r2序列依次如seqidno:1-4所示。
表1果胶酶基因的引物序列
3、黑曲霉sc323果胶酶编码基因pgaa的克隆
(1)首先以提取的黑曲霉sc323果胶酶编码基因组为模板,以pgaa-f1/pgaa-r2为引物扩增果胶酶基因pgaa的全长。pcr反应的体系为(见表2):
表2pcr反应的体系
pcr反应条件:95℃3min,(98℃10sec,55℃15sec,72℃30sec)×30个循环,72℃2min。
(2)0.8%琼脂糖凝胶电泳检测pcr产物,并用pcr产物纯化回收试剂盒回收,送invitrogen公司测序,结果显示果胶酶基因pgaa全长1167bp,其基因序列如seqidno:5所示。经过ncbi中黑曲霉果胶酶基因pgaa的比对,发现其全长中含有一个51bp的内含子,将全长分为前230bp和后886bp的两个片段。因此分别设计重叠pcr引物pgaa-f1/pgaa-r1和pgaa-f2/pgaa-r2扩增内含子前200bp和后800bp左右的基因片段。pcr反应体系和反应条件如上所述。2%琼脂糖凝胶电泳检测pcr产物,并回收这两个片段。利用重叠pcr将上述两个片段进行pcr连接。重叠pcr反应体系为(见表3):
表3重叠pcr反应的体系
pcr反应条件:95℃3min,(98℃10sec,55℃15sec,72℃30sec)×30个循环,72℃2min。
0.8%琼脂糖凝胶电泳检测pcr产物,并用pcr产物纯化回收试剂盒回收,获得成熟的果胶酶基因(pgaa),-20℃保藏备用。成熟的果胶酶基因(pgaa)的cdna序列如seqidno:6所示,其编码的氨基酸序列如seqidno:7所示。
果胶酶的pgaa基因序列和cdna序列分析结果表明,其全长1167bp,含有1个51bp的内含子,cdna全长1113bp,编码370个氨基酸,理论分子量为38.8kda,等电点为3.96,n端19个氨基酸为其预测的信号肽序列。所测出基因pgaa的成熟蛋白部分核甘酸序列与genebank上的果胶酶基因序列进行同源比较,同aspergillusnigerjl-15来源的果胶酶基因的一致性最高为99%。
实施例2:果胶酶pgaa基因的展示表达载体的构建
本实施例采用酿酒酵母a-凝集素表面展示系统,其是应用最早也是最多的酵母凝集素表面展示系统,由aga1p和aga2p两个核心亚基糖蛋白组成(参考文献yangn,yuz,jiad,xiez,zhangk,xiaz,leil,qiaom.applmicrobiolbiotechnol.2014,98(7):2897-2905)。aga1p亚基是由aga1基因编码的725个氨基酸残基组成,相对分子量大小为75kda,aga1p亚基通过其gpi锚定区域与β-葡聚糖的共价连接进而锚定在酵母的细胞壁上。aga2p亚基是由aga2基因编码的69个氨基酸残基组成,相对分子量大小为18kda,aga2p的c端与外源目的蛋白融合,通过2个二硫键与aga1p亚基相连接,进而展示在细胞壁表面,如图3所示。
本申请中果胶酶pgaa基因展示表达载体的构建如图4所示。首先,利用pcr的方法,以pgaa的cdna为模板,以pgaaf3/pgaar3进行pcr扩增(见表4),引物序列如seqidno:8-9所示。去掉pgaa基因的信号肽序列和taa终止子。pcr产物经凝胶回收后,同pyd1载体质粒一起进行bamhi/ecori双酶切。酶切产物胶回收,用t4dnaligase连接酶连接,并转化e.colidh5α大肠杆菌,对转化子进行质粒提取,双酶切验证阳性克隆子(图5所示),图5中m表示5000bpdnamarker,1表示pyd1-pgaa质粒,2表示pyd1-pgaa质粒双酶切。
表4pgaa基因去信号肽及终止密码子引物序列
实施例3:转化酿酒酵母及重组子筛选
酿酒酵母eby100菌株为亮氨酸(leu)和色氨酸双缺陷型,不能在不含亮氨酸(leu—)和色氨酸(trp—)的培养基中生长,而表达质粒pyd1-pgaa或空载体pyd1带有色氨酸合成基因,因此质粒转化成功的细胞可以在不含色氨酸的mdl培养基(leu+,trp—)中生长,从而筛选出重组子。从e.colidh5α大肠杆菌大量提取构建完成并验证的重组质粒,酿酒酵母eby100细胞的转化方法及过程按invitrogen公司说明书方法(pyd1yeastdisplayvectorkit)进行,并将转化后的酿酒酵母eby100细胞,涂布到mdl筛选培养平板上,长出的单菌落进行菌液pcr验证(图6)。结果如图6所示,菌液pcr扩增出的目的片段大小相符,说明pyd1-pgaa质粒转化成功。
实施例4:重组酿酒酵母pgaa基因表达蛋白的细胞定位
用半乳糖诱导表达菌液pcr成功的酵母eby100细胞,收集表达后的细胞。由于pyd1载体带有6×his标签,按照说明书的方法进行操作,加入一抗(抗6×his标签的小鼠单克隆抗体)和二抗(山羊抗小鼠igg-fitc)后进行免疫荧光检测。结果显示(图7),未转化质粒的eby100细胞没有检测到黄绿色荧光,而带有pyd1-pgaa质粒的酵母菌细胞壁上检测到了明显的黄绿色荧光。结果表明pgaa基因成功展示到了酿酒酵母的细胞壁上。
实施例5:细胞表面展示果胶酶的酿酒酵母全细胞催化剂制备
1、将培养于ypd琼脂固体平板上的酿酒酵母重组菌株接种至ypd液体培养基中,30℃、250r/min培养24h,再以1%的接种量转接到新鲜mdl培养基中30℃、250r/min培养24h,然后在4℃、8000r/min离心10min得到菌体,菌体转入mdl培养基中30℃、250r/min培养5d,每隔24h用半乳糖诱导产酶。
2、收集发酵液,离心,取菌体沉淀,用双蒸水洗涤,加保护剂,通过真空冷冻干燥得到全细胞催化剂干粉。
实施例6:重组pgaa果胶酶酿酒酵母的酶学性质
1、绘制标准曲线
取8支试管,按表5数据分别加入1.0mg/mld-半乳糖醛酸标准溶液和缓冲液,再分别加入dns试剂2.0ml,摇匀并于沸水中加热5min进行显色反应,取出用流水冷却后加入蒸馏水至15ml,摇匀,在540nm波长处测定光吸收。以光吸收值(od540nm)为横坐标,d-半乳糖醛酸浓度(mg/ml)为纵坐标绘制标准曲线。
表5d-半乳糖醛酸标准曲线绘制
2、重组pgaa果胶酶的酶活测定
取1.0%(w/v)的果胶溶液1.5ml于试管中,并于50℃水浴平衡5min然后加入0.5ml上清粗酶液,50℃保温30min,再加入2mldns试剂终止反应,沸水浴5min之后迅速冷却,用蒸馏水定容至15ml,以灭活的发酵液作为空白对照,在540nm处测定吸光值,根据标准曲线计算半乳糖醛酸量。本文中酶活的定义为:在测定条件下,每分钟水解果胶产生1μmol半乳糖醛酸所需酶量定义为1个酶活力单位,以u/ml表示。
3、重组pgaa果胶酶的酶学性质
(1)温度对酶活力的影响
取分离纯化后的重组果胶酶酶液,用ph4.5的缓冲液(柠檬酸-磷酸缓冲液,ph4.5)适当稀释,分别在30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃的温度下测定酶活力,观察不同温度对酶促反应的影响;将酶液置于上述温度下保温,每30min取样测定酶活力。
酶学性质结果显示,全细胞展示pgaa酶的最适温度和分泌的游离酶是一致的,为50℃,但最适温度的范围提高了一些,在30-60℃之间酶活的波动性不大,其相对酶活高于80%,大于65℃后酶活迅速下降(见图9)。这种现象与其他aga1-aga2表面展示系统有类似的性质,其可以扩展展示酶的温度作用范围。其原因有可能是由于温度过高导致酵母细胞表面与展示酶相邻的其他的蛋白或糖类结构发生变化,从而影响展示酶的活性,也有可能是温度高时酵母细胞进行自我调节影响了展示酶的活性,具体原因有待进一步的研究。
(2)ph对酶活力的影响
分别配制ph2.0-ph9.0的柠檬酸-磷酸酸钠缓冲液,40℃条件下与相应纯化后的酶液混合反应测定其酶活,观察最适ph;同时将酶液加入上述不同ph缓冲液中40℃条件下,定时测定其酶活力,观察其在不同ph条件下的稳定性。
酶学性质结果显示,全细胞展示pgaa酶的最适ph略大于分泌游离酶,大约在ph5.5左右,且其ph的作用范围向碱性条件偏移,ph3.0-7.0时其酶活还在70%以上(见图10)。
(3)取分离纯化后的重组果胶酶酶液,用ph4.5的缓冲液(柠檬酸-磷酸缓冲液,ph4.5)适当稀释,40℃条件下与相应纯化后的酶液混合反应测定其酶活,结果显示,酿酒酵母展示的果胶酶的比酶活为87.3u/g
对比例1:
合成专利文献cn201010618557.3中记载酸性果胶酶endo-pgi的基因。并按本发明的方法将该果胶酶endo-pgi基因展示到酿酒酵母eby100表面,将果胶酶endo-pgi基因整合到酿酒酵母基因组中。结果显示,酿酒酵母展示的果胶酶的比酶活为56.2u/g。
对比例2:
合成专利文献cn201610323889.6中记载酸性酸性果胶酶pagl8的基因。并按本发明的方法将该酸性果胶酶pagl8基因展示到酿酒酵母eby100表面,将酸性果胶酶pagl8基因整合到酿酒酵母基因组中。结果显示,酿酒酵母展示的果胶酶的比酶活为63.4u/g。
结果分析
通过对比实施例与对比例1~2的实验数据可以看出,通过优选特定的果胶酶基因并将该基因表面展示在酿酒酵母细胞表面,可以使该酶分泌性能极大提高酶学性质明显提升,相比较利用本申请以外的果胶酶基因进行细胞表面展示组合来说,采用本发明的方法展示果胶酶显得更加有优势。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!