一种(R)-3-氨基丁醇的合成方法与流程
本发明属于医药化工领域,具体涉及一种手性药物中间体(r)-3-氨基丁醇的制备方法。
背景技术:
(r)-3-氨基丁醇,(r)-3-amino-1-butanol,cas:61477-40-5,无色或淡黄色液体,易溶于四氢呋喃、乙醇、水等溶剂,是很多手性药物的关键中间体。如j.org.chem.,1977,42:1650,报道它是抗肿瘤药物4-甲基环磷酰胺的关键中间体;tetrahed.lett.,1988,29:231,报道它是合成青霉烯类抗生素的重要中间体;drugs.ofthefuture2012,37:697,报道它是合成抗艾滋病药物杜鲁特韦手性六元环的关键中间体。
(r)-3-氨基丁醇结构式如下式(a)所示:
(r)-3-氨基丁醇的合成专利报道较多,如j.org.chem.1977,42:1650-1652报道的通过诱导手性苯乙胺和巴豆酸乙酯的加成来合成手性化合物,随后利用氢化铝锂还原得到保护的氨基醇,再经过钯碳氢化得到目标产物。虽然操作步骤较短,但该方法不适合放大生产,反应路线如scheme1所示。
tetrahed.lett.,1992,33(20):2895-2898报道利用(r)-n-苄基-2-苯甘氨醇和乙醛反应,再经开环、钯炭氢化、四氢铝锂还原合成目标物。此路线产物ee值仅为60%,远低于质量标准;反应路线如scheme2所示。
us2003/73723中报道以巴豆酸叔丁酯及(r)-n-苄基-1-苯乙胺反应,在-78℃以强碱拔氢,再经四氢铝锂还原和催化剂氢化得到目标产物。该路线存在较大的安全风险,且产物收率低,纯化难度大,不适合放大生产,反应路线如scheme3所示。
tetrahedron,2005,61(38):9031-9041中报道以d-丙氨酸为原料,经邻苯二甲酸酐保护后,加入重氮甲烷,再通过重排反应、水解反应得到目标产物。此路线步骤较长,原料昂贵,另水解产物内酯难以处理,不适合放大生产,反应路线如scheme4所示。
us2011/0275855中报道利用(s)-扁桃酸拆分消旋3-氨基丁醇,形成(r)-3-氨基丁醇扁桃酸盐,溶于吗啡啉中再进行蒸馏得最终产品,但蒸馏产物中始终含有溶剂无法得到纯化,产品纯度受到限制,反应路线如scheme5所示。
heterocycliclett.,2015,5(2):241-244中报道以(d)-酒石酸拆分消旋3-氨基丁醇,形成(r)-3-氨基丁醇酒石酸盐,再经碱游离,乙腈萃取得到产物。但(r)-3-氨基丁醇水溶性较大,此方法后处理损失较大,无法进行放大生产,反应路线如scheme6所示。
技术实现要素:
本发明提供了一种(r)-3-氨基丁醇的制备方法,采用的原料廉价易得,工艺路线简单,操作简单快捷,相较于现有的化学拆分和手性引入,大幅提高了收率,降低了成本,三废较少,而且易于实现规模化生产,是一种安全风险小,具有较高优势的合成方法。
本发明提供了一种(r)-3-氨基丁醇的制备方法,包括如下步骤:
1)以(r)-3-氨基丁酸为原料,在醇溶剂中,在酸性条件下,得到(r)-3-氨基丁酸酯,见式1
2)以(r)-3-氨基丁酸酯为原料,在碱性条件下,滴加氨基保护基得到氨基保护的(r)-3-氨基丁酸酯,见式2。
3)以氨基保护的(r)-3-氨基丁酸酯为原料,在醇溶剂中,在路易斯酸存在下,与硼氢化物进行还原反应,得到氨基保护的(r)-3-氨基丁醇,见式3。
4)以氨基保护的(r)-3-氨基丁醇为原料,直接脱氨基保护基,得到(r)-3-氨基丁醇,见式4。
优选的,步骤1)所述的醇类溶剂,所述醇溶剂为c1-c7的直链或支链醇中的一种或两种以上的混合物,优选为甲醇、乙醇或异丙醇;
优选的,步骤1)所述的酸性条件为氯化亚砜、草酰氯或硫酸体系;
优选的,步骤2)所述的碱性条件为碳酸钠、三乙胺或氢氧化钠;
优选的,步骤2)所述的氨基保护基为乙酰氯、氯甲酸苄酯或苯甲酰氯;
优选的,步骤3)所述的醇类溶剂为甲醇、乙醇或异丙醇;
优选的,步骤3)所述的路易斯酸,为此类反应中各种常规的路易斯酸,优选氯化镁、氯化锂或氯化钙。
优选的,步骤3)所述的硼氢化物,为此类反应中各种常规的硼氢化物,优选硼氢化钾、硼氢化钠或硼氢化锂。
优选的,步骤4)所述脱氨基保护是指在强碱条件下直接水解或加氢还原方法脱除氨基保护基。
本发明首次采用(r)-3-氨基丁酸为原料,依次经过酯化、氨基保护,还原,脱氨基保护基得到高光学纯度(r)-3-氨基丁醇;与现有技术相比,具有如下优点:
1)本发明原料易得,价格便宜、成本低;
2)本发明各步骤反应条件温和,相较于现有的化学拆分和手性引入,大幅提高了收率,降低了生产成本;
3)本发明整体收率高,且制备过程中无消旋化产生,产物(r)-3-氨基丁醇的化学纯度和光学纯度高达99%以上。
附图说明
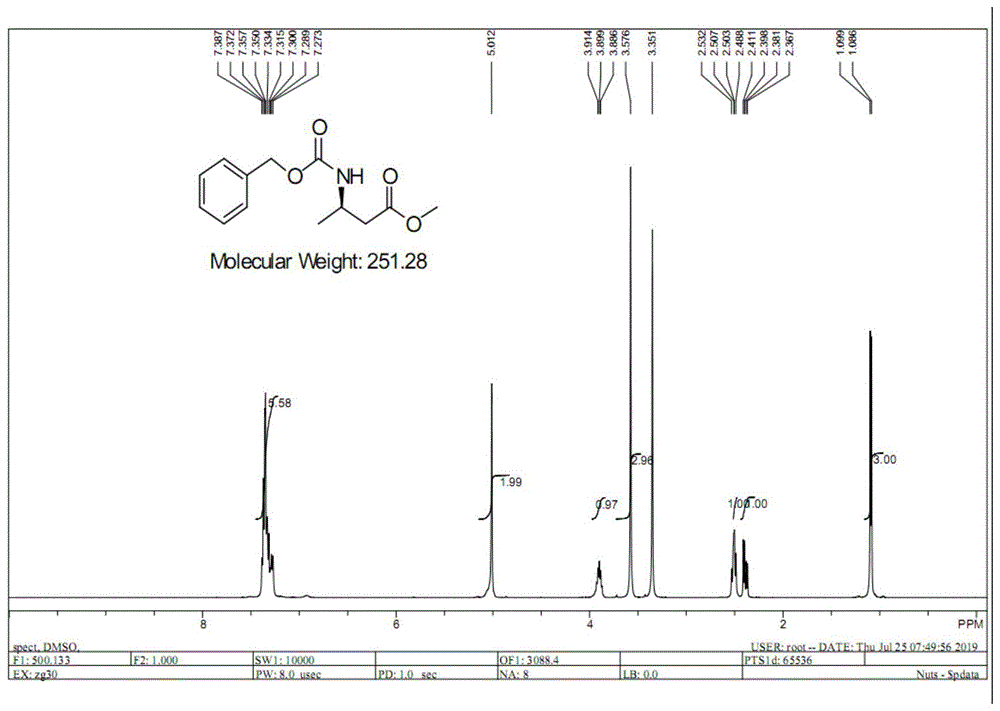
图1为(r)-3-苄氧基酰胺基丁酸甲酯的h-nmr谱图。
图2为(r)-3-苄氧基酰胺基丁醇的h-nmr谱图。
图3为本发明方法制备的(r)-3-氨基丁醇的化学纯gc检测典型谱图。
图4为本发明方法制备的(r)-3-氨基丁醇的手性纯hplc检测典型谱图。
具体实施方式
实施例1:(r)-3-氨基丁酸甲酯的合成
洁净反应瓶中投入240g甲醇,50g(r)-3-氨基丁酸,用冰水冷却,温度下降至0~10℃,缓慢滴加66.4g氯化亚砜。滴加完毕,升温至回流反应,至原料消失。反应液直接减压浓缩,浓缩得产品。收率:98.5%,纯度:99.7%,ee:99.9%。
实施例2:(r)-3-苄氧基酰胺基丁酸甲酯的合成
洁净四口瓶中投入50g(r)-3-氨基丁酸甲酯盐酸盐,400g水,缓慢投入41.4g碳酸钠。投料毕,搅拌溶清,温度下降至0~10℃,缓慢滴加55.5g氯甲酸苄酯,控温0~10℃。滴加毕,升温至20~30℃,保温搅拌3~4h,至原料消失。反应液加入200ml*2次二氯甲烷提取,分层,合并有机层,硫酸钠干燥,减压浓缩得产品。收率:95.3%,纯度99.4%,ee:99.9%。
hnmr(400mhz,dmso-d6):δ1.086~1.099(d,3h),δ2.367~2.411(m,1h),δ2.488~2.532(m,1h),δ3.576(s,3h),δ3.886~3.914(m,1h),δ5.012(s,2h),δ7.273~7.387(m,5h).;核磁谱图如图1所示。
实施例3:(r)-3-苄氧基酰胺基丁醇的合成
洁净四口瓶中投入50g(r)-3-苄氧基酰胺基丁酸甲酯,250ml乙醇,搅拌溶清。温度下降至0~10℃,先投入16.6g硼氢化钾,再投入45.7g氯化镁,保温搅拌5h,至原料检测反应完,滴加盐酸水溶液淬灭。过滤,滤液减压浓缩至无馏出液,结晶得白色晶体。收率:94.2%,纯度:99.2%,ee:99.9%。
hnmr(400mhz,dmso-d6):,1.048~1.061(d,3h),δ1.487~1.607(m,2h),δ3.383~3.418(m,2h),δ3.624~3.651(m,1h),δ4.379~4.398(t,1h),δ5.010(s,2h),δ7.099~7.388(m,5h);核磁谱图如图2所示。
实施例4:(r)-3-氨基丁醇的合成
洁净四口瓶中投入50g(r)-3-苄氧基酰胺基丁醇,加入200ml乙醇,2.5g10wt%pd/c,升温至50~60℃,氢气压力0.4~0.6mpa,反应至原料消失。过滤,滤液减压浓缩,得油状物,油状物为(r)-3-氨基丁醇。收率:96.0%,纯度99.7%,ee:99.9%。
实施例5:(r)-3-乙酰胺基丁酸甲酯的合成
洁净四口瓶中投入50g(r)-3-氨基丁酸甲酯盐酸盐,400g水,缓慢投入41.4g碳酸钠。投料毕,搅拌溶清,温度下降至0~10℃,缓慢滴加24.9g乙酰氯,控温0~10℃。滴加毕,升温至20~30℃,保温搅拌3~4h,至原料消失。反应液加入200ml*3次乙酸乙酯提取,分层,合并有机层,硫酸钠干燥,减压浓缩得产品。收率:92.6%,纯度99.5%,ee:99.9%。
实施例6:(r)-3-苯甲酰胺基丁酸甲酯的合成
洁净四口瓶中投入50g(r)-3-氨基丁酸甲酯盐酸盐,400g水,缓慢投入41.4g碳酸钠。投料毕,搅拌溶清,温度下降至0~10℃,缓慢滴加44.8g苯甲酰氯,控温0~10℃。滴加毕,升温至20~30℃,保温搅拌3~4h,至原料消失。反应液加入200ml*2次二氯甲烷提取,分层,合并有机层,硫酸钠干燥,减压浓缩得产品。收率:93.9%,纯度99.4%,ee:99.9%。
实施例7:(r)-3-乙酰胺基丁醇的合成
洁净四口瓶中投入50g(r)-3-乙酰胺基丁酸甲酯,250ml乙醇,搅拌溶清。温度下降至0~10℃,先投入25.5g硼氢化钠,再投入37.5g氯化钙,保温搅拌8~10h,至原料检测反应完,滴加盐酸水溶液淬灭。反应液浓缩,加入200ml*2次二氯甲烷提取,分层,合并有机层,硫酸钠干燥,减压浓缩得产品。收率:89.6%,纯度:98.6%,ee:99.9%。
实施例8:(r)-3-苯甲酰胺基丁醇的合成
洁净四口瓶中投入50g(r)-3-乙酰胺基丁酸甲酯,250ml乙醇,搅拌溶清。温度下降至0~10℃,先投入14.7g硼氢化锂,再投入3.51g氯化锂,升温至20~30℃,保温搅拌2~3h,至原料检测反应完,滴加盐酸水溶液淬灭。反应液浓缩,加入200ml*2次二氯甲烷提取,分层,合并有机层,硫酸钠干燥,减压浓缩得产品。收率:90.5%,纯度:98.6%,ee:99.9%。
实施例9:(r)-3-氨基丁醇的合成
洁净四口瓶中投入50g(r)-3-乙酰胺基丁醇,加入100ml乙醇,100ml液碱溶液,升温至70~80℃保温反应18~20h,反应至原料消失。反应液浓缩,加入200ml*2次二氯甲烷提取,分层,合并有机层,硫酸钠干燥,减压浓缩得油状物为(r)-3-氨基丁醇。收率:97.5%,纯度99.8%,ee:99.9%。
实施例10:(r)-3-氨基丁醇的合成
洁净四口瓶中投入50g(r)-3-苯甲酰胺基丁醇,加入100ml乙醇,100ml液碱溶液,升温至70~80℃保温反应10~12h,反应至原料消失。反应液降温至20~30℃,过滤,滤液减压浓缩,得油状物,油状物为(r)-3-氨基丁醇。收率:92.6%,纯度99.3%,ee:99.9%。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!