一种fkbS基因、含其的基因工程菌及其制备方法和用途与流程
一种fkbs基因、含其的基因工程菌及其制备方法和用途
技术领域
[0001]
本发明涉及基因工程领域,具体涉及一种fkbs基因、含其的基因工程菌及其制备方法和用途。
背景技术:
[0002]
巴豆酰-coa还原酶(crotonyl-coa carboxylase/reductase,ccr)在微生物的次生代谢过程中起到重要作用,它能够催化巴豆酰-coa合成乙基丙二酰辅酶a(乙基丙二酰-coa),而后者是形成子囊霉素(ascomycin,fk520)结构的关键前体。在子囊霉素的产生菌株(streptomyces hygroscopicus var.ascomyceticus atcc 14891)中,目前已报道的生物合成簇并不完整,尤其是编码巴豆酰-coa还原酶的基因fkbs只有460bp被报道。最近公开的专利(cn107629994a)通过向子囊霉素产生菌中整合外源编码巴豆酰-coa还原酶和3-氧酰基-酰基载体蛋白合酶iii的基因,将子囊霉素提高至550mg/l,fk523/fk520为10%(图1中r为ch2ch3时,所示结构图为子囊霉素fk520;r为ch2时,所示结构图为关键杂质fk523)。也有报道在子囊霉素产生菌中过表达天蓝色链霉菌来源的巴豆酰-coa还原酶基因,将子囊霉素提高至361.67mg/l(microbial cell factories,2017,16(1):169.)。但是这两例应用外源巴豆酰-coa还原酶基因过表达的方式对于子囊霉素产量提升和杂质下降的作用有限,远不能满足工业化生产的需求。目前对于子囊霉素的产生菌株吸水链霉菌(streptomyces hygroscopicus)中自身巴豆酰-coa还原酶基因fkbs的研究和应用未见报道。
技术实现要素:
[0003]
本发明所要解决的技术问题是为了克服现有技术中微生物发酵法生产的子囊霉素产量较低和杂质含量高的缺陷,提供了一种fkbs基因、含其的基因工程菌及其制备方法和用途。利用本发明所述基因工程菌,可有效提高子囊霉素的产量,并且同时降低了杂质含量;利用本发明所述基因工程菌生产子囊霉素,成本较低,适于工业化生产。
[0004]
现有技术中,过表达外源性巴豆酰-coa还原酶基因的结果均不理想,而想要过表达内源性巴豆酰-coa还原酶的基因时,现有技术中只公开了460bp的内源性巴豆酰-coa还原酶编码基因fkbs,在子囊霉素产生菌中无法转录和翻译,因而无法表达出巴豆酰-coa。现有技术中,想要获得基因fkbs的完整序列有许多种方法,本发明人通过大量实验利用不同链霉菌来源的巴豆酰-coa还原酶氨基酸序列的保守型设计出特定的简并引物,再配合其他改进后的pcr等方法后,终于从子囊霉素的产生菌株中成功克隆得到了内源性的巴豆酰-coa还原酶编码基因fkbs全长,并且将该全长基因在子囊霉素产生菌中过表达时取得了非常好的效果。
[0005]
为了解决上述技术问题,本发明的第一方面提供了一种fkbs基因,所述fkbs基因编码的氨基酸序列如seq id no.2所示。
[0006]
较佳地,所述fkbs基因的核苷酸序列如seq id no.1所示。
[0007]
为了解决上述技术问题,本发明的第二方面提供了一种包含如本发明的第一方面
所述的fkbs基因的重组表达载体。
[0008]
较佳地,所述重组表达载体的骨架为含有强启动子的质粒;更佳地,所述重组表达载体的骨架为含有红霉素抗性基因启动子、链霉菌启动子或硫链丝菌素诱导型启动子的质粒;进一步更佳地,所述重组表达载体的骨架为含有perm*、kasop*或tipap的质粒,优选质粒pset-152。
[0009]
为了解决上述技术问题,本发明的第三方面提供了一种转化体,在宿主中导入如本发明的第一方面所述的fkbs基因或者如本发明的第二方面所述的重组表达载体。
[0010]
较佳地,所述宿主为大肠杆菌;优选大肠杆菌et12567。
[0011]
为了解决上述技术问题,本发明的第四方面提供了一种fkbs蛋白,其氨基酸序列如seq id no.2所示。
[0012]
为了解决上述技术问题,本发明的第五方面提供了一种生产子囊霉素的基因工程菌,其为天然生产子囊霉素的吸水链霉菌(streptomyces hygroscopicus)中过表达如本发明第一方面所述的fkbs基因的工程菌。
[0013]
较佳地,所述基因工程菌为在所述天然生产子囊霉素的吸水链霉菌的基因组中整合了所述fkbs基因的工程菌;所述整合的位点优选为attb位点,更优选φc31 attb位点。
[0014]
较佳地,所述基因工程菌为包含含有所述fkbs基因的重组表达载体的工程菌。
[0015]
较佳地,所述天然生产子囊霉素的吸水链霉菌含有一个、两个或者三个拷贝的fkbs基因。
[0016]
较佳地,所述天然生产子囊霉素的吸水链霉菌为吸水链霉菌atcc14891。
[0017]
为了解决上述技术问题,本发明的第六方面提供了一种制备如本发明的第五方面所述的基因工程菌的方法,包括将如本发明的第三方面所述的转化体与天然生产子囊霉素的吸水链霉菌进行接合培养,挑选接合子即得。
[0018]
较佳地,所述天然生产子囊霉素的吸水链霉菌为吸水链霉菌atcc14891。
[0019]
较佳地,所述的接合培养为在ms培养基培养,培养温度为28℃。
[0020]
为了解决上述技术问题,本发明的第七方面提供了一种制备子囊霉素的方法,包括将如本发明的第五方面所述的基因工程菌发酵,从发酵液中获得子囊霉素。
[0021]
较佳地,所述发酵的发酵培养基包括以下组分:甘油6%、酵母提取物2%、黄豆饼粉2%、磷酸二氢钾0.02%、微量元素;所述百分比为各组分占所述发酵培养基的质量体积百分比(克/毫升);
[0022]
更佳地:
[0023]
所述发酵的发酵培养基还包括0.05-0.5%的巴豆酸,例如0.1%、0.15%或者0.2%的巴豆酸;
[0024]
和/或,所述微量元素包括以下组分:feso4·
7h2o 0.001%、znso4·
7h2o0.001%、cuso4·
5h2o,0.00001%,所述百分比为各组分占所述发酵培养基的质量体积百分比(克/毫升);
[0025]
和/或,所述发酵的发酵培养基的ph值为6.5
±
2;
[0026]
和/或,所述发酵的温度为25~30℃,优选28℃;
[0027]
和/或,所述发酵的培养时间为6~10天,优选8天;
[0028]
和/或,所述发酵的培养转速为180~250rpm,优选200rpm。
[0029]
较佳地,所述制备子囊霉素的方法还包括先将所述基因工程菌接种于种子培养基中进行种子培养,然后将所得培养物转接至发酵培养基;
[0030]
更佳地,所述种子培养基的培养温度为25~30℃,优选28℃;和/或,所述种子培养的时间为1~2天;和/或,所述种子培养的转速为180~250rpm,优选200rpm;和/或,所述转接的接种量为5~20%,优选10%。
[0031]
为了解决上述技术问题,本发明的第八方面提供了如本发明第五方面所述的基因工程菌在制备子囊霉素中的用途。
[0032]
为了解决上述技术问题,本发明的第九方面提供了如本发明第一方面所述的fkbs基因在调控子囊霉素的产量或者合成乙基丙二酰辅酶a中的应用。
[0033]
较佳地,所述调控子囊霉素的产量为提高子囊霉素的产量。
[0034]
此外,本发明还提供了一种简并引物对,所述简并引物对的核苷酸序列如seq id no.4(5
’-
rtgnnnganathhtnnnngcn-3’(r=a,g;h=a,t,c;n=a,t,c,g))和seq id no.5(5
’-
tcaccgcaccccctcgg-3’)所示。
[0035]
此外,本发明还提供了一种含有上述简并引物对的试剂盒。
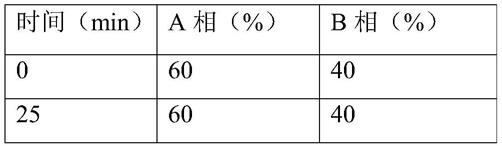
[0036]
此外,本发明还提供了一种发酵培养基,所述发酵培养基包括以下组分:甘油6%、酵母提取物2%、黄豆饼粉2%、磷酸二氢钾0.02%、微量元素和0.05-0.5%的巴豆酸;所述百分比为各组分占培养基的质量体积百分比(克/毫升)。
[0037]
较佳地,所述发酵培养基的ph值为6.5
±
2。
[0038]
较佳地,所述微量元素包括以下组分:feso4·
7h2o 0.001%、znso4·
7h2o0.001%、cuso4·
5h2o,0.00001%,所述百分比为各组分占所述发酵培养基的质量体积百分比(克/毫升)。
[0039]
较佳地,所述巴豆酸的含量为0.05-0.2%,例如为0.1%或者0.15%。
[0040]
较佳地,所述发酵的温度为25~30℃,优选28℃;和/或,所述发酵的培养时间为6~10天,优选8天;和/或,所述发酵的培养转速为180~250rpm,优选200rpm。
[0041]
此外,本发明还提供了上述发酵培养基在培养如本发明第一方面所述的基因工程菌中的用途。
[0042]
此外,本发明还提供了巴豆酸在提高子囊霉素产量中的应用。
[0043]
本发明中,所述巴豆酸为本领域常规的巴豆酸,一般是不饱和脂肪酸,分子中含有双键和羧基,有顺式和反式两种异构体,本发明中所提巴豆酸一般为反式巴豆酸。
[0044]
与本发明中的fkbs序列同源性为80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%以上的序列及突变体都应落在本发明的保护范围之内。
[0045]
本发明中,过表达一般是指将目的基因的序列与骨架质粒构建成质粒载体,通过接合转移或者转化等手段,获得该基因产物大量积累的生物体。基因过表达的作用主要与基因本身编码蛋白的功能有关。一般来讲,过表达会导致该蛋白的含量增高,如果在细菌中过表达,有利于批量生产。
[0046]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0047]
本发明所用试剂和原料均市售可得。
[0048]
本发明的积极进步效果在于:
[0049]
本发明通过在天然生产子囊霉素的吸水链霉菌中过表达内源性的巴豆酰-coa还原酶基因fkbs,提高了子囊霉素的产量并降低了杂质fk523。在本发明某一较佳实施例中,利用吸水链霉菌atcc 14891构建的一株子囊霉素高产菌株中,子囊霉素的产量1543.3mg/l以上,最高产量可达为2363.6mg/l,较原始菌株atcc 14891提高了89.64%以上(原始菌株atcc 14891的子囊霉素产量仅为813.8mg/l);杂质比fk523/fk520可达7.1%以下。利用本发明所述基因工程菌生产子囊霉素,成本较低,适于工业化生产。
附图说明
[0050]
图1为fk523和fk520的结构图。
[0051]
图2为实施例1中的fk520液相检测图谱。
[0052]
图3为质粒pset-dcas9-fkbs图谱。
[0053]
图4为实施例3中采用简并引物fkbs-j-f-1/fkbs-j-r从吸水链霉菌基因组中扩增得到的电泳图;其中,m为1kb gene ruler;泳道1为简并引物fkbs-j-f-1/fkbs-j-r扩增得到的pcr产物的结果图。
[0054]
图5为实施例3中采用简并引物fkbs-j-f-2/fkbs-j-r和fkbs-j-f-3/fkbs-j-r分别从吸水链霉菌基因组中扩增得到的电泳图,其中,m为1kb gene ruler;泳道1为简并引物fkbs-j-f-2/fkbs-j-r扩增得到的pcr产物的结果图;泳道2为简并引物fkbs-j-f-3/fkbs-j-r扩增得到的pcr产物的结果图。
[0055]
图6为实施例3中的测序结果。
[0056]
图7为质粒pset-fkbs图谱。
[0057]
图8为质粒pset-2fkbs图谱。
[0058]
图9为质粒pset-3fkbs图谱。
[0059]
图10为质粒pset-ccr图谱。
[0060]
图11为pset-a2be质粒图谱。
[0061]
图12为pset-acc质粒图谱。
具体实施方式
[0062]
下面通过实施例的方式进一步说明本发明,但这仅仅是一些例子,而非对本发明的限定,并不因此将本发明限制在所述的实施例范围之中。本发明还包括未在这里示例的全部的许多改变或修饰。尤其,与本发明中的fkbs序列同源性为80%以上的序列及突变体都应落在本发明的保护范围之内。
[0063]
下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0064]
本发明所用的菌株、质粒、试剂和仪器:
[0065]
本发明涉及放线菌s.hygroscopicus var.ascomyceticus atcc 14891采购自美国模式培养物集存库(atcc)。用于构建多表达质粒的pset-152购自takara。用于做为pcr模板的模式菌streptomyces coelicolor的基因组为实验室保存(ncbi accession number:al645882.2)。用于接合转移的escherichia coli et12567购自takara公司。用于fkbs功能
验证的crispr/dcas9系统来自biotechnology journal,2018:1800121。
[0066]
本发明中使用的dna胶回收纯化试剂盒和质粒提取试剂盒购自生工生物工程(上海)股份有限公司,所有限制性内切酶和dna聚合酶都购自takara公司,同源重组试剂盒购自vazyme公司,巴豆酸购自国药集团化学试剂有限公司,乙腈购自amethyst chemicals公司,其他常规试剂均为国产分析纯或进口分装。
[0067]
本发明中使用的恒温发酵摇床购自上海知楚仪器有限公司,1200型高效液相色谱仪购自agilent technologies公司。
[0068]
本发明所用的培养基:
[0069]
1.ms培养基:
[0070]
甘露醇20g/l,黄豆饼粉20g/l,琼脂20g/l;121℃灭菌30分钟。
[0071]
2.种子培养基:
[0072]
玉米浆8g/l,葡萄糖10g/l,棉籽饼粉3g/l,磷酸二氢钾1g/l,ph7.0;121℃灭菌30分钟。
[0073]
3.发酵培养基:
[0074]
甘油60g/l、酵母提取物20g/l、黄豆饼粉20g/l、磷酸二氢钾0.2g/l、微量元素(feso4·
7h2o,0.01g/l znso4·
7h2o,0.01g/l cuso4·
5h2o,0.0001g/l),ph 6.5;121℃灭菌30分钟。
[0075]
实施例1
[0076]
将产子囊霉素的原始菌株s.hygroscopicus atcc 14891接种于装有20ml上述种子培养基的250ml摇瓶中,28℃,200rpm,生长2天。再将种子液以10%的接种量转接至装有25ml上述发酵培养基的250ml摇瓶中进行发酵培养,28℃,200rpm,发酵周期为8天。通过hplc液相方法(结果见图2)测得发酵液中子囊霉素的产量为813.8mg/l,杂质比例fk523/fk520为10.8%(子囊霉素的计算方法是通过本领域常规的定量方法-内标法测定,具体可以参照amb express,2019,9(1):25中所述。fk523/fk520则是通过两者峰面积相比等得到的)。
[0077]
其中,上述摇瓶发酵后的样品取样处理方法具体为:取300μl上述在摇瓶发酵培养后的发酵液,加入4倍体积的丙酮,超声20min后,12000rpm离心3min,取上清,用于hplc分析。所述hplc液相方法的具体条件如下:
[0078]
液相柱:agilent c18,3.5um,4.6mm*150mm;
[0079]
柱温:60℃;
[0080]
检测波长:205nm;
[0081]
流速:2.0ml/min;
[0082]
a流动相:10%乙腈水溶液(添加0.01%乙酸)
[0083]
b流动相:乙腈(添加0.01%乙酸)
[0084]
梯度条件见表1。
[0085]
表1
[0086][0087][0088]
实施例2 利用crispr/dcas9研究巴豆酰-coa还原酶在子囊霉素fk520生物合成中的作用
[0089]
根据已报道的巴豆酰-coa还原酶编码基因fkbs的部分基因序列(即上述460bp的核苷酸序列,ncbi accession no:af235504.1),设计相应的sgrna:
[0090]5’-
gttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttt tttgag-3’(seq id no:3),插入到pset-dcas9质粒(biotechnology journal,2018:1800121中已报道了该质粒的构建方法,详见其method and material部分)的spei/ecori酶切位点,置于启动子j223119的控制之下,从而构建质粒pset-dcas9-fkbs(见图3)。pset-dcas9-fkbs中dcas9基因由红霉素抗性基因启动子perm*启动表达。将pset-dcas9-fkbs质粒导入到et12567大肠杆菌之后,通过接合转移的方式将其导入到fk520(子囊霉素,ascomycin)的产生菌株atcc 14891中,构建工程菌株sfk-dfkbs。参照实施例1中的培养方法和液相检测方法,测得在工程菌株sfk-dfkbs中子囊霉素的产量仅为247.3mg/l。可见,通过抑制所述部分fkbs序列(460bp)的转录,从而抑制了全长dna的转录,导致fkbs不能完整转录,那么也就不具备催化功能。
[0091]
实施例3 利用简并引物对fkbs基因序列的扩增及测序
[0092]
通过对多种不同链霉菌来源的巴豆酰-coa还原酶氨基酸序列(s.coelicoflavus(ncbi accession no:wp_007387963.1),s.coelicolor(ncbi accession no:np_630556.1),s.mirabilis(ncbi accession no:wp_037706421.1),s.griseofuscus(ncbi accession no:wp_037654730.1),s.venezuela(ncbi accession no:agx26728.1),s.tsukubaensis(ncbi accession no:eif93549.1),s.lasaliensis(ncbi accession no:wp_137304740.1),s.nbrc 110611(ncbi accession no:wp_066930901.1),s.rapamycinicus(ncbi accession no:wp_020866310.1))的保守性分析,设计出fkbs基因的上游简并引物fkbs-j-f-1(seq id no:4):5
’-
rtgnnnganathhtnnnngcn-3’(r=a,g;h=a,t,c;n=a,t,c,g),同时还设计了其他fkbs基因的上游简并引物例如fkbs-j-f-2(seq id no:5):5
’-
rtgnnnganathhtnnnn-3’;fkbs-j-f-3(seq id no:6):5
’-
rtgnnnganathhtnnnngcnrtn-3’(r=a,g;h=a,t,c;n=a,t,c,g)。并针对已知的fkbs基因的下游序列(seq id no:1的1346-1362位)设计下游引物fkbs-j-r(seq id no:7):5
’-
tcaccgcaccccctcgg-3’(合成引物的公司为上海杰李生物技术有限公司)。利用fkbs-j-f-1/fkbs-j-r从streptomyces hygroscopicus atcc 14891的基因组中克隆出目的片段,跑
胶电泳结果如图4,可见大小合适且条带清楚;而利用fkbs-j-f-2/fkbs-j-r和fkbs-j-f-3/fkbs-j-r从streptomyces hygroscopicus atcc 14891的基因组进行克隆后的跑胶电泳结果如图5,可见用这2对引物并未扩增出大小合适且条带清楚的目的片段。基因fkbs的pcr条件如下:使用1μg的链霉菌atcc 14891基因组dna作为模板,加入20μmol/l上下游引物fkbs-j-f-1/fkbs-j-r,使用primestar gxl dna polymerase按以下循环条件进行:98℃
·
5min;(68℃
·
1min)*30次;68℃
·
10min。通过琼脂糖凝胶电泳(胶浓度1%,120v,20min),分离出1.4kb左右的电泳条带,并利用胶回收试剂盒回收目的片段。目的片段通过rtaq酶添加a尾,然后连接到pmd18-t载体上,并转化大肠感受态dh5α,37℃,过夜培养后,挑选单菌落送去测序(上海杰李生物技术有限公司),测序结果如图6、表2和表3所示。经比对,该序列与已报道的fkbs基因的下游序列(460bp)完全一致。
[0093]
表2
[0094][0095][0096]
表3
[0097][0098]
实施例4 在子囊霉素产生菌株atcc 14891中过表达fkbs基因
[0099]
利用下述引物fkbs-f/fkbs-r(根据实施例3中所得的fkbs基因序列进行设计)从吸水链霉菌atcc 14891的基因组中扩增编码巴豆酰-coa还原酶的fkbs基因,采用同源重组(利用同源重组试剂盒)的方式插入到pset-152质粒的ndei/asci位点,该基因置于红霉素抗性基因启动子perm*的控制之下,从而构建过表达质粒pset-fkbs(见图7)。用引物fkbs-f-2/fkbs-r-2从pset-fkbs扩增出含有红霉素抗性基因启动子perm*和fkbs基因的片段,采用酶切酶连的方式插入到pset-fkbs质粒的asci/noti位点,构建重组质粒pset-2fkbs(见图8)。用引物fkbs-f-3/fkbs-r-3从pset-fkbs扩增出含有红霉素抗性基因启动子perm*和fkbs基因的片段,采用酶切酶连的方式插入到pset-2fkbs质粒的noti/ecor
ⅴ
位点,构建重组质粒pset-3fkbs(见图9)。通过依次构建不同质粒的目的考察fkbs基因不同拷贝数对子囊霉素合成的促进作用,pset-fkbs,pset-2fkbs和pset-3fkbs分别在atcc 14891中增加了1个,2个和3个拷贝。
[0100]
所用引物序列如下:
[0101]
fkbs-f:
[0102]5’-
aaccactccacaggaggacccatatgatgcgtgacattcttcaggcgt-3’(seq id no:8)
[0103]
fkbs-r:
[0104]5’-
tggaaagacgacaaaactttggcgcgcctcaccgcaccccctcgg-3’(seq id no:9)
[0105]
fkbs-f-2:5
’-
aaaaggcgcgccggtaccagcccgacccgag-3’(seq id no:10)
[0106]
fkbs-r-2:5
’-
aaaagcggccgctcaccgcaccccctcgg-3’(seq id no:11)
[0107]
fkbs-f-3:5
’-
aaaagcggccgcggtaccagcccgacccgag-3’(seq id no:12)
[0108]
fkbs-r-3:5
’-
aaaagatatctcaccgcaccccctcgg-3’(seq id no:13)
[0109]
将上述pset-fkbs、pset-2fkbs、pset-3fkbs分别转化至et12567感受态细胞,然后通过接合转移的方式将这3个过表达质粒分别整合至atcc14891的φc31 attb位点,在添加了萘啶酮酸和安普霉素的ms培养基、温度为28℃的条件下进行培养,得到接合子。将所得接合子接种于添加了安普霉素的mb平板上,于28℃传代培养,得到fkbs基因过表达菌株sfk-ofkbs、sfk-ofkbs-2、sfk-ofkbs-3。对这3株工程菌参照实施例1中的条件进行摇瓶发酵实验。结果显示,sfk-ofkbs中子囊霉素的产量为1917.5mg/l,杂质比fk523/fk520为6.3%;sfk-ofkbs-2中子囊霉素的产量为1649.5mg/l,杂质比fk523/fk520为6.6%;sfk-ofkbs-3中子囊霉素的产量为1543.3mg/l,杂质比fk523/fk520为7.1%。
[0110]
由上述结果可以看出,在atcc14891中fkbs的拷贝数增加不是越多越好,即巴豆酰-coa还原酶的功能也不是越强越好,当在atcc14891中增加一个fkbs的拷贝数时,对子囊霉素的促进作用最好,杂质比也最低;而进一步增加fkbs的拷贝数,产量反而有所下降,说明更多的fkbs拷贝对子囊霉素的积累反而有所抑制。
[0111]
实施例5 巴豆酸添加对sfk-ofkbs中子囊霉素合成的促进作用
[0112]
为了考察外源添加巴豆酸对子囊霉素生物合成的影响,向sfk-ofkbs的发酵培养基中添加0.5g/l-5.0g/l的巴豆酸,采用实施例1中介绍的培养条件和液相检测方法进行分析。结果显示,当巴豆酸添加量为1.0g/l时,子囊霉素的产量提高至2363.6mg/l,杂质为5.3%;而原始菌株atcc 14891在同样添加1.0g/l的发酵培养基中发酵时,子囊霉素的产量和杂质fk523的含量并没有明显的变化。
[0113]
sfk-ofkbs在不同巴豆酸添加的发酵培养基中的发酵结果见表4。
[0114]
表4
[0115][0116][0117]
对比例1 在子囊霉素产生菌株atcc 14891中过表达外源巴豆酸还原酶基因ccr
[0118]
利用引物ccr-f/ccr-r从模式菌株天蓝色链霉菌(streptomyces coelicolor)的基因组(ncbi accession number:al645882.2)中扩增出编码巴豆酰-coa还原酶的ccr基因(ncbi accession number:np_630556.1),然后将该片段通过同源重组的方式整合到pset-152质粒的ndei/asci位点,该基因置于红霉素抗性基因启动子perm*的控制之下,从而构建过表达质粒pset-ccr(见图10)。
[0119]
所用引物序列如下:
[0120]
ccr-f:
[0121]5’-
aaccactccacaggaggacccatatggtgaccgtgaaggacatcctg-3’(seq id no:14)
[0122]
ccr-r:
[0123]5’-
tggaaagacgacaaaactttggcgcgcctcagatgttccggaagcgg t-3’(seq id no:15)
[0124]
将pset-ccr转化et12567感受态细胞后,通过接合转移的方式将其导入atcc 14891中,整合至atcc 14891的φc31 attb位点,在添加了萘啶酮酸和安普霉素的ms培养基、温度为28℃的条件下进行培养,得到接合子。将所得接合子接种于添加了安普霉素的mb平板上,于28℃传代培养,得到工程菌株sfk-occrc。采用实施例1中相同的发酵和hplc检测
方法测定sfk-occrc中子囊霉素的产量。结果显示:sfk-occrc中子囊霉素产量为950.3mg/l,杂质比fk523/fk520为9.5%。表明过表达ccr基因在提高子囊霉素产量和降低杂质的效果方面,远差于过表达fkbs基因。
[0125]
对比例2 过表达其他内源性基因和外源性基因时的效果对比
[0126]
(1)将产子囊霉素的原始菌株s.hygroscopicus atcc 14891接种于装有20ml上述种子培养基的250ml摇瓶中,28℃,200rpm,生长2天。再将种子液以10%的接种量(体积比)转接至装有25ml上述发酵培养基的250ml摇瓶中进行发酵培养,28℃,200rpm,发酵周期为8天。取300μl所得发酵液,用丙酮稀释5倍,超声处理20min后,12000rpm离心3min,取上清用0.22μm滤膜过滤后进行hplc分析。hplc的条件:色谱柱为hypersil bds c18,5um,4.6mm*150mm;流动相为水:乙腈=35:65(v/v);柱温为55℃;检测波长为210nm;流速为1.0ml/min。通过hplc液相方法测得发酵液中子囊霉素的产量为813.8mg/l(子囊霉素的计算方法是通过本领域常规的定量方法-内标法进行测定,具体可以参照amb express,2019,9(1):25)。
[0127]
(2)在子囊霉素产生菌中过表达外源性乙酰-coa羧化酶的基因acc
[0128]
利用引物a2be-f/a2be-r从质粒plc1-a2be中扩增出目的片段acca2be(包含编码乙酰-coa羧化酶的基因acca2(geneid:1100362,对应的氨基酸序列的ncbi登录号为np_629074.1)、accb(geneid:1100975,对应的氨基酸序列的ncbi登录号为np_629669.1)和acce(geneid:1100976,对应的氨基酸序列的ncbi登录号为np_629670.1)),pcr条件如下:使用质粒plc1-a2be作为模板,加入20μmol/l的上下游引物a2be-f/a2be-r,使用primestar gxl dna polymerase按以下循环条件进行:98℃
·
5min;(68℃
·
4min)*30次;68℃
·
10min。利用胶回收试剂盒回收目的片段。然后用同源重组的方式(利用同源重组试剂盒)将目的片段acca2be插入到质粒pset-152的ndei/asci位点,从而构建组合过表达质粒pset-a2be(见图11)。
[0129]
所用引物序列如下:
[0130]
a2be-f:
[0131]5’-
aaccactccacaggaggacccatatggtgcgcaaggtgctcatcg-3’(seq id no:16)
[0132]
a2be-r:
[0133]5’-
tggaaagacgacaaaactttggcgcgcctcagcgccagctgtgcg-3’(seq id no:17)
[0134]
将所得质粒pset-a2be转化至et12567感受态细胞后,通过常规的接合转移的方式将其导入atcc 14891的φc31 attb位点中,在添加了萘啶酮酸和安普霉素的ms培养基、温度为28℃的条件下进行培养,得到接合子。将所得接合子接种于添加了安普霉素的ms平板上,于28℃传代培养,得到基因acca2、accb和acce过表达菌株fk-oa2be。将fk-oa2be参照本对比例第(1)部分中的培养方法进行发酵培养,经hplc液相检测fk-oa2be中子囊霉素产量为2320.1mg/l,较原始菌株atcc 14891提高185.1%。
[0135]
(2)在子囊霉素产生菌中过表达内源性乙酰-coa羧化酶的基因acc
[0136]
利用引物acc-f/acc-r从吸水链霉菌atcc 14891的基因组中扩增出编码乙酰-coa羧化酶的基因acc(序列如序列表中seq id no:18所示)。pcr条件为:使用吸水链霉菌atcc 14891基因组作为模板,加入20μmol/l的上下游引物acc-f/acc-r,使用primestar gxl dna polymerase按以下循环条件进行:98℃
·
5min;(68℃
·
2min)*30次;68℃
·
10min。利用胶回收试剂盒回收目的片段。然后用同源重组的方式将目的片段acc插入到质粒pset-152的
ndei/asci位点,从而构建过表达质粒pset-acc(见图12)。
[0137]
所用引物序列如下:
[0138]
acc-f:
[0139]5’-
aaccactccacaggaggacccatatgatgaccggaacgaactcaccc-3’(seq id no:19)
[0140]
acc-r:
[0141]5’-
tggaaagacgacaaaactttggcgcgcctcaacggggtagcccgatg-3’(seqid no:20)
[0142]
将过表达质粒pset-acc转化至et12567感受态细胞后,通过接合转移的方式将其导入atcc 14891的φc31 attb位点,在添加了萘啶酮酸和安普霉素的ms培养基、温度为28℃的条件下进行培养,得到接合子。将所得接合子接种于添加了安普霉素的ms平板上,于28℃传代培养,得到工程菌株fk-oacc。在本对比例第(1)部分相同的培养条件下进行发酵并进行检测,结果显示在组合过表达菌株fk-oacc中,fk520产量达到853.1mg/l,较原始菌株atcc 14891没有明显的提高。
[0143]
从上述结果可以看出生物领域的不可预见性,在过表达菌株内源性表达的基因时,其效果并不一定会优于过表达同类型的外源性基因。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 基于核酸外切酶Ⅲ末端保护分析检测小分子与结合蛋白相互作用的荧光生物传感技术的制作方法
- 基于单链核酸外切酶末端保护分析检测小分子与结合蛋白相互作用的生物传感技术的制作方法
- 基于核酸外切酶Ⅲ/Ⅰ保护分析检测单核苷酸多态性的荧光生物传感方法
- 核酸外切酶Ⅲ消化FRET-dsDNA微阵列芯片检测转录因子蛋白的制作方法
- 人核酸外切酶因子基因编码蛋白的制作方法
- 基于t7核酸外切酶抑制分析检测有机小分子与结合蛋白相互作用的荧光生物传感方法
- 基于核酸外切酶Ⅰ保护分析检测有机小分子和蛋白质相互作用的可视传感方法
- 一种定量核酸外切酶i活性测定方法
- 一种t5核酸外切酶在大肠杆菌中的制备方法
- 限制性内切酶和核酸外切酶ⅲ的无标记荧光检测dna甲基化和甲基转移酶活性的检测方法