一种提高茶黄素类物质合成产率的方法与流程
本发明属于植物活性成分提取技术领域,具体涉及一种提高茶黄素类物质合成产率的方法。
背景技术:
茶黄素类物质是红茶的重要品质成分,它是由儿茶素类物质在多酚氧化酶及有氧条件下氧化聚合形成,一般占红茶干物重的0.5-2%。茶黄素共有20多种衍生物,其中主要成分包括四种,分别为茶黄素(tf)、茶黄素-3-没食子酸酯(tf-3-g)、茶黄素-3′-没食子酸酯(tf-3′-g)及茶黄素-3,3′-双没食子酸酯(tfdg)。大量研究表明,茶黄素类物质具有多种药理功能,如抗氧化、防癌抗癌、抗炎、降血糖、降血脂及减肥等功效。
目前,茶黄素类物质的合成方法包括酶法合成、化学合成及微生物发酵。其中,化学方法由于产率低、控制难度大及安全等问题目前基本已被弃用,微生物发酵由于存在极大技术难题还处在研究初期,因此,目前茶黄素类物质的来源主要是通过酶法合成,应用较多的为茶鲜叶悬浮发酵及其它植物外源酶发酵,目前报道的外源酶有梨、苹果、枇杷等几十种植物,其中梨是合成茶黄素类最好的外源酶,该外源酶最佳反应条件通常为ph=4.5-5.5,20-30℃下反应30-50min。但是该条件下虽然能生成大量茶黄素类物质,但儿茶素类氧化副产物也会显著增加,从而导致茶黄素类物质的合成产率偏低,为高纯茶黄素类物质的分离带来很大障碍。
技术实现要素:
有鉴于此,本发明的目的在于提供一种提高茶黄素类物质合成产率的方法。
为达到上述目的,本发明提供如下技术方案:
1、一种提高茶黄素类物质合成产率的方法,所述方法如下:
将两种相对应儿茶素单体或儿茶素类混合物溶解于缓冲液中,然后以0.5-1ml/min的速度滴加到预先通氧且温度为1-3℃的多酚氧化酶粗酶液中,待滴加完成后,冰浴条件下反应。
优选的,所述方法如下:
(1)将新鲜去皮梨加入ph为4.5-5.5,温度为1-3℃的缓冲液中,匀浆后过滤,获得滤液,并以所述缓冲液洗涤滤渣,获得洗液,将所述滤液和洗液混匀后置于冰浴条件下搅拌至混合液的温度降至1-3℃,获得多酚氧化酶粗酶液,对所述多酚氧化酶粗酶液预先通氧至氧气饱和;
(2)将两种相对应儿茶素单体溶解于步骤(1)中所述缓冲液中,然后以0.5-1ml/min的速度液滴加到步骤(1)中预先通氧且温度为1-3℃的多酚氧化酶粗酶液中,待滴加完成后,冰浴条件下反应30-40min;所述两种相对应儿茶素单体的摩尔比为0.08-0.1:0.08-0.1;所述新鲜去皮梨与任一儿茶素单体的质量摩尔比为30:0.08-0.1,所述质量摩尔比的单位为g:mm。
优选的,所述方法如下:
(1)将新鲜去皮梨加入ph为4.5-5.5,温度为1-3℃的缓冲液中,匀浆后过滤,获得滤液,并以所述缓冲液洗涤滤渣,获得洗液,将所述滤液和洗液混匀后置于冰浴条件下搅拌至混合液的温度降至1-3℃,获得多酚氧化酶粗酶液,对所述多酚氧化酶粗酶液预先通氧至氧气饱和;
(2)将儿茶素类混合物溶解于步骤(1)中所述缓冲液中,然后以0.5-1ml/min的速度滴加到步骤(1)中预先通氧且温度为1-3℃的多酚氧化酶粗酶液中,待滴加完成后,冰浴条件下反应30-40min;所述儿茶素类混合物中egc、ec、egcg和ecg的总含量为60-85wt%;所述新鲜去皮梨与所述儿茶素类混合物的质量比为30:80-120。
优选的,所述梨为皇冠梨或雪梨中的一种。
优选的,所述缓冲液为磷酸缓冲液。
优选的,所述过滤具体为通过4-8层纱布过滤。
优选的,所述洗涤的方式为少量多次。
本发明的有益效果在于:本发明提供了一种提高茶黄素类物质合成产率的方法,该方法利用低温滴加技术,通过合理控制儿茶素类原料与酶源的用量配比、反应温度及滴加速度,极大地减少了副产物的生成,从而大大提高茶黄素类物质的合成产率。其中,低温不但能大大减少儿茶素类单体在多酚氧化酶条件下的自身氧化聚合,也能降低产物茶黄素类物质在该酶作用下的氧化;另外,与一次性加入相比,滴加能间接增加酶与底物及时浓度比(即与同时添加相比酶的浓度远远过量),在该条件下儿茶素类的酶法合成产物会向茶黄素类化合物方向调整,从而使底物快速转化成产物,同时也减少了部分底物与酶的接触时间,能有效减少自身氧化副产物及其他聚合产物(如底物儿茶素类与产物茶黄素类进一步氧化聚合)的形成。该方法简单易操作,且成本低,适合扩大化生产。
本发明的其他优点、目标和特征在某种程度上将在随后的说明书中进行阐述,并且在某种程度上,基于对下文的考察研究对本领域技术人员而言将是显而易见的,或者可以从本发明的实践中得到教导。本发明的目标和其他优点可以通过下面的说明书来实现和获得。
附图说明
为了使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作优选的详细描述,其中:
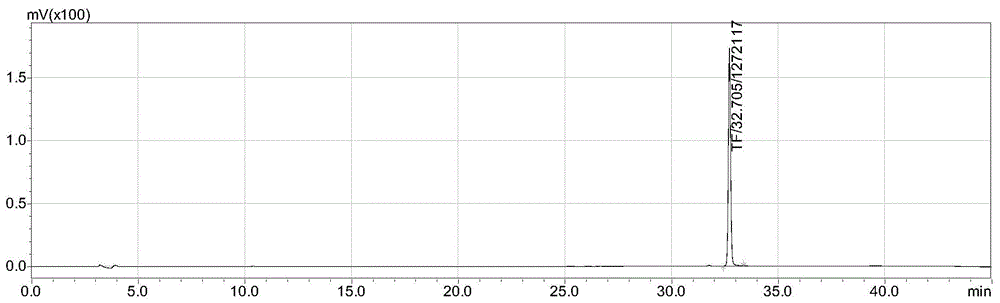
图1为实施例1中制备的tf的高效液相色谱图;
图2为对比实施例1中制备的tf的高效液相色谱图;
图3为实施例2中制备的tf-3-g的高效液相色谱图;
图4为对比实施例2中制备的tf-3-g的高效液相色谱图;
图5为实施例3中制备的tf-3'-g的高效液相色谱图;
图6为对比实施例3中制备的tf-3'-g的高效液相色谱图;
图7为实施例4中制备的tfdg的高效液相色谱图;
图8为对比实施例4中制备的tfdg的高效液相色谱图;
图9为实施例5中制备的tfs的高效液相色谱图;
图10为对比实施例5中制备的tfs的高效液相色谱图;
图11为实施例1和对比实施例1中反应结束后反应液中产物茶黄素经乙酸乙酯萃取后水层的实物图。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
实施例1
茶黄素(tf)的合成
(1)将30g新鲜去皮雪梨加入20mlph为5.0,温度为3℃的磷酸缓冲液(以柠檬酸将浓度为0.1m的磷酸氢二钠溶液的ph值调制5)中,匀浆后过6层纱布过滤,获得滤液,并以上述相同的磷酸缓冲液以少量多次的方式洗涤滤渣,获得洗液,将滤液和洗液混匀后共80ml置于冰浴条件下搅拌至混合液的温度降至3℃,获得多酚氧化酶粗酶液,对多酚氧化酶粗酶液预先通氧2min至氧气饱和;
(2)将0.1mmegc和0.1mmec均溶解于20mlph为5.0,温度为3℃的磷酸缓冲液中,然后以1ml/min的速度液滴加到步骤(1)中预先通氧且温度为3℃的多酚氧化酶粗酶液中,待滴加完成后,冰浴条件下反应30min,其中,滴加完成后以上述磷酸缓冲液洗涤滴加器皿,洗涤两次,每次磷酸缓冲液的用量为5ml。
反应完成后取1ml反应液,用等体积的乙酸乙酯萃取,重复两次,合并乙酸乙酯层,以乙醇定容至10ml,以hplc进行检测,进样量为10μl,检测波长为278nm,检测结果见图1。
对比实施例1
茶黄素(tf)的合成
(1)将30g新鲜去皮雪梨加入20mlph为5.0的磷酸缓冲液(以柠檬酸将浓度为0.1m的磷酸氢二钠溶液的ph值调制5)中,匀浆后过6层纱布过滤,获得滤液,并以上述相同的磷酸缓冲液以少量多次的方式洗涤滤渣,获得洗液,将滤液和洗液混匀后共80ml,获得多酚氧化酶粗酶液,对多酚氧化酶粗酶液预先通氧2min至氧气饱和;
(2)将0.1mmegc和0.1mmec均溶解于20mlph为5.0的磷酸缓冲液中,然后一次性加入步骤(1)中预先通氧的多酚氧化酶粗酶液中,25℃下反应30min,其中,待溶解有egc和ec的缓冲液加入后,再以上述磷酸缓冲液洗涤盛装溶解有egc和ec的缓冲液的器皿,洗涤两次,每次磷酸缓冲液的用量为5ml。
反应完成后取1ml反应液,用等体积的乙酸乙酯萃取,重复两次,合并乙酸乙酯层,以乙醇定容至10ml,以hplc进行检测,进样量为10μl,检测波长为278nm,检测结果见图2。
对比图1及图2可知,较对比实施例1中的传统方法,以本发明中低温滴加的方式制备tf,tf的生成量都提高了1倍以上。
实施例1中最终获得的反应液经乙酸乙酯萃取后水层的颜色呈无色透明状(如图11中左图所示),而对比实施例1中最终获得的反应液经乙酸乙酯萃取后水层的颜色呈淡黄色(如图11中右图所示),说明以对比实施例1中的传统方法制备tf时,生成了大量不溶于乙酸乙酯的多酚氧化副产物。
实施例2
茶黄素-3-没食子酸酯(tf-3-g)的合成
与实施例1的区别在于,将实施例1步骤(2)中0.1mmegc和0.1mmec替换为0.1mmegcg和0.1mmec。
反应完成后取1ml反应液,用等体积的乙酸乙酯萃取,重复两次,合并乙酸乙酯层,以乙醇定容至10ml,以hplc进行检测,进样量为10μl,检测波长为278nm,检测结果见图3。
对比实施例2
茶黄素-3-没食子酸酯(tf-3-g)的合成
与对比实施例1的区别在于,将对比实施例1步骤(2)中0.1mmegc和0.1mmec替换为0.1mmegcg和0.1mmec。
反应完成后取1ml反应液,用等体积的乙酸乙酯萃取,重复两次,合并乙酸乙酯层,以乙醇定容至10ml,以hplc进行检测,进样量为10μl,检测波长为278nm,检测结果见图4。
对比图3及图4可知,较对比实施例2中的传统方法,以本发明中低温滴加的方式制备tf-3-g,tf-3-g的生成量都提高了1倍以上。
实施例3
茶黄素-3'-没食子酸酯(tf-3'-g)的合成
与实施例1的区别在于,将实施例1步骤(2)中0.1mmegc和0.1mmec替换为0.08mmegc和0.08mmecg。
反应完成后取1ml反应液,用等体积的乙酸乙酯萃取,重复两次,合并乙酸乙酯层,以乙醇定容至10ml,以hplc进行检测,进样量为10μl,检测波长为278nm,检测结果见图5。
对比实施例3
茶黄素-3'-没食子酸酯(tf-3'-g)的合成
与对比实施例1的区别在于,将对比实施例1步骤(2)中0.1mmegc和0.1mmec替换为0.08mmegc和0.08mmecg。
反应完成后取1ml反应液,用等体积的乙酸乙酯萃取,重复两次,合并乙酸乙酯层,以乙醇定容至10ml,以hplc进行检测,进样量为10μl,检测波长为278nm,检测结果见图6。
对比图5及图6可知,较对比实施例3中的传统方法,以本发明中低温滴加的方式制备tf-3'-g,tf-3'-g的生成量都提高了20.91%。
实施例4
茶黄素-3,3'-双没食子酸酯(tfdg)的合成
与实施例1的区别在于,将实施例1步骤(2)中0.1mmegc和0.1mmec替换为0.08mmegcg和0.08mmecg。
反应完成后取1ml反应液,用等体积的乙酸乙酯萃取,重复两次,合并乙酸乙酯层,以乙醇定容至10ml,以hplc进行检测,进样量为10μl,检测波长为278nm,检测结果见图7。
对比实施例4
茶黄素-3,3'-双没食子酸酯(tfdg)的合成
与对比实施例1的区别在于,将对比实施例1步骤(2)中0.1mmegc和0.1mmec替换为0.08mmegcg和0.08mmecg。
反应完成后取1ml反应液,用等体积的乙酸乙酯萃取,重复两次,合并乙酸乙酯层,以乙醇定容至10ml,以hplc进行检测,进样量为10μl,检测波长为278nm,检测结果见图8。
对比图7及图8可知,较对比实施例4中的传统方法,以本发明中低温滴加的方式制备tfdg,tfdg的生成量都提高了11.35%。
实施例5
茶黄素类(tfs)的合成
与实施例1的区别在于,将实施例1步骤(2)中0.1mmegc和0.1mmec替换为100mg儿茶素类混合物,该混合物中egc、ec、egcg和ecg的总含量为85wt%。
反应完成后取1ml反应液,用等体积的乙酸乙酯萃取,重复两次,合并乙酸乙酯层,以乙醇定容至10ml,以hplc进行检测,进样量为10μl,检测波长为278nm,检测结果见图9。
对比实施例5
茶黄素类(tfs)的合成
与对比实施例1的区别在于,将实施例1步骤(2)中0.1mmegc和0.1mmec替换为100mg儿茶素类混合物,该混合物中egc、ec、egcg和ecg的总含量为85wt%。
反应完成后取1ml反应液,用等体积的乙酸乙酯萃取,重复两次,合并乙酸乙酯层,以乙醇定容至10ml,以hplc进行检测,进样量为10μl,检测波长为278nm,检测结果见图10。
对比图9及图10可知,较对比实施例5中的传统方法,以本发明中低温滴加的方式制备tfs,tfs的生成量都提高了52.74%。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!