特定基团修饰的N1,N3取代4,5-二芳基咪唑环卡宾铑配合物及其制备方法和应用与流程
本发明属于医药领域,涉及特定基团修饰的n1,n3取代4,5-二芳基咪唑环卡宾铑配合物及其制备方法和应用。
背景技术:
近年来,癌症的发生率和死亡率都在逐年上升,现已成为严重危害人类生命健康的一大恶疾,因而对新型高效低毒的抗癌药物的研发迫在眉睫。
铂类药物在癌症的治疗中取得了令人瞩目的成就,但是严重的毒副作用和耐药性限制了其使用范围,因此寻找具有不同作用机理的新型抗癌药物,以改良或补充现有的铂类药物是当前研究的热点。在此大背景下,开发新的非铂类金属抗癌药物是可行途径之一。目前,金诺芬在临床上的广泛应用,钌类配合物kp1019和nami-a已进入到临床实验阶段,以及硝酸镓用于治疗癌症已通过了ii期临床实验等事实证明了这一点。
早期研究表明铑配合物与顺铂具有相同数量级的抗肿瘤活性(chem.-biol.interact.1983,45,1-6),自此,具有良好抗肿瘤活性的铑配合物也开始进入了人们的视野。在2013年后,rh(i)配合物的抗癌活性研究取得了新的进展(organometallics,2013,32,141-150;inorg.chiem.acta,2013,400,26-31;chem.eur.j.,2013,19,17871-17880;j.med.chem.,2015,58,9591-9600)。
此外,研究发现临床上使用的金属抗癌药物及大部分有机抗癌药物的作用机制多与dna作用引起的细胞凋亡有关,其长期使用过程中极易使癌细胞产生耐药性,因而,开发具有新型作用机制的抗癌活性药物是解决现有药物耐药性问题的有效策略之一。硫氧还蛋白还原酶(trxr)是细胞内重要的氧化还原系统成员之一,主要以trxr1分布于线粒体中,与癌症的发生和发展密切相关,在多种癌症中都能观察到trxr的过表达。trxr的靠近碳末端处具有一硒醇残基,在氧化还原中比较活跃,容易与金属离子结合使trxr失活,破环癌细胞内的氧化还原平衡,从而杀死癌细胞。因此,通过抑制trxr的活性,诱导细胞凋亡的抗癌药物具有光明的研发前景。
本发明将特定基团修饰的n1,n3取代4,5-二芳基咪唑化合物与金属铑配位,从而获得了具有较好trxr抑制活性和抗肿瘤活性的先导化合物,其化合物结构、制备方法和生物活性等尚未见相关报道。
技术实现要素:
本发明要解决的技术问题是提供一种特定基团修饰的n1,n3取代4,5-二芳基咪唑铑配合物及其中间体的制备方法和应用。该化合物及其金属铑配体具有合成简单易得、产率高等特点,并且具有较好的抗肿瘤活性。这类含氮杂环的卡宾铑配合物还是一种trxr抑制剂,能破坏癌细胞中氧化还原的平衡,该配合物结构稳定,抗癌活性强且作用机制不同于顺铂。
为解决上述技术问题,本发明采用以下技术方案实现:
一种特定基团修饰的n1,n3取代4,5-二芳基咪唑环卡宾铑配合物(ii)或其药学上可接受的盐,其结构通式为nhc(cod)rhcl,具有式ii的结构:
其中,r1选自卤素、c1-4的烷氧基或芳基,r2选自取代或非取代的c1-4烷基,其中取代基选自芳环或c3-6环烷基。
所述的r1优选f、br、甲氧基或苯基。
所述的r2优选乙基、苄基、1-萘甲基、环丙甲基或9-蒽甲基。
所述的特定基团修饰的n1,n3取代4,5-二芳基咪唑环卡宾铑配合物(ii)进一步优选以下化合物:
一种上述的金属配合物的制备方法,
(1)当r1不为苯基时,反应路线如下:
(2)当r1为苯基时,反应路线如下:
取式i所示化合物与适量氧化银溶解于有机溶剂中,氮气保护,于室温至90℃避光反应2~12h,再加入适量的1,5-环辛二烯氯化铑二聚体,相同条件下继续反应4~48h,硅藻土过滤,滤液旋干,硅胶柱分离纯化,即得特定基团修饰的n1,n3取代4,5-二芳基咪唑环卡宾铑配合物(ii)。
优选地,所述有机溶剂为选自甲醇、乙醇、二氯甲烷中的一种或两种以上的组合。
优选地,所述氧化银与式i所示化合物的反应摩尔比为2:1~1:2。
优选地,所述1,5-环辛二烯氯化铑二聚体与式i所示化合物的的反应摩尔比为0.5:1~1:0.5。
当r1不为苯基时,反应路线优选如下:
上述的金属配合物或其药学上可接受的盐在用于制备抗肿瘤药物、抗肿瘤药物组分的应用。
优选地,所述的抗肿瘤为抗实体瘤癌症。
更优选地,所述的抗肿瘤是抗人肝癌、人宫颈癌、人口腔表皮样癌、人结肠癌、人肺癌、人卵巢癌和/或人乳腺癌。
上述的金属配合物或其药学上可接受的盐在用于制备trxr抑制剂药物、trxr抑制剂药物组分的应用。
本发明所述的特定基团修饰的n1,n3取代4,5-二芳基咪唑环卡宾铑配合物或其药学上可接受的盐在制备抗肿瘤药物中的应用;优选在制备人肝癌、人宫颈癌、人口腔表皮样癌、人结肠癌、人肺癌、人卵巢癌和/或人乳腺癌的药物中的应用。
本发明所述的特定基团修饰的n1,n3取代4,5-二芳基咪唑环卡宾铑配合物或其药学上可接受的盐在制备trxr抑制剂药物中的应用。
一种制备本发明所述的特定基团修饰的n1,n3取代4,5-二芳基咪唑环卡宾铑配合物的中间体,结构式如下所示:
其中,r1选自卤素、c1-4的烷氧基或芳基,r2选自取代或非取代的c1-4烷基,其中取代基选自芳环或c3-6环烷基;且当r1为f时,r2不为乙基或苄基;当r1为甲氧基时,r2不为苄基。
所述的r1优选f、br、甲氧基或苯基;所述的r2优选乙基、苄基、1-萘甲基、环丙甲基或9-蒽甲基。
所述的中间体进一步优选以下任意一种化合物:
所述的中间体的制备方法:
(1)当r1不为苯基时,反应路线如下:
(2)当r1为苯基时,反应路线如下:
本发明所述的中间体的制备方法,优选包含以下步骤:
(1)以对位取代的苯甲醛为起始原料,在盐酸硫胺素的催化下,发生安息香缩合反应。
将盐酸硫胺素溶于含水的醇溶液中,搅拌下加入氢氧化钠或氢氧化钙的固体或者二者任意一种的溶液调节ph至8~14,再加入对位取代的苯甲醛,室温至100℃搅拌反应2~5天,反应结束后,旋干,水相用二氯甲烷或三氯甲烷或乙酸乙酯萃取,有机层用无水硫酸钠干燥,过滤,旋干,得粗产物,硅胶柱分离纯化得到对位取代的安息香化合物。
进一步优选地,所述含水的醇溶液为乙醇溶液或甲醇溶液或异丙醇溶液;所述含水的醇溶液中,水与醇的体积比为1:5~5:1。
进一步优选地,所述盐酸硫胺素与对位取代的苯甲醛的反应摩尔比为1:20~20:1。
(2)对位取代的安息香化合物与甲酰胺回流得4,5-二芳基取代咪唑化合物。
将对位取代的安息香化合物溶于过量甲酰胺中,210~310℃回流2~5h,冷却,至反应液温度冷却到100~60℃以下,再将其缓慢加入3~5倍体积的水中,边加边搅拌,过滤析出的固体,少量乙醚洗涤3次,干燥,即得4,5-二芳基咪唑化合物。
(3)当r1不为苯基时,步骤(3)包括以下步骤:
溴乙烷与4,5-二芳基取代咪唑发生取代反应得n1-乙基取代的4,5-二芳基咪唑。
取适量上述(2)所得的4,5-二芳基咪唑溶于无水四氢呋喃中,加入氢化钠,搅拌约10~60min,氮气保护下,加入溴乙烷回流2~7h,旋干,硅胶柱分离纯化得到n1-乙基取代的4,5-二芳基咪唑。
进一步优选地,所述氢化钠与4,5-二芳基咪唑化合物的反应摩尔比为1:1~10:1。
进一步优选地,所述溴乙烷与4,5-二芳基咪唑化合物的反应摩尔比为1:1~5:1。
当r1为苯环时,n1-乙基-4,5-二联苯咪唑的合成优选包括以下步骤:
取适量n1-乙基-4,5-二(4’-溴苯基)咪唑、碳酸钾或碳酸钠、苯硼酸以及pd(pph3)4溶解于适量的混合溶液中,加热回流12~72h,得粗产物,通过硅胶柱层析分离纯化得n1-乙基-4,5-二联苯咪唑。
进一步优选地,所述n1-乙基-4,5-二(4’-溴苯基)咪唑与碳酸钾或碳酸钠、苯硼酸和pd(pph3)4的反应摩尔比为1:8:2.4:1~1:12:5:2。
进一步优选地,所述混合溶液为乙醇或甲醇或异丙醇/水/丙酮或甲苯,体积比为3:2:3~7:5:9。
(4)卤代烃与n1-乙基取代的4,5-二芳基咪唑发生取代反应得n1,n3有取代的4,5-二芳基咪唑溴/氯化物。
取适量步骤(3)所得的n1-乙基取代的4,5-二芳基咪唑与卤代烃溶于适量的有机溶剂中,加热回流2~4天,即得n1,n3有取代的4,5-二芳基咪唑溴/氯化物。
进一步优选地,所述n1-乙基取代的4,5-二芳基咪唑化合物与卤代烃的反应摩尔比为1:3~1:10。
进一步优选地,所述有机溶剂为乙腈或苯乙腈中的一种或二种混合。
本发明所述的中间体(i)在制备所述的特定基团修饰的n1,n3取代4,5-二芳基咪唑环卡宾铑配合物(ii)或其药学上可接受的盐中的应用。
与现有技术相比,本发明具有以下有益效果:
(1)本发明提供了一种由特定基团修饰的n1,n3取代4,5-二芳基咪唑化合物(i),并且该化合物可以与1,5-环辛二烯氯化铑二聚体合成具有抗肿瘤作用和抑制trxr活性的系列特定基团修饰的n1,n3取代4,5-二芳基咪唑环卡宾铑配合物(ii),本发明在制备过程中反应简单、分离纯化方便、易于提高反应产率。
(2)本发明提供的特定基团修饰的n1,n3取代4,5-二芳基咪唑化合物(i)及其金属铑配合物(ii)或其药学上可接受的盐具有很好的trxr抑制剂作用和抗肿瘤作用,具备可能成药的前景和价值。
(3)本发明提供的抗肿瘤铑配合物(ii)对多种常见的人体癌细胞均具有很强的生长抑制能力,特别是能抑制人肝癌细胞hepg2细胞的生长,其ic50值可达1.33±0.21μm,具有成为治疗肝癌先导化合物的价值。
(4)本发明提供的抗肿瘤铑配合物(ii)通过抑制trxr活性,增加细胞内活性氧水平调控线粒体内电位变化,从而诱导肿瘤细胞凋亡,可以克服由于铂类药物耐药性对肿瘤治疗的缺陷,在开发新型非铂类高效的抗癌药物方面具有很好的应用前景。
(5)体内实验表明本发明提供的抗肿瘤铑配合物(ii)在10mg·kg-1的剂量下抑制肿瘤生长率可达45%,具有很强的肿瘤生长抑制能力以及较高的安全性。
附图说明
图1为rh1的核磁共振氢谱图
图2为rh1的核磁共振碳谱图
图3为rh1的电喷雾质谱图
图4为rh1的单晶结构示意图
图5为rh2的核磁共振氢谱图
图6为rh2的核磁共振碳谱图
图7为rh2的电喷雾质谱图
图8为rh1在gsh、nac和重水环境下的核磁共振氢谱随时间变化图
图9为特定基团修饰的n1,n3取代4,5-二芳基咪唑环卡宾铑配合物(ii)(rh1~rh8)的化学结构示意图
图10为rh1对三种肝癌细胞(hepg2细胞、hep3b细胞、smmc-7721细胞)和正常肝细胞(lo2)的细胞毒性及rh1处理lo2细胞后alt和ldh的释放水平
图a中,每个系列从左至右依次代表hepg2细胞、hep3b细胞、smmc-7721细胞和lo2细胞。
图11为rh1的trxr抑制活性结果
图12为体外rh1对trxr酶的抑制结果
图13为rh5在hepg2细胞中的分布
图14为rh1对细胞内活性氧(ros)的影响
图15为不同浓度的nac保护下的rh1的细胞毒性
图16为rh1处理hepg2细胞后jc-1染色间的线粒体膜电位的染色免疫荧光图和细胞内atp释放的水平
图17为rh1对caspase依赖性的细胞凋亡通路的影响
图18为rh1对caspase非依耐性的细胞凋亡通路及parp凋亡信号通路的影响
图19为rh1对细胞周期的影响
图20为体外rh1与dna作用的紫外光谱图
图21为体外rh1与dna作用的荧光光谱图
图22为体外rh1与dna作用的圆二色谱图
图23为体内rh1对裸鼠体重(a)和肿瘤体积(b、c)及肿瘤(d)的影响
图24为体内rh1对四氯化碳造模的肝损伤小鼠的肝形态影响图、肝切片的h&e染色,siriusred染色和cd45染色的结果
图25为体内rh1和四氯化碳共处理组,四氯化碳模型组及正常小鼠组的肝切片的masson染色,f4/80染色的结果
图26为体内rh1对四氯化碳造模的肝损伤小鼠的血清肝损伤指标的影响
图27为体内rh1对四氯化碳造模的肝损伤小鼠的血清中trxr含量及肝组织中trxr表达水平的影响
具体实施方式
以下结合附图和具体实施例对本发明的上述内容再做进一步的详细说明,但不应将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容所实现的技术均属于本发明的范围。
实施例1
n1,n3-二乙基-4,5-二(4’-氟苯基)咪唑环卡宾铑配合物rh1的合成:
(1)盐酸硫胺素(2.0g)溶于水(10ml)和乙醇(20ml)混合溶液中,搅拌,加入适量氢氧化钠使溶液ph为9~10,再加入4-氟苯甲醛(10ml),常温下反应3天,反应结束后,用旋转蒸发仪浓缩,尽可能除去乙醇,用二氯甲烷萃取所得水溶液,有机层用无水硫酸钠干燥,过滤,旋干,得粗产物,硅胶柱分离纯化得到对二氟苯偶姻,白色固体,产率为62%。
(2)对二氟苯偶姻(5.0g)溶于甲酰胺(30ml)中,210~220℃回流2~3h,冷却,反应液温度降到100℃以下,缓慢加入100ml的纯水,边加边搅拌,过滤析出的固体,少量乙醚洗涤(5ml×3),干燥,得4,5-二(4’-氟苯基)咪唑,白色固体,产率为79%。
(3)4,5-二(4’-氟苯基)咪唑(1.5g)溶于无水四氢呋喃(25ml)中,加入氢化钠(289mg,60%),搅拌约10min,加入溴乙烷(528μl),氮气保护下加热回流2~3h,反应结束后,旋干,硅胶柱分离纯化得到n1-乙基-4,5-二(4’-氟苯基)咪唑,白色固体,产率为83%。n1-乙基-4,5-二(4’-氟苯基)咪唑结构确认数据如下:
1hnmr(500mhz,cdcl3,20℃):δ7.62(s,1h),7.43–7.37(m,2h),7.35–7.28(m,2h),7.17(t,j=8.1hz,2h),6.90(t,j=8.2hz,2h),3.82(q,j=7.1hz,2h),1.28(t,j=7.2hz,3h).
(4)n1-乙基-4,5-二(4’-氟苯基)咪唑(1.0g)与溴乙烷(1.32ml)溶于乙腈(20ml)中,加热回流反应3天,反应结束后,旋干,得粗产物,经硅胶柱分离纯化得n1,n3-二乙基-4,5-二(4’-氟苯基)咪唑溴化物,白色固体,产率72%。n1,n3-二乙基-4,5-二(4’-氟苯基)咪唑溴化物结构确认数据为:1hnmr(500mhz,cdcl3,20℃):δ10.86(s,1h),7.27(d,j=3.7hz,4h),7.14(t,j=8.4hz,4h),4.33(q,j=7.3hz,4h),1.51(t,j=7.3hz,6h).13cnmr(126mhz,cdcl3,20℃):δ164.76,162.75,136.99,132.60,132.53,131.04,120.82,120.79,116.93,116.75,43.53,15.79.
(5)将n1,n3-二乙基-4,5-二(4’-氟苯基)咪唑溴化物(98.5mg),氧化银(35mg),溶于无水二氯甲烷(15ml)中,避光,氮气保护,室温下搅拌,反应过夜,向反应混合物中加入1,5-环辛二烯氯化铑二聚体(62mg),相同条件下继续反应6h,反应结束后,反应液经硅藻土过滤,滤液旋干,得粗产品,经硅胶柱分离纯化得到配合物rh1,黄色固体,产率为71%。
对所得n1,n3-二乙基-4,5-二(4’-氟苯基)咪唑环卡宾铑配合物rh1进行结构鉴定:
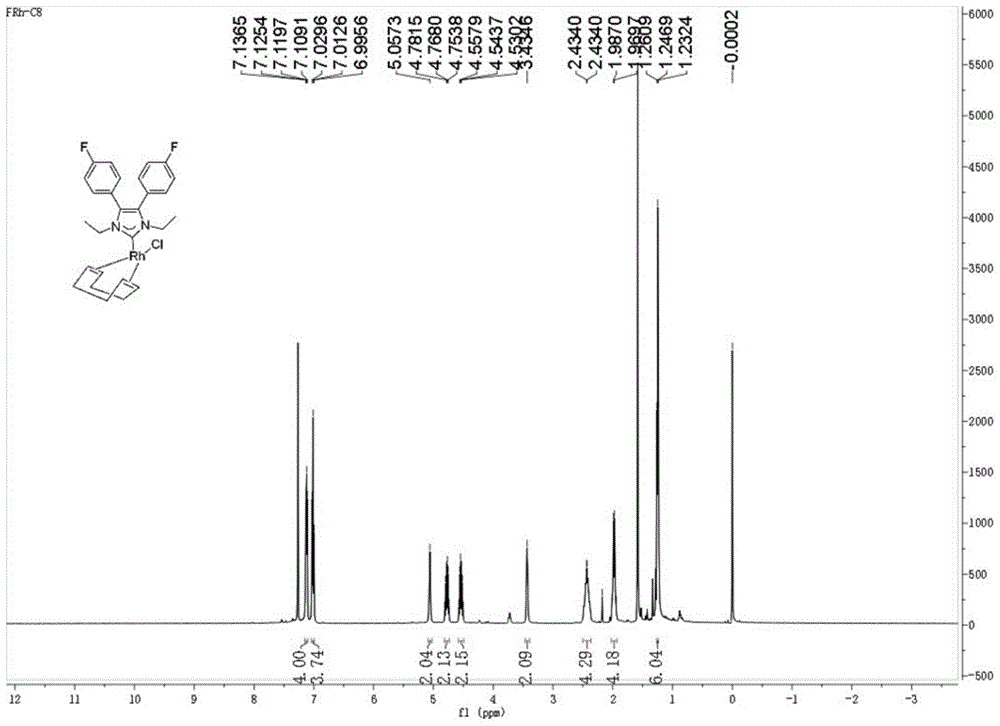
a)核磁共振氢谱如图1所示
1hnmr(500mhz,cdcl3,20℃):δ7.12(dd,j=8.3,5.4hz,4h),7.01(dd,j=8.3hz,5.4hz,4h),5.05(s,2h),4.77(m,2h),4.54(m,2h),3.43(s,2h),2.50–2.36(m,4h),2.02–1.93(m,4h),1.25(t,j=7.2hz,6h).
b)核磁共振碳谱如图2所示
13cnmr(126mhz,cdcl3,20℃):δ182.46,163.71,161.73,132.06,131.99,130.78,124.79,124.76,115.97,115.80,98.41,98.36,68.45,68.33,44.21,32.94,28.81,16.12.
c)电喷雾质谱如图3所示
esi-ms(+)[m/z]:523.1[m-cl-]+。
d)本实施例最终产物的元素分析结果
分子式:c27h30clf2n2rh
元素分析理论值(%):c,58.02;h,5.41;n,5.01;
元素分析实验值(%):c,57.90;h,5.43;n,5.03.
e)化合物的x-单晶结构鉴定如图4所示
实施例2
n1,n3-二乙基-4,5-二(4’-甲氧基苯基)咪唑环卡宾铑配合物(ii)rh2的合成:
(1)对二甲氧基苯偶姻(5.0g)溶于甲酰胺(30ml)中,210~220℃回流2~3h,冷却,反应液温度降到100℃以下,缓慢加入100ml的纯水,边加边搅拌,过滤析出的固体,少量乙醚洗涤(5ml×3),干燥,得4,5-二(4’-甲氧基苯基)咪唑,白色固体,产率为70%。
(2)4,5-二(4’-甲氧基苯基)咪唑(2.0g)溶于无水四氢呋喃(25ml)中,加入氢化钠(342mg,60%),搅拌约10min,加入溴乙烷(643μl),氮气保护下加热回流2~3h,反应结束后,旋干,硅胶柱分离纯化得到n1-乙基-4,5-二(4’-甲氧基苯基)咪唑,白色固体,产率为85%。n1-乙基-4,5-二(4’-甲氧基苯基)咪唑结构确认数据为:1hnmr(400mhz,dmso,20℃):δ7.77(s,1h),7.30(dd,j=16.9,8.7hz,4h),7.06(d,j=8.7hz,2h),6.77(d,j=8.8hz,2h),3.82(s,3h),3.80–3.74(m,2h),3.69(s,3h),1.13(t,j=7.2hz,3h).
(3)n1-乙基-4,5-二(4’-甲氧基苯基)咪唑(1.5g)与溴乙烷(1.83ml)溶于乙腈(20ml)中,加热回流反应3天,反应结束后,旋干,得粗产物,经硅胶柱纯化得n1,n3-二乙基-4,5-二(4’-甲氧基苯基)咪唑溴化物,白色固体,产率75%。n1,n3-二乙基-4,5-二(4’-甲氧基苯基)咪唑溴化物结构确认数据为:1hnmr(500mhz,cdcl3,20℃):δ10.76(s,1h),7.15(d,j=8.7hz,4h),6.92(d,j=8.6hz,4h),4.30(q,j=7.3hz,4h),3.82(s,6h),1.48(t,j=7.3hz,6h).13cnmr(126mhz,cdcl3,20℃):δ160.91,136.28,131.75,131.46,116.92,114.77,55.38,43.24,15.89.
(4)n1,n3-二乙基-4,5-二(4’-甲氧基苯基)咪唑溴化物(104mg),氧化银(35mg),溶于无水二氯甲烷(15ml)中,避光,氮气保护,室温下搅拌,反应过夜,向反应混合物中加入1,5-环辛二烯氯化铑二聚体(62mg),相同条件下继续反应6h,反应结束后,反应液经硅藻土过滤,滤液旋干,得粗产品,经硅胶柱分离纯化得到配合物rh2,黄色固体,产率为40%。
对所得n1,n3-二乙基-4,5-二(4’-甲氧基苯基)咪唑环卡宾铑配合物(ii)rh2进行结构鉴定:
a)核磁共振氢谱如图5所示
1hnmr(500mhz,cdcl3,20℃):δ7.05(d,j=8.7hz,4h),6.80(d,j=8.7hz,4h),5.02(s,2h),4.73(m,2h),4.50(m,2h),3.76(s,6h),3.42(s,2h),2.41(m,4h),1.95(m,4h),1.22(t,j=7.1hz,6h).
b)核磁共振碳谱如图6所示
13cnmr(126mhz,cdcl3,20℃):δ180.92,159.49,131.51,131.15,121.27,113.95,97.99,97.94,68.33,68.21,55.19,44.08,32.95,28.91,16.24.
c)电喷雾质谱如图7所示
esi-ms(+)[m/z]:547.2[m-cl-]+.
d)本实施例最终产物的元素分析结果
分子式:c29h36cln2o2rh
元素分析理论值(%):c,59.75;h,6.22;n,4.81;
元素分析实验值(%):c,59.70;h,6.15;n,5.03.
实施例3
n1,n3-二乙基-4,5-二(4’-溴苯基)咪唑环卡宾铑配合物(ii)rh3的合成:
(1)对二溴苯偶姻(5.0g)溶于甲酰胺(30ml)中,210~220℃回流2~3h,冷却,反应液温度降到100℃以下,缓慢加入100ml的纯水,边加边搅拌,过滤析出的固体,少量乙醚洗涤(5ml×3),干燥,得4,5-二(4’-溴苯基)咪唑,白色固体,产率为65%。
(2)4,5-二(4’-溴苯基)咪唑(2.5g)溶于无水四氢呋喃(25ml)中,加入氢化钠(317mg,60%),搅拌约10min,加入溴乙烷(596μl),氮气保护下加热回流2~3h,反应结束后,旋干,硅胶柱分离纯化得到n1-乙基-4,5-二(4’-溴苯基)咪唑,白色固体,产率为82%。
(3)n1-乙基-4,5-二(4’-溴苯基)咪唑(1.8g)与溴乙烷(1.66ml)溶于乙腈(20ml)中,加热回流反应3天,反应结束后,旋干,得粗产物,经硅胶柱纯化得n1,n3-二乙基-4,5-二(4’-溴苯基)咪唑溴化物,白色固体,产率73%。n1,n3-二乙基-4,5-二(4’-溴苯基)咪唑溴化物结构确认数据为:1hnmr(500mhz,cdcl3,20℃):δ10.94(s,1h),7.58(d,j=8.4hz,4h),7.14(d,j=8.4hz,4h),4.33(q,j=7.3hz,4h),1.51(t,j=7.3hz,6h).13cnmr(126mhz,cdcl3,20℃):δ137.44,132.88,131.81,130.90,123.53,125.52,43.62,15.82.esi-ms(+)[m/z]:435.0[m-br]+
(4)n1,n3-二乙基-4,5-二(4’-溴苯基)咪唑溴化物(129mg),氧化银(35mg),溶于无水二氯甲烷(15ml)中,避光,氮气保护,室温下搅拌,反应过夜,向反应混合物中加入1,5-环辛二烯氯化铑二聚体(62mg),相同条件下继续反应6h,反应结束后,反应液经硅藻土过滤,滤液旋干,得粗产品,经硅胶柱分离纯化得到配合物rh3,黄色固体,产率为38%。
对所得n1,n3-二乙基-4,5-二(4’-溴苯基)咪唑环卡宾铑配合物(ii)rh3进行了核磁共振氢谱,核磁共振碳谱,电喷雾质谱和元素分析等方法的结构表征。
a)核磁共振氢谱
1hnmr(500mhz,cdcl3,20℃):δ7.46(d,j=8.2hz,4h),7.01(d,j=8.2hz,4h),5.06(s,2h),4.78(dq,j=14.2,7.1hz,2h),4.56(dq,j=14.0,7.0hz,2h),3.43(s,2h),2.44(m,4h),1.98(m,4h),1.25(t,j=7.1hz,6h).
b)核磁共振碳谱
13cnmr(126mhz,cdcl3,20℃):δ182.96,132.05,131.60,130.70,127.57,123.22,98.55,98.50,68.48,68.37,44.29,32.93,28.87,16.22.
c)电喷雾质谱
esi-ms(+)[m/z]:701.7[m-h+na]+,645.1[m-cl-]+.
d)本实施例最终产物的元素分析结果
分子式:c27h30br2cln2rh
元素分析理论值(%):c,47.64;h,4.44;n,4.12;
元素分析实验值(%):c,47.69;h,4.42;n,4.17.
实施例4
n1,n3-二乙基-4,5-二联苯咪唑环卡宾铑配合物(ii)rh4的合成:
(1)、(2)同实施例3中的步骤(1)、(2)。
(3)n1-乙基-4,5-二(4’-溴苯基)咪唑(0.8g),苯硼酸(576mg),碳酸钾(2.18g),pd(pph3)4(2.28g)溶于乙醇/水/丙酮体积比为3/2/3的混合溶液中(25ml)中,加热回流48h,反应结束后,用旋转蒸发仪浓缩样品,浓缩液二氯甲烷萃取,有机层用无水硫酸钠干燥,旋干,通过硅胶柱层析分离纯化得n1-乙基-4,5-二联苯咪唑,白色固体,产率为56%。n1-乙基-4,5-二联苯咪唑结构确认数据为:1hnmr(500mhz,cdcl3,20℃):δ7.77–7.71(m,4h),7.70(s,1h),7.64–7.58(m,4h),7.54–7.45(m,6h),7.42(m,3h),7.31(t,j=7.4hz,1h),3.93(q,j=7.3hz,2h),1.36(t,j=7.3hz,3h).
(4)n1-乙基-4,5-二联苯咪唑(430mg),溴乙烷(403μl)乙腈(20ml)中,加热回流反应3天,反应结束后,旋干,得粗产物,经硅胶柱纯化得n1,n3-二乙基-4,5-二联苯咪唑溴化物,白色固体,产率68%。n1,n3-二乙基-4,5-二联苯咪唑溴化物结构确认数据为:1hnmr(500mhz,cdcl3,20℃):δ10.96(s,1h),7.66(d,j=8.2hz,4h),7.58(d,j=7.3hz,4h),7.46(t,j=7.6hz,4h),7.41–7.33(m,6h),4.41(q,j=7.3hz,4h),1.56(t,j=7.3hz,6h).13cnmr(126mhz,cdcl3,20℃):δ143.23,139.31,137.06,131.54,130.76,129.02,128.26,127.95,127.06,123.64,45.52,15.99.esi-ms(+)[m/z]:429.2[m-br]+.
(5)n1,n3-二乙基-4,5-二联苯咪唑溴化物(127mg),氧化银(35mg),溶于无水二氯甲烷(15ml)中,避光,氮气保护,室温下搅拌,反应过夜,向反应混合物中加入1,5-环辛二烯氯化铑二聚体(62mg),相同条件下继续反应6h,反应结束后,反应液经硅藻土过滤,滤液旋干,得粗产品,经硅胶柱分离纯化得到配合物rh4,黄色固体,产率为31%。
对所得n1,n3-二乙基-4,5-二联苯咪唑环卡宾铑配合物(ii)rh4进行了核磁共振氢谱,核磁共振碳谱,电喷雾质谱和元素分析等方法的结构表征。
a)核磁共振氢谱
1hnmr(500mhz,cdcl3,20℃):δ7.56(dd,j=11.7,8.1hz,8h),7.42(t,j=7.6hz,4h),7.35(d,j=7.4hz,2h),7.26(d,j=7.7hz,4h),5.07(s,2h),4.86(m,2h),4.64(m,2h),3.49(s,2h),2.54–2.36(m,4h),1.99(m,4h),1.31(t,j=7.2hz,6h).
b)核磁共振碳谱
13cnmr(126mhz,cdcl3,20℃):δ181.85,141.10,140.00,131.39,130.57,128.84,127.85,127.69,127.19,126.97,98.39,98.24,68.47,68.36,44.30,32.97,28.92,16.33.
c)电喷雾质谱
esi-ms(+)[m/z]:639.42[m-cl-]+.
d)本实施例最终产物的元素分析结果
分子式:c39h40cln2rh
元素分析理论值(%):c,69.38;h,5.97;n,4.15;
元素分析实验值(%):c,69.15;h,5.97;n,4.22.
实施例5
n1-乙基,n3-(9’-蒽甲基)-4,5-二(4’-氟苯基)咪唑环卡宾铑配合物(ii)rh5的合成:
(1)、(2)、(3)同实施例1中的步骤(1)、(2)、(3)。
(4)n1-乙基-4,5-二(4’-氟苯基)咪唑(1.0g)与9-氯甲基蒽(2.39g)溶于乙腈(25ml)中,加热回流反应3天,反应结束后,旋干,得粗产物,经硅胶柱纯化得n1-乙基,n3-(9’-蒽甲基)-4,5-二(4’-氟苯基)咪唑氯化物,白色固体,产率67%。n1-乙基,n3-(9’-蒽甲基)-4,5-二(4’-氟苯基)咪唑氯化物结构确认数据为:1hnmr(500mhz,dmso-d6,20℃):δ8.87(s,1h),8.70(s,1h),8.23(d,j=8.2hz,2h),8.19(d,j=8.7hz,2h),7.72(dd,j=8.6,5.4hz,2h),7.64(m,4h),7.54(dd,j=8.6,5.4hz,2h),7.34(dd,j=17.7,2.2hz,4h),6.16(s,2h),3.97(q,j=7.1hz,2h),0.99(t,j=7.2hz,3h).13cnmr(126mhz,cdcl3,20℃):δ164.63,164.51,162.63,162.50,136.16,133.06,132.99,132.72,132.65,132.13,131.31,131.19,130.84,130.32,129.29,127.98,125.41,123.20,122.83,120.85,120.82,120.70,120.67,116.58,116.40,116.08,115.91,45.49,43.56,15.39.esi-ms(+)[m/z]:475.2[m-cl]+.
(5)n1-乙基,n3-(9’-蒽甲基)-4,5-二(4’-氟苯基)咪唑氯化物(128mg),氧化银(35mg),溶于无水二氯甲烷(15ml)中,避光,氮气保护,室温下搅拌,反应过夜,向反应混合物中加入1,5-环辛二烯氯化铑二聚体(62mg),相同条件下继续反应6h,反应结束后,反应液经硅藻土过滤,滤液旋干,得粗产品,经硅胶柱分离纯化得到配合物rh5,黄色固体,产率为63%。
对所得n1-乙基,n3-(9’-蒽甲基)-4,5-二(4’-氟苯基)咪唑环卡宾铑配合物(ii)rh5进行了核磁共振氢谱,核磁共振碳谱,电喷雾质谱和元素分析等方法的结构表征。
a)核磁共振氢谱
1hnmr(500mhz,cdcl3,20℃):δ8.36(d,j=8.9hz,2h),8.24(s,1h),7.86(d,j=8.4hz,2h),7.52–7.46(m,2h),7.43–7.37(m,2h),7.32(d,j=15.2hz,1h,),6.94(dd,j=8.6,5.4hz,2h),6.85(t,j=8.6hz,2h),6.53(d,j=15.1hz,1h),6.03–5.95(m,2h),5.93(t,j=8.7hz,2h),5.21–5.10(m,2h),4.86–4.74(m,2h),3.69(s,2h),2.63–2.54(m,1h),2.44–2.31(m,3h),2.14–2.07(m,1h),2.04–1.90(m,3h),1.31(t,j=7.2hz,3h).
b)核磁共振碳谱
13cnmr(126mhz,cdcl3,20℃):δ183.11,182.70,163.54,162.45,161.56,160.48,131.97,131.90,131.84,131.24,131.21,131.17,131.07,130.82,128.77,128.65,126.53,126.03,124.89,124.60,124.50,124.47,123.68,123.66,115.61,115.44,113.67,113.50,99.09,99.03,98.51,98.46,69.55,69.44,67.95,67.88,48.46,44.53,33.59,32.44,29.32,28.31,16.25.
c)电喷雾质谱
esi-ms(+)[m/z]:743.14[m+na]+.
d)本实施例最终产物的元素分析结果
分子式为:c40h36clf2n2rh
元素分析理论值(%):c,66.63;h,5.03;n,3.88;
元素分析实验值(%):c,66.56;h,4.99;n,4.15.
实施例6
n1-乙基,n3-(环丙基甲基)-4,5-二(4’-氟苯基)咪唑环卡宾铑配合物(ii)rh6的合成:
(1)、(2)、(3)同实施例1中的步骤(1)、(2)、(3)。
(4)n1-乙基-4,5-二(4’-氟苯基)咪唑(1.0g)与环丙基甲基溴(1.72ml)溶于乙腈(25ml)中,加热回流反应3天,反应结束后,旋干,得粗产物,经硅胶柱纯化得n1-乙基,n3-(环丙基甲基)-4,5-二(4’-氟苯基)咪唑溴化物,白色固体,产率72%。n1-乙基,n3-(环丙基甲基)-4,5-二(4’-氟苯基)咪唑溴化物结构确认数据为:1hnmr(500mhz,cdcl3,20℃):δ10.85(s,1h),7.32–7.26(m,4h),7.15(m,4h),4.37(q,j=7.3hz,2h),4.11(d,j=7.4hz,2h),2.19(s,1h),1.52(t,j=7.3hz,3h),0.71(q,j=5.7hz,2h),0.50(q,j=5.1hz,2h).13cnmr(126mhz,cdcl3,20℃):δ164.71,162.70,136.80,132.83,132.76,132.68,132.61,131.07,130.98,121.01,120.98,120.89,120.86,116.87,116.85,116.69,116.67,52.77,43.55,15.83,11.10,4.89.esi-ms(+)[m/z]:339.1[m-br]+.
(5)n1-乙基,n3-(环丙基甲基)-4,5-二(4’-氟苯基)咪唑溴化物(105mg),氧化银(35mg),溶于无水二氯甲烷(15ml)中,避光,氮气保护,室温下搅拌,反应过夜,向反应混合物中加入1,5-环辛二烯氯化铑二聚体(62mg),相同条件下继续反应6h,反应结束后,反应液经硅藻土过滤,滤液旋干,得粗产品,经硅胶柱分离纯化得到配合物rh6,黄色固体,产率为40%。
对所得n1-乙基,n3-(环丙基甲基)-4,5-二(4’-氟苯基)咪唑环卡宾铑配合物(ii)rh6进行了核磁共振氢谱,核磁共振碳谱,电喷雾质谱和元素分析等方法的结构表征。
a)核磁共振氢谱
1hnmr(500mhz,cdcl3,20℃):δ7.19–7.11(m,4h),7.08–6.97(m,4h),5.10(d,j=6.9hz,1h),5.05(dd,j=12.6,7.8hz,1h),4.79–4.70(m,2h),4.66(td,j=14.2,7.1hz,1h),4.32(dd,j=14.0,7.1hz,1h),3.48(t,j=7.2hz,1h),3.41(s,1h),2.53–2.36(m,4h),2.06–1.92(m,4h),1.27(t,j=7.2hz,3h),1.14(m,1h),0.38(m,2h,),0.25–0.18(m,1h),-0.16(m,1h).
b)核磁共振碳谱
13cnmr(126mhz,cdcl3,20℃):δ182.68,182.67,163.72,161.73,132.31,132.25,132.14,132.07,131.05,130.79,125.34,125.31,124.86,124.83,115.95,115.88,115.77,115.70,98.49,98.44,98.28,98.22,68.78,68.66,68.25,68.14,53.86,44.29,33.23,32.61,29.24,28.58,16.15,11.61,5.01,4.33.
c)电喷雾质谱
esi-ms(+)[m/z]:549.2[m-cl-]+.
d)本实施例最终产物的元素分析结果
分子式为:c29h32clf2n2rh
元素分析理论值(%):c,59.55;h,5.51;n,4.79;
元素分析实验值(%):c,59.49;h,5.56;n,4.98.
实施例7
n1-乙基,n3-苄基-4,5-二(4’-氟苯基)咪唑环卡宾铑配合物(ii)rh7的合成:
(1)、(2)、(3)同实施例1中的步骤(1)、(2)、(3)。
(4)n1-乙基-4,5-二(4’-氟苯基)咪唑(0.8g)与苄基氯(1.62ml)溶于乙腈(25ml)中,加热回流反应3天,反应结束后,旋干,得粗产物,经硅胶柱纯化得n1-乙基,n3-苄基-4,5-二(4’-氟苯基)咪唑氯化物,白色固体,产率63%。n1-乙基,n3-苄基-4,5-二(4’-氟苯基)咪唑氯化物结构确认数据为:1hnmr(500mhz,dmso,20℃):δ9.78(s,1h),7.55–7.51(m,2h),7.32(ddd,j=7.0,5.8,3.0hz,7h),7.23(t,j=8.8hz,2h),7.09(dd,j=6.6,2.8hz,2h),5.42(s,2h),4.14(q,j=7.2hz,2h),1.33(t,j=7.3hz,3h).
(5)n1-乙基,n3-苄基-4,5-二(4’-氟苯基)咪唑溴化物(103mg),氧化银(35mg),溶于无水二氯甲烷(15ml)中,避光,氮气保护,室温下搅拌,反应过夜,向反应混合物中加入1,5-环辛二烯氯化铑二聚体(62mg),相同条件下继续反应6h,反应结束后,反应液经硅藻土过滤,滤液旋干,得粗产品,经硅胶柱分离纯化得到配合物rh7,黄色固体,产率为62%。
对所得n1-乙基,n3-苄基-4,5-二(4’-氟苯基)咪唑环卡宾铑配合物(ii)rh7进行了核磁共振氢谱,核磁共振碳谱,电喷雾质谱和元素分析等方法的结构表征。
a)核磁共振氢谱
1hnmr(500mhz,cdcl3,20℃):δ7.19–7.12(m,5h),7.07–6.99(m,4h),6.86–6.78(m,4h),6.11(d,j=15.3hz,1h),5.73(d,j=15.3hz,1h),5.09(p,j=8.1hz,2h),4.81(dq,j=14.3,7.2hz,1h),4.70(dq,j=14.3,7.2hz,1h),3.54(m,1h),3.33(m,1h),2.56–2.46(m,1h),2.43–2.33(m,2h),2.17(m,1h),2.06–1.90(m,3h),1.83(m,1h),1.31(t,j=7.2hz,3h).
b)核磁共振碳谱
13cnmr(126mhz,cdcl3,20℃):δ183.62,183.21,163.74,163.58,161.75,161.60,136.94,132.32,132.26,132.04,131.97,131.47,131.21,128.27,127.47,127.28,124.63,124.60,124.55,124.53,115.96,115.78,115.45,115.28,98.94,98.88,98.39,98.33,68.92,68.81,68.61,68.49,53.25,44.31,33.34,32.40,29.15,28.46,16.19.
c)电喷雾质谱
esi-ms(+)[m/z]:585.1[m-cl-]+.
d)本实施例最终产物的元素分析结果
分子式为:c32h32clf2n2rh
元素分析理论值(%):c,61.89;h,5.19;n,4.51;
元素分析实验值(%):c,61.78;h,5.28;n,4.67.
实施例8
n1-乙基,n3-(1’-萘甲基)-4,5-二(4’-氟苯基)咪唑环卡宾铑配合物(ii)rh8的合成:
(1)、(2)、(3)同实施例1中的步骤(1)、(2)、(3)。
(4)n1-乙基-4,5-二(4’-氟苯基)咪唑(0.8g)与1-氯甲基萘(2.13ml)溶于乙腈(25ml)中,加热回流反应3天,反应结束后,旋干,得粗产物,经硅胶柱纯化得n1-乙基,n3-(1’-萘甲基)-4,5-二(4’-氟苯基)咪唑氯化物,白色固体,产率38%。n1-乙基,n3-(1’-萘甲基)-4,5-二(4’-氟苯基)咪唑氯化物结构确认数据如下:1hnmr(500mhz,dmso-d6,20℃):δ9.82(s,1h),8.02–7.98(m,1h),7.95(d,j=8.5hz,2h),7.62–7.55(m,4h),7.47(t,j=7.7hz,1h),7.42(dd,j=8.5,5.4hz,2h),7.34(d,j=8.8hz,2h),7.19(dd,j=16.9,8.0hz,3h),5.93(s,2h),4.16(q,j=7.2hz,2h),1.31(t,j=7.2hz,3h).13cnmr(126mhz,dmso-d6,20℃):δ164.41,164.30,162.44,162.33,136.76,133.88,133.81,133.74,133.67,133.60,130.36,130.15,129.59,129.22,127.42,126.79,126.58,125.89,123.15,122.01,121.98,121.85,121.82,116.74,116.57,116.40,48.76,131.55,131.48,43.37,15.22.esi-ms(+)[m/z]:425.1[m-cl]+.
(5)n1-乙基,n3-(1’-萘甲基)-4,5-二(4’-氟苯基)咪唑溴化物(115mg),氧化银(35mg),溶于无水二氯甲烷(15ml)中,避光,氮气保护,室温下搅拌,反应过夜,向反应混合物中加入1,5-环辛二烯氯化铑二聚体(62mg),相同条件下继续反应6h,反应结束后,反应液经硅藻土过滤,滤液旋干,得粗产品,经硅胶柱分离纯化得到配合物rh8,黄色固体,产率为30%。
对所得n1-乙基,n3-(1’-萘甲基)-4,5-二(4’-氟苯基)咪唑环卡宾铑配合物(ii)rh8进行结构鉴定:
a)核磁共振氢谱
1hnmr(500mhz,cdcl3,20℃):δ8.12(d,j=8.3hz,1h),7.85(d,j=7.9hz,1h),7.73(d,j=8.2hz,1h),7.58(t,j=7.2hz,1h),7.53(t,j=7.2hz,1h),7.32(t,j=7.7hz,1h),7.22(dd,j=8.6,5.3hz,2h),7.05(t,j=8.6hz,2h),6.97(dd,j=5.3hz,2h),6.93(d,1h),6.86(d,j=16.5hz,1h),6.71(t,j=8.6hz,2h),6.00(d,j=16.5hz,1h),4.99(p,j=8.1hz,2h),4.90(dq,j=14.3,7.2hz,1h),4.65(dq,j=14.1,7.1hz,1h),3.54(t,j=6.9hz,1h),3.12(s,1h),2.54–2.44(m,1h),2.29(m,1h),2.00–1.87(m,2h),1.78(m,2h),1.51–1.39(m,2h),1.35(t,j=7.2hz,3h).
b)核磁共振碳谱
13cnmr(126mhz,cdcl3,20℃):δ184.44,184.03,163.76,163.45,161.77,161.47,133.45,133.25,132.10,132.04,131.11,130.28,128.67,124.74,127.82,126.49,125.01,125.95,124.71,124.19,124.16,124.05,122.60,116.04,115.87,115.57,115.39,99.08,99.03,97.78,97.72,69.13,69.01,68.59,68.47,49.93,44.40,33.55,31.84,28.85,28.16,16.32.
c)电喷雾质谱
esi-ms(+)[m/z]:635.2[m-cl-]+.
d)本实施例最终产物的元素分析结果
分子式为:c36h34clf2n2rh
元素分析理论值(%):c,64.44;h,5.11;n,4.17;
元素分析实验值(%):c,63.94;h,5.07;n,4.37.
实施例9
本发明所合成的铑配合物(ii)rh1在还原型谷胱甘肽(gsh)、n-乙酰半胱氨酸(nac)及水溶液中的稳定性实验
用1350μl氘代乙腈将8.37mg本发明所合成的铑配合物rh1溶解,分别用50μl重水将两倍当量的gsh,nac溶解,取450μlrh1溶液与50μl的gsh溶液混合,记录其不同时间点的核磁共振氢谱;取450μlrh1溶液与50μl的nac溶液混合,记录其不同时间点的核磁共振氢谱;取450μlrh1溶液与50μl的重水混合,记录其不同时间点的核磁共振氢谱,其结果如图8所示,随时间的推移,本发明所合成的铑配合物在含gsh和nac的环境中,其核磁共振氢谱发生了变化,出现了一系列的新信号峰,如在gsh中8.68ppm,7.40ppm,7.22ppm,4.07ppm新信号峰代表nhc配体释放,5.53ppm新信号峰在nac中同样出现,属于铑配合物与巯基形成的复合物的信号峰,而在含重水的溶液中,其核磁共振氢谱在96h后仍未出现明显改变,表明本发明所合成的铑配合物能与gsh及nac等含巯基的化合物反应,而在水溶液中比较稳定。
实施例10
本发明所合成的铑配合物(ii)rh1~rh8的抗肿瘤细胞增殖活性(mtt)实验
对本发明所述铑配合物(ii)rh1~rh8在乳腺癌细胞(mcf-7)、结肠癌细胞(ht-29)和肝癌细胞(hepg2)中进行了体外细胞毒性实验,在96孔细胞培养板中接种细胞(1000个/孔),37℃,5%co2条件培养过夜,加入不同浓度的用dmf溶解的铑配合物或顺铂,dmf作空白对照,继续培养72h,每孔加入0.5%的mtt试液孵育4h,小心弃去培养液,每孔加入200μldmso溶解沉淀,注意避光,在摇床上低速振摇10min,用酶标仪在490nm处测量每孔的吸收值。配合物rh1~rh8的化学结构如图9所示,其体外细胞毒性结果见表1。
表1.配合物rh1~rh8和顺铂对mcf-7,ht-29和hepg2细胞的细胞毒性结果(ic50为平均值±标准差)
结果显示,本发明的铑配合物(ii)对多种人体不同组织部位的癌细胞都具有很好的抑制杀伤作用:rh1对肝癌细胞hepg2的细胞增殖抑制最强,其中更优于对照组药物顺铂;rh6和rh8对乳腺癌细胞mcf-7的细胞增殖抑制活性优于对照组药物顺铂;rh1,rh3,rh4,rh6,rh7和rh8对结肠癌细胞ht-29的细胞增殖抑制活性优于对照组药物顺铂,尤其以rh4的细胞增殖抑制活性最强。可见,本发明所合成的铑配合物(ii)是一类潜在的高效抗癌药物。
从表1中可以看出,rh1~rh8对hepg2细胞较为敏感,随后本发明选取了另外两种肝癌细胞(hep3b和smmc-7721细胞)和肝正常细胞(lo2细胞)测试了rh1的细胞毒性,评估了rh1处理后的正常肝细胞(lo2)中的谷丙转氨酶(alt)和乳酸脱氢酶(ldh)的释放水平,其实验结果如图10所示,其具体实施步骤为:
a)hep3b和smmc-7721及lo2细胞毒性(mtt)实验步骤同rh1-rh8的mtt实验。
b)不同浓度rh1处理lo2细胞24h后,培养基中alt水平严格按照人谷丙转氨酶(alt)elisa试剂盒(ek-h10789,ek-bioscience)的操作流程进行测定。
c)不同浓度rh1处理lo2细胞24h后,培养基中ldh水平严格按照乳酸脱氢酶细胞毒性检测试剂盒(c0016ru,碧云天)的操作流程进行测定。
从实验结果可以看出,以rh1为例,本发明合成的铑配合物(ii)对hep3b、hepg2、smmc-7721三种肝癌细胞均具有良好的抗肿瘤作用(ic50值:hep3b约为1.78μm,hepg2约为1.33μm,smmc-7721约为4.01μm),对肝正常细胞(lo2细胞)的选择性不高(ic50约为2.18μm)。并且在lo2细胞的alt和ldh释放实验中,1.5μm和3.0μm剂量的rh1对lo2细胞中alt和ldh释放水平的影响较正常对照组无明显差异,表明了rh1在该剂量下对肝损伤较小,具有进一步研究的价值。
实施例11
本发明所合成的铑配合物(ii)rh1抑制硫氧还蛋白还原酶(trxr)活性的实验
a)细胞trxr活性的测定
当hepg2细胞生长至70~80%的丰度时,用不同浓度的rh1处理并孵育48小时和72小时。小心地弃去培养基,用磷酸盐缓冲液(pbs)洗涤两次。在冰浴上通过ripa缓冲液(150mmnacl,50mmtris-hcl,ph7.5,0.5%脱氧胆酸盐,2mmedta,0.1%sds,1%tritonx-100,1mmpmsf和1mmna3vo4)处理提取总细胞蛋白。使用bradford程序量化。根据trxr活性检测试剂盒测定细胞中trxr的活性,其结果如图11a所示。
b)westernblot检测细胞内trxr的表达水平
将hepg2细胞(1×106)接种到直径为10cm的组织培养皿(10ml/孔)中,在37℃,5%co2的潮湿环境中培养24小时,然后用rh1处理24小时,小心弃去培养基,用冷pbs洗涤三次。在冰浴中用ripa缓冲液裂解,然后离心,收集上清液并通过dcproteinassay(bio-rad)定量。通过12.5%sds-page凝胶分离样品(15~45μg/泳道),tris-甘氨酸作为涌动液。分离结束后,将蛋白质印迹到pvdf膜上,室温下,在含有5%bsa的tbst(20mmtris-hcl,ph=7.6,0.1%v/vtween-20)中封闭过夜。将印迹与tbst在环境温度下孵育1小时,其含有一抗和5%bsa。用tbst洗涤三次,然后与相应的二抗孵育2小时。通过化学发光程序(ecl,amersham)检测蛋白质条带,其结果如图11b所示。
c)实时定量pcr分析细胞内trxrmrna的表达水平
总rna的提取:将细胞用pbs洗2次,加入1mlrnaisoreagent试剂充分裂解细胞,将细胞裂解液收集到depc水处理过的离心管里,加200μl氯仿,混匀后4℃、12000r·min-1离心15min,小心吸取上清液并加入等体积的冷异丙醇,混匀后在冰上静置15min,4℃12000r·min-1离心15min,弃上清液,用灭菌的depc水配制的75%乙醇溶液纯化总rna沉淀,再次4℃12000r·min-1离心15min,弃上清,将提取的rna于-80℃保存。用紫外分光光度计测定260nm、280nm和320nm处的吸光度值,计算总rna的浓度及纯度。
逆转录:使用takaraprimescripttmreagentkit将提取的总rna反转录为cdna,10μl的反应体系使用500ng的totalrna,反转录体系如下:
rt-pcr检测:用7500rt-pcr体系检测,两步法pcr扩增,95℃预变性30s;95℃反应5s,60℃退火30s,40个循环。引物如下:
β-actin:(forward)5′-tgtggatcagcaagcaggagta-3′(seqidno.1)(reverse)5′-tgcgcaagttaggttttgtca-3′(seqidno.2)
trxr:(forward)5′-gccctgcaagactctcgaaatta-3′(seqidno.3)(reverse)5′-gcccataagcattctcatagacga-3′(seqidno.4)
rh1的对细胞内trxrmrna的表达水平影响如图11c所示。
d)荧光免疫法检测细胞内trxr活性
用4’,6-二脒基-2-苯基吲哚(dapi)染色hepg2细胞的细胞核。将hepg2细胞接种在24孔板中并培养24小时,然后用rh1(1.5μm,3μm和6μm)处理24小时。在4℃下将hepg2细胞与抗体一起孵育过夜,然后在环境温度下用抗小鼠或抗兔igg处理2小时,然后用pbs洗涤hepg2细胞三次。用荧光显微镜(leicadmi8)检测免疫荧光。
e)体外trxr酶活性的测定
将dmf或不同浓度的rh1和大鼠肝脏trxr溶解于50μl反应缓冲液中,向每个孔中加入200μl反应混合物和25μl20mm的nadph溶液,25μl20mm的dtnb溶液开始反应。混匀,前六分钟每隔10s用酶标仪在405nm处记录其吸收数据。分析dtnb浓度随时间的增加遵循线性趋势(r2≥0.99),酶活性计算为其斜率(增加的每秒吸光度)。
rh1的trxr抑制活性结果如图11d和图12所示。
上述结果表明,从细胞水平上看,本发明的铑配合物(ii)能抑制hepg2细胞内trxr的活性;从转录水平上看,本发明的铑配合物(ii)能抑制hepg2细胞中trxr的转录;从蛋白水平上看,本发明的铑配合物(ii)能降低hepg2细胞中trxr蛋白的表达水平;在荧光免疫法实验中,随铑配合物(ii)浓度的增加,trxr的荧光强度呈下降趋势;从trxr酶活性水平上看,本发明的铑配合物(ii)能在体外抑制trxr酶的活性。综上所述,本发明所合成的铑配合物(ii)确实能抑制trxr的活性。
实施例12
本发明所合成铑配合物(ii)在细胞中的分布研究
选取本发明所合成的具有荧光特性的rh5,与mito-tracke活细胞线粒体红色染料共孵育,用荧光显微镜记录不同波长下细胞中染色的情况,分析rh5在hepg2细胞中的分布。具体步骤为:将hepg2细胞接种在24孔板细胞爬片上,用含10%胎牛血清的dmem培养基培养,直至细胞密度达到60%。然后,将它们与10μm的rh5在37℃,5%co2的环境中孵育24小时。随后小心吸出培养基,用pbs(1×)洗涤三次,用200nm的
实施例13
本发明所合成的铑配合物(ii)用于处理hepg2细胞后,对活性氧(ros)的影响
a)荧光探针检测rh1处理对hepg2细胞中ros的影响
荧光dcfh-da本身没有荧光,可以自由穿过细胞膜。进入细胞内后,可以被细胞内的酯酶水解生成dcfh,而dcfh不会通透细胞膜,因此探针很容易被积聚在细胞内。细胞内的活性氧能够氧化无荧光的dcfh生成有绿色荧光的dcf。绿色荧光强度与活性氧的水平成正比。将细胞种于12孔板中,细胞完全贴壁后,加入不同浓度的rh1处理24h,弃去培养基,用无血清的培养基配置10μm的dcfh-da加至每孔中,然后在37℃下孵育30min,最后用荧光显微镜成像,其结果如图14所示,随本发明铑配合物浓度的增加,明亮的绿色荧光点也增加,表明本发明的铑配合物(ii)能促进hepg2肝癌细胞中ros的积累。
b)本发明所合成的铑配合物(ii)处理hepg2细胞时,加入n-乙酰半胱氨酸(nac,ros清除剂)后,对hepg2细胞活性的影响
用不同浓度的nac和rh1共同处理hepg2细胞,孵育48h后,用mtt法测试hepg2细胞的细胞活性,其结果如图15所示。用rh1处理能显著降低hepg2细胞的活力,其抑制作用可在1mm~4mm的nac处理后部分或完全消除。
综上可见,本发明合成的铑配合物(ii)可以激活ros诱导的hepg2细胞凋亡。
实施例14
本发明所合成的铑配合物(ii)对线粒体的影响
因实施例12中表明本发明所合成的铑配合物(ii)主要分布于线粒体,故研究了本发明所合成的铑配合物(ii)对线粒体的影响。主要考察指标有不同浓度rh1作用后线粒体膜电位和atp水平的变化。线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。细胞在凋亡、坏死或处于一些毒性状态时,atp水平会下降,通常atp水平的下降表明线粒体的功能受损或下降,在细胞凋亡时atp水平的下降通常和线粒体的膜电位下降同时发生。其具体实施严格按照试剂盒说明书进行。实验结果如图16所示,随本发明的铑配合物rh1浓度的升高,hepg2细胞中atp表达水平显著下降,而在jc-1染色测定线粒体膜电位实验中,随本发明所合成的铑配合物rh1浓度的上升,荧光逐渐由红色变为绿色,表明本发明所合成的铑配合物rh1作用hepg2细胞后,可导致其线粒体膜电位和atp水平均下降,表明本发明所合成的铑配合物rh1促进了hepg2细胞的早期凋亡。
实施例15
本发明所合成的铑配合物(ii)对hepg2细胞凋亡的影响实验
a)fitc和碘化丙啶双染法检测rh1对hepg2细胞凋亡的影响
annexinv与膦脂酰丝氨酸的结合是凋亡早期的一个重要检测标志事件,所以fitc标记的annexinv可以用来检测细胞凋亡,从而使细胞呈现绿色荧光。但细胞坏死的过程中也会发生细胞膜损伤,坏死的细胞同样也会结合annexinv-fitc。而碘化丙啶(pi)可以染色坏死细胞或凋亡晚期丧失细胞膜完整性的细胞,呈现红色荧光。将hepg细胞接种在6孔板中,当细胞密度达70~80%时,用不同浓度rh1处理细胞72h,然后根据试剂盒说明书,用bd6plus流式细胞仪检测细胞凋亡情况,其结果如图17a所示,横坐标为annexinvfitc染色情况,纵坐标为pi染色情况,细胞根据染色情况可分为四个区域,正常细胞两者都不染色,位于左下角区域;pi单染为已经死亡的细胞,位于左上角区域;annexinvfitc单染为早期凋亡细胞,位于右下角区域;pi和annexinvfitc双染为晚期凋亡细胞,位于右上角区域。与对照组相比,随本发明的铑配合物剂量的增加,hepg2细胞凋亡率不断增加,本发明的铑配合物剂量为1.5μm时,细胞早期凋亡率为3.84%,晚期凋亡率为1.97%,总凋亡率为5.81%;本发明的铑配合物剂量为3μm时,细胞早期凋亡率为9.79%,晚期凋亡率为1.40%,总凋亡率为11.49%;本发明的铑配合物剂量为6μm时,细胞早期凋亡率为44.3%,晚期凋亡率为12.1%,总凋亡率为56.4%;可见,本发明的铑配合物(ii)能促进细胞凋亡的发生。
b)细胞内caspase-3和caspase-9表达的测定
当细胞发生凋亡时,细胞内的caspase-3表达被激活并且caspase-9表达下调,因此,caspase-3和caspase-9的表达变化在一定程度上可以反应出细胞的凋亡程度。hepg2细胞接种到10cm的培养皿中,贴壁后,细胞密度达到70~80%时,用不同浓度的rh1处理24h,用west-blot方法检测caspase-3和caspase-9的表达水平,其结果如图17b所示,随本发明所合成铑配合物(ii)浓度的增大,caspase-3蛋白含量呈增大的趋势,其相应的cleaved-caspase-3蛋白含量也呈增大趋势,而caspase-9蛋白含量呈下降趋势,其相应的cleaved-caspase-9蛋白含量却呈下降的趋势,表明本发明所合成的铑配合物(ii)作用hepg2细胞后,能激活细胞中caspase-3的表达,下调caspase-9的表达,从而激活caspase依赖性的细胞凋亡信号通路。
c)hoechst33258检测rh1对hepg2细胞凋亡的影响
hoechst33258是一种活细胞dna染料,可用于细胞凋亡检测,在荧光显微镜下,活细胞核呈弥漫均匀的蓝色荧光,当细胞发生凋亡时,细胞核或细胞质中可见浓染致密的颗粒状荧光。将细胞接种于12孔板中,待细胞贴壁后,加入不同浓度的rh1处理24h,去掉培养基,加入10μl5mg·ml-1的hoechst33258避光染色15min,最后用荧光显微镜成像,其结果如图17c所示,随本发明的铑配合物rh1浓度的增加,hepg2细胞在在荧光显微镜下出现的浓染致密的颗粒状荧光密度呈增大趋势,表明本发明所合成的铑配合物rh1能促进细胞凋亡的发生。
d)检测凋亡诱导因子aif的表达
凋亡诱导因子aif是细胞凋亡的起始因子,正常情况下,aif位于线粒体中,能清除细胞内的自由基,阻止细胞凋亡,当受凋亡信号刺激后,aif从线粒体转移至胞浆,再进入细胞核,诱导染色体凝结、dna大片段化,促进细胞凋亡。使用免疫荧光法和westernblot检测了不同浓度的rh1处理后的hepg2细胞中aif的表达,其结果如图18所示,随rh1浓度的增加,aif的绿色荧光强度增加,与dapi(dna活性染料)染色结果完全重合,表明aif随rh1给药浓度增大而表达上调,westblot蛋白条带也证明了这一点,说明发明的铑配合物rh1能诱导细胞凋亡。
e)检测凋亡通路蛋白bax/bcl-2、bak、cytochromec、parp/cleaved-parp的表达
westernblot检测了凋亡信号通路中bax/bcl-2、bak、cytochromec、parp/cleaved-parp的表达,其结果如图18所示,随rh1浓度的增加,抗凋亡蛋白bcl-2的表达下调,促凋亡蛋白bax、bak的表达上调,cytochromec表达上调,dna修复酶parp表达下调,而cleaved-parp表达上调,cleaved-parp可激活caspase-3的表达。
以上实验均证明,本发明的铑配合物(ii)呈剂量依赖性的促进hepg2细胞的凋亡。
实施例16
本发明所合成的铑配合物(ii)用于处理hepg2细胞后,对细胞周期的影响
a)碘化丙啶染色法检测rh1对hepg2细胞周期的影响
hepg2细胞悬液均匀的加入到6孔板中(每孔1.8ml,密度为5×104个/ml),于培养箱中培养过夜,贴壁后,设置对照组与不同浓度的rh1组,置于培养箱中共孵育24h。收集培养基中悬浮的细胞,用pbs清洗一遍,用不含edta的胰酶消化一段时间后再用培养基终止消化,将贴壁的细胞从6孔板上吹下来并收集,离心,弃去液体。加入预冷的70%乙醇置于冰箱对细胞进行固定。次日将已经固定好的细胞离心、洗涤,用pbs重悬,加入rnasea酶,在37℃水浴锅中保持30min,之后加入已经配好的染色剂pi,于4℃冰箱中避光作用15min,上机检测,其结果如图19a所示,随着rh1浓度的增加,g0/g1期细胞所占比例明显升高,表明本发明所合成的铑配合物(ii)能影响hepg2细胞的细胞周期,并将细胞阻滞在g0/g1期。
b)hepg2细胞内周期蛋白cyclind1/e1、周期蛋白依赖激酶cdk4/6的检测
cyclind1/e1是细胞周期蛋白依赖性激酶cdks的调控者,能促进血细胞通过细胞周期g1/s期限制点。cdk4/6是一类丝/苏氨酸激酶,与cyclind结合,调节细胞由g1期向s期转换。而p27、p21、p15是一类同源的能抑制cyclin-cdk活性的小分子量蛋白质,其中p15能特异性的抑制cdk4和cdk与cyclind形成复合物。hepg2细胞接种到10cm的培养皿中,贴壁后,细胞密度达到70~80%时,用不同浓度的rh1处理24h,用westernblot检测了本发明所合成的铑配合物rh1对hepg2细胞中周期蛋白cyclind1/e1及周期蛋白依赖激酶cdk4/6的影响,其结果如图19b和19c所示,随着本发明所合成的rh1浓度的增加,hepg2细胞中细胞周期蛋白cyclind1/e1及细胞周期依赖激酶cdk4/6表达均降低,而p27、p21及p15的表达水平均升高,表明本发明所合成的铑配合物能抑制hepg2细胞中周期蛋白d1/e1的表达水平,并促进p27、p21及p15的表达,从而使细胞阻滞在g1期。
实施例17
本发明所合成的铑配合物(ii)于体外和dna结合作用检测
通过紫外-可见光谱法、荧光光谱法和圆二色光谱法检测了rh1和小牛胸腺dna(ct-dna)的结合作用。所有光谱分析均在tris-hcl缓冲液(5mm,kcl50mm,ph=7.8)中进行。将ct-dna(4.439mm)储备液储存在4℃的冰箱中,使用前保存5天以下。将rh1溶解在dmf中并混合成2mm储备溶液,用tris-hcl缓冲液稀释至相应的浓度,用于随后的光谱实验。
紫外-可见光谱法:将rh1储备液用tris-hcl缓冲液稀释100倍,得到2.0×105m溶液(3ml),然后逐渐加入ct-dna储备液或sds储备液,混匀,充分反应,记录紫外-可将光谱,结果如图20所示,随着ct-dna的不断加入,紫外光谱的最大吸收增强,最大吸收波长蓝移,当ct-dna与本发的铑配合物浓度比达到1.25时,最大吸收波长蓝移了2nm,而作为dna骨架模拟物的sds不断加入时没有这种变化,表明本发明的铑配合物能以沟槽结合模式而非静电作用模式与dna结合。
荧光光谱法:通过改变rh1的浓度并固定eb-ct-dna体系的浓度,研究eb或rh1与dna之间的竞争性结合实验,其结果如图21所示,随着本发明的铑配合物的浓度的增加,eb-ct-dna体系的荧光强度不断降低,表明本发明的铑配合物能与eb竞争性的结合ct-dna。
圆二色光谱法:将rh1加入到ct-dna(1.0×10-4m)溶液中并在37℃下孵育5分钟。rh1的最终浓度为0,2.0,4.0,6.0×10-4m,并且通过cd光谱仪记录每个样品在200~320nm范围内的光谱,其结果如图22所示,随着本发明铑配合物的加入,ct-dna的旋光性下降。
以上结果表明,本发明的铑配合物(ii)确实能与dna结合,且以沟槽结合模式而非静电作用模式与dna结合。
实施例18
本发明所合成的铑配合物(ii)的体内抗肿瘤实验
a)rh1抑制裸鼠肿瘤生长
将hepg2细胞(1.5×107个/小鼠)皮下接种到雄性balb/c裸鼠(18~22g)中,得到hepg2肿瘤裸鼠模型。肿瘤达到180~200mm3后,将小鼠随机分为两组(n=4),每天腹腔注射rh1(10mg·kg-1)或相同体积的生理盐水,持续15天,用游标卡尺每3天测量肿瘤大小,并使用以下公式计算肿瘤体积(tv):tv(mm3)=宽度2×长度/2。肿瘤生长抑制率(irt)计算如下:irt=100%×(m1-m2)/m1,m1代表空白组中肿瘤的平均重量,m2代表药物治疗组中肿瘤的平均重量。对照组肿瘤模型裸鼠体重在实验期间不断增加,与之相比,本发明所合成的铑配合物rh1治疗的裸鼠用药前后体重变化不大,用药10天后,裸鼠体重开始下降;类似地,对照组裸鼠肿瘤体积随治疗时间不断增大,而rh1治疗组的裸鼠肿瘤体积增长速率较慢;实验结束时,取出裸鼠体内的肿瘤,观察到rh1治疗后,肿瘤生长明显收到抑制,计算本发明所合成的铑配合物rh1的抑瘤率为45%,裸鼠体重变化及实验结束时的肿瘤体积和重量如图23所示。
b)rh1可缓解由四氯化碳造成的慢性肝癌,肝损伤
将4周龄雄性balb/c小鼠(18~22g)随机分成3组,每组5只小鼠,所有动物在标准条件下饲养,适当湿度的明/暗循环,并提供水和标准无病原体饲料。第1组是空白对照,其中小鼠在没有四氯化碳或rh1处理的情况下进行处理。第2组是四氯化碳模型组。第3组是rh1处理组,其中小鼠同时接受四氯化碳和rh1处理。第2组和第3组每周三次注射四氯化碳(5mg·kg-1)并治疗14周以诱导肝癌。第3组每天腹膜内注射rh1(10mg·kg-1),持续两周。处理14周后,收集肝脏和血液,将肝脏固定在4%多聚甲醛缓冲液中,用于蛋白质印迹分析和组织学分析,其肝脏形态及肝切片免疫组化染色实验(h&e染色,sirius染色,masson染色,cd45染色,f4/80染色)结果如图24和图25所示,空白对照组小鼠肝脏,质地柔软,表面鲜红;ccl4模型组小鼠肝表面粗糙,颜色明显变暗,并且表面明显出现脂肪斑点,而本发明所合成的铑配合物rh1和ccl4共处理组的肝脏表观形态明显得到改善。从h&e染色结果可以看出,空白对照组小鼠肝组织结构正常,ccl4模型组脂质堆积,h&e染色后,脂质溶解,形成大量的空泡,肝纤维化程度严重,而本发明所合成的铑配合物rh1和ccl4共处理组脂质堆积较少(空泡较少),肝纤维化程度较弱。masson可以将总胶原蛋白染成蓝色,而胶原蛋白堆积是肝纤维化的一大特征,从masson染色结果分析,空白对照组小鼠肝组织结构正常,ccl4模型组小鼠肝组织中总胶原蛋白大量堆积,肝组织损伤较为严重,而本发明所合成的铑配合物rh1和ccl4共处理组总胶原堆积较少(蓝色较少),肝损伤程度较低。siriusred可以特异性的将iv型胶原蛋白染成红色,从siriusred染色结果可以看出,空白对照组小鼠肝组织细胞结构正常,ccl4模型组小鼠肝汇管区胶原蛋白堆积严重,而本发明所合成的铑配合物rh1和ccl4共处理组iv胶原堆积较少(红色较少)。免疫组化标记cd45,f4/80可以反应组织炎症水平,从cd45染色结果可以看出,空白对照组小鼠肝组织结构正常,ccl4模型组小鼠肝肝组织损伤区域明显,汇管区有大量的炎细胞侵袭,炎细胞的cd45被染成棕黄色,而本发明所合成的铑配合物rh1和ccl4共处理组也有炎细胞侵袭,但染色面积较模型组少,说明本发明所合成的铑配合物rh1可以抑制炎细胞向肝组织侵袭;f4/80染色结果可以看出,空白对照组小鼠肝组织正常ccl4模型组小鼠,ccl4模型组小鼠肝组织部分坏死,汇管区扩大,炎性细胞大量侵袭,炎细胞的f4/80被染成棕黄色,而本发明所合成的铑配合物rh1和ccl4共处理组小鼠肝组织结构正常,汇管区未见扩大,炎细胞侵袭较少。由此可以看出,本发明所合成的铑配合物rh1能减少肝损伤过程中的脂质堆积和胶原蛋白堆积,抑制炎细胞向肝组织侵袭,减缓肝损伤的进程。
血清中炎症因子表达水平及肝损伤指标如图26所示,血清中trxr含量和westernblot检测的肝组织中trxr表达水平如图27所示。结果表明,本发明的铑配合物(ii)能抑制肿瘤小鼠中肿瘤生长,修复四氯化碳造成的慢性肝损伤症状,能降低四氯化碳肝损伤小鼠中炎症因子il-6、il-8、alt、ast、alp和ldh的表达,降低血液中trxr的含量和组织中trxr的水平。
本发明的上述实施例仅仅是为清楚地说明本发明的技术构思及特点而作的举例,而并非是对本发明作任何形式上的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而这些属于本发明的实质精神所引伸出的显而易见的变化或变动仍属于本发明的保护范围。
序列表
<110>南京中医药大学
<120>特定基团修饰的n1,n3取代4,5-二芳基咪唑环卡宾铑配合物及其制备方法和应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>1
tgtggatcagcaagcaggagta22
<210>2
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>2
tgcgcaagttaggttttgtca21
<210>3
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>3
gccctgcaagactctcgaaatta23
<210>4
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>4
gcccataagcattctcatagacga24
- 还没有人留言评论。精彩留言会获得点赞!