沉默小菜蛾整合素β1亚基基因Pxβ的RNAi载体及其应用的制作方法
本发明属于农业生物技术领域,具体涉及沉默小菜蛾整合素β1亚基基因pxβ的rnai载体及其应用。一种可以在转基因植物中表达小菜蛾整合素β1亚基基因pxβ双链rna(dsrna)结构的rnai载体,通过农杆菌介导的方法将该rnai载体导入植物基因组,从而获得抗小菜蛾的转基因植株,为小菜蛾的防治提供一种新的策略。
背景技术:
小菜蛾(plutellaxylostellal.)是十字花科蔬菜上的全球性重要害虫之一,据估计小菜蛾对我国的经济损失和防治费用每年高达7.7亿美元(lietal.,2016)。目前,防治小菜蛾的手段依然是以化学农药为主,但大量使用农药不仅对其它生物甚至人类造成危害,而且对环境也会造成污染,更严重的是会对小菜蛾形成抗药性定向选择。已有报道表明小菜蛾对绝大部分农药已经产生了抗药性,并且是第一个被报道在田间对bt蛋白毒素产生抗性的昆虫(furlongetal.,2013)。因此,防治小菜蛾的新技术研发已是迫在眉睫。
rna干扰(rnai)指外源或内源的双链rna(doublestrandrna,dsrna)引起生物体内与之互补配对的信使rna(mrna)的裂解或抑制其蛋白的表达,这一现象于1998年在线虫中首次报道(fireetal.,1998)。rnai技术作为一种基因调控的有效手段,目前已被广泛的应用于昆虫功能基因组学和害虫防治等的研究(胡少茹等,2019)。在早期的rnai研究中,一般是通过注射、混合食料饲喂等方式实现基因沉默的效果,但是这些方式在田间害虫防治中的应用比较困难,2007年首次出现了利用转基因植物表达害虫基因dsrna来防治棉铃虫的报道,即植物介导昆虫rnai防治害虫(maoetal.,2007)。通过转基因植物表达害虫靶标基因dsrna的方式为田间害虫治理提供了一种有效的解决思路。
整合素(integrin)是一类由α和β亚基通过非共价键组成的异二聚体的跨膜蛋白家族,可由18个α亚基和8个β亚基组成24种不同的整合素(hynes,2002)。其中β1整合素是由β1亚基和α亚基组成,占到了整合素蛋白家族数量的一半,是生物体组织和器官发育的必需蛋白(schnittertetal.,2018)。有报道表明喂食小菜蛾整合素β1亚基基因的dsrna后,小菜蛾的死亡率可以显著的提高(mohamedandkim,2011)。这些结果说明了整合素β1亚基基因具有作为植物介导昆虫rnai防治害虫的靶标基因的潜力。
技术实现要素:
有鉴于此,本发明的目的在于克服现有技术的缺陷,提供一种沉默小菜蛾整合素β1亚基基因pxβ的rnai载体及其应用。在转基因植株中表达小菜蛾整合素β1亚基pxβ基因dsrna结构的rnai载体,通过农杆菌介导的方法将该rnai载体导入植物基因组,从而获得抗小菜蛾的转基因植株,为小菜蛾的防治提供一种新的策略。
本发明的技术方案如下所述:
一种沉默小菜蛾整合素β1亚基基因pxβ的rnai载体:选择小菜蛾整合素β1亚基基因pxβ(genbank登入号:gq178290.1,2487bp)中的一段497bp长的保守序列为靶标,构建表达靶标基因序列dsrna的植物表达rnai载体,所述靶标的核苷酸序列如seqidno:1。
一种沉默小菜蛾整合素β1亚基基因pxβ的rnai载体:通过gateway同源重组技术将靶标序列插入植物表达载体phellsgate-4中,构建表达靶标序列dsrna结构的rnai重组载体phells-dsβ;在该载体中小菜蛾基因pxβ靶标序列片段以正反两个方向相向排列,中间包含一个pdk内含子序列,以camv35s启动子启动表达,ocsterminator为终止子,具有真核卡那霉素抗性和原核壮观霉素抗性。
一种沉默小菜蛾整合素β1亚基基因pxβ的rnai载体的制备方法,包括以下步骤:
(1)提取小菜蛾rna,反转录为cdna,以该cdna为模板,以pxβf/pxβr为引物对(pxβf:5’-atgtcggcgacgaggggtctag-3’;pxβr:5’-ttacttgccagcgtacgtcgggttc-3’)扩增获得整合素β1亚基基因pxβ全长,并将其插入克隆载体peasy-blunt中获得重组克隆载体peasy-pxβ。
(2)在小菜蛾整合素β1亚基基因pxβ内选择了一个长为497bp的保守区域,并利用引物对attb1-βf/attb2-βr(attb1-βf:5’-ggggacaagtttgtacaaaaaagcaggctca-gccaacgcttgccgcttctgg-3’;attb2-βr:5’-ggggaccactttgtacaagaaagctgggtc-gatgtcgtacacgccgccctc-3’)从质粒peasy-pxβ中克隆基因pxβ相应的497bprnai靶标区域(seqidno:1),且在克隆序列的两端分别添加用于gateway同源重组的同源臂序列attb1和attb2;
(3)利用gateway同源重组技术将克隆的靶标序列片段与植物表达载体phellsgate-4连接,使靶标序列片段以正反两个方向分别插入载体中,其中两个序列片段之间包含一个pdk内含子序列,以camv35s启动子启动表达,ocsterminator为终止子,具有真核卡那霉素抗性和原核壮观霉素抗性,从而获得表达pxβ靶标序列dsrna的植物表达rnai载体,命名为phells-dsβ载体。
一种含有沉默小菜蛾整合素β1亚基基因pxβ的rnai载体,即phells-dsβ载体的微生物转化体。
进一步的,一种含有沉默小菜蛾整合素β1亚基基因pxβ的rnai载体,即phells-dsβ载体的大肠杆菌或农杆菌。
一种含有沉默小菜蛾整合素β1亚基基因pxβ的rnai载体在抗小菜蛾转基因植物制备中的应用。
一种含有沉默小菜蛾整合素β1亚基基因pxβ的rnai载体应用于抗小菜蛾转基因植物的制备中,所得转基因植物成功表达小菜蛾整合素β1亚基基因pxβ的dsrna结构。
一种含有沉默小菜蛾整合素β1亚基基因pxβ的rnai载体应用于抗小菜蛾转基因植物,小菜蛾取食转基因植物后靶标基因整合素β1亚基pxβ的转录表达水平显著降低,且蛹重减轻、化蛹率下降,从而导致死亡率显著升高。
一种含有沉默小菜蛾整合素β1亚基基因pxβ的rnai载体应用于抗小菜蛾转基因植物的制备方法包括以下步骤:
(1)采用冻融法将植物表达rnai载体phells-dsβ导入农杆菌gv3101感受态细胞内,再通过农杆菌浸染拟南芥花蕾的遗传转化方法导入拟南芥种子基因组内,获得转基因拟南芥种子;收集这些种子播种于含有50mg/l卡那霉素的筛选培养基中,待种子发芽生长一周后,依然保持绿色状态的拟南芥被认为是转基因拟南芥。
(2)提取转基因拟南芥的基因组,以该基因组为模板,用特异性的引物进行pcr扩增小菜蛾的基因pxβ的靶标序列片段,对转基因植株进行pcr阳性分子鉴定,并且通过rt-pcr和rt-qpcr技术分析转基因植株转录表达基因pxβ靶标序列dsrna的能力。
(3)转基因植株的接虫喂养试验:表达了小菜蛾基因pxβ靶标序列dsrna的转基因植株和正常野生型的植株长至第四周后进行试验,分别将小菜蛾初孵幼虫挑至这两种植株叶片上,罩上透明的塑料杯,并盖上具有滤网的盖子防止其逃逸,保持植株的生长。分析小菜蛾靶标基因pxβ被沉默水平,同时比较其蛹重、化蛹率和死亡率,评估转基因植株抗小菜蛾的能力。
本发明的积极效果如下:本发明提供了一种含有沉默小菜蛾整合素β1亚基基因pxβ的rnai载体及其应用。选择小菜蛾整合素β1亚基基因pxβ中的一段497bp长的保守序列为靶标,构建植物表达rnai载体。该植物表达rnai载体应用于抗小菜蛾转基因植物的制备中,表达小菜蛾整合素β1亚基基因pxβ靶标序列dsrna的转基因植株抑制了小菜蛾靶标基因pxβ的44.7%-49.8%转录表达水平,且减轻了小菜蛾雄蛹重、减少了化蛹率,并提高了小菜蛾15.0%的死亡率,为小菜蛾的防治提供了新的策略。
附图说明
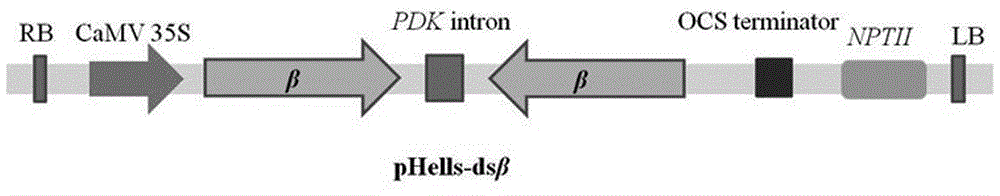
图1:含有小菜蛾整合素β1亚基基因pxβ靶标序列的植物表达rnai载体phells-dsβ的t-dna区段图谱。图中lb和rb为t-dna的左右边界;camv35s为启动子,pdkintron为内含子,ocsterminator为终止子,nptii为卡那霉素抗性基因,β为小菜蛾整合素β1亚基pxβ基因靶标序列。
图2:农杆菌介导的rnai载体phells-dsβ转化拟南芥。a为待转化的拟南芥;b为农杆菌转化的拟南芥的种子收集;c为正常拟南芥种子播种于不含卡那霉素抗生素的培养基中生长;d为正常拟南芥种子播种于含50mg/l卡那霉素抗生素的培养基中生长;e为农杆菌转化后拟南芥的种子播种于含50mg/l卡那霉素抗生素的培养基中生长,其中箭头指示的是具有卡那霉素抗性的转基因拟南芥。
图3:表达小菜蛾整合素β1亚基基因pxβ靶标序列dsrna的转基因拟南芥pcr阳性检测示意图。图中1-15为转基因拟南芥,c为正常对照拟南芥,p为含有靶标基因序列的阳性质粒,18srdna为拟南芥内参基因。
图4:表达小菜蛾整合素β1亚基基因pxβ靶标序列dsrna的转基因拟南芥rt-pcr琼脂糖凝胶电泳检测示意图。图中数字201、202、203、205、208、209、21、214、218、22、23、24、297、298和299均为不同转基因拟南芥株系,c为正常对照拟南芥,p为含有靶标基因序列的阳性质粒,18srrna为拟南芥内参基因。
图5:表达小菜蛾整合素β1亚基基因pxβ靶标序列dsrna的转基因拟南芥rt-qpcr检测示意图。图中数字202、205、208、209、218、23、24和297均为不同转基因拟南芥株系,pxβ基因相对表达量采用拟南芥sand基因为内参。
图6:表达小菜蛾整合素β1亚基基因pxβ靶标序列dsrna的转基因拟南芥24株系喂饲小菜蛾的方法。
图7:表达小菜蛾整合素β1亚基基因pxβ靶标序列dsrna的转基因拟南芥24株系对小菜蛾的抗性评价。a为转基因拟南芥24株系对小菜蛾化蛹率的影响;b为转基因拟南芥24株系对小菜蛾雄蛹重的影响;c为转基因拟南芥24株系对小菜蛾死亡率的影响;wt为正常对照拟南芥。
图8:表达小菜蛾整合素β1亚基基因pxβ靶标序列dsrna的转基因拟南芥24株系对小菜蛾pxβ基因mrna表达水平的抑制。a为取食了转基因拟南芥后小菜蛾四龄幼虫pxβ基因的相对表达水平;b为取食了转基因拟南芥后小菜蛾一日蛹pxβ基因的相对表达水平。
具体实施方式
为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是下述的实例仅仅是本发明其中的例子而已,并不代表本发明所限定的权利保护范围,本发明的权利保护范围以权利要求书为准。
实施例1小菜蛾整合素β1亚基基因pxβ的cds全长的扩增
提取单头4龄幼虫小菜蛾总rna,用dna酶去除残留的基因组dna,再用反转录酶反转录1μgrna成第一链cdna。分别以pxβf/pxβr为引物对(pxβf:5’-atgtcggcgacgaggggtctag-3’;pxβr:5’-ttacttgccagcgtacgtcgggttc-3’),用高保真聚合酶扩增靶标基因pxβ(genbank登入号:gq178290.1,2487bp)。反应体系为50μl:1μldna聚合酶,1μlcdna,上下游引物(pxβf/pxβr)各2μl,1μldntp,25μlbuffer缓冲液,ddh2o补充至50μl。pcr反应程序:95℃预变性3分钟;95℃变性15秒,58℃退火15秒,72℃延伸90秒,35个循环;72℃延伸5分钟。将pcr产物进行琼脂糖凝胶电泳检测,利用胶回收试剂盒对正确大小的条带进行胶回收,并与平末端克隆载体peasy-blunt连接构建重组质粒peasy-pxβ,将重组质粒分别转化大肠杆菌感受态细胞dh5α,再经氨苄抗生素筛选后,利用质粒提取试剂盒提取其质粒,送测序公司进行靶标基因的测序验证。
实施例2小菜蛾整合素β1亚基基因pxβ靶标序列的植物表达rnai载体构建
利用引物对attb1-βf/attb2-βr从质粒peasy-pxβ中扩增基因pxβ相应的497bprnai靶标区域(seqidno:1),并在靶标区域两端添加attb1和attb2序列,即attb1-β-attb2(attb1-βf:5’-ggggacaagtttgtacaaaaaagcaggctca-gccaacgcttgccgcttctgg-3’;attb2-βr:5’-ggggaccactttgtacaagaaagctgggtc-gatgtcgtacacgccgccctc-3’)。pcr反应体系为50μl:1μldna聚合酶,1μl质粒模板,上下游引物(attb1和attb2)各2μl,1μldntp,25μlbuffer缓冲液,ddh2o补充至50μl。pcr反应程序:95℃预变性30秒;95℃变性15秒,58℃退火15秒,72℃延伸30秒,35个循环;72℃延伸5分钟。将pcr产物凝胶电泳检测,胶回收获得基因pxβ相应的rnai靶标区域后用于gatewaybp同源重组反应。gateway反应体系及程序为:胶回收产物50ng,1μl载体phellsgate-4,te缓冲液补至8μl;2μlbpclonase聚合酶混合液;25℃反应1小时后,加入1μl蛋白酶k后37℃孵育10分钟,获得表达dsrna的植物表达载体phells-dsβ后,将重组载体phells-dsβ转化大肠杆菌感受态细胞dh5α,经壮观霉素筛选后,获得含有重组质粒的大肠杆菌,经大肠杆菌扩繁后,提取其质粒即为小菜蛾基因pxβ的植物表达rnai载体phells-dsβ(图1)。
实施例3农杆菌介导的载体phells-dsβ转化拟南芥
利用冻融法将构建好的植物表达rnai载体phells-dsβ转入根癌农杆菌gv3101感受态细胞,均匀涂布至含有25mg/l利福平、50mg/l庆大霉素和100mg/l壮观霉素的lb固体培养基平板后,于28℃暗培养60小时,得到单克隆菌落,用无菌牙签接种单克隆菌落于4ml的lb液体培养基内,在28℃180rpm振荡培养15小时进行扩繁培养,获得农杆菌菌液。同时将拟南芥种子播种于23℃、16小时光照2000lux和8小时黑暗的光周期和湿度为60%-70%的环境下,待拟南芥长出花蕾后进行农杆菌的转染。即分别在100mllb液体培养基中加入0.1ml的农杆菌菌液,28℃180rpm振荡培养15小时。将培养后的农杆菌于室温下5000rpm离心10分钟,弃上清,用1/2ms液体培养基稀释至od600=0.8,再加入0.02vol%表面活性剂silwet-l77用于拟南芥花蕾的浸染。用准备好的农杆菌菌液浸染拟南芥的花蕾3-5秒后,再用薄膜覆盖拟南芥保湿避光48小时,然后正常培育,收集浸染后的拟南芥种子。将收集到的种子于0.2wt%浓度naclo中灭菌10分钟,播种于含有50mg/l卡那霉素的筛选培养基中(4.43g/lms+30g/l蔗糖+8g/l琼脂粉)生长,成功转化的拟南芥能对卡那霉素形成抗性,保持绿色,而未转化苗则会出现白化死亡(图2)。因此,拟南芥生长一周后,依然保持绿色状态的正常拟南芥被认为是转基因t1代拟南芥。
实施例4转基因拟南芥表达小菜蛾整合素β1亚基pxβ基因dsrna的检测
(1)转基因拟南芥的pcr阳性检测
利用植物基因组提取试剂盒提取转基因t1代拟南芥叶片基因组,以该基因组为模板分别扩增小菜蛾pxβ基因靶标序列片段,同时扩增拟南芥的基因18srdna作为对照基因。引物对分别为βf/βr和18sf/18sr(βf:5’-gtactccggaaccttctgtg-3’;βr:5’-acgtcgcctgcttgtagatc-3’;18sf:5’-ctagtggtacacagaagtcatgg-3’;18sr:5’-gtggggaatcttggacaat-3’)。pcr反应体系为25μl,含有转基因植株基因组50ng,上下游引物(βf/βr或18sf/18sr)各1μm,taq聚合酶混合物12.5μl,添加相应的蒸馏水至25μl。pcr反应程序为95℃3分钟;95℃30秒,58℃30秒,72℃1分钟,进行35个循环;72℃10分钟。之后将pcr产物进行电泳检测扩增出的条带是否与靶标序列片段长度一致,一致则认为扩增到了相应的基因,获得了转基因植株(图3)。将获得的t1代转基因拟南芥进行自交获得t2代转基因拟南芥,t2代再自交获得纯合体t3代转基因拟南芥。
(2)转基因拟南芥的rt-pcr检测dsrna的表达
利用植物rna提取试剂盒提取转基因t3代纯合体拟南芥叶片rna,用dna酶去除残留的基因组dna,再用反转录酶反转录1μgrna成第一链cdna。以该cdna为模板分别扩增小菜蛾pxβ基因靶标序列相应片段和拟南芥的基因18srrna作为对照基因。rt-pcr反应引物、体系和程序与pcr阳性检测的一致,之后将pcr产物进行电泳检测扩增出的条带是否与靶标序列相应片段长度一致,一致则认为表达了其dsrna(图4)。
(3)转基因拟南芥的rt-qpcr检测dsrna的相对表达量
以cdna为模板,βqf/βqr为引物,拟南芥自带基因sand为参照基因(atqf/atqr为参照基因的引物),利用rt-qpcr的方法检测不同转基因植株的dsrna相对表达量(βqf:5’-gctgatgctgtggaagat-3’;βqr:5’-cctgcttgtagatcggatt-3’;atqf:5’-aactctatgcagcatttgatccact-3’;atqr:5’-tgattgcatatctttatcgccatc-3’)。rt-qpcr反应体系为20μl:含cdna模板2μl,上下游引物各0.4μl,qpcrmastermix酶10μl,添加无rna酶蒸馏水至20μl;rt-qpcr反应程序为95°c3分钟;95°c15秒,56°c15秒,72°c15秒,进行45个循环。分析比较不同转基因植株的dsrna相对表达量(图5),并以转基因植株进行下一步的接虫喂食试验。
实施例5表达pxβ基因dsrna的转基因拟南芥抗小菜蛾能力
(1)转基因拟南芥对小菜蛾生长发育的影响
表达pxβ基因dsrna的转基因拟南芥和正常拟南芥生长至第四周后进行接虫喂食试验,将小菜蛾初孵幼虫挑至拟南芥叶片上,用透明的塑料杯罩住,再用带滤网的盖子盖住塑料杯,防止小菜蛾逃逸,并保持拟南芥的正常生长外,这样还能方便观察小菜蛾的取食情况(图6)。试验分为5个重复,每个重复8头幼虫。小菜蛾羽化后,比较其化蛹率和最终死亡率。结果表明取食了转基因植株株系24的小菜蛾蛹重显著减轻,化蛹率显著下降,并且死亡率达到了22.5%,显著的高于对照7.5%的死亡率(图7)。
(2)转基因拟南芥对小菜蛾pxβ基因mrna的抑制水平
分别取喂食了转基因拟南芥株系24和正常对照拟南芥叶片的小菜蛾四龄幼虫和蛹,利用rt-qpcr技术分别检测其靶标基因pxβ的相对表达水平,评估转基因拟南芥对小菜蛾靶标基因mrna表达水平的影响。提取单头小菜蛾总rna,用dna酶去除残留的基因组dna,再用反转录酶反转录1μgrna成第一链cdna。以βqf/βqr为引物对,小菜蛾基因rps13和ef1a为双内参基因(rps13f:5’-tcaggcttattctcgtcg-3’;rps13r:5’-gctgtgctggattcgtac-3’;ef1af:5’-gcctccctacagcgaatc-3’;ef1ar:5’-ccttgaaccagggcatct-3’)。rt-qpcr反应体系为20μl:含cdna模板2μl,上下游引物各0.4μl,qpcrmastermix酶10μl,添加无rna酶蒸馏水至20μl;rt-qpcr反应程序为95°c3分钟;95°c15秒,56°c15秒,72°c15秒,进行45个循环。结果表明小菜蛾幼虫和蛹的基因pxβ的表达水平被沉默了44.7%-49.8%(图8)。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
sequencelisting
<110>福建农林大学
<120>沉默小菜蛾整合素β1亚基基因pxβ的rnai载体及其应用
<130>17
<160>17
<170>patentinversion3.3
<210>1
<211>497
<212>dna
<213>seqidno:1
<400>1
gtactccggaaccttctgtgagaagtgcccggcgtgcaccggcaaatgcaaggagtacaa60
ggactgcgtgctatgcgaggtgcacaagcgcgggccgatgttcgacatggaggcgccgcc120
ggggctcgagtgcggcaactgctcgctcaaccctgtcattgaagaggggaagattgaagc180
gaacgagacgcgcggcgagtacctgtgcagtttctacgacgacgaggactgtctgtacgt240
gtacgtgtactcctactcgtacacgcaacacctgaatgtgcgcgcgcagaaggaccggga300
ctgcccgcctaaggtgttcatcctgggcatcgtgctgggcgtgatcgcggcgatcgtgct360
ggtggggctggcgctgctgatgctgtggaagatggtcaccaccatccacgaccgccgcga420
gttcgcgcgcttcgagaaggaacgcatgatggccaagtgggacacgggtgaaaatccgat480
ctacaagcaggcgacgt497
<210>2
<211>22
<212>dna
<213>pxβf
<400>2
atgtcggcgacgaggggtctag22
<210>3
<211>25
<212>dna
<213>pxβr
<400>3
ttacttgccagcgtacgtcgggttc25
<210>4
<211>52
<212>dna
<213>attb1-βf
<400>4
ggggacaagtttgtacaaaaaagcaggctcagccaacgcttgccgcttctgg52
<210>5
<211>51
<212>dna
<213>attb2-βr
<400>5
ggggaccactttgtacaagaaagctgggtcgatgtcgtacacgccgccctc51
<210>6
<211>20
<212>dna
<213>βf
<400>6
gtactccggaaccttctgtg20
<210>7
<211>20
<212>dna
<213>βr
<400>7
acgtcgcctgcttgtagatc20
<210>8
<211>23
<212>dna
<213>18sf
<400>8
ctagtggtacacagaagtcatgg23
<210>9
<211>19
<212>dna
<213>18sr
<400>9
gtggggaatcttggacaat19
<210>10
<211>18
<212>dna
<213>βqf
<400>10
gctgatgctgtggaagat18
<210>11
<211>19
<212>dna
<213>βqr
<400>11
cctgcttgtagatcggatt19
<210>12
<211>25
<212>dna
<213>atqf
<400>12
aactctatgcagcatttgatccact25
<210>13
<211>24
<212>dna
<213>atqr
<400>13
tgattgcatatctttatcgccatc24
<210>14
<211>18
<212>dna
<213>rps13f
<400>14
tcaggcttattctcgtcg18
<210>15
<211>18
<212>dna
<213>rps13r
<400>15
gctgtgctggattcgtac18
<210>16
<211>18
<212>dna
<213>ef1af
<400>16
gcctccctacagcgaatc18
<210>17
<211>18
<212>dna
<213>ef1ar
<400>17
ccttgaaccagggcatct18
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:杨广;傅淑;刘昭霞;陈金芝;孙庚晓;尤民生
- 技术所有人:福建农林大学
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
- 还没有人留言评论。精彩留言会获得点赞!