一种苯并呋喃类杂环磺酰氯的合成方法与流程
本发明涉及一种苯并呋喃类杂环磺酰氯的合成方法,属于有机合成技术领域。
背景技术:
磺酰氯一类重要的“有机合成砌块”,在药物合成中具有重要应用。磺酰胺是一类以磺酰氯和有机胺为原料合成的化合物。目前已有多种磺酰胺类药物用于临床,如广谱抗菌药磺胺甲噁唑、抗炎药塞来昔布以及用于勃起功能障碍的西地那非。此外,磺胺类新药仍不断涌现,仅2018年fda批准上市的15化学小分子药物中就有两个磺胺类结构。
据统计,大部分的上市药物均含有杂环结构。因此,为了满足新药开发需求,开发含有杂环结构的磺酰氯对新药开发具有重要意义。5-溴-2,3-二氢苯并呋喃-7-磺酰氯是一种杂环磺酰氯,近年来已用于多种抗肿瘤新药设计之中。例如,powell等(2018年)以5-溴-2,3-二氢苯并呋喃-7-磺酰氯为起始原料,合成了一系列nrp1小分子拮抗剂,这些化合物可以具有抗血管生成、抗肿瘤效果,还可以通过减少tgfβ的产生达到免疫调节的作用。brabander(2019年)等利用该磺酰氯合成了可以特异性靶向腺瘤性结肠息肉病(apc)突变的直肠癌细胞系的抑制剂,为结肠癌的治疗提供了新一代候选药物。虽然国外已有公司销售该磺酰氯原料,但价格昂贵。此外,关于该化合物的合成方法,仍无公开文献报道。
目前,已有一些用于制备其他磺酰氯衍生物的合成方法被报道。与本发明合成方法最接近的是氯磺酸直接氯磺化法,主要是采用氯磺酸作为氯磺化试剂。但是,由于化学反应大多具有一定的底物(也称反应物)适用范围,因此,不同的底物往往具有不同的反应效果,利用氯磺酸制备磺酰氯的方法并非适合所有的反应底物。
技术实现要素:
为了弥补现有技术的不足,本发明提供了一种苯并呋喃类杂环磺酰氯的合成方法。
本发明创造性的使用新的底物,即5-溴-2,3-二氢苯并呋喃(化合物2),并以氯磺酸为氯磺化试剂,对目标化合物进行制备。值得注意的是,虽然采用氯磺酸制备磺酰氯已经是公开的方法,但从未有研究将氯磺酸用于本发明化合物制备。此外,氯磺酸的用量及配比、溶剂的选用、反应时间和反应温度都是影响反应成败以及效果的重要因素,这些技术方法在本发明所制备的化合物上仍然是空白。本发明通过创造性的工艺条件优化,确定了较优的工艺条件,高收率的得到目标化合物,且步骤短,设计的后处理操作方法简单,适合工业化生产,该方法可以有效降低生产成本。
本发明的技术方案如下:
一种苯并呋喃类杂环磺酰氯的合成方法,包括如下步骤:
1)以化合物1,即2,3-二氢苯并呋喃为原料,二氯甲烷作溶剂,以溴素对苯环进行亲电加成,得到化合物2,即5-溴-2,3-二氢苯并呋喃;
2)将化合物2通过氯磺酸进行苯环上的氯磺化反应得到式i化合物,即5-溴-2,3-二氢苯并呋喃-7-磺酰氯,所述的化合物2与氯磺酸的摩尔比为1:(2-20),反应温度为0-60℃,反应时间为0.5-12h;
合成路线如下:
优选地,
所述的步骤2)中,化合物2与氯磺酸的摩尔比为1:(4-10),反应温度为0-40℃,反应时间为1-3h。
本发明选择氯磺酸直接氯磺化法制备磺酰氯,通过具体的反应条件探索和优化,确定了最优反应条件:所述的步骤2)中,化合物2与氯磺酸的摩尔比为1:6,反应温度为室温,反应时间为2.5h。
本发明提供了一种制备5-溴-2,3-二氢苯并呋喃-7-磺酰氯的新方法,这种制备工艺目前未见任何国内外文献报道。本发明设计全新的合成路线,并针对路线中的关键反应步骤开展条件优化,确定了最优工艺条件。新工艺具有起始原料廉价易得,步骤简洁,易于后处理和收率高等特点,适合工业化生产。
附图说明
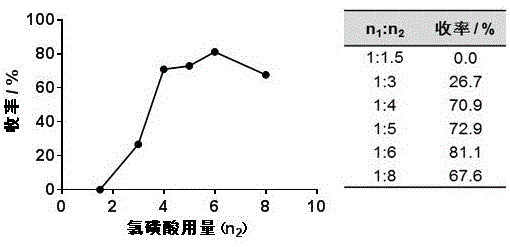
图1为氯磺酸用量对化合物i合成收率影响图。
图2为反应时间对化合物i合成收率影响图。
具体实施方式
实施例15-溴-2,3-二氢苯并呋喃-7-磺酰氯的制备(化合物i)
合成路线如下:
步骤15-溴-2,3-二氢苯并呋喃(化合物2)的合成
将2,3-二氢苯并呋喃(1,5g,41.6mmol)溶于二氯甲烷(35ml)中,另称取br2(6.65g,41.6mmol)溶于二氯甲烷(15ml),并在室温下于45分钟内滴入到上述混合物中,后将该混合物在室温下继续搅拌2小时。反应结束后,加入饱和nahso3溶液(25ml)淬灭,并用二氯甲烷萃取(15ml×3)。分离的有机层用水洗涤,无水na2so4干燥,减压浓缩,得到目标化合物为白色固体7.5g,产率:91%,此白色固体为5-溴-2,3-二氢苯并呋喃(化合物2)。
1hnmr(500mhz,cdcl3)δ7.28(s,1h),7.19(dd,j=8.4,2.0hz,1h),6.66(d,j=8.4hz,1h),4.57(t,j=8.7hz,2h),3.20(t,j=8.7hz,2h);13cnmr(126mhz,cdcl3)δ159.3,130.8,129.5,128.0,112.0,110.9,71.7,29.7.ms(esi)m/zcalcdforc8h7bro197.97;found[m+h]+199.0.
步骤25-溴-2,3-二氢苯并呋喃-7-磺酰氯(化合物ⅰ)的合成
将步骤1)制备的化合物2,即5-溴-2,3-二氢苯并呋喃(400mg,2.01mmol)溶于二氯甲烷(2ml)。另称取氯磺酸(1.4g,12.06mmol)溶于4ml二氯甲烷中,用滴液漏斗在5min内将氯磺酸的二氯甲烷溶液缓慢滴加入上述反应体系,待搅拌10min后转至室温,继续反应2.5h。
结束后将混合物滴至碎冰上,搅拌0.5h,将析出的固体抽滤,干燥后得到目标化合物为白色固体(484.3mg,收率:81%),此处的白色固体为5-溴-2,3-二氢苯并呋喃-7-磺酰氯(化合物ⅰ)。
1hnmr(400mhz,cdcl3)δ7.78(t,j=0.8hz,1h),7.60(d,j=1.7hz,1h),4.91(t,j=8.8hz,2h),3.35(t,j=8.8hz,2h).13cnmr(126mhz,cdcl3)δ156.82,135.08,134.02,128.72,126.88,111.89,74.58,28.94.ms(esi)m/zcalcdforc8h6brclo3s,295.89&297.89;found[m+na]+321.0.ir(kbr),ν,cm–1:3088.17,3012.94,2967.61,2903.96,1653.07,1576.87,1506.47,1476.57,1457.28,1448.60,1379.16,1266.32,1205.56,1184.34,1148.66,906.58,848.72,714.66.
实施例2化合物i的制备工艺优化
本发明通过初步研究发现,氯磺酸用量、反应时间、反应温度等因素是影响目标化合物收率的主要因素。因此,设计了单因素考察实验,对几种因素的影响效果开展深入研究。
(1)氯磺酸用量对化合物i合成收率的影响
将反应时间设为4h,反应温度为室温,考察化合物2与氯磺酸的不同投料摩尔比对反应收率的影响。由图1可知,随着摩尔比逐渐增加,化合物i的收率先增加,当n1(化合物2):n2(氯磺酸)的投料摩尔比达1:6时,收率达到最高;若继续提高摩尔比,反应收率反而降低。因此,选择最佳的化合物2与氯磺酸的摩尔比为1:6。
(2)反应时间对化合物i合成收率的影响
将n1(化合物2):n2(氯磺酸)的投料摩尔比确定为1:6,反应温度为室温,考察不同反应时间对化合物i合成收率的影响。如图2显示,随着反应时间延长,化合物的收率增加,当时间达到2.5h时,收率达到最高,进一步延长时间,收率不再继续增加,说明反应已经完成。因此,确定最优反应时间为2.5h。
(3)反应温度对化合物i合成收率的影响
最后,将n1(化合物2):n2(氯磺酸)的投料摩尔比确定为1:6,反应时间为2.5h,考察不同反应温度对化合物i合成收率的影响。结果显示(表1),升温后没有提高产率。因此,反应温度为室温。
表1反应温度对化合物i合成的影响
最终,确定最优反应条件为n1(化合物2):n2(氯磺酸)=1:6,反应时间2.5h,反应温度为室温,收率达81%。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种具有抗氧化活性的芳基苯并呋喃类化合物及其制备方法和应用与流程
- 一种含苯并双环酮与乙氧磺隆的除草组合物及其应用的制造方法与工艺
- 一种6‑氯呋喃[3,2‑B]吡啶的合成方法与流程
- 一类苯并吡喃类化合物及其应用的制造方法与工艺
- 一种以二苯并环庚烯为核心的化合物及其在有机电致发光器件上的应用的制造方法与工艺
- 一种含苯并双环酮与乙草胺的除草组合物及其应用的制造方法与工艺
- 一种含苯并双环酮与噁草酮的除草组合物及其应用的制造方法与工艺
- 分解二噁英前体的催化剂筛选系统及其使用方法与流程
- 一种无卤热固性树脂组合物以及含有它的预浸料、层压板和印制电路板的制造方法与工艺
- 一种以二联二苯并五元杂环为骨架的有机化合物及其在OLED上的应用的制造方法与工艺