利用CRISPR/Cas9技术构建斑马鱼asap1a基因敲除突变体的方法与流程
本发明涉及一种斑马鱼突变体
技术领域:
,尤其涉及一种利用crispr/cas9技术构建斑马鱼asap1a基因敲除突变体的方法。
背景技术:
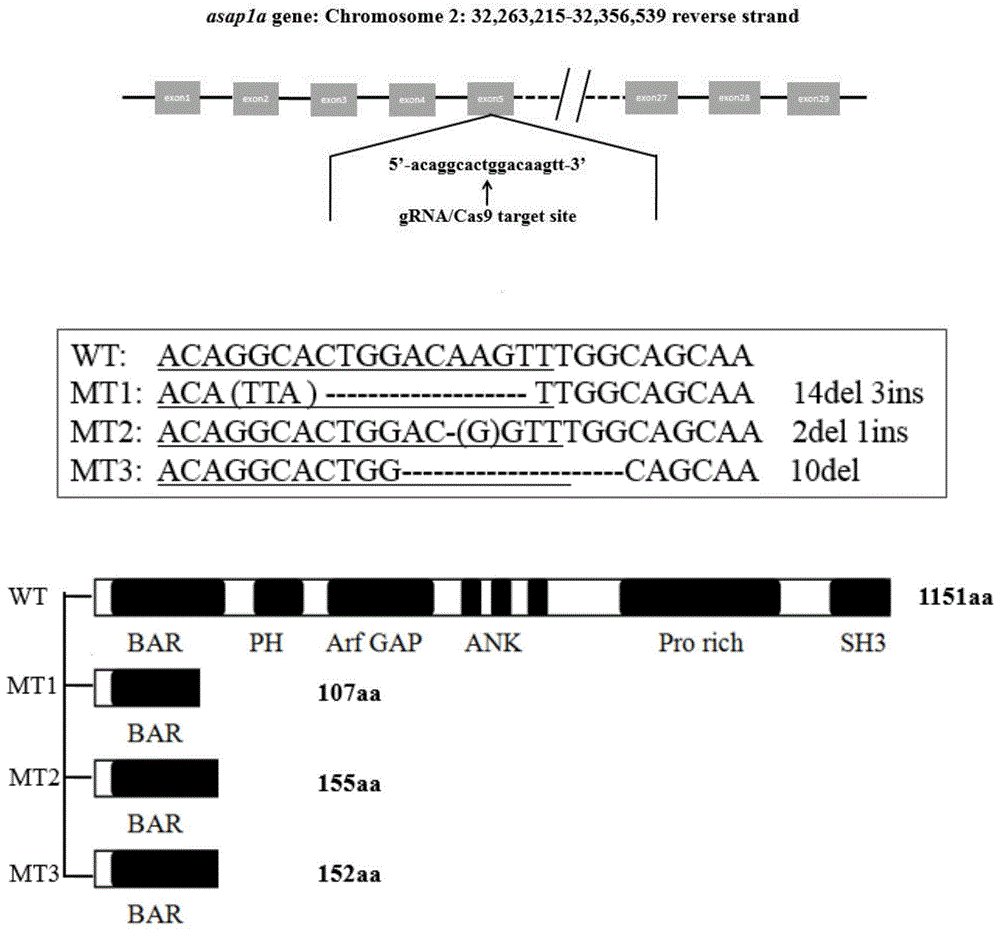
:crispr/cas9系统作为近年来新兴的一种基因编辑技术工具,其最初发现来源于细菌或古细菌在长期进化过程中形成的一种抵抗病毒和质粒侵袭的获得性免疫防御机制。crispr(clusteredregularlyinterspacedshortpalindromicrepeat,crispr)是指规律成簇的间隔短回文重复序列,能够靶向和干扰侵入的同源dna序列。cas9具有核酸外切酶的活性,在与crrna(crispr-derivedrna)配对的序列靶位点附近剪切双链dna。crispr/cas9具体是将改造后的crrna即grna(guiderna)和cas9mrna混合导入目标体系后引发dna错配修复造成基因的突变,进而完成对靶位点dna的定向切割。由于grna设计合成方便,且此系统对靶基因敲除效率的高效性,使得crispr/cas9系统成为继锌指核酸酶(zincfingerendonuclease,zfn)与转录激活样效应分子核酸酶(transcriptionactivator-likeeffectornuclease,talen)等敲除技术之后的又一种应用更为广泛的基因编辑技术,目前该技术广泛应用于细胞与动物模型的遗传学改造。斑马鱼asap1a位于第二号染色体,cds区约3400bp,29个外显子,编码蛋白约130kda,与人asap1蛋白的同源性可达76%,目前关于斑马鱼asap1a基因的解释与功能验证未见报道。人类asap1(adpribosylationfactor-gtpaseactivatingprotein)是adp-核糖基化因子(adp-ribosylationfactors,arf)的gtp酶激活蛋白,关于asap1的功能主要集中在与细胞内吞、细胞内膜泡转运与细胞骨架的运动调控方面,还与肿瘤的转移和扩散有关。asap1作为近年来新发现的结核易感基因,首先由剑桥大学研究者通过gwas筛选得到,他们发现位于asap1内含子的11个snp位点与结核病易感染性相关,之后国内研究者在不同地区、种族人群中进行了asap1关联性研究及连锁分析,且对asap1的功能和影响结核易感的机制在细胞水平上作出了初步探究,现主要集中在asap1蛋白表达对于免疫细胞迁徙能力的调控进而影响人类对于结核病的易感性。斑马鱼作为近年来新型的模式生物日益成为体内试验理想的动物模型,且已经被逐渐用作研究疾病致病机理的良好材料。目前斑马鱼-海鱼分枝杆菌模型被广泛应用于结核病致病机理的基础研究,此模型的显著优势在于海鱼分枝杆菌感染斑马鱼与结核分枝杆菌感染人的病理病程极其相似,并且斑马鱼拥有与人类相似的复杂的免疫系统,发育早期机体呈现透明状,这极大地方便了研究者实时观察和动态研究细菌感染与机体病理损伤过程,如:肉芽肿的形成和成熟。因此,在斑马鱼中利用基因编辑的手段对结核病易感基因改造,建立以斑马鱼为生物模型的结核病动物模型,对研究结核病易感基因的功能和结核病药物的筛选具有良好的指导意义。但是,目前国内鲜有利用反式遗传学手段在斑马鱼模型中研究结核易感病理的报道,也未有利用基因编辑技术产生斑马鱼asap1a基因突变体的报道。本专利则通过crispr/cas9技术建立斑马鱼asap1a敲除突变体,为深入研究asap1a的基本功能和结核病易感机制提供材料基础。技术实现要素:为了填补对于斑马鱼asap1a基因基本功能的认识空白以及探究结核病易感性调节机制,利用基因编辑的手段对斑马鱼asap1a进行改造建立基因敲除动物模型就显得尤为重要,本发明的目的在于提供一种高效的利用crispr/cas9技术构建斑马鱼asap1a基因敲除突变体的方法,具体是通过以下技术步骤来实现的:s1.在斑马鱼asap1a基因上选择asap1a-grna靶位点,分析确认asap1a-grna靶位点敲除特异性;s2.制备asap1a-grna;s3.将asap1a-grna和cas9mrna导入斑马鱼中制备f0代斑马鱼,并鉴定asap1a-grna靶位点打靶效率;s4.鉴定f0代斑马鱼子代即f1代斑马鱼卵中asap1a基因类型,进而筛选出亲本f0代斑马鱼中可以遗传的asap1a敲除突变体;s5.筛选f2代斑马鱼中asap1a基因敲除纯合突变体,培养获得稳定遗传的斑马鱼asap1a基因敲除突变体,即完成利用crispr/cas9技术对斑马鱼asap1a基因敲除突变体的构建。作为上述方案的进一步改进,所述步骤s1中asap1a-grna靶位点序列为seqidno.1所示序列。其中靶位点的选择应遵循3’端为ngg的原则(n代表任意碱基)。作为上述方案的进一步改进,所述步骤s1中asap1a-grna靶位点位于斑马鱼asap1a基因第五个外显子上。本方法首先选择在asap1a蛋白的第一个结构域设置靶位点,有效地降低了因crispr/cas9敲除后产生的截短蛋白对后续基因功能研究的干扰。作为上述方案的进一步改进,所述步骤s2中制备asap1a-grna的方法为:s2.1将asap1a-grna靶位点的dna序列连接入pdr274载体;s2.2从重组的pdr274-asap1a-grna质粒中扩增t7promoter-asap1a-grna;s2.3扩增的产物进行pcr产物回收并进行体外转录得到asap1a-grna。通过琼脂糖凝胶电泳与nanodrop仪器检测asap1a-grna纯度,高质量的grna的合成可以最大程度的为后续生物体内敲除实验提供分子材料保证。作为上述方案的进一步改进,所述步骤s2.1中将asap1a-grna靶位点的dna序列连接入pdr274载体的引物序列为seqidno.2和seqidno.3所示序列。通过sanger测序鉴定pdr274-asap1a-grna是否连接成功。作为上述方案的进一步改进,所述步骤s2.2中扩增t7promoter-asap1a-grna引物序列为seqidno.4和seqidno.5所示序列。扩增的产物t7promoter-asap1a-grna通过进行琼脂糖凝胶电泳验证分子量是否与预期相符,保证后续体外转录实验的准确性。作为上述方案的进一步改进,所述步骤s3将asap1a-grna和cas9mrna导入斑马鱼中制备f0代斑马鱼,并鉴定asap1a-grna靶位点打靶效率,具体为:s3.1将体外转录获得的asap1a-grna与cas9mrna混合后通过显微注射导入斑马鱼受精卵,其中asap1a-grna终浓度为100ng/μl,cas9mrna终浓度为300ng/μl,导入体积为:1nl/卵;s3.2选取50粒已经导入asap1a-grna与cas9mrna的受精后24h斑马鱼卵并混合提取鱼卵基因组,且以此混合基因组为模板扩增asap1a-grna靶位点上下游序列各约150bp,将扩增产物测序后与野生型斑马鱼dna序列进行比对,计算设计的asap1a-grna靶位点敲除效率。排除显微注射等主观实验操作的影响因素外,选择的靶位点的突变效率原则上应高于20%,以方便后续f0代敲除斑马鱼种的筛选与鉴定,且保证此种crispr/cas9技术对斑马鱼asap1a基因敲除的高效性。作为上述方案的进一步改进,所述步骤s3.2中扩增asap1a-grna靶位点上下游序列各约150bp的引物为seqidno.6和seqidno.7所示序列。作为上述方案的进一步改进,所述步骤s4中鉴定f0代斑马鱼子代即f1代斑马鱼卵中asap1a基因类型,进而筛选出亲本f0代斑马鱼中可以遗传的asap1a敲除突变体,具体为:s4.1将导入asap1a-grna与cas9mrna的性成熟的f0代斑马鱼与ab野生型斑马鱼侧交,得到f1代斑马鱼卵,随机挑取受精后24h的f1代斑马鱼卵约50粒分别提基因组,然后以单个卵的基因组为模板利用seqidno.6和seqidno.7引物扩增asap1a-grna靶位点上下游序列各约150bp,将扩增产物测序后与野生型斑马鱼dna序列进行比对,通过鉴定f1代斑马鱼卵中asap1a基因类型进而分析f0代斑马鱼中是否产生可以遗传的asap1a成功敲除的突变体;s4.2将f1代鱼养至2-3月龄,剪取部分尾鳍分别提基因组,然后以单个尾鳍的基因组为模板利用seqidno.6和seqidno.7引物扩增asap1a-grna靶位点上下游序列各约150bp,将扩增产物测序后与野生型斑马鱼dna序列进行比对,测序鉴定不同类型突变的f1代斑马鱼,得到asap1a成功敲除的f1代杂合突变体。考虑到crispr/cas9技术在基因敲除过程中会出现的脱靶效应和误敲效应,所以在鉴定f1代突变斑马鱼的过程中应尽量筛选到2-3种不同突变类型的斑马鱼品系,进而增强实验结果的准确性。作为上述方案的进一步改进,所述步骤s5中筛选f2代斑马鱼中asap1a基因敲除纯合突变体,培养获得稳定遗传的斑马鱼asap1a基因敲除突变体,具体为:s5.1将鉴定得到的asap1a相同敲除突变类型的f1代斑马鱼自交,产生asap1af2代敲除突变体斑马鱼;s5.2待asap1af2代敲除突变斑马鱼长至2-3月龄,剪取部分尾鳍分别提取基因组,然后以单个尾鳍的基因组为模板利用seqidno.6和seqidno.7引物扩增asap1a-grna靶位点上下游序列各约150bp,将扩增产物测序后与野生型斑马鱼dna序列进行比对,鉴定f2代中asap1a基因敲除的纯合子,此即为稳定遗传的asap1a基因敲除突变体。本发明的有益效果是:1通过测序鉴定得到一个针对斑马鱼asap1a高敲除效率的asap1a-grna靶位点;2首次在斑马鱼中利用crispr/cas9技术获得asap1a基因敲除的纯合突变体,该突变体为国内外首例;3为解释斑马鱼asap1a基本功能和研究asap1a在结核易感中的作用提供动物材料;4该基因突变体可用于结核的易感功能基因研究与抗结核药物筛选研究。附图说明以下结合附图对本发明的具体实施方式做进一步的详细说明,其中:图1为asap1af1突变类型统计结果与示意图;图2为asap1af1和f2代纯合和杂合突变体斑马鱼基因型测序峰图结果。具体实施方式本发明中所涉及到的材料、设备具体如下:1材料与设备实验用鱼:本实验中所用的斑马鱼均为ab品系,购自于国家斑马鱼资源中心(czrc)。质粒:pdr274质粒,pucm-t质粒;pt3ts-nzcas9n质粒。主要试剂:dnaclean&contentrator-5(zymoresearch),普通dna纯化试剂盒(上海生工生物技术有限公司),megashortscripttmt7kit(invitrogencat#am1354),2×premixtaqtm(extaqtmversion2.0plusdye)(takara,rr902),质粒小提试剂盒(上海生工生物技术有限公司),dh5α感受态细胞(北京全式金生物技术有限公司),pucm-tvectorcloningkit(上海生工生物技术有限公司),2×primestarmaxpremix(takara,9165a),mmessagemmachinetmt3transcriptionkit(invitrogencat#am1348)。主要仪器:pcr仪器(品牌:abi,型号:veriti),离心机(品牌:genespeed,型号:1730r),震荡混匀仪(品牌:vortex-genie,型号:g560e),紫外分光光度计(品牌:thermoscientific,型号:nanodrop2000c),电泳仪(品牌:bio-rad,型号:powerpacbasic),凝胶成像仪(品牌:gene,型号:g:boxf3),垂直拉针仪(品牌:wpi,型号:pul-1000),恒温摇床(品牌:zhicheng,型号:zwy-200d),微量注射泵(品牌:wpi,型号pv830),恒温水浴锅(品牌:上海一恒,型号:dk-8d型),4℃冰箱(品牌:中科都菱,型号:mpc-5v316),-20℃低温冰箱(品牌:中科都菱,型号:mdf-25v278w),-80℃超低温冰箱(品牌:pana-sonic,型号:mdf-u53v),高压蒸汽灭菌锅(品牌:zealway,型号:gi80dws),电热恒温鼓风干燥箱(品牌:上海齐欣,型号:dhg-9055a),体式显微镜(品牌:olympus,型号:szx16)。2实验方法一种利用crispr/cas9技术构建斑马鱼asap1a基因敲除突变体的方法,包括如下步骤:s1.在斑马鱼asap1a基因上选择asap1a-grna靶位点,分析确认asap1a-grna靶位点敲除特异性。从ensemble网站上获取斑马鱼asap1a的蛋白编码序列(cds);在chopchop网站输入asap1a蛋白编码序列并设计靶位点,设定靶位点长度为18-22bp,靶位点的3’端碱基构成pam区,自动生成靶位点序列位于asap1a第5个外显子,见表1所示;表1asap1a-grna靶位点序列所述asap1a-grna靶位点序列为seqidno.1所示序列,在ensemble网站和ncbi上比对靶位点序列,比对结果显示asap1a-grna靶位点是asap1a基因的特异序列,且位于斑马鱼asap1a基因第五个外显子上。s2.制备asap1a-grna,方法为:s2.1将asap1a-grna靶位点的dna序列连接入pdr274载体,反应体系见表2所示,扩增引物信息见表3所示。表2pcr反应体系组分体积pdr274plasmid5-20ngforwardasap1a-grnaprimer(5mmol/l)0.5μluniversalreversecrisprprimer(5mmol/l)0.5μlprimestarmaxpremix(2×)10μlddh2oto20μl表3上述表2中的扩增引物信息注:表3引物序列信息中大写字母代表通用序列,小写字母代表特异性序列。按照表2反应体系进行pcr反应并将pcr产物进行电泳分离,得到大约2.1kbp电泳条带,将目的条带进行切胶回收后取40-100ng进行自连反应,转化入lbkana+平板;所述将asap1a-grna靶位点的dna序列连接入pdr274载体的引物序列为seqidno.2和seqidno.3所示序列。s2.2从重组的pdr274-asap1a-grna质粒中扩增t7promoter-asap1a-grna,使用引物信息见表4所示:表4引物序列所述扩增t7promoter-asap1a-grna引物序列为seqidno.4和seqidno.5所示序列。s2.3扩增的pcr产物进行回收,使用megashortscripttmt7kit进行体外转录得到asap1a-grna,反应体系为表5所示:表5体外转录反应体系组分体积t7promoter-asap1a-grnadnatemplate1000ng10×transcriptionbuffer2μl10mmatp1μl10mmctp1μl10mmgtp1μl10mmutp1μlt7enzymemix1μlnuclease-freewaterto20μl反应体系混匀后,37℃放置2h,再向体系中加入1μlturbodnase并混匀,37℃15min;每20μl体外转录体系中加入15μl醋酸铵和115μl无核酸酶水,混匀后放于-20℃冰箱至少1h;4℃12000rpm离心20min,弃去上清,用70%无核酸酶水乙醇清洗沉淀转录产物,4℃12000rpm离心5min,弃上清后将转录产物吹干,使乙醇挥发干净;加入适量的无核酸酶水溶解asap1a-grna沉淀;用nanodrop分光光度计检测浓度和od值,并电泳检测条带的单一性。s3.将asap1a-grna和cas9mrna导入斑马鱼中制备f0代斑马鱼,并鉴定asap1a-grna靶位点打靶效率,具体为:s3.1将体外转录获得的asap1a-grna与cas9mrna(质粒pt3ts-nzcas9n购自于国家斑马鱼资源中心)混合后通过显微注射导入斑马鱼受精卵,其中asap1a-grna终浓度为100ng/μl,cas9mrna终浓度为300ng/μl,加入10%酚红作为指示剂,导入体积为:1nl/卵;s3.2取注射后24h的发育正常的f0代鱼卵50粒混合放置于1.5ml离心管中,按照5μl/卵加入预先配制的鱼卵温和提取基因组溶液250μl(配方见表6),将鱼卵置于金属浴中50℃裂解2h,98℃5s灭活蛋白酶,其中混匀数次,加入等体积的异丙醇后吸取出白色线索状的物质,用70%乙醇洗涤2-3次,将白色物质吹干后,加入40-100μlddh2o混匀即得到斑马鱼卵的基因组dna;表6鱼卵温和提取基因组溶液配方组分终浓度或质量分数trisph8.210mmedta10mmnacl200mmsds0.5%proteinasek200μg/ml以上一步提取的斑马鱼卵的基因组dna为模板,用引物asap1a-grna-screenfr扩增asap1a-grna靶位点附近基因组dna(引物信息见表7),设计的引物应在靶位点的上下游各约150bp左右,由上海生工生物工程股份有限公司合成,然后pcr产物进行切胶回收并通过ta克隆连接入pucm-t载体,转化入lbamp+平板中,通过蓝白斑筛选阳性重组子,挑取48个阳性重组子使用通用引物m13分别进行菌落pcr,将48个pcr产物送测序检测敲除的效率。所述扩增asap1a-grna靶位点上下游序列各约150bp的引物为seqidno.6和seqidno.7所示序列。表7引物asap1a-grna-screenfr序列s4.鉴定f0代斑马鱼子代即f1代斑马鱼卵中asap1a基因类型,进而筛选出亲本f0代斑马鱼中可以遗传的asap1a敲除突变体,具体为:s4.1将导入asap1a-grna与cas9mrna的性成熟的f0代斑马鱼与ab野生型斑马鱼侧交,得到f1代斑马鱼卵,随机挑取受精后24h的f1代斑马鱼卵约50粒分别提基因组,将每颗鱼卵单独放于离心管后加入预先配制的鱼卵粗提取基因组溶液(配方见表8),置于金属浴中50℃裂解2h,98℃5s即得到鱼卵基因组粗提物,用引物seqidno.6和seqidno.7扩增asap1a-grna靶位点上下游序列各约150bp,扩增体系见表9所示,将扩增产物测序后与野生型斑马鱼dna序列进行比对,通过鉴定f1代斑马鱼卵中asap1a基因类型进而分析f0代斑马鱼中是否产生可以遗传的asap1a成功敲除的突变体,并饲养剩余的可以遗传的asap1a敲除突变f1代斑马鱼卵;表8鱼卵粗提取基因组溶液配方组分终浓度或质量分数trisph8.010mmedta2mmtritonx-1000.2%proteinasek200μg/ml表9pcr反应体系组分体积genomicdna0.5μlasap1a-grna-screenf(5mmol/l)0.5μlasap1a-grna-screenr(5mmol/l)0.5μl2×premixtaq10μlddh2oto20μls4.2将f1代鱼养至2-3月龄,剪取部分尾鳍分别提基因组,使用溶液与pcr反应体系同上述粗提鱼卵基因组方法,然后以单个尾鳍的基因组为模板利用seqidno.6和seqidno.7引物扩增asap1a-grna靶位点上下游序列各约150bp,将扩增产物测序后与野生型斑马鱼dna序列进行比对,测序鉴定不同类型突变的f1代斑马鱼,筛选至少2-3种突变类型,相同类型的突变体集中饲养,得到asap1a成功敲除的f1代杂合突变体。s5.筛选f2代斑马鱼中asap1a基因敲除纯合突变体,培养获得稳定遗传的斑马鱼asap1a基因敲除突变体,具体为:s5.1将鉴定得到的asap1a相同敲除突变类型的f1代斑马鱼自交,产生asap1af2代敲除突变体斑马鱼;s5.2待asap1af2代敲除突变斑马鱼长至2-3月龄,剪取部分尾鳍分别提取基因组,使用溶液与pcr反应体系同上述粗提鱼卵基因组方法,然后以单个尾鳍的基因组为模板利用seqidno.6和seqidno.7引物扩增asap1a-grna靶位点上下游序列各约150bp,将扩增产物测序后与野生型斑马鱼dna序列进行比对,鉴定f2代中asap1a基因敲除的纯合子,此即为稳定遗传的asap1a基因敲除突变体,然后通过自交获得大量的纯合突变体,即建立起可稳定遗传的asap1a基因敲除突变体。3试验例-敲除突变斑马鱼与结核病易感性的关联分析采用尾静脉注射的方法评价斑马鱼对于海分枝杆菌的易感程度,具体方法为:收集野生型与asap1a敲除突变体斑马鱼的受精卵,待发育至28-32h时用镊子除去卵膜,幼鱼浸泡在0.016%三卡因中进行麻醉。将海鱼分枝杆菌荧光细菌用pbs重悬至108cfu/ml,加入10%酚红溶液(0.2g/ml)作为注射指示剂,然后将此细菌悬液移入毛细注射针内。麻醉后的幼鱼将其放置于2%琼脂糖表面,将注射针管固定在持针器中,并与鱼体成45°夹角从泄殖孔附近的尾静脉处缓缓注入海鱼分枝杆菌悬液,注射完毕后用轻轻将幼鱼移入新鲜的e3培养液中,定期更换培养液并统计胚胎的存活率。注射后每天观测鱼体内细菌的荧光强度与扩散程度,共聚焦显微镜采集荧光图片后,用imagej软件分析细菌荧光密度,比较敲除突变asap1a斑马鱼与野生型斑马鱼对于结核分枝杆菌的易感程度。本发明实施例提供一种利用crispr/cas9构建斑马鱼asap1a基因敲除突变体的方法,其具体结果与特征在于:1测序分析得到asap1a-grna靶位点打靶效率高达80%以上;2得到asap1a基因敲除突变体斑马鱼三个品系,具有不同的突变类型:突变1(mt1):缺失14bp;突变2(mt2):缺失2bp插入1bp;突变3(mt3):缺失10bp,测序峰图与说明如附图所示;3得到的asap1a突变体斑马鱼其蛋白翻译提前终止,三个突变都位于asap1a蛋白的第一个结构域bar,野生型asap1a蛋白有1151个氨基酸构成,突变1有107个氨基酸,突变2有155个氨基酸,突变3有152个氨基酸;4得到的asap1a突变体斑马鱼无致死现象,为进一步研究asap1a的功能提供了材料基础,将有助于结核病易感基因的研究以及结核病药物的筛选。序列信息表:seqidno.1:acaggcactggacaagtt;seqidno.2:acaggcactggacaagttgttttagagctagaaatagc;seqidno.3:cctatagtgagtcgtattagc;seqidno.4:cattatggtgaaagttggaac;seqidno.5:aaaagcaccgactcggtgccac;seqidno.6:tggaaggaagagcatgaattgtc;seqidno.7:ctttaccaggttcttgaggaga;以上实施例不局限于该实施例自身的技术方案,实施例之间可以相互结合成新的实施例。以上实施例仅用以说明本发明的技术方案而并非对其进行限制,凡未脱离本发明精神和范围的任何修改或者等同替换,其均应涵盖在本发明技术方案的范围内。序列表<110>山西大学长治医学院<120>利用crispr/cas9技术构建斑马鱼asap1a基因敲除突变体的方法<160>7<170>siposequencelisting1.0<210>1<211>18<212>dna<213>斑马鱼(zebrafish)<400>1acaggcactggacaagtt18<210>2<211>38<212>dna<213>质粒(plasmid)<400>2acaggcactggacaagttgttttagagctagaaatagc38<210>3<211>21<212>dna<213>质粒(plasmid)<400>3cctatagtgagtcgtattagc21<210>4<211>21<212>dna<213>质粒(plasmid)<400>4cattatggtgaaagttggaac21<210>5<211>22<212>dna<213>质粒(plasmid)<400>5aaaagcaccgactcggtgccac22<210>6<211>23<212>dna<213>斑马鱼(zebrafish)<400>6tggaaggaagagcatgaattgtc23<210>7<211>22<212>dna<213>斑马鱼(zebrafish)<400>7ctttaccaggttcttgaggaga22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1