酪蛋白平板法在蛋白酶酶活的定量分析中的应用的制作方法
本发明涉及蛋白酶活性检测技术领域,特别涉及混菌发酵法制备紫苏酱的方法。
背景技术:
蛋白质水解酶简称蛋白酶,是一种进行蛋白质水解的酶,是一组具有高度专一的蛋白水解功能的大型复杂酶分子,即通过水解形成蛋白质的多肽链中连接氨基酸的肽键,开始蛋白质的分解代谢。蛋白酶活性分析是研究和应用蛋白酶重要的一步。基于蛋白酶诱导底物裂解的策略,虽然比色法和荧光法在蛋白酶活性测定中得到了广泛的发展,但光信号重叠和复杂的化学标记过程限制了方法的应用。蛋白酶活性的检测有采用荧光法,但也有基于量热技术、放射性、免疫测定、电泳、安培、光学等方法的报道。基质辅助激光脱附/电离飞行时间质谱(maldi-tof-ms)、探针、或利用硅基纳米孔光子晶体的有机衍生化方法来固定化多肽,这些检测方法都需要一定的仪器且对实验者有一定的操作要求,故不常用。并且,许多蛋白酶检测技术需要耗时进行样品制备,这会对酶的天然活性产生不利影响。目前常用的蛋白酶活性检测方法是比色法。常见的蛋白酶活性主要通过检测酶水解前后,底物蛋白质浓度的减少或产物游离氨基酸或多肽浓度的增加进行量化表达。如紫外分光光度计法和缩二脲试剂法属于前者,而茚三酮显色法、三硝基苯磺酸法和福林酚试剂法属于后者。这些方法检测结果精确,但是检测有色食品时检测结果易产生误差,主要因为紫外分光光度计是利用光散射原理,当样品颜色过深时吸光值过大,从而产生误差。福林酚法测蛋白酶活力的原理为:以酪蛋白为底物,与样品反应一段时间后测定生成氨基酸的量,从而计算出样品蛋白酶活力,此方法缺点是影响反应体系的因素较多,样品中若含有柠檬酸、甘油、甘氨酸、tris缓冲液、透明质酸、二硫代苏糖醇、巯基乙醇、乙二胺四乙酸(edta)和尿素等物质,均会产生干扰作用;且受蛋白质特异性的影响,及不同蛋白质因酪氨酸、色氨酸含量的不同而使显色强度稍有不同,测定结果容易产生误差。
技术实现要素:
针对现有发明材料的不足,本发明提供了一种酪蛋白平板法在蛋白酶酶活的定量分析中的应用,它特别适合于检测有色样品蛋白酶活力,而且精密度高,重复性良好,并具有良好的回收率。
为实现以上目的,本发明通过以下技术方案予以实现:酪蛋白平板法在蛋白酶酶活的定量分析中的应用,包括如下步骤:本方法的步骤:
步骤一:制备酪蛋白平板:包括酪蛋白5g/l、葡萄糖10g/l、酵母膏1g/l、磷酸氢二钾1g/l、磷酸二氢钾0.5g/l、硫酸镁0.1g/l及琼脂20g/l,在121℃高压蒸汽灭菌20min;
步骤二:将培养基倒至培养皿,制成厚度均匀的平板;
步骤三:将所配制酪蛋白平板用10ml枪头进行打孔,一个平板三个孔,作为平行,吸取10μl酶液注入孔内,静置10min后放入37℃培养箱倒置培养1h-24h,取出测量其水解圈直径并计算溶解圈面积;将商业胰蛋白酶适当稀释配制成所需酶活力的溶液,分别在酪蛋白平板上进行打孔培养,以溶解圈面积为横坐标(x,mm2),商业胰蛋白酶活力为纵坐标(y,u×ml-1)做出商业胰蛋白酶标准曲线;
步骤四:样品酶活力按标准曲线步骤进行测定,将样品水解圈面积与商业胰蛋白酶标准曲线进行计算,得到相应待测样品酶活。
蛋白酶能水解以酪蛋白为底物的平板,形成可观察到的水解圈。酪蛋白水解圈容易观察,水解圈面积与蛋白酶酶活正相关,可基本不受颜色影响。基于此,构建了酪蛋白平板法对有色食品中蛋白酶活力进行定量分析。
以商业胰蛋白酶进行稀释,配制成不同活力溶液进行培养,测量结果作标准曲线,根据样品水解圈大小,计算样品活力,探讨利用酪蛋白平板法定量分析蛋白酶活力的可行性。这种方法的构建尤其适合于有色食品中蛋白酶的活力定量分析。
本发明同现有技术相比,本发明利用酪蛋白平板法检测有色食品中蛋白酶活力,结果表明酪蛋白平板法线性关系较好,精密度较好、重复性较好,检测限较低,对有色样品蛋白酶活力的检测结果准确,为蛋白酶活力检测提供了一种新方法。本发明优点是能有效的避免由于样品颜色过深导致的误差及测量结果不准确,对于样品颜色、形态没有要求,可用于检测浅色或无色样品,也可用于检测深色样品如红心火龙果等,其操作简单,应用范围广,能达到一般的检测要求。本发明可有效应用于酱油、茶叶等颜色较深的产品酶活力测定。
附图说明
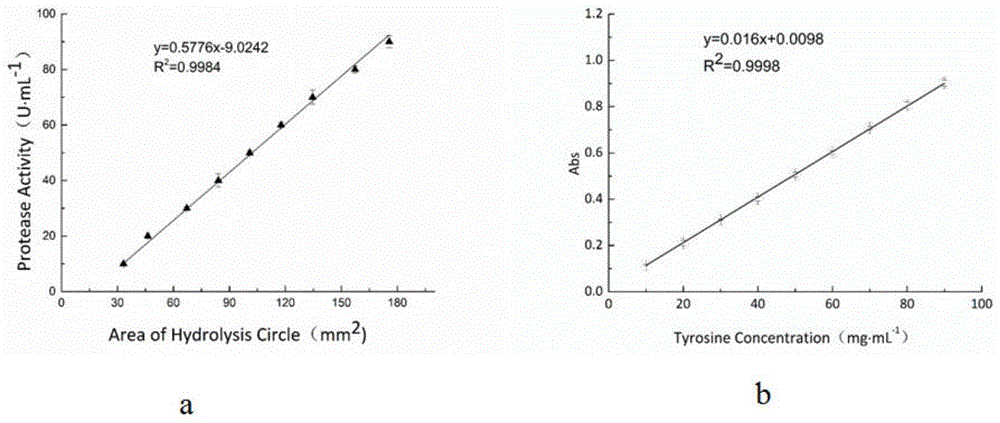
图1为胰蛋白酶标准曲线和酪氨酸标准曲线;
图2为无色样品中蛋白酶活性的检测;
图2中,a:酪蛋白平板商业化胰蛋白酶水解圈;b:酪蛋白平板无菌水水解;c:福林酚法与酪蛋白板法的比较;
图3为有色样品酶活力测定;
图3中,a:失活酱油样品在酪蛋白平板水解图;b:酱油样品在酪蛋白平板水解图;c:酪蛋白法和福林酚法检测有色食品
具体实施方式
实施例1福林酚法与酪蛋白平板法对比
(1)酪蛋白平板法:将所配制酪蛋白平板用10ml枪头进行打孔(一个平板三个孔,作为平行),吸取10μl酶液注入孔内,静置10min后放入37℃培养箱倒置培养18h,取出测量其水解圈直径并计算溶解圈面积。将商业胰蛋白酶适当稀释配制成所需酶活力的溶液,分别在酪蛋白平板上进行打孔培养,以溶解圈面积为横坐标(x,mm2),商业胰蛋白酶活力为纵坐标(y,u·ml-1)做出商业胰蛋白酶标准曲线。样品酶活力按标准曲线步骤进行测定,将样品水解圈面积与商业胰蛋白酶标准曲线进行计算,得到相应待测样品酶活。
(2)福林酚法:按gb/t23527-2009《蛋白酶制剂》进行测定。
(3)两种方法检测结果对比
图1(a)为测蛋白酶活力的标准曲线,其回归方程为y=0.016x+0.0098,r2=0.9998,其中y为吸光度,x为酪氨酸浓度(μg/ml)。利用回归方程,计算出当吸光度为1时的酪氨酸浓度(μg/ml),即吸光常数k值(应该在95~100范围),本实验k为99。图1(b)为胰蛋白酶标准曲线,其回归方程为y=0.5776x-9.0242,r2=0.9984,其中y为商业胰蛋白酶活力(u·ml-1),x为水解圈面积(mm2)。根据gb/t27404-2008《实验室质量控制规范》,确证方法回归系数要求0.99,本标准曲线回归系数为0.9984,符合标准,并表明在较宽范围内,水解圈面积与蛋白酶活力之间存在较好的线性关系。
商业胰蛋白酶溶液水解酪蛋白平板如图2(a、b),可明显观察到加入胰蛋白酶溶液进行反应的酪蛋白平板出现圆滑且轮廓边缘清晰的水解圈,而无菌水水解酪蛋白平板未出现水解圈,说明其没有蛋白酶活力。水解圈圆滑、边缘明显能有效减小测量时产生的误差,得到更准确的测量结果。
对25u/ml的商业蛋白酶溶液分别用福林酚法与酪蛋白平板法进行测定,如图2(c)。可以看出两种方法检测结果较为接近,福林酚法测定结果为24.14u/ml,酪蛋白平板法测定结果为24.01u/ml。福林酚法作为当前应用最广泛的蛋白酶活力检测方法,具有一定的代表性,酪蛋白平板法对于商业胰蛋白酶的检测结果与福林酚法检测结果几乎一样(p>0.05),说明酪蛋白平板法检测结果较为准确可信。
实施例2酪蛋白平板法精密度
准确称取18份0.100g商业胰蛋白酶,加入无菌水溶解定容至10ml,配制成250u/ml胰蛋白酶溶液,分别稀释成6份10u·ml-1、25u·ml-1、50u·ml-1溶液。分别吸取10μl注入酪蛋白平板,静置10min后于37℃培养箱倒置培养18h,测量其水解圈直径,计算酶活力及rsd值。
表1低浓度、中浓度和高浓度测量结果及rsd值
该方法的精密度结果如表1所示。精密度为1.22%-8.07%,均小于10%,低浓度下其rsd范围为2.92%-8.07%,小于10%;中浓度下其rsd范围为0.45%-4.86%,小于10%;高浓度下其rsd范围为1.22%-2.85%,小于10%。haowu使用hplc-uv测定邻苯二甲酸酯含量,其精密度范围为3.9%~5.7%,本方法精密度为1.22%-8.07%,较其稍高一些,这主要是因为本实验为人工测量,有一定的操作误差,而haowu是使用仪器进行测定,对精密度要求更高。以上结果表明,此方法测量结果rsd值均小于10%,可以说明本方法精密度较好。
实施例3酪蛋白平板法检测限
准确称取0.1g商业胰蛋白酶,溶于10ml水,配制成250u/ml溶液。再吸取1ml以上浓度溶液,稀释25倍,配制成10u/ml溶液。再分别配制成1u/ml、2u/ml、3u/ml、4u/ml、5u/ml、6u/ml、7u/ml、8u/ml、9u/ml、10u/ml,分别吸取10μl注入酪蛋白平板,静置10min后于37℃培养箱倒置培养18h,测量其水解圈直径,计算酶活力及rsd值,平行三次。结果如表2所。
表2检测限实验结果
根据实验结果,在蛋白酶活力为7u/ml时能检测到较为精确的结果,检测值分别为7.115、7.115、6.604u/ml,平均值为6.945u/ml,标准偏差0.295,相对标准偏差4.25%,小于10%,结果较为准确。而在蛋白酶活力为6u/ml时,其测量结果接近6u/ml,但其rsd为8.57%,误差较大,测量结果容易产生误差,故此方法检测限为7u/ml。
实施例4酪蛋白平板法重复性
准确称取6份0.100g商业胰蛋白酶,加入无菌水溶解定容至10ml,配制成250u/ml胰蛋白酶溶液。吸取250u/ml胰蛋白酶溶液1ml,稀释10倍,为25u/ml。分别吸取10μl注入酪蛋白平板,静置10min后于37℃培养箱倒置培养18h,测量其水解圈直径,计算酶活力及rsd值。对25u/ml蛋白酶溶液使用酪蛋白平板法测定其酶活力,结果表明测量值rsd在2.1%-5.73%之间,小于10%,说明结果较为准确。rsd是表明方法准确度的一个重要指标,本方法重复性好,误差小,检测结果准确可靠。
表3重复性实验结果
实施例4有色食品蛋白酶活力测定
称取1g桑葚干、火龙果、紫甘蓝和红苋菜样品,加入10mlpbs缓冲液进行浸提24h(酱油直接进行检测)。酪蛋白平板打孔,注入10μl酶液,放置10min后37℃进行倒置培养18h。测量其水解圈直径并计算其酶活力和rsd值。
经过pbs浸提24h后的样品用慢速定性滤纸过滤,滤液在8000r/min下离心10min,使菌体沉淀,得到粗酶液。吸取10μl样品粗酶液注入打孔的酪蛋白平板,静置10min后于37℃培养箱倒置培养18h,取出测量其水解圈直径并计算其面积与酶活力。并对提取液进行福林酚法测定蛋白酶活力,结果见图3。
酱油样品水解酪蛋白平板如图3,图3(a)未出现明显水解圈,说明此样品没有蛋白酶活力,未能对底物酪蛋白进行水解作用,故未产生水解圈;图3(b)出现明显水解圈,表明此样品对底物酪蛋白产生了一定的水解作用,水解点样点周围一定范围内的酪蛋白,故出现明显水解圈。通过测量水解圈直径计算水解圈面积,再根据商业胰蛋白酶标准曲线可计算出样品蛋白酶活力。
福林酚法对有色样品如桑葚干和红心火龙果等蛋白酶活力的测定与酪蛋白平板法检测相差较大,结果如图3(c)。使用福林酚法测定烟叶蛋白酶活力时,桑葚干提取液样品颜色过深,经过福林酚试剂等反应后颜色为蓝黑色,经紫外可见分光光度计测定其吸光值为4.000,已达到分光光度计最大值,这主要是因为杂散光的原因,使分析测试结果严重偏离朗伯比尔定律,会使分析误差增大,造成结果不准确。本次对有色样品即桑葚干样品的检测,对提取液进行10倍稀释,得到溶液颜色为橘色。对此溶液进行福林酚法测蛋白酶,得到反应液为蓝黑色,通过测定其吸光值,发现空白管比样品管吸光值高,这主要是因为杂散光的原因,产生试样浓度增大时,吸光度值反而减小等反常现象。杂散光可能使分析测试结果的数据偏小,也可能偏大;若测试波长以外的杂散光被试样吸收则测量数据偏小,这是本实验样品管吸光值比空白管吸光值小的主要原因。采用福林酚法测定了火龙果和酱油等有色食品中蛋白酶的活性。火龙果、酱油、紫甘蓝、苋菜的相对标准偏差分别为131.32%、55.13%、27.2%和10.10%。相对标准偏差表明,用福林酚法检测有色食品中蛋白酶活性的误差较大。然而,该方法没有检测到桑葚干中蛋白酶的活性,说明该方法的结果是错误的,不可靠的。采用酪蛋白平板法测定了六种有色食品提取物的蛋白酶活性。结果的相对标准偏差在4.265-10.35%之间,误差较小,结果准确可靠。
实施例5有色样品蛋白酶活力加标回收
对酱油、红心火龙果、紫甘蓝、红苋菜和桑葚干样品进行加标,加入10u/ml商业胰蛋白酶溶液,吸取10μl混合液体注入酪蛋白平板孔内,于37℃倒置培养18h。取出,测量其直径,计算水解圈面积及酶活。
福林酚法加标采用50μg/ml酪氨酸溶液进行加标回收实验。吸取0.1ml酪氨酸溶液于试管中,按照福林酚法检测蛋白酶活力进行测定。加标回收率=(加标式样测定值-试样测定值)/加标量*100%。
福林酚法和酪蛋白平板法对5种有色食品的回收率见表4。酪蛋白平板法回收率为92.26%-97.84%,相对标准偏差为3.91%-10.88%。而福林酚法的回收率为0.99%-4.21%,相对标准偏差为17.59%。而福林酚法测定红火龙果的加标回收率为4.21%,其相对标准偏差为17.59%;紫甘蓝的加标回收率为0.99%,相对标准偏差为112.31%,这是因为标准误差大于样品检测值。但桑葚干样品中未检测到酶活性,酱油加标样品中也未检测到酶活性,故无法计算桑葚干和酱油样品的回收率。在测定红苋菜加标回收率时,发现标准添加酶的活性为0.446±0.35u/ml,样品的活性为1.386±0.14u/ml,加标样品酶活力为0.446±0.35u/ml,加标样品酶的活性小于样品的酶活性,无法计算回收率。用福林酚法检测有色食品的结果误差较大,且可能无法检测到酶活。
根据gb/t27404-2008《实验室质量控制规范-食品理化检验》,被粗组分含量<0.1mg/kg时,其加标回收率应在60~120%之间,酪蛋白平板法检测样品回收率为97.8%~107.49%,在此区间内,说明此方法对蛋白酶活力测定较为准确;而福林酚法检测红心火龙果样品时,其回收率仅为4.21%,未达到国家标准要求,说明福林酚法进行有色样品蛋白酶活力测定时,误差较大,结果不准确。并且在使用福林酚法检测酱油样品时,尽管酱油样品已从棕黑色稀释10倍至橘色,但还是出现了样品管吸光值较空白管吸光值低的情况,说明颜色对福林酚法干扰较为严重,使用福林酚法检测有色样品蛋白酶活力时,其结果不可靠。
表4有色食品样品加标回收
通过使用福林酚法与酪蛋白平板法对已知酶活胰蛋白酶溶液进行检测,结果表明酪蛋白平板法检测结果准确;对酪蛋白平板法检测精密度、检测限、重复性实验,结果表明精密度、重复性良好,检测限为7u/ml。通过使用福林酚法和酪蛋白平板法对实际样品如桑葚干、酱油、红心火龙果等进行蛋白酶活测的定量测定,并检测其加标回收率,结果表明酪蛋白平板法安检测较准确,误差较小,且回收率较好。6种有色样品的回收率在92.26%-107.49%之间,相对标准偏差在3.91%-10.88%之间。酪蛋白平板法测定结果具有较高的准确度。
说明本发明能有效的避免由于样品颜色过深导致的误差及测量结果不准确,对于样品颜色、形态没有要求,可用于检测浅色或无色样品,也可用于检测深色样品如红心火龙果等,其操作简单,应用范围广,能达到一般的检测要求。本发明可有效应用于酱油、茶叶等颜色较深的产品酶活力测定。
以上实施方式仅是本发明的具体例子,显然本发明的实现并不受上述方式的限制。只要采用本发明的方法构思和技术方案进行的非实质性改进,或未经改进将本发明的构思和技术方案直接应用于其他场合的,均在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!