一种从流体剪切应力灌流液中分离外泌体的方法与流程
本发明涉及泌体的研究领域,具体地讲是涉及一种从流体剪切应力灌流液中有效分离外泌体的方法。
背景技术:
此前,人们体外对血管内皮细胞分泌的外泌体的研究,仅限于正常量的细胞培养液,最常见为底面积为10cm2的细胞,只需要2毫升培养基。此时,细胞培养液的量少、其中外泌体的浓度相对较高,易于提取。然而,该类研究局限于静态细胞,忽略了体内细胞所处的流体剪切应力环境。体内的血管内皮细胞,位于血管的最内层,在正常情况下会受到血液流动产生的流体剪切应力的影响。
因此,为了更好的模拟体内真实微环境,必须同时观察内皮细胞在流体剪切应力环境下的外泌体分泌情况。目前学者们用构建的体外剪切应力加载系统来干预内皮细胞,以更好的反映体内血液流动的真实环境。但目前流体剪切应力对内皮细胞的影响,仅涉及细胞的形态及功能,未涉及对细胞分泌外泌体的影响、以及不同形式的流体剪切应力(层流或振荡流)干预细胞后,分泌的外泌体中内容物的差异表达。主要原因是流体剪切应力干预细胞时,需要大量的培养液(>100毫升),其中外泌体的浓度相对较低、液体量多,用传统的超速离心法、超滤法和亲和层析法无法有效进行,导致此类外泌体功能的研究不能顺利开展。
本发明创建了一种能够有效从剪切应力加载系统的灌流液中分离外泌体的技术和方法,能够成功从大量的灌流液中分离得到高浓度、高质量的外泌体,其大小、完整性及活性良好,为流体剪切应力(层流或振荡流)干预细胞后外泌体的差异表达及相关功能研究提供可行的研究手段。
技术实现要素:
本发明的目的在于克服上述传统技术的不足之处,提供一种从流体剪切应力(层流或振荡流)加载系统灌流液中有效分离外泌体的技术和方法,能有效的从大容量灌流液中分离得到结构完整的、高浓度、高质量的外泌体,进而研究流体剪切应力对细胞外泌体的影响以及应用外泌体进行后续相关研究。
本发明的目的是通过以下技术措施来达到的:
一种从流体剪切应力灌流液中分离外泌体的方法,包括以下步骤:
s1:收集灌流液:将流体剪切应力干预完细胞之后的细胞灌流液收集,离心后取上清液,将上清液用0.22微米过滤器过滤,得过滤灌流液;
s2:冷冻:将过滤灌流液冷冻至-80℃;
s3:真空干燥制粉:将冷冻的过滤灌流液置入真空冻干机,冻干成粉;
s4:复溶过滤:将冻干成粉的过滤灌流液加入培养液溶解,以0.45微米过滤器过滤,得复溶灌流液;
s5:离心:将复溶灌流液离心,取上清液,得外泌体浓缩液。
s6:脱盐提纯:将将外泌体浓缩液置于透析袋中,透析袋置于缓冲液中透析,得到脱盐提纯后的外泌体浓缩液。
s7:纯化外泌体悬液制备:
s7-1:透析提纯后的外泌体浓缩液与bufferxbp按照1:1比例混合,翻转并混匀后,置入自旋柱中,500g,1min,倒掉收集管中的液体;
s7-2:将自旋柱重新放入收集管中再加入bufferxwp,3000g,10min,倒掉收集管中的液体;
s7-3:将自旋柱转移到新的收集管,在自旋柱中加入bufferxe,500g洗脱5min,收集洗脱液;
s7-4:将洗脱液放入自旋柱中,静置1min,3000g洗脱10min,可得到纯化的外泌体悬液。
s8:冷藏保存:将收集的外泌体悬液冷却至-80℃,备用。
其中,s2中冷冻时间为24小时,s3中真空冻干机冻干16小时以上。
其中,s4中得到的复溶灌流液与过滤灌流液体积之比为1:5~20,优选为1:10。
其中,s5中将复溶灌流液冷却至4℃,并在4℃条件下以3000g离心30分钟。
其中,s6中采用的缓冲液为磷酸盐缓冲液,采用透析袋的孔径是25nm~30nm,透析时间为12小时,每3小时更换一次透析液。
其中,纯化外泌体悬液制备采用的是exoeasymaxikit试剂。
本发明中的外泌体提取方法和传统方法相比,
(1)同外泌体最经典的超速离心法相比,本发明不需要昂贵的超速离心机即可操作,而且不会因为高速离心破坏外泌体结构的完整性。
(2)同常用的超滤法相比,本发明应用冻干技术,可一次性冻干大量液体成粉末状并全部收集,将所有外泌体都包含在内,避免了用多个超滤管分多次提取之后,收集过程中造成的外泌体损耗;也避免了超滤膜破损或堵塞后造成的外泌体损失。
(3)同亲和层析法相比,本方法更加经济和高效,商用试剂盒提取100毫升流体剪切应力灌流液中的外泌体,需要5000元左右,而应用本方法之后只需1/10的价格即可完成一次提取;而且用商用试剂盒需要分多次提取,重复多次提取过程中同样伴随着外泌体的损耗。
(4)通过透析技术,能有效把冻干液的高渗状态变成等渗状态,应用外泌体干预细胞时避免了渗透压的产生不利影响。
(5)本发明获得的外泌体大小合适、结构完整、浓度较高。
由于采用了上述技术方案,与现有技术相比,本发明的优点是:
本发明公开了一种从流体剪切应力灌流液中分离外泌体的方法,采用冻干、复溶浓缩流体剪切应力灌流液中外泌体的方法,使流体剪切应力灌流液中外泌体浓缩10倍左右,且浓缩过程中不损伤外泌体,不造成外泌体损耗,获得的外泌体不仅结构完整,纯度高,杂蛋白污染少,还可一次性提取大量细胞灌流液中的外泌体,不需要昂贵的设备,所用耗材价格低廉,提取方法简单、易于操作。
下面结合附图和具体实施方式对本发明作进一步说明。
附图说明
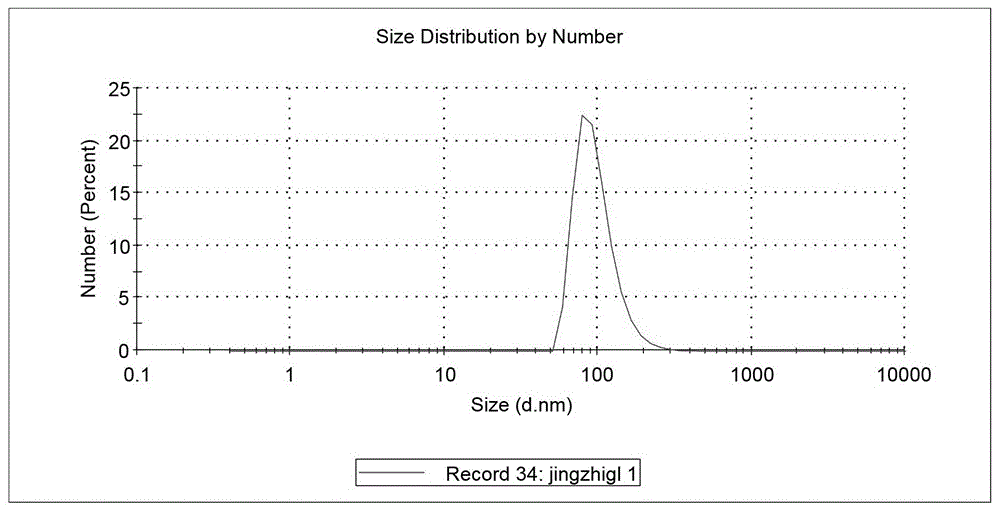
附图1是应用本发明提取的外泌体粒径分析结果图。
附图2是应用本发明提取的外泌体电镜检查结果图。
附图3是应用本发明提取的外泌体中表达标志分子cd9的wb结果图。
附图4是应用本发明提取的外泌体中表达标志分子cd81的wb结果图。
附图5是应用本发明提取的外泌体进行荧光定量pcr分析结果图。
附图6是应用本发明提取的外泌体进行pkh26染色的图。
附图7是应用本发明提取的外泌体进行dapi染细胞核的图。
具体实施方式
实施例:本实施例中以实验室从流体剪切应力灌流液中分离外泌体的方法为例,进一步说明本发明。
分离外泌体步骤如下:
s1:收集灌流液:流体剪切应力干预完细胞之后,收集细胞灌流液100毫升,离心机3000rpm离心5分钟以去除细胞碎片;取上清液用0.22微米针头滤器过滤,以去除大颗粒的非外泌体的囊泡结构,得过滤灌流液;
s2:冷冻:将过滤灌流液放于多个50毫升的一次性塑料平皿,培养液量不多于平皿容量的2/3,将装有冷冻的过滤灌流液的平皿放在-80℃冰箱24小时,使其冷冻成固体;
s3:真空干燥制粉:取出冷冻的装有过滤灌流液的平皿快速用保鲜膜封口,保鲜膜封口处扎孔,封口时保持保鲜膜松弛,将封口的平皿放入真空冻干机冻干16小时以上,使冷冻的过滤灌流液冻成粉末。
s4:复溶过滤:收集冻干成粉末的过滤灌流液,用7毫升无外泌体血清的培养液溶解,溶解后溶液体积10毫升左右,以0.45微米针式过滤器过滤到15毫升规格的离心管中,得复溶灌流液;
s5:离心:将复溶灌流液冷却至4℃,并在4℃条件下以3000g离心30分钟,取上清液,得到外泌体浓缩液。
至此时,100毫升灌流液浓缩成10毫升外泌体浓缩液。
s6:脱盐提纯:将将外泌体浓缩液置于透析袋中,透析袋置于磷酸盐缓冲液中进行透析,得到脱盐提纯后的外泌体浓缩液。磷酸盐缓冲液即pbs,采用透析袋的孔径是25nm~30nm,透析时间为12小时,每3小时更换一次透析液。本步骤保证外泌体被完全截留在透析袋内,同时高渗的盐颗粒则会透过透析袋被滤除,从而得到等渗脱盐提纯的外泌体浓缩液。
本步骤得到的等渗脱盐提纯的外泌体浓缩液就可以按照传统步骤进一步提取外泌体,而本发明采用了更优化的外泌体提取方法,提高外泌体提取效率和纯度,外泌体粒径均位于30-150nm之间,大小合适,外泌体结构完整、活性良好。
具体步骤如下:
s7:纯化外泌体悬液制备:
s7-1:透析脱盐提纯后的外泌体浓缩液加入普通离心管,按照1:1比例加入bufferxbp混合,上下翻转5次以混匀后,置入自旋柱中,500g,1min,倒掉收集管中的液体;
s7-2:将自旋柱重新放入收集管中再加入10毫升bufferxwp,3000g,10min,倒掉收集管中的液体;
s7-3:将自旋柱转移到新的收集管,在自旋柱中加入500微升bufferxe,500g洗脱5min,收集洗脱液。洗脱前可先孵育1分钟;
s7-4:将洗脱液放入自旋柱中,静置1min,3000g洗脱10min,可得到纯化的外泌体悬液。
s8:冷藏保存:将收集的外泌体悬液冷却至-80℃,即得纯化外泌体。
上述s7中纯化外泌体悬液制备采用的是exoeasymaxikit试剂。
经上述步骤纯化提取的外泌体实验室检查结果如下:
1、粒径结果:将外泌体悬液取出10微升,用1毫升已过滤的pbs重悬,通过纳米粒度及zeta电位分析仪进行分析。结果显示,该方法提取的外泌体粒径均位于30-150nm之间,表明其大小合适、纯度非常高。分析结果见附图1。
2、电镜结果:电镜下可见外泌体呈现典型的结构清晰完整的囊泡样结构;电镜图片见附图2。
3、wb结果:可见表达外泌体的标志分子cd9,cd81;cd9见附图3,cd81见附图4。
4、荧光定量pcr:可见里面包含内皮细胞表达的cd31和vwf和gapdh等mrna及mir-126、mir-21、mir-155及u6等microrna等分子;分析结果见附图5。
5、pkh26染色后,见附图6,附图6为pkh26染色外泌体,彩色图片上可见外泌体膜上呈现红色荧光;而且染色后的外泌体可以被正常细胞吸收。附图7显示dapi染细胞核,彩色图片中为蓝色,其中dapi染细胞核,代表一个完整的细胞。表明外泌体结构完整、活性良好。pkh26即专门染膜性结构的红色荧光染料。
以上结果提示,通过本发明的提取方法,能够从大量液体中分离得到大小合适、纯度较高、结构完整和活性良好的外泌体,为下一步进行相关外泌体功能研究打下坚实的基础。
- 还没有人留言评论。精彩留言会获得点赞!