作为Wee1抑制剂的嘧啶衍生物的制作方法
作为wee1抑制剂的嘧啶衍生物
技术领域
[0001]
本发明属涉及药物化学领域,更具体而言,涉及具有wee1激酶抑制作用的新化合物,及其制备方法和该类化合物在抗肿瘤药物制备中的用途。
背景技术:
[0002]
wee-1蛋白激酶是细胞周期检查点中重要的负调控蛋白。细胞周期检查点包括g1(细胞静息期)到s期(dna合成期)转变的g1期检查点,g2(细胞分裂准备期)到m(细胞分裂期)期转变的g2期检查点以及m期metaphase(细胞分裂期中期)到anaphase(细胞分裂期后期)转变的纺锤体检查点。wee-1蛋白激酶在g2期检查点中发挥了重要的作用。细胞进入m期依赖于cdk1激酶活性,wee-1通过磷酸化cdk1蛋白的tyr15,抑制cdk1的活性,阻止细胞进入m期(细胞分裂期)。而polo kinase激酶磷酸化wee-1,激活wee-1蛋白的降解,促进细胞进入m期。由此可见,wee-1激酶活性决定了g2检查点的活性,进而调节细胞g2到m期的转变[cell cycle,2013.12(19):p.3159-64.]。
[0003]
细胞周期检查点主要在dna损伤后激活,对细胞中dna的修复发挥了重要作用。细胞周期检查点的正常激活阻滞细胞周期促进dna修复。抑制检查点的功能,dna损伤无法修复,细胞发生凋亡。与正常细胞相比,多种肿瘤细胞由于g1期检查点重要蛋白p53蛋白的功能受损,主要依赖于g2期检查点的激活修复dna损伤,规避凋亡。因此,抑制g2期检查点,可以选择性的杀伤肿瘤细胞。而wee-1激酶活性在g2期检查点中的重要作用,提示wee-1激酶决定了dna损伤后肿瘤细胞的修复或死亡,抑制wee-1活性可以促进dna损伤后未修复的肿瘤细胞进入m期,诱发凋亡[curr clin pharmacol,2010.5(3):p.186-91.]。
[0004]
研究表明,除了在g2检查点中的作用以外,wee-1还参与了dna合成,dna同源修复,染色体组蛋白翻译后修饰等与肿瘤发生和发展密切相关的功能[j cell biol,2011.194(4):p.567-79.]。在大量包括肝癌,乳腺癌,宫颈癌,黑色素瘤和肺癌等肿瘤中[plos one,2009.4(4):p.e5120.;hepatology,2003.37(3):p.534-43.;mol cancer,2014.13:p.72.],wee-1表达大大升高。而wee-1的高表达与肿瘤的发展和预后较差成正相关,提示wee-1激酶可能参与了肿瘤的发生和发展。体外细胞模型和体内动物模型的研究表明在诱发dna损伤的同时抑制wee-1活性能够显著抑制多种肿瘤的生长[cancer biol ther,2010.9(7):p.514-22.;mol cancer ther,2009.8(11):p.2992-3000.]。
[0005]
因此,开发特异性的高活性wee-1激酶的小分子抑制剂对于肿瘤治疗,尤其是靶向诸如p53缺失的g1检查点受损的肿瘤具有重要的临床价值。
技术实现要素:
[0006]
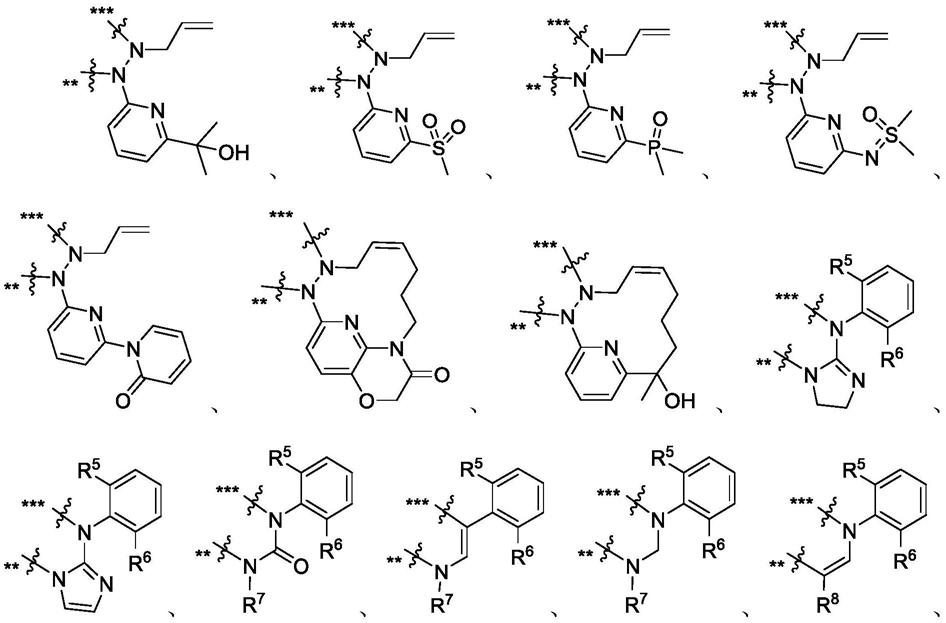
本发明提供了结构如式(1a)或式(1b)所示的化合物、其光学异构体或其药学上可接受的盐,
[0007][0008]
其中,
[0009]“*”表示手性中心;
[0010]
n为0或1;
[0011]
w为-co-或-ch
2-;
[0012]
y为h、f、me或ome;
[0013]
m为-ch
2-、-cf
2-、-o-、-nr
1-、-n(cor1)-、-n(coor1)-、-ch(or1)-或-ch(nr2r3)-,其中r1为h、c1-c3烷基、c3-c6环烷基、卤素取代c3-c6环烷基或杂环烷基,r2和r3独立为h或c1-c3烷基,或r2和r3共n形成4-7元杂环烷基;
[0014]
q为-o-、-s-或-nr
4-,其中r4为h、c1-c3烷基或c3-c6环烷基;
[0015]
x为下列基团:
[0016][0017]
[0018]
其中,“**”表示与嘧啶环直接连接,“***”表示与w连接,r5和r6独立为h、f、cl或me,r7为h、c1-c3烷基或c3-c6环烷基,r8为h、cn、c1-c3烷基或卤素取代c1-c3烷基,r9为c1-c3烷基或卤素取代c1-c3烷基。
[0019]
本发明的一些方案中,上述r1为h、me、et、
n-pr、
i-pr、
t-bu、环丁基、环戊基、环己基、
[0020]
本发明的一些方案中,上述r2和r3独立为h、me或et,或r2和r3共n原子形成
[0021]
本发明的一些方案中,上述r4为h、me、et、
n-pr或环丙基。
[0022]
本发明的一些方案中,上述x为下列基团:
[0023][0024]
本发明的一些方案中,上述化合物、异构体或药学上可接受的盐,其选自:
[0025]
[0026]
[0027][0028]
本发明的另一个目的是一种药物组合物,其含有药理上可接受的赋形剂或载体,以及本发明的式(1a)或式(1b)所示的化合物、其异构体或其药学上可接受的盐作为活性成分。
[0029]
本发明的再一个目的提供了本发明的上述化合物、其异构体或其药学上可接受盐用于制备治疗由wee1介导的相关疾病的药物中的应用。
[0030]
定义和说明
[0031]
除非另有说明,本文所用的下列术语和短语旨在具有下列含义。一个特定的术语或短语在没有特别定义的情况下不应该被认为是不确定或不清楚的,而应该按照普通的定义去理解,当本文中出现商品名称是,意在指代其对应的商品或其活性成分。这里所采用的术语“药学上可接受的”,是针对那些化合物、组合物和/或制剂而言,它们在可靠的医学判断的范围之内,适用于与人类和动物的组织接触使用,而没有过多的毒性、刺激性、过敏性反应或其它问题或并发症,与合理的利益/风险比相称。
[0032]
术语“药学上可接受的盐”指一种化合物的存在形式,该形式不会引起对给药有机体的重要的刺激,且不会使化合物的生物活性和性质消失。在某些具体方面,药学上可接受的盐是通过式(1a)或式(1b)化合物与酸反应获得,如盐酸、氢溴酸、氢氟酸、硫酸、磷酸、硝酸、磷酸等无机酸,甲酸、乙酸、丙酸、草酸、三氟乙酸、丙二酸、琥珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬酸、苦味酸、甲磺酸、苯磺酸、对甲苯磺酸等有机酸以及天冬氨酸、谷氨酸等酸性氨基酸。
[0033]
应理解药学上可接受的盐的参考包括溶剂添加形式或结晶形式,尤其是溶剂化物或多晶型。溶剂化物含有化学计量或非化学计量的溶剂,且是在与药学上可接受溶剂如水,乙醇等,结晶化过程中选择性形成的。当溶剂是水时形成水合物,或当溶剂是乙醇时形成醇化物。式(1a)或式(1b)化合物的溶剂化物按照本文所述的方法,很方便的制得或形成。举例说明,式(1a)或式(1b)化合物的水合物从水/有机溶剂的混合溶剂中重结晶而方便的制得,使用的有机溶剂包括但不限于,乙腈、四氢呋喃,乙醇或甲醇。此外,在此提到的化合物能够以非溶剂化和溶剂化形式存在。总之,对于在此提供的化合物和方法为目的,溶剂化形式被认为相当于非溶剂化形式。
[0034]
在其他具体实施例中,式(1a)或式(1b)化合物被制备成不同的形式,包括但不限于,无定形,粉碎形和毫微-粒度形式。此外,式(1a)或式(1b)化合物包括结晶型,也可以作为多晶型。多晶型包括化合物的相同元素组成的不同晶格排列。多晶型通常有不同的x-射线衍射图,红外光谱,熔点,密度,硬度,晶型,光和电的性质,稳定性和溶解性。不同的因素如重结晶溶剂,结晶速率和贮存温度可能引起单一晶型为主导。
[0035]
在另一个方面,式(1a)或式(1b)化合物有一个或多个立体中心,并因此以消旋体、外消旋混合物、单一对映体、非对映异构体化合物和单一非对映体的形式出现。可以存在的不对称中心,取决于分子上各种取代基的性质。每个这种不对称中心将独立地产生两个旋光异构体,并且所有可能的旋光异构体和非对映体混合物以及纯或部分纯的化合物包括在本发明的范围之内。本发明意味着包括这些化合物的所有这种异构形式。
[0036]
除非另有说明,用楔形键和虚线键表示一个立体中心的绝对构型,用波浪线表示楔形键或虚线键(或)。
[0037]
本发明的化合物可以在一个或多个构成该化合物的原子上包含非天然比例的原子同位素。例如,可用放射性同位素标记化合物,比如氚(3h)、碘-125(
125
i)或碳-14(
14
c)。本发明的化合物的所有同位素组成的变换,无论放射性与否,都包括在本发明的范围之内。
[0038]
本发明的化合物及其药学上可接受的盐可制成各种制剂,其中包含安全、有效量范围内的本发明化合物或其药学上可接受的盐及药理上可以接受的赋形剂或载体。其中“安全、有效量”指的是:化合物的量足以明显改善病情,而不至于产生严重的副作用。化合物的安全、有效量根据治疗对象的年龄、病情、疗程等具体情况来确定。
[0039]“药学上可以接受的赋形剂或载体”指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。药理上可以接受的赋形剂或载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂(如)、润湿剂(如十二烷基硫酸钠)、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、无热原水等。
[0040]
施用本发明化合物时,可以口服、直肠、肠胃外(静脉内、肌肉内或皮下)、局部给药。
[0041]
除非另有规定,术语“烷基”表示饱和脂肪烃基,包括1至6个碳原子的直链和支链基团。优选含有1至4个碳原子的低级烷基,例如甲基、乙基、丙基、2-丙基、正丁基、异丁基、叔丁基。如本文所用,“烷基”包括未取代和取代的烷基,尤其是被一个或多个卤素所取代的烷基。优选的烷基选自ch3,ch3ch2,cf3,chf2,cf3ch2,
i
pr,
n
pr,
i
bu,
c
pr,
n
bu或
t
bu。
[0042]
除非另有规定,术语“环烷烷基”指由碳原子以及选自氮、氧或硫等杂原子组成的饱和或部分饱和的非芳香环状基团,此环状基团可为单环或多环基团,在本发明中,杂环烷基中杂原子个数优选1、2、3或4,杂环烷基中的氮、碳或硫原子可人选地被氧化。氮原子可任选地进一步被其它基团取代而形成叔胺或季铵盐。杂环烷基的实例包括但不限于:氮丙啶基、氮杂环丁烷-1-基、n-烷基氮杂环丁烷-3-基、四氢呋喃
--
2基、四氢呋喃-3-基、吗啉-4基、硫代吗啉-4-基、硫代吗啉-s-氧化物-4-基、哌啶-1-基、n-烷基哌啶-4-基、吡咯烷-1-基、n-烷基吡咯烷-2-基、哌嗪-1-基、4-烷基哌嗪-1-基等。
[0043]
除非另有规定,术语“卤素取代”或“卤素”本身或作为另一取代基的一部分表示氟、氯、溴或碘原子。此外,“卤代烷基”意在包括单卤代烷基或多卤代烷基。例如“卤代c1-c3烷基”意在包括但不限于三氟甲基、2,2,2-三氟乙基2-氯丙基和3-溴丙基等等。
[0044]
术语“元环”包括任何环状结构。术语“元”意为表示构成环的骨架原子的数量。例如,环己基、吡啶基、吡喃基、噻喃基是六元环,环戊基、吡咯基、呋喃基和噻吩基是五元环。
[0045]
术语“片断”指分子的具体部分或官能团。化学片断通常被认为是包含在或附在分子中的化学实体。
[0046]
化合物的合成
[0047]
下面具体地描述本发明式(1a)或式(1b)化合物的制备方法,但这些具体方法不对本发明构成任何限制。
[0048]
以上说明的式(1a)或式(1b)化合物可使用标准的合成技术或公知的技术与文中结合的方法来合成。此外,在此提到的溶剂,温度和其他反应条件可以改变。用于式(1a)或式(1b)化合物的合成的起始物料可以由合成或从商业来源上获得,如,但不限于aldrich chemical co.(milwaukee,wis.)或sigma chemical co.(st.louis,mo.)。本文所述的化合物和其他具有不同取代基的有关化合物可使用公知的技术和原料来合成,包括发现于march,a
dvanced o
rganic c
hemistry 4
th ed.,(wiley 1992);carey和sundberg,a
dvanced o
rganic c
hemistry 4
th ed.,vols.a和b(plenum 2000,2001),green和wuts,p
rotective g
roups in o
rganic s
ynthesis 3
rd ed.,(wiley 1999)中的方法。化合物制备的一般方法可通过使用适当的试剂和在此提供的分子式中引入不同基团的条件来改变。
[0049]
一方面,本文所述的化合物根据工艺中公知的方法。然而方法的条件,例如反应
物、溶剂、碱、所用化合物的量、反应温度、反应所需时间等不限于下面的解释。本发明化合物还可以任选将在本说明书中描述的或本领域已知的各种合成方法组合起来而方便的制得,这样的组合可由本发明所属领域的技术人员容易的进行。一方面,本发明还提供了一种所述的式(1a)或式(1b)化合物的制备方法,其采用下列方法a或方法b制备:
[0050]
方法a包含下列步骤:首先化合物a1和化合物a2在碱性条件下反应生成化合物a3,化合物a3进一步在强碱作用下反应生成化合物a4,化合物a4在还原剂存在下还原生成化合物a5,化合物a5和化合物a6进一步反应生成目标化合物a7。
[0051][0052]
上述反应方程式中,m、q、y、w、x和n的定义如前所述,z为ch3s,ch3so、ch3so2、br、cl或i等基团。
[0053]
方法b包含下列步骤:首先化合物b1和化合物b2在碱性条件下反应生成化合物b3,化合物b3去除保护基得到化合物b4,接着化合物b4进行分子内偶联反应得到化合物b5,化合物b5进行还原得到化合物b6,化合物b6和化合物a6进一步反应生成目标化合物b7。
[0054][0055]
上述反应方程式中,m、q、y、w、x和n的定义如前所述,z为ch3s,ch3so、ch3so2、br、cl或i等基团。
[0056]
治疗用途
[0057]
文中描述的化合物或组合物通常可用于抑制wee1激酶,因此可用于治疗与wee1激酶活性相关的一种或多种病症。因此,在某些实施方式中,本发明提供了用于治疗wee1激酶介导的病症的方法,所述方法包括向有需要的患者施用本发明化合物、或其药学上可接受的组合物的步骤。
[0058]
可用本发明化合物治疗的癌症包括但不限于,血液恶性肿瘤(白血病、淋巴瘤、骨髓瘤包括多发性骨髓瘤、骨髓异常增生综合症和骨髓增生姓综合症)和实体瘤(癌例如前列腺、乳腺、肺、结肠、胰腺、肾、卵巢以及软组织癌和骨肉瘤,以及间质瘤)等。
[0059]
在下面的说明中将会详细阐述上述化合物、方法、药物组合物的各个具体方面、特性和优势,使本发明的内容变得十分明了。在此应理解,下述的详细说明及实例描述了具体的实施例,仅用于参考。在阅读了本发明的说明内容后,本领域的技术人员可对本发明作各种改动或修改,这些等价形势同样落于本申请所限定的范围。
[0060]
所有实施例中,熔点用x-4熔点仪测定,温度计未校正;1h-nmr用varian mercury400核磁共振仪记录,化学位移以δ(ppm)表示;分离用硅胶未说明均为200-300目,洗脱液的配比均为体积比。
[0061]
本发明采用下述缩略词:acn代表乙腈;acoh代表乙酸;ar代表ar;cdcl3代表氘代氯仿;dcm代表二氯甲烷;dipea代表二异丙基乙基胺;dmf代表二甲基甲酰胺;dmso代表二甲基亚砜;ea代表乙酸乙酯;etoh代表乙醇;h代表小时;h2代表氢气;k2co3代表碳酸钾;lc-ms代表液相-质谱;m-cpba代表间氯过氧苯甲酸;ml代表毫升;meoh代表甲醇;min代表分钟;ms代表质谱;nabh3cn代表氰基硼氢化钠;nabh(oac)3代表三乙酰氧基硼氢化钠;na2co3代表碳酸钠;nah代表氢化钠;nahco3代表碳酸氢钠;na2so3代表亚硫酸钠;na2so4代表硫酸钠;nmr代表核磁共振;℃代表摄氏度;pd(oac)2代表醋酸钯;pe代表石油醚;r.t.代表室温;socl2代表二氯亚砜;tfa代表三氟乙酸;toluene代表甲苯;tscl代表对甲基苯磺酰氯。
具体实施方式
[0062]
实施例1:化合物1
[0063][0064]
合成路线:
[0065][0066]
步骤1:化合物1-1的合成
[0067]
将3-羟甲基哌嗪-1-甲酸叔丁酯(1.0g,4.63mmol)和1,2-二氟-4-硝基苯(809mg,5.1mmol)溶于dmf(20ml)中,加入dipea(1.8g,13.89mmol),升温120℃反应过夜,lc-ms监测反应完毕后,反应体系加入水(100ml),ea(50ml*2)萃取,合并有机相,有机相用饱和食盐水(50ml)洗,无水na2so4干燥,滤液浓缩后残留物经柱层析(pe/ea=10/1to 5/1)得到黄色固体化合物(600mg,收率60%),esi-ms m/z:356.1[m+h]
+
。
[0068]
步骤2:化合物1-2的合成
[0069]
将化合物1-1((3.6g,10mmol)溶于dmf(30ml)中,冰浴,加入nah(60%含量,440mg,11mmol),升温至80℃反应过夜,lc-ms监测反应完毕,冷却,倒入冰水(100ml)中,ea(50ml*2)萃取,合并有机相,有机相用水洗(150ml*2),饱和食盐水(50ml)洗,无水na2so4干燥,滤液浓缩后残留物经柱层析(pe/ea=20/1to 10/1)得到黄色固体化合物(2.1g,收率62%),esi-ms m/z:336.1[m+h]
+
。
[0070]
步骤3:化合物1-3的合成
[0071]
将化合物1-2(2.0g,6.0mmol)溶于ea(40ml)中,加入hcl/二氧六环溶液(4.0m,10ml),r.t.搅拌3h,lc-ms监测反应完毕,直接浓缩,得到黄色固体粗产物(2.0g,收率100%),未经纯化并直接投入下一步反应,esi-ms m/z:236.1[m+h]
+
。
[0072]
步骤4:化合物1-4的合成
[0073]
将化合物1-3(2.0g,6.0mmol)溶于acn(20ml)中,加入甲醛水溶液(35%~40%,0.5ml),acoh(360mg,6.0mmol),r.t.搅拌1h,加入nabh(oac)3(2.5g,12mmol),r.t.反应过夜,lc-ms监测反应完毕后,浓缩,残留物用ea(50ml)溶解,饱和nahco3溶液(30ml)洗,无水na2so4干燥,滤液浓缩,残留物经柱层析(dcm/meoh=100/1to 20/1)纯化得到黄色固体(1.0g,收率66%),esi-ms m/z:250.1[m+h]
+
。
[0074]
步骤5:化合物1-5的合成
[0075]
将化合物1-4(1.0g,4.0mmol)溶于meoh(50ml)中,加入pd/c(10%,200mg),通入氢气,r.t.反应过夜,lc-ms监测反应完毕,过滤,滤液浓缩,得到浅黄色固体化合物(800mg,收
率91%),未经纯化并直接用于下一步反应,esi-ms m/z:220.1[m+h]
+
。
[0076]
步骤6:化合物1的合成
[0077]
将化合物1-6(合成参见wo2017075629,360mg,1.0mmol)溶于甲苯(10ml)中,冰浴冷却下,加入m-cpba(377mg,2.0mmol),r.t.反应3h,tlc监测反应完毕,反应液中加入dipea(520mg,4.0mmol)和化合物1-5(220mg,1.0mmol),于80℃下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到化合物1(黄色固体300mg,收率56%)。
[0078]1h nmr(400mhz,dmso-d6)δ:10.09(s,1h),8.79(s,1h),7.95(t,j=7.9hz,1h),7.72(d,j=8.1hz,1h),7.57(dd,j=7.7,0.9hz,1h),7.16(d,j=29.3hz,2h),6.79(d,j=8.9hz,1h),5.62(ddd,j=16.5,10.7,5.3hz,1h),5.30(s,1h),4.99-4.92(m,1h),4.78(dd,j=17.1,1.5hz,1h),4.66(s,2h),4.21(d,j=10.5hz,1h),3.87(t,j=9.8hz,1h),3.64(d,j=11.6hz,1h),2.96(t,j=9.9hz,1h),2.79(d,j=10.9hz,2h),2.61-2.51(m,1h),2.19(s,3h),2.09-2.00(m,1h),1.65(t,j=10.6hz,1h),1.42(s,6h);esi-ms m/z:529.2[m+h]
+
.
[0079]
通过不同的手性原料或者手性分离的方法,可以得到化合物1的两个光学异构体,其结构式如下:
[0080][0081]
实施例2:化合物2
[0082][0083]
合成路线:
[0084]
[0085]
步骤1:化合物2-1的合成
[0086]
将化合物1-3(706mg,3.0mmol)溶于1,2-二氯乙烷(20ml)中,加入丙酮(1ml),acoh(180mg,3.0mmol),r.t.搅拌1h,加入nabh(oac)3(1.26g,6mmol),r.t.反应过夜,lc-ms监测反应完毕,浓缩,残留物用ea(30ml)溶解,饱和nahco3溶液(30ml)洗,无水na2so4干燥,滤液浓缩,残留物经柱层析(dcm/meoh=100/1to 20/1)得到黄色固体(400g,收率48%),esi-ms m/z:278.1[m+h]
+
。
[0087]
步骤2:化合物2-2的合成
[0088]
将化合物2-1(400mg,1.44mmol)溶于meoh(30ml)中,加入pd/c(10%,80mg),通入h2,r.t.反应过夜,lc-ms监测反应完毕后,过滤,滤液浓缩,得到浅黄色固体化合物(300mg,收率84%),未经纯化并直接用于下一步反应,esi-ms m/z:248.1[m+h]
+
。
[0089]
步骤3:化合物2的合成
[0090]
将化合物1-6(360mg,1.0mmol)溶于甲苯中(10ml)中,冰浴冷却下,加入m-cpba(377mg,2.0mmol),r.t.反应3h,tlc监测反应完毕,反应液中加入dipea(520mg,4.0mmol)和化合物2-2(247mg,1.0mmol),于80℃下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到化合物2(黄色固体320mg,收率57%)。
[0091]1h nmr(400mhz,dmso-d6)δ:10.12(s,1h),8.80(s,1h),7.97(t,j=7.9hz,1h),7.75(d,j=8.1hz,1h),7.60(dd,j=7.7,0.9hz,1h),7.19(d,j=13.3hz,2h),6.81(d,j=8.9hz,1h),5.65-5.55(m,1h),5.31(s,1h),5.05-4.95(m,1h),4.80(dd,j=17.1,1.5hz,1h),4.68(s,2h),4.23(d,j=10.5hz,1h),3.91(t,j=9.8hz,1h),3.65(d,j=11.6hz,1h),2.97(t,j=9.9hz,1h),2.93-2.81(m,2h),2.62-2.50(m,2h),2.09-2.00(m,1h),1.65(t,j=10.6hz,1h),1.42(s,6h),1.25(s,6h);esi-ms m/z:557.2[m+h]
+
.
[0092]
实施例3:化合物3
[0093][0094]
以氧杂环丁烷和化合物1-3为原料,采用实施例2相似的合成方法,得到化合物3。
[0095]1h nmr(400mhz,dmso-d6)δ:9.98(s,1h),8.76(s,1h),7.94(t,j=7.9hz,1h),7.72(d,j=8.1hz,1h),7.58(dd,j=7.7,0.9hz,1h),7.15(d,j=9.3hz,2h),6.79(d,j=8.9hz,1h),5.67-5.56(m,1h),5.28(s,1h),4.81-4.73(m,3h),4.64-4.48(m,4h),4.22(d,j=10.5hz,1h),3.87-3.70(m,2h),3.64(d,j=11.6hz,1h),2.96(t,j=9.9hz,1h),2.79(d,j=10.9hz,2h),2.63-2.50(m,2h),2.09-2.00(m,1h),1.70-1.60(m,1h),1.43(s,6h);esi-ms m/z:571.2[m+h]
+
.
[0096]
实施例4:化合物4
[0097][0098]
以环丁酮和化合物1-3为原料,采用实施例2相似的合成方法,得到化合物4。
[0099]1h nmr(400mhz,dmso-d6)δ:9.98(s,1h),8.79(s,1h),7.95(t,j=7.9hz,1h),7.73(d,j=8.1hz,1h),7.56(dd,j=7.7,0.9hz,1h),7.15(d,j=11.3hz,2h),6.78(d,j=8.9hz,1h),5.65-5.57(m,1h),5.30(s,1h),4.99-4.92(m,1h),4.78(dd,j=17.1,1.5hz,1h),4.66(s,2h),4.21(d,j=10.5hz,1h),3.87(t,j=9.8hz,1h),3.64(d,j=11.6hz,1h),2.96(t,j=9.9hz,1h),2.83-2.71(m,3h),2.61-2.51(m,1h),2.05-1.92(m,3h),1.69-1.58(m,5h),1.42(s,6h);esi-ms m/z:569.2[m+h]
+
.
[0100]
实施例5:化合物5
[0101][0102]
合成路线:
[0103][0104]
步骤1:化合物5-1的合成
[0105]
将化合物1-3(2.35g,10mmol)溶于dcm(50ml)中,加入dipea(2.6g,20mmol),冰浴冷却下,加入乙酰氯(940mg,12mmol),r.t.反应3h,lc-ms监测反应完毕后,倒入冰水(30ml)中,分液,有机层无水na2so4干燥,滤液浓缩,残留物经柱层析(pe/ea=20/1to 10/1)得到黄色固体化合物(2.1g,收率76%),esi-ms m/z:278.1[m+h]
+
。
[0106]
步骤2:化合物5-2的合成
[0107]
将化合物5-1(1.0g,3.6mmol)溶于meoh(50ml)中,加入pd/c(10%,200mg),通入氢气,r.t.反应过夜,lc-ms监测反应完毕,过滤后浓缩,得到浅黄色固体化合物(770mg,收率86%),未经纯化并直接用于下一步反应,esi-ms m/z:248.1[m+h]
+
。
[0108]
步骤3:化合物5的合成
[0109]
将化合物1-6(360mg,1.0mmol)溶于甲苯(10ml)中,冰浴,加入m-cpba(377mg,2.0mmol),r.t.反应3h,tlc监测反应完毕,反应液中加入dipea(520mg,4.0mmol)和化合物5-2(247mg,1.0mmol),于80℃下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到化合物5(黄色固体320mg,收率57%)。
[0110]1h nmr(400mhz,dmso-d6)δ:9.89(s,1h),8.78(s,1h),7.95(t,j=7.9hz,1h),7.72(d,j=8.1hz,1h),7.57(dd,j=8.0,0.9hz,1h),7.16(d,j=9.5hz,2h),6.79(d,j=8.9hz,1h),5.58-5.52(m,1h),5.31(s,1h),4.97-4.91(m,1h),4.78(dd,j=13.1,1.5hz,1h),4.66(s,2h),4.21(d,j=10.5hz,1h),3.86(t,j=9.8hz,1h),3.65(d,j=10.6hz,1h),2.96(t,j=9.9hz,1h),2.75-2.65(m,3h),2.15(s,3h),2.12-1.96(m,2h),1.42(s,6h);esi-ms m/z:557.2[m+h]
+
.
[0111]
实施例6:化合物6
[0112][0113]
以氯甲酸甲酯和化合物1-3为原料,采用实施例5相似的合成方法,得到化合物6。
[0114]1h nmr(400mhz,dmso-d6)δ:9.96(s,1h),8.76(s,1h),7.96(t,j=7.9hz,1h),7.69(d,j=8.1hz,1h),7.58(dd,j=8.1,1.2hz,1h),7.12(d,j=11.3hz,2h),6.78(d,j=9.2hz,1h),5.62-5.55(m,1h),5.29(s,1h),4.96-4.92(m,1h),4.76(dd,j=12.1,1.6hz,1h),4.61(s,2h),4.21(d,j=10.5hz,1h),3.86(t,j=9.8hz,1h),3.70(s,3h),3.62(d,j=10.6hz,1h),2.93(t,j=9.6hz,1h),2.71-2.60(m,3h),2.15(s,3h),2.05-1.91(m,2h),1.43(s,6h);esi-ms m/z:573.2[m+h]
+
.
[0115]
实施例7:化合物7
[0116][0117]
合成路线:
[0118][0119]
步骤1:化合物7-1的合成
[0120]
将哌啶-2-基甲醇(2.3g,20mmol),1,2-二氟-4-硝基苯(3.82g,24mmol)溶于etoh(50ml)中,加入nahco3(1.68g,20mmol),回流反应5h,lc-ms监测反应完毕后,过滤,滤液浓缩,残留物经柱层析(pe/ea=10/1to 5/1)得到黄色固体化合物(3.56g,收率70%),esi-ms m/z:255.1[m+h]
+
。
[0121]
步骤2:化合物7-2的合成
[0122]
将化合物7-1(2.54g,10mmol)溶于thf(30ml)中,冰浴冷却下,加入nah(60%含量,600mg,15mmol),升温70℃回流反应5h,lc-ms监测反应完毕,冷却,倒入冰水(100ml)中,ea(50ml*2)萃取,合并有机相,有机相用水(150ml)洗,饱和食盐水(50ml)洗,无水na2so4干燥,滤液浓缩,残留物经柱层析(pe/ea=20/1to 10/1)得到黄色固体化合物(1.8g,收率76%),esi-ms m/z:235.1[m+h]
+
。
[0123]
步骤3:化合物7-3的合成
[0124]
将化合物7-2(1.0g,4.3mmol)溶于meoh(50ml)中,加入pd/c(10%,200mg),通入氢气,r.t.反应过夜,lc-ms监测反应完毕,过滤,滤液浓缩,得到浅黄色固体化合物(800mg,收率91%),未经纯化并直接用于下一步反应,esi-ms m/z:205.1[m+h]
+
。
[0125]
步骤4:化合物7的合成
[0126]
将化合物1-6(360mg,1.0mmol)溶于甲苯中(10ml)中,冰浴,加入m-cpba(377mg,2.0mmol),r.t.反应3h,tlc监测反应完毕,反应液中加入dipea(520mg,4.0mmol)和化合物7-3(204mg,1.0mmol),于80℃下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到化合物7(黄色固体260mg,收率51%)。
[0127]1h nmr(400mhz,dmso-d6)δ:9.97(s,1h),8.79(s,1h),7.95(t,j=7.9hz,1h),7.73(d,j=8.1hz,1h),7.56(dd,j=7.7,0.9hz,1h),7.15(d,j=11.3hz,2h),6.78(d,j=8.9hz,1h),5.65-5.60(m,1h),5.30(s,1h),4.99-4.92(m,1h),4.78(d,j=10.5hz,1h),4.66(s,2h),4.21(d,j=10.5hz,1h),3.78(t,j=9.8hz,1h),3.45-3.35(m,1h),3.05-2.95(m,2h),1.95-1.75(m,3h),1.65-1.50(m,3h),1.43(s,6h);esi-ms m/z:514.2[m+h]
+
.
[0128]
实施例8:化合物8
[0129][0130]
合成路线:
[0131][0132]
步骤1:化合物8-1的合成
[0133]
将4,4-二氟哌啶-2-羧酸乙酯(合成参照wo2008125570,1.93g,10mmol)和1,2
--
二氟-4-硝基苯(1.91g,12mmol)溶于dmf(30ml)中,加入nahco3(840mg,10mmol),90℃反应5h,lc-ms监测反应完毕,过滤,滤液浓缩,残留物经柱层析(pe/ea=10/1to 5/1)得到黄色固体化合物(2.0g,收率60%),esi-ms m/z:333.1[m+h]
+
。
[0134]
步骤2:化合物8-2的合成
[0135]
将化合物8-1(1.66g,5.0mmol)溶于etoh(20ml)中,冰浴冷却下,加入nabh4(380mg,10mmol),r.t.反应过夜,lc-ms监测反应完毕后,浓缩,残留物用ea(50ml)溶解,水(50ml)洗,有机层用无水na2so4干燥,滤液浓缩,残留物经柱层析(pe/ea=10/1to2/1)得到黄色固体化合物(1.0g,收率69%),esi-ms m/z:291.1[m+h]
+
。
[0136]
步骤3:化合物8-3的合成
[0137]
将化合物8-2(1.0g,3.45mmol)溶于thf(30ml)中,冰浴冷却下,加入nah(60%含量,208mg,5.2mmol),升温70℃回流反应5h,lc-ms监测反应完毕后,冷却,倒入冰水(100ml)中,ea(50ml*2)萃取,合并有机相,有机相用水(150ml)洗,饱和食盐水(50ml)洗,无水na2so4干燥,滤液浓缩,残留物经柱层析(pe/ea=20/1to 5/1)得到黄色固体化合物(460mg,收率49%),esi-ms m/z:271.1[m+h]
+
。
[0138]
步骤4:化合物8-4的合成
[0139]
将化合物8-3(400mg,1.48mmol)溶于meoh(30ml)中,加入pd/c(10%,100mg),通入氢气,r.t.反应过夜,lc-ms监测反应完毕后,过滤,滤液浓缩,得到浅黄色固体化合物(300mg,收率84%),未经纯化并直接用于下一步反应,esi-ms m/z:241.1[m+h]
+
。
[0140]
步骤5:化合物8的合成
[0141]
将化合物1-6(360mg,1.0mmol)溶于甲苯(10ml)中,冰浴,加入m-cpba(377mg,
2.0mmol),r.t.反应3h,tlc监测反应完毕,反应液中加入dipea(520mg,4.0mmol)和化合物8-4(270mg,1.0mmol),于80℃下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到化合物8(黄色固体220mg,收率40%)。
[0142]1h nmr(400mhz,dmso-d6)δ:9.56(s,1h),8.77(s,1h),7.93(t,j=7.9hz,1h),7.72(d,j=8.1hz,1h),7.55(dd,j=7.7,0.9hz,1h),7.14(d,j=11.3hz,2h),6.78(d,j=8.9hz,1h),5.65-5.60(m,1h),5.30(s,1h),4.99-4.92(m,1h),4.67(d,j=10.5hz,1h),4.61(s,2h),4.20(d,j=10.5hz,1h),3.65(t,j=9.8hz,1h),3.45-3.35(m,1h),3.05-2.95(m,2h),1.95-1.75(m,4h),1.43(s,6h);esi-ms m/z:550.2[m+h]
+
.
[0143]
实施例9:化合物9
[0144][0145]
以(s)-吡咯烷-2-基甲醇代替哌啶-2-基甲醇为原料,采用实施例7相似的合成方法,得到化合物9。
[0146]1h nmr(400mhz,dmso-d6)δ:9.87(s,1h),8.76(s,1h),7.96(t,j=7.8hz,1h),7.72(d,j=7.8hz,1h),7.55(dd,j=7.7,0.9hz,1h),7.16(d,j=10.3hz,2h),6.78(d,j=8.8hz,1h),5.65-5.60(m,1h),5.30(s,1h),4.99-4.92(m,1h),4.56(d,j=10.8hz,1h),4.60(s,2h),4.21(d,j=10.8hz,1h),3.68(t,j=9.8hz,1h),3.35-3.25(m,1h),3.03-2.93(m,2h),1.65-1.50(m,4h),1.41(s,6h);esi-ms m/z:500.2[m+h]
+
.
[0147]
实施例10:化合物10
[0148][0149]
以吗啉-3-基甲醇代替哌啶-2-基甲醇为原料,采用实施例7相似的合成方法,得到化合物10。
[0150]1h nmr(400mhz,dmso-d6)δ:10.02(s,1h),8.79(s,1h),7.96(t,j=7.9hz,1h),7.71(d,j=8.1hz,1h),7.56(d,j=10.4hz,1h),7.17(d,j=10.3hz,2h),6.79(d,j=8.9hz,1h),5.61(ddd,j=15.5,10.5,5.2hz,1h),5.31(s,1h),5.01-.93(m,1h),4.79(d,j=10.1hz,1h),4.65(s,2h),4.22(d,j=10.5hz,1h),3.87(t,j=9.8hz,1h),3.75-3.65(m,4h),3.60-3.45(m,3h),1.42(s,6h);esi-ms m/z:516.2[m+h]
+
.
[0151]
实施例11:化合物11
[0152][0153]
合成路线:
[0154][0155]
步骤1:化合物11-1的合成
[0156]
将(2s,4r)-4-(二甲氨基)-2-(羟甲基)吡咯烷-1-羧酸叔丁酯(合成参照wo2001000206,2.44g,10.0mmol)溶于ea(40ml)中,加入hcl/二氧六环(4.0m,15ml),r.t.搅拌3h,lc-ms监测反应完毕,直接浓缩,得到黄色固体化合物(2.5g,收率100%),未经纯化并直接投入下一步反应,esi-ms m/z:145.1[m+h]
+
。
[0157]
步骤2:化合物11-2的合成
[0158]
将化合物11-1(2.5g,10mmol)和1,2-二氟-4-硝基苯(1.91g,12mmol)溶于dmf(20ml)中,加入dipea(6.5g,50mmol),升温120℃,反应过夜,lc-ms监测,反应完毕后,到入水(60ml)中,ea(30ml*3)萃取,合并有机相,有机相用水(60ml)洗,饱和食盐水(60ml)洗,无水na2so4干燥,滤液浓缩,残留物经柱层析(dcm/meoh=100/1to 30/1)得到黄色固体化合物(2.0g,收率70%),esi-ms m/z:284.1[m+h]
+
。
[0159]
步骤3:化合物11-3的合成
[0160]
将化合物11-2(1.42g,5.0mmol)溶于thf(30ml)中,冰浴冷却下,加入nah(60%含量,300mg,7.5mmol),升温70℃回流反应5h,lc-ms监测反应完毕,冷却,倒入冰水(100ml)中,ea(50ml*2)萃取,合并有机相,有机相用水洗(150ml),饱和食盐水(50ml)洗,无水na2so4干燥,滤液浓缩,残留物经柱层析(dcm/meoh=100/1to 30/1)得到黄色固体化合物(1.0g,收率75%),esi-ms m/z:264.1[m+h]
+
。
[0161]
步骤4:化合物11-4的合成
[0162]
将化合物11-3(1.0g,3.8mmol)溶于meoh(50ml)中,加入pd/c(10%,200mg),通入氢气,r.t.反应过夜,lc-ms监测反应完毕,过滤,滤液浓缩,得到浅黄色固体化合物(600mg,收率67%),未经纯化并直接用于下一步反应,esi-ms m/z:234.1[m+h]
+
。
[0163]
步骤5:化合物11的合成
[0164]
将化合物1-6(360mg,1.0mmol)溶于甲苯(10ml)中,冰浴,加入m-cpba(377mg,2.0mmol),r.t.反应3h,tlc监测反应完毕,反应液中加入dipea(520mg,4.0mmol)和化合物11-4(233mg,1.0mmol),于80℃下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到化合物11(黄色固体220mg,收率41%)。
[0165]1h nmr(400mhz,dmso-d6)δ:9.89(s,1h),8.77(s,1h),7.95(t,j=7.8hz,1h),7.73(d,j=7.8hz,1h),7.55(dd,j=7.7,0.9hz,1h),7.14(d,j=10.3hz,2h),6.79(d,j=8.8hz,1h),5.65-5.60(m,1h),5.30(s,1h),4.99-4.92(m,1h),4.56(d,j=10.6hz,1h),4.63(s,2h),4.21(d,j=10.6hz,1h),3.78(t,j=9.8hz,1h),3.35-3.25(m,1h),3.03-2.93(m,2h),2.85-2.72(m,1h),2.35(s,6h),1.65-1.50(m,2h),1.41(s,6h),esi-ms m/z:543.2[m+h]
+
.
[0166]
实施例12:化合物12
[0167][0168]
以((2s,4r)-4-甲氧基吡咯烷-2-基)甲醇(合成参照wo2011088045)代替哌啶-2-基甲醇为原料,采用实施例7相似的合成方法,得到化合物12。
[0169]1h nmr(400mhz,dmso-d6)δ:9.92(s,1h),8.78(s,1h),7.96(t,j=7.9hz,1h),7.71(d,j=7.6hz,1h),7.53(dd,j=7.5,0.9hz,1h),7.15(d,j=10.2hz,2h),6.76(d,j=8.9hz,1h),5.67-5.62(m,1h),5.31(s,1h),5.01-4.95(m,1h),4.66(d,j=10.6hz,1h),4.60(s,2h),4.15(d,j=10.6hz,1h),3.68(t,j=9.8hz,1h),3.56(s,3h),3.35-3.25(m,2h),3.13-3.03(m,2h),2.05-1.92(m,2h),1.42(s,6h);esi-ms m/z:530.2[m+h]
+
.
[0170]
实施例13:化合物13
[0171][0172]
以(2s,4s)-4-(二甲氨基)-2-(羟甲基)吡咯烷-1-羧酸叔丁酯(合成参照wo2016008411)为原料,采用实施例11相似的合成方法,得到化合物13。
[0173]1h nmr(400mhz,dmso-d6)δ:9.88(s,1h),8.77(s,1h),7.96(t,j=7.8hz,1h),7.73(d,j=7.9hz,1h),7.55(dd,j=7.8,1.0hz,1h),7.14(d,j=10.3hz,2h),6.78(d,j=8.8hz,1h),5.64-5.60(m,1h),5.31(s,1h),4.98-4.93(m,1h),4.57(d,j=10.5hz,1h),4.65(s,2h),4.21(d,j=10.5hz,1h),3.77(t,j=9.9hz,1h),3.35-3.25(m,1h),3.03-2.92
(m,2h),2.86-2.73(m,1h),2.33(s,6h),1.66-1.52(m,2h),1.42(s,6h);esi-ms m/z:543.2[m+h]
+
.
[0174]
实施例14:化合物14
[0175][0176]
以((2s,4s)-4-甲氧基吡咯烷-2-基)甲醇(参见journal of medicinal chemistry,2017,60(4),1417-1431)代替哌啶-2-基甲醇为原料,采用实施例7相似的合成方法,得到化合物14。
[0177]1h nmr(400mhz,dmso-d6)δ:9.93(s,1h),8.78(s,1h),7.96(t,j=7.9hz,1h),7.72(d,j=7.6hz,1h),7.51(dd,j=7.6,1.0hz,1h),7.16(d,j=10.3hz,2h),6.77(d,j=8.8hz,1h),5.68-5.62(m,1h),5.31(s,1h),5.00-4.95(m,1h),4.65(d,j=10.5hz,1h),4.61(s,2h),4.16(d,j=10.6hz,1h),3.69(t,j=9.0hz,1h),3.57(s,3h),3.36-3.22(m,2h),3.14-3.03(m,2h),2.06-1.91(m,2h),1.43(s,6h);esi-ms m/z:530.2[m+h]
+
.
[0178]
实施例15:化合物15
[0179][0180]
合成路线:
[0181]
[0182]
步骤1:化合物15-1的合成
[0183]
将4-(2-氟-4-硝基苯)-3-(羟甲基)哌嗪-1-甲酸叔丁酯(3.55g,10mmol)溶于dcm(50ml)中,加入dipea(2.6g,20mmol),加入tscl(2.3g,12mmol),加毕,r.t.搅拌反应过夜,lc-ms监测,反应完毕,到入水(50ml)中,分液,水层用dcm(30ml)萃取,合并有机相,有机相用水(50ml)洗,饱和食盐水(50ml)洗,无水na2so4干燥,滤液浓缩,柱层析(pe/ea=20/1to 5/1),得到浅黄色胶状物(4.0g,收率78%),esi-ms m/z:510.1[m+h]
+
。
[0184]
步骤2:化合物15-2的合成
[0185]
将化合物15-1(1.4g,2.75mmol)溶于etoh(20ml)中,加入甲胺醇溶液(25%~30%,1.8g,ca.55mmol),于封管中80℃反应过夜,lc-ms监测反应完毕,浓缩,残留物经柱层析(pe/ea=5/1to 1/1),得到黄色胶状物(480mg,收率50%),esi-ms m/z:510.1[m+h]
+
。
[0186]
步骤3:化合物15-3的合成
[0187]
将化合物15-2(3.48g,10.0mmol)溶于ea(50ml)中,加入hcl/二氧六环(4.0m,15ml),r.t.搅拌3h,lc-ms监测反应完毕,直接浓缩,得到黄色固体化合物(3.5g,收率100%),未经纯化并直接投入下一步反应,esi-ms m/z:249.1[m+h]
+
。
[0188]
步骤4:化合物15-4的合成
[0189]
将化合物15-3(3.5g,10mmol)溶于dmf(20ml)中,加入k2co3(6.91g,50mmol),mei(1.43g,10mmol),r.t.反应过夜,lc-ms监测反应完毕,过滤,浓缩,残留物经柱层析(dcm/meoh=100/1to 20/1)得到黄色固体化合物(1.8g,收率68%),esi-ms m/z:263.1[m+h]
+
。
[0190]
步骤5:化合物15-5的合成
[0191]
将化合物15-5(786mg,3.0mmol)溶于meoh(30ml)中,加入pd/c(10%,150mg),通入氢气,r.t.反应过夜,lc-ms监测反应完毕,过滤,滤液浓缩,得到浅黄色固体化合物(500mg,收率71%),未经纯化并直接用于下一步反应,esi-ms m/z:233.1[m+h]
+
。
[0192]
步骤6:化合物15的合成
[0193]
将化合物1-6(360mg,1.0mmol)溶于甲苯(10ml)中,冰浴,加入m-cpba(377mg,2.0mmol),r.t.反应3h,tlc监测反应完毕,反应液中加入dipea(520mg,4.0mmol)和化合物15-5(233mg,1.0mmol),于80℃下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到化合物15(黄色固体220mg,收率40%)。
[0194]1h nmr(400mhz,dmso-d6)δ:9.89(s,1h),8.76(s,1h),7.94(t,j=7.9hz,1h),7.70(d,j=8.2hz,1h),7.57(dd,j=7.7,0.9hz,1h),6.98(s,1h),6.76(s,1h),6.59(s,1h),5.62(ddt,j=16.5,10.2,5.9hz,1h),5.29(s,1h),4.98-4.91(m,1h),4.78(dq,j=17.1,1.5hz,1h),4.61(d,j=5.9hz,2h),3.64(d,j=12.3hz,1h),3.22-3.11(m,2h),3.02(d,j=10.1hz,2h),2.97-2.81(m,2h),2.69-2.61(m,4h),2.30-2.20(m,4h),1.42(s,6h);esi-ms m/z:542.2[m+h]
+
.
[0195]
实施例16:化合物16
3.80(m,3h),3.75-3.65(m,4h),3.60-3.45(m,2h),1.42(s,6h);esi-ms m/z:529.2[m+h]
+
.
[0208]
实施例17:化合物17
[0209][0210]
合成路线:
[0211][0212]
步骤1:化合物17-1的合成
[0213]
在100ml反应瓶中加入1-n-叔丁氧羰基-2-(羟甲基)哌嗪(2g,9.2mmol)和多聚甲醛(1.38g,46mmol),接着加入meoh(20ml)和hoac(5ml)的混合液,在r.t.下加入nabh3cn(2.3g,36.8mmol),在80℃下回流搅拌3h,lc-ms监测反应完毕,浓缩,残留物用ea(50ml)溶解,饱和nahco3溶液(50ml)洗,浓缩,残留物柱层析(dcm/meoh=100/1to 20/1)得到浅黄色胶状物(1.7g,收率80%),esi-ms m/z:231.1[m+h]
+
。
[0214]
步骤2:化合物17-2的合成
[0215]
无水无氧条件下,在100ml反应瓶中加入化合物17-1(1.0g,4.3mmol)的thf溶液(17ml),在0℃下加入nah(60%含量,0.34g,8.6mmol),反应20min后加入2-溴-1-氟-4-硝基苯(0.86g,3.87mmol),将反应瓶升至85℃回流搅拌反应5h,lc-ms监测反应完毕,加水(50ml)淬灭,ea(50ml*2)萃取,合并有机相,饱和食盐水(50ml)洗,无水na2so4干燥,滤液浓缩,残留物经柱层析(dcm/meoh=100/1to 20/1)得到浅黄色胶状物(835mg,收率50%),esi-ms m/z:430.1[m+h]
+
。
[0216]
步骤3:化合物17-3的合成
[0217]
在50ml反应瓶中加入化合物17-2(600mg,1.4mmol)的dcm(2ml)溶液,接着加入tfa(0.6ml),r.t.下搅拌,lc-ms监测反应完毕,加饱和nahco3溶液(5ml)中和,并加水(30ml),
dcm(30ml*2)萃取,合并得到有机相,饱和食盐水(30ml)洗,无水na2so4干燥,滤液蒸馏后柱层析(dcm/meoh=100/1to 10/1),得到黄色胶状物(370mg,收率80%),esi-ms m/z:330.0[m+h]
+
。
[0218]
步骤4:化合物17-4的合成
[0219]
无水无氧条件下,在100ml反应瓶中加入化合物17-3(1.3g,3.9mmol),pd(oac)2(22mg,0.0975mmol),csco3(3.8g,11.7mmol),binap(121mg,0.195mmol)的甲苯溶液(60ml),在100℃下反应,lc-ms监测反应完毕,反应液冷却并用ea(30ml)稀释,有机相水(50ml)洗,饱和食盐水(50ml)洗,无水na2so4干燥,滤液浓缩后柱层析(dcm/meoh=100/1to 10/1)得到黄色固体化合物(710mg,收率73%),esi-ms m/z:250.1[m+h]
+
。
[0220]
步骤5:化合物17-5的合成
[0221]
将化合物17-4(500mg,2.0mmol)溶于meoh(40ml)中,加入pd/c(10%,100mg),通入氢气,r.t.反应过夜,lc-ms监测反应完毕,过滤,滤液浓缩,得到浅黄色固体化合物(260mg,收率59%),未经纯化并直接用于下一步反应,esi-ms m/z:220.1[m+h]
+
。
[0222]
步骤6:化合物17的合成
[0223]
将化合物1-6(360mg,1.0mmol)溶于甲苯(10ml)中,冰浴,加入m-cpba(377mg,2.0mmol),r.t.反应3h,tlc监测反应完毕,反应液中加入dipea(520mg,4.0mmol)和化合物17-5(220mg,1.0mmol),于80℃下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到化合物17(黄色固体230mg,收率43%)。
[0224]1h nmr(400mhz,dmso-d6)δ:9.97(s,1h),8.79(s,1h),7.93(t,j=7.9hz,1h),7.67(d,j=8.1hz,1h),7.59(d,j=7.7hz,1h),7.13(d,j=2.4hz,1h),6.98(dd,j=8.6,2.3hz,1h),6.63(d,j=8.6hz,1h),5.68-5.55(m,1h),5.32(s,1h),4.95(dd,j=10.2,1.6hz,1h),4.78(dd,j=17.1,1.7hz,1h),4.61(dd,j=6.0,2.5hz,2h),4.17(dd,j=10.6,2.7hz,1h),3.84(dd,j=10.6,8.7hz,1h),3.33-3.23(m,1h),3.12-3.02(m,1h),2.90-2.80(m,2h),2.65-2.55(m,1h),2.27(s,3h),2.20-2.10(m,1h),1.85-1.75(m,1h),1.42(s,6h);esi-ms m/z:529.2[m+h]
+
.
[0225]
通过不同的手性原料或者手性分离的方法,可以得到化合物17的两个光学异构体,其结构式如下:
[0226][0227]
实施例18:化合物18
[0228][0229]
合成路线:
[0230][0231]
步骤1:化合物18-1的合成
[0232]
在500ml反应瓶中加入1-n-叔丁氧羰基-2-(羟甲基)哌嗪(5g,23.9mmol),加入thf(80ml)和h2o(80ml),搅拌使之溶解,r.t.下缓慢滴加(boc)2o(22ml,95.6mmol),接着加入无水na2co3(20.3g,191.2mmol),溶液为白色浑浊状,r.t.下搅拌2h,lc-ms监测反应完毕,蒸干部分溶剂后,用ea(50ml*3)萃取,合并有机相,用饱和食盐水(50ml)洗涤,无水na2so4干燥,滤液浓缩,残留物经柱层析(pe/ea=20/1to 8/1)得到白色固体化合物(6.0g,收率79%),esi-ms m/z:317.2[m+h]
+
。
[0233]
步骤2:化合物18-2的合成
[0234]
无水无氧条件下,在250ml反应瓶中加入化合物18-1(3g,9.48mmol),置换n2三次,n2保护下加入无水dcm(100ml),搅拌使之溶解,再加入dess-martin氧化剂(8g,18.96mmol),溶液为白色浑浊状,r.t.下反应3h,lc-ms监测反应完毕,加入饱和nahco3溶液(50ml)淬灭,加入饱和na2so3溶液(50ml)搅拌至澄清,分液,水层用dcm(100ml)萃取,合并有机相,用饱和食盐水(100ml)洗涤,无水na2so4干燥,滤液浓缩,残留物经柱层析(pe/ea=20/1to 10/1)得到白色固体化合物(2.6g,收率80%),esi-ms m/z:315.2[m+h]
+
。
[0235]
步骤3:化合物18-3的合成
[0236]
在100ml反应瓶中加入化合物18-2(2.8g,8.9mmol),dcm(25ml),搅拌使之溶解,接着加入ch3nh2盐酸盐(1.8g,26.6mmol),滴加三乙胺(5ml),溶液呈白色浑浊状,r.t.下搅拌4h,lc-ms监测反应完毕,溶剂旋干,加入meoh(30ml),搅拌使之溶解,接着加入nabh3cn(3.6g,57.3mmol),r.t.下搅拌2h,lc-ms监测反应完毕,溶剂旋干,残留物经用柱层析(dcm/meoh=100/1to 10/1)得到无色油状化合物(2.3g,收率78%),esi-ms m/z:330.2[m+h]
+
。
[0237]
步骤4:化合物18-4的合成
[0238]
在100ml反应瓶中加入化合物18-3(1g,3mmol)和dmf(30ml),搅拌使之溶解,接着加入k2co3(830mg,6mmol),3-溴-4-氟硝基苯(1.33g,6mmol),r.t.下搅拌4h,溶液从无色逐渐变成黄色,再变成橙色,lc-ms监测反应完毕,直接浓缩,残留物经用柱层析(pe/ea=20/1to 10/1)得到黄色固体化合物(960mg,收率60%),esi-ms m/z:529.1[m+h]
+
。
[0239]
步骤5:化合物18-5的合成
[0240]
在50ml的反应瓶中加化合物18-4(900mg,1.7mmol),dcm(5ml),搅拌使之溶解,0℃缓慢滴加tfa(10ml),溶液呈深黄色,升至r.t.反应过夜。用lc-ms监测反应完毕,直接浓缩,得到三氟乙酸盐,用饱和nahco3溶液(50ml)中和,dcm(50ml*3)萃取,合并有机相,用饱和食盐水(50ml)洗涤,无水na2so4干燥,滤液浓缩,残留物经柱层析(dcm/meoh=100/1to 20/1)得到黄色固体化合物(230mg,收率51%),esi-ms m/z:329.1[m+h]
+
。
[0241]
步骤6:化合物18-6的合成
[0242]
无水无氧条件下,在100ml反应瓶中加入化合物18-5(200mg,0.6mmol)、pd(oac)2(3.5mg,0.015mmol)、cs2co3(596mg,1.8mmol)、binap(19mg,0.03mmol),置换n2三次,加入无水甲苯(10ml),100℃反应3h,溶液逐渐变成橙色,用lc-ms监测反应完毕,冷却至r.t.,过滤,滤液浓缩,残留物经柱层析(dcm/meoh=100/1to 20/1)得到橙色固体化合物(100mg,收率67%),esi-ms m/z:249.1[m+h]
+
。
[0243]
步骤7:化合物18-7的合成
[0244]
在100ml反应瓶中加入化合物18-6(200mg,0.8mmol)和多聚甲醛(142mg,4mmol),加入meoh(15ml)和hoac(3ml),搅拌使之溶解,r.t.下加入nabh3cn(238mg,3.2mmol),80℃下回流搅拌3h,用lc-ms监测反应完毕,冷却至r.t.,浓缩,残留物经柱层析(dcm/meoh=100/1to 20/1)得到橙色固体化合物(100mg,收率47%),esi-ms m/z:263.1[m+h]
+
。
[0245]
步骤8:化合物18-8的合成
[0246]
将化合物18-7(300mg,1.14mmol)溶于meoh(30ml)中,加入pd/c(10%,60mg),通入氢气,r.t.反应过夜,lc-ms监测反应完毕,过滤,浓缩,得到浅黄色固体化合物(150mg,收率56%),未经纯化并直接用于下一步反应,esi-ms m/z:233.1[m+h]
+
。
[0247]
步骤8:化合物18的合成
[0248]
将化合物1-6(232mg,0.64mmol)溶于甲苯(10ml)中,冰浴,加入m-cpba(241mg,1.28mmol),r.t.反应3h,tlc监测反应完毕,反应液中加入dipea(332mg,2.56mmol)和化合物18-8(150mg,0.64mmol),于80℃下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到化合物18(黄色固体128mg,收率37%)。
[0249]1h nmr(400mhz,dmso-d6)δ:9.98(s,1h),8.79(s,1h),7.94(t,j=7.8hz,1h),7.68(d,j=8.2hz,1h),7.60(d,j=7.8hz,1h),7.14(d,j=2.4hz,1h),6.99(dd,j=8.6,2.3hz,1h),6.65(d,j=8.6hz,1h),5.68-5.55(m,1h),5.32(s,1h),4.95(dd,j=10.2,1.6hz,1h),
4.78(dd,j=17.1,1.7hz,1h),4.61(dd,j=6.0,2.5hz,2h),3.65-3.55(m,1h),3.33-3.23(m,2h),3.12-3.02(m,2h),2.90-2.80(m,1h),2.65-2.55(m,1h),2.45(s,3h),2.27(s,3h),2.20-2.10(m,1h),1.85-1.75(m,1h)1.42(s,6h);esi-ms m/z:542.2[m+h]
+
.
[0250]
通过不同的手性原料或者手性分离的方法,可以得到化合物18的两个的光学异构体,其结构式如下:
[0251][0252]
实施例19:化合物19
[0253][0254]
合成路线:
[0255][0256]
将化合物19-1(合成参照wo2018001569,406mg,1.0mmol)溶于甲苯(20ml)中,加入化合物17-5a(220mg,1.0mmol)和dipea(390mg,3.0mmol)h,于80℃下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=20/1to 5/1)得到黄色固体化合物19(270mg,收率48%)。
[0257]1h nmr(400mhz,cdcl3)δ:8.79(s,1h),7.62(t,j=7.9hz,1h),7.40(s,1h),7.29(d,j=7.8hz,1h),7.06(d,j=2.3hz,1h),6.84-6.76(m,1h),6.72(d,j=8.5hz,1h),6.65(d,j=8.0hz,1h),5.71-5.55(m,1h),5.03-4.92(m,2h),4.85(d,j=6.6hz,2h),4.17(dd,j=10.6,2.8hz,1h),3.98(dd,j=10.6,8.9hz,1h),3.46(d,j=9.4hz,1h),3.31(d,j=10.6hz,6h),3.21(t,j=10.0hz,1h),2.87(d,j=11.5hz,1h),2.78(t,j=14.4hz,2h),2.34(s,3h),2.23-2.15(m,1h),1.85-1.80(m,1h);esi-ms m/z:562.2[m+h]
+
.
[0258]
实施例20:化合物20
[0259][0260]
合成路线:
[0261]
以化合物18-8a代替化合物17-5a为原料,采用实施例19类似的合成方法,得到化合物20。
[0262]1h nmr(400mhz,cdcl3)δ8.79(s,1h),7.62(t,j=7.9hz,1h),7.40(s,1h),7.29(d,j=7.8hz,1h),7.06(d,j=2.3hz,1h),6.84-6.76(m,1h),6.72(d,j=8.5hz,1h),6.65(d,j=8.0hz,1h),5.71-5.55(m,1h),5.03-4.92(m,2h),4.85(d,j=6.6hz,2h),3.65-3.55(m,1h),3.35(s,6h),3.33-3.23(m,2h),3.12-3.02(m,2h),2.90-2.80(m,1h),2.65-2.55(m,1h),2.45(s,3h),2.27(s,3h),2.20-2.10(m,1h),1.85-1.75(m,1h);esi-ms m/z:575.2[m+h]
+
.
[0263]
实施例21:化合物21
[0264][0265]
合成路线:
[0266][0267]
步骤1:化合物21-1的合成
[0268]
将2-烯丙基-6-(甲硫基)-1,2-二氢-3h-吡唑并[3,4-d]嘧啶-3-酮(合成参照wo2017075629,2.2g,10mmol),2-溴-6-甲硫基吡啶(2.0g,10mmol),cui(1.9g,10mmol),碳酸钾(2.8g,20mmol),n,n'-二甲基乙二胺(880mg,10mmol)加入到1,4-dioxane(100ml)中,ar保护下,升温100℃反应过夜。lc-ms监测反应完毕,过滤,滤液浓缩,残留物柱层析(dcm/
meoh=100/1to 30/1)得到浅黄色固体化合物(1.0g,收率29%),esi-ms m/z:346.1[m+h]
+
。
[0269]
步骤2:化合物21-2的合成
[0270]
将化合物21-1(345mg,1mmol)溶于dcm(10ml)中,冰浴冷却下,缓慢加入m-cpba(0.87g,5mmol),r.t.反应5h,lc-ms监测反应完毕,反应液直接用于下一步反应。
[0271]
步骤3:化合物21的合成
[0272]
将上步所得化合物21-2的反应液中,加入dipea(780mg,6.0mmol)和化合物17-5a(220mg,1.0mmol),于r.t.下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到黄色固体化合物21(200mg,收率36%)。
[0273]1h nmr(400mhz,cdcl3)δ:8.78(s,1h),7.63(t,j=7.9hz,1h),7.51(s,1h),7.40(d,j=7.8hz,1h),7.12(d,j=2.3hz,1h),6.85-6.77(m,1h),6.73(d,j=8.5hz,1h),6.66(d,j=8.0hz,1h),5.72-5.57(m,1h),5.05-4.95(m,2h),4.81(d,j=6.8hz,2h),4.13(dd,j=10.5,2.8hz,1h),3.97(dd,j=10.5,8.8hz,1h),3.46(d,j=9.5hz,1h),3.40(s,3h),3.21(t,j=10.0hz,1h),2.88(d,j=11.5hz,1h),2.76(t,j=14.4hz,2h),2.34(s,3h),2.26-2.17(m,1h),1.83-1.18(m,1h);esi-ms m/z:549.2[m+h]
+
.
[0274]
实施例22:化合物22
[0275][0276]
合成路线:
[0277][0278]
以化合物18-8a和化合物21-2为原料,按照实施例21类似的合成方法,得到化合物22。
[0279]1h nmr(400mhz,cdcl3)δ:8.76(s,1h),7.62(t,j=7.9hz,1h),7.50(s,1h),7.39(d,j=7.8hz,1h),7.11(d,j=2.3hz,1h),6.84-6.75(m,1h),6.73(d,j=8.5hz,1h),6.66(d,j=8.0hz,1h),5.72-5.57(m,1h),5.05-4.95(m,2h),4.81(d,j=6.8hz,2h),3.65-3.55(m,1h),3.39(s,3h),3.33-3.23(m,2h),3.12-3.02(m,2h),2.90-2.80(m,1h),2.65-2.55(m,1h),2.45(s,3h),2.27(s,3h),2.23-2.08(m,1h),1.83-1.73(m,1h);esi-ms m/z:562.2[m+h]
+
.
[0280]
实施例23:化合物23
[0281][0282]
合成路线:
[0283][0284]
步骤1:化合物23的合成
[0285]
将化合物23-1(参见wo2018133829,375mg,1.0mmol)溶于甲苯(10ml)中,冰浴冷却下,加入m-cpba(377mg,2.0mmol),r.t.反应3h,加入dipea(520mg,4.0mmol),加入17-5a(220mg,1.0mmol),于r.t.下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到黄色固体化合物23(300mg,收率55%)。
[0286]1h nmr(400mhz,cdcl3)δ:8.76(s,1h),7.62(s,1h),7.43(s,1h),7.22(d,j=7.8hz,1h),7.06(d,j=2.3hz,1h),6.83-6.73(m,1h),6.73(d,j=8.5hz,1h),6.66(d,j=8.0hz,1h),5.72-5.57(m,1h),5.05-4.95(m,2h),4.83(d,j=6.8hz,2h),4.17(dd,j=10.6,2.8hz,1h),3.98(dd,j=10.6,8.9hz,1h),3.46(d,j=9.4hz,1h),3.21(t,j=10.0hz,1h),2.87(d,j=11.5hz,1h),2.78(t,j=14.4hz,2h),2.34(s,3h),2.29(s,6h),2.23-2.15(m,1h),1.85-1.80(m,1h);esi-ms m/z:547.2[m+h]
+
.
[0287]
实施例24:化合物24
[0288][0289]
合成路线:
[0290][0291]
以化合物23-1和化合物18-8a为原料,按照实施例23相似的合成方法,得到化合物24。
[0292]1h nmr(400mhz,cdcl3)δ:8.76(s,1h),7.62(s,1h),7.43(s,1h),7.22(d,j=7.8hz,1h),7.06(d,j=2.3hz,1h),6.83-6.73(m,1h),6.73(d,j=8.5hz,1h),6.66(d,j=8.0hz,1h),5.72-5.57(m,1h),5.05-4.95(m,2h),4.81(d,j=6.8hz,2h),3.66-3.56(m,1h),,3.32-3.22(m,2h),3.11-3.02(m,2h),2.91-2.82(m,1h),2.65-2.55(m,1h),2.46(s,3h),2.29(s,3h),2.25(s,6h)2.20-2.10(m,1h),1.83-1.70(m,1h);esi-ms m/z:560.2[m+h]
+
。
[0293]
实施例25:化合物25
[0294][0295]
合成路线:
[0296][0297]
以化合物25-1(合成参照wo2009054332)和17-5a为原料,按照实施例23相似的合成方法,得到化合物25。
[0298]1h nmr(400mhz,cdcl3)δ:8.76(s,1h),7.95(s,1h),7.82(s,1h),7.62(s,1h),7.53(s,1h),7.43(s,1h),7.22(d,j=7.8hz,1h),7.06(d,j=2.3hz,1h),6.83-6.73(m,1h),6.75-6.68(m,2h),6.66(d,j=8.0hz,1h),5.73-5.53(m,1h),5.05-4.95(m,2h),4.81(d,j=6.8hz,2h),4.17(dd,j=10.6,2.8hz,1h),3.98(dd,j=10.6,8.9hz,1h),3.46(d,j=9.4hz,1h),3.22(t,j=10.0hz,1h),2.87(d,j=11.5hz,1h),2.78(t,j=10.4hz,2h),2.35(s,3h),2.25-2.15(m,1h),1.86-1.79(m,1h);esi-ms m/z:564.2[m+h]
+
.
[0299]
实施例26:化合物26
[0300][0301]
合成路线:
[0302][0303]
以化合物25-1和18-8a为原料,按照实施例23相似的合成方法,得到化合物26。
[0304]1h nmr(400mhz,cdcl3)δ:8.79(s,1h),7.94(s,1h),7.81(s,1h),7.60(s,1h),7.51(s,1h),7.41(s,1h),7.21(d,j=7.8hz,1h),7.04(d,j=2.3hz,1h),6.85-6.75(m,1h),6.75-6.65(m,3h),5.73-5.51(m,1h),5.05-4.95(m,2h),4.81(d,j=6.8hz,2h),3.63-3.52(m,1h),3.30-3.21(m,2h),3.13-3.01(m,2h),2.92-2.81(m,1h),2.63-2.53(m,1h),2.48(s,3h),2.28(s,3h),2.23-2.10(m,1h),1.79-1.68(m,1h);esi-ms m/z:577.2[m+h]
+
.
[0305]
实施例27:化合物27
[0306][0307]
合成路线:
[0308][0309]
以化合物27-1(合成参照wo2018171633)和化合物17-5a为原料,按照实施例23相似的合成方法,得到化合物27。
[0310]1h nmr(400mhz,cdcl3)δ:8.79(s,1h),7.65(s,1h),7.41(s,1h),7.12(d,j=7.8hz,1h),6.83-6.73(m,1h),6.73(d,j=8.5hz,1h),6.66(d,j=8.0hz,1h),5.72-5.57(m,2h),4.78(s,2h),4.66(d,j=6.8hz,2h),4.17(dd,j=10.6,2.8hz,1h),3.98(dd,j=10.6,8.9hz,1h),3.46-3.36(m,3h),3.21(t,j=10.0hz,1h),2.87(d,j=11.5hz,1h),2.78(t,j=14.4hz,2h),2.34(s,3h),2.23-2.15(m,1h),1.95-1.80(m,3h),1.65-1.55(m,2h);esi-ms m/z:582.2[m+h]
+
.
[0311]
实施例28:化合物28
[0312][0313]
合成路线:
[0314][0315]
以化合物27-1和化合物18-8a为原料,按照实施例23相似的合成方法,得到化合物28。
[0316]1h nmr(400mhz,cdcl3)δ:8.78(s,1h),7.63(s,1h),7.40(s,1h),7.14(s,1h),6.83-6.73(m,1h),6.75(d,j=8.5hz,1h),6.68(d,j=8.0hz,1h),5.32-5.56(m,2h),4.78(s,2h),4.65(d,j=6.8hz,2h),3.64-3.53(m,1h),3.34-3.22(m,4h),3.12-3.02(m,2h),2.90-2.80(m,1h),2.65-2.55(m,1h),2.45(s,3h),2.27(s,3h),2.20-2.10(m,3h),1.85-1.75(m,1h),1.66-1.50(m,2h);esi-ms m/z:595.2[m+h]
+
.
[0317]
实施例29:化合物29
[0318][0319]
合成路线:
[0320][0321]
以化合物29-1(合成参照wo2019085933)和化合物17-5a为原料,按照实施例23相似的合成方法,得到化合物29。
[0322]1h nmr(400mhz,cdcl3)δ:8.79(s,1h),7.62(s,1h),7.41(s,1h),7.12(d,j=7.8hz,1h),7.05(d,j=7.8hz,1h),6.83-6.73(m,1h),6.73(d,j=8.5hz,1h),6.67(d,j=8.0hz,1h),5.72-5.57(m,2h),4.82(d,j=17.1hz,1h),4.66(d,j=6.8hz,2h),4.17(dd,j=10.6,2.8hz,1h),3.98(dd,j=10.6,8.9hz,1h),3.46-3.36(m,1h),3.21(t,j=10.0hz,1h),2.87-2.65(m,5h),2.34(s,3h),2.23-2.15(m,1h),1.95-1.80(m,1h),1.65-1.55(m,
4h),1.42(s,3h);esi-ms m/z:555.2[m+h]
+
.
[0323]
实施例30:化合物30
[0324][0325]
合成路线:
[0326][0327]
以化合物29-1和化合物18-8a为原料,按照实施例23相似的合成方法,得到化合物30。
[0328]1h nmr(400mhz,cdcl3)δ:8.79(s,1h),7.62(s,1h),7.41(s,1h),7.12(d,j=7.8hz,1h),7.05(d,j=7.8hz,1h),6.83-6.73(m,1h),6.73(d,j=8.5hz,1h),6.67(d,j=8.0hz,1h),5.72-5.57(m,2h),4.82(d,j=17.1hz,1h),4.66(d,j=6.8hz,2h),3.65-3.55(m,1h),3.33-3.23(m,2h),3.12-3.02(m,2h),2.90-2.80(m,1h),2.65-2.55(m,1h),2.45(s,3h),2.27(s,3h),2.20-2.10(m,5h),1.85-1.75(m,3h),1.42(s,3h);esi-ms m/z:568.2[m+h]
+
.
[0329]
实施例31:化合物31
[0330][0331]
合成路线:
[0332][0333]
以化合物31-1(合成参照wo2018090939)和化合物17-5a为原料,按照实施例23相似的合成方法,得到化合物31。
[0334]1h nmr(400mhz,dmso-d6)δ:10.23(s,1h),8.70(s,1h),7.75-7.61(m,3h),7.13(d,j=2.4hz,1h),6.98(dd,j=8.6,2.3hz,1h),6.63(d,j=8.6hz,1h),4.65-4.52(m,2h),
7.25(m,2h),7.13(d,j=2.4hz,1h),6.98(dd,j=8.6,2.3hz,1h),6.63(d,j=8.6hz,1h),4.25-4.10(m,1h),3.84(dd,j=10.6,8.7hz,1h),3.33-3.23(m,1h),3.12-3.01(m,1h),2.92-2.81(m,2h),2.67-2.56(m,1h),2.29(s,3h),2.26-2.06(m,1h),1.88-1.79(m,1h);esi-ms m/z:549.2[m+h]
+
.
[0347]
实施例34:化合物34
[0348][0349]
合成路线:
[0350][0351]
以化合物33-1和化合物18-8a为原料,按照实施例23相似的合成方法,得到化合物34。
[0352]1h nmr(400mhz,dmso-d6)δ:10.28(s,1h),8.76(s,1h),7.73-7.60(m,3h),7.33-7.22(m,2h),7.11(d,j=2.4hz,1h),6.98(dd,j=8.5,2.3hz,1h),6.63(d,j=8.5hz,1h),3.65-3.54(m,1h),,3.32-3.23(m,2h),3.12-3.02(m,2h),2.90-2.80(m,1h),2.66-2.55(m,1h),2.43(s,3h),2.26(s,3h),2.20-2.11(m,1h),1.85-1.73(m,1h);esi-ms m/z:562.2[m+h]
+
.
[0353]
实施例35:化合物35
[0354][0355]
合成路线:
[0356][0357]
以化合物35-1(合成参照wo2010067888)和化合物17-5a为原料,按照实施例23相似的合成方法,得到化合物35。
[0358]1h nmr(400mhz,dmso-d6)δ:10.01(s,1h),8.78(s,1h),7.63-7.51(m,3h),7.10(d,j=2.3hz,1h),6.95(dd,j=8.0,2.3hz,1h),6.65(d,j=8.0hz,1h),4.25-4.10(m,1h),3.84(dd,j=10.6,8.7hz,1h),3.35(s,3h),3.33-3.23(m,1h),3.12-3.02(m,1h),2.90-2.80(m,2h),2.66-2.55(m,1h),2.41(s,3h),2.21-2.11(m,1h),1.87-1.80(m,1h);esi-ms m/z:540.1[m+h]
+
.
[0359]
实施例36:化合物36
[0360][0361]
合成路线:
[0362][0363]
以化合物35-1和化合物18-8a为原料,按照实施例23相似的合成方法,得到化合物36。
[0364]1h nmr(400mhz,dmso-d6)δ:9.87(s,1h),8.79(s,1h),7.62-7.50(m,3h),7.02(d,j=2.3hz,1h),6.91(dd,j=8.0,2.3hz,1h),6.62(d,j=8.0hz,1h),3.64-3.55(m,1h),3.36(s,3h),3.33-3.22(m,2h),3.13-3.02(m,2h),2.91-2.80(m,1h),2.65-2.53(m,1h),2.45(s,3h),2.26(s,3h),2.23-2.10(m,1h),1.83-1.76(m,1h);esi-ms m/z:553.1[m+h]
+
.
[0365]
实施例37:化合物37
[0366][0367]
合成路线:
[0368][0369]
以化合物37-1(合成参照wo2013059485)和化合物17-5a为原料,按照实施例23相似的合成方法,得到化合物37。
[0370]1h nmr(400mhz,dmso-d6)δ:9.89(s,1h),8.95(s,1h),8.05(s,1h),7.63-7.51(m,
3h),7.10(d,j=2.3hz,1h),6.95(dd,j=8.0,2.3hz,1h),6.65(d,j=8.0hz,1h),4.25-4.10(m,1h),3.84(dd,j=10.6,8.7hz,1h),3.55(s,3h),3.33-3.23(m,1h),3.12-3.02(m,1h),2.90-2.80(m,2h),2.66-2.55(m,1h),2.41(s,3h),2.21-2.11(m,1h),1.87-1.80(m,1h);esi-ms m/z:523.1[m+h]
+
.
[0371]
实施例38:化合物38
[0372][0373]
合成路线:
[0374][0375]
以化合物37-1和化合物18-8a为原料,按照实施例23相似的合成方法,得到化合物38。
[0376]1h nmr(400mhz,dmso-d6)δ:9.86(s,1h),8.85(s,1h),8.03(s,1h),7.61-7.51(m,3h),7.09(d,j=2.3hz,1h),6.93(dd,j=8.0,2.3hz,1h),6.63(d,j=8.0hz,1h),3.65-3.55(m,1h),3.51(s,3h),3.33-3.23(m,2h),3.12-3.02(m,2h),2.90-2.80(m,1h),2.65-2.54(m,1h),2.46(s,3h),2.26(s,3h),2.23-2.10(m,1h),1.85-1.74(m,1h);esi-ms m/z:536.1[m+h]
+
.
[0377]
实施例39:化合物39
[0378][0379]
合成路线:
[0380][0381]
以化合物39-1(合成参照wo2015092431)和化合物17-5a为原料,按照实施例23相似的合成方法,得到化合物39。
[0382]1h nmr(400mhz,cdcl3)δ:8.68(s,1h),7.46-7.38(m,2h),7.31-7.25(m,1h),7.17
7.51(m,2h),7.35-7.25(m,1h),7.12(d,j=2.3hz,1h),6.96(dd,j=8.0,2.3hz,1h),6.65(d,j=8.0hz,1h),4.27-4.15(m,1h),3.88(dd,j=10.6,8.7hz,1h),3.32-3.16(m,1h),3.13-3.02(m,1h),2.95-2.83(m,2h),2.65-2.55(m,1h),2.40(s,3h),2.28-2.15(m,1h),1.94-1.87(m,1h);esi-ms m/z:534.1[m+h]
+
.
[0431]
实施例48:化合物48
[0432][0433]
合成路线:
[0434][0435]
以化合物47-1和化合物18-8a为原料,按照实施例23相似的合成方法,得到化合物48。
[0436]1h nmr(400mhz,dmso-d6)δ:9.86(s,1h),8.81(s,1h),7.75-7.66(s,1h),7.60-7.50(m,2h),7.33-7.21(m,1h),7.14(d,j=2.3hz,1h),6.97(dd,j=8.0,2.3hz,1h),6.67(d,j=8.0hz,1h),4.26-4.13(m,1h),3.87(dd,j=10.6,8.7hz,1h),3.33-3.18(m,1h),3.11-3.01(m,1h),2.93-2.81(m,2h),2.62-2.50(m,1h),2.38(s,3h),2.24-2.10(m,1h),1.90-1.86(m,1h);esi-ms m/z:547.1[m+h]
+
.
[0437]
实施例49:化合物49
[0438][0439]
合成路线:
[0440][0441]
步骤1:化合物49-1的合成
[0442]
将4-羟基-2-(甲硫基)嘧啶-5-甲酸(3.7g,20mmol)加入到socl2(100ml)中,滴加催化量的dmf(0.25ml),回流反应2h,lc-ms监测反应完毕,直接浓缩,得到米黄色固体,分别甲苯(50ml)和正己烷(50ml)加热溶解,过滤,滤液浓缩,得到白色固体化合物(4.0g,收率78%),初产物未经纯化并直接用于下一步反应。
[0443]
步骤2:化合物49-2的合成
[0444]
将2,6-二氯苯胺(3.24,20mmol)溶于dcm(50ml),加入吡啶(3.95g,50mmol),冰浴,滴加化合物49-1(5.2g,20mmol)的dcm(30ml)溶液,加毕,r.t.反应2天,lc-ms监测反应完毕,倒入水(50ml)中,分液,有机相用稀盐酸(30ml)洗,饱和食盐水(50ml)洗,无水na2so4干燥,滤液浓缩,得到浅黄色固体初产物,乙醇(20ml)重结晶,得到类白色固体化合物(3g,收率43%),esi-ms m/z:347.9[m+h]
+
。
[0445]
步骤3:化合物49-3的合成
[0446]
将化合物49-2(3.5g,10mmol)溶于thf(20ml)中,冰浴,加入nh3/meoh(7m,5ml),r.t.反应过夜,lc-ms监测反应完毕,浓缩,残留物水(30ml)洗,干燥,得到浅黄色固体化合物(2.5g,收率76%),esi-ms m/z:329.0[m+h]
+
。
[0447]
步骤4:化合物49-4的合成
[0448]
将化合物49-3(3.3g,10mmol)置于三颈瓶中,ar保护,加热原乙酸三乙酯(14.6g,90mmol),搅拌下加入hoac(1.2g,20mmol),60℃反应5h,lc-ms监测反应完毕,冷却,加入正庚烷(50ml),析出固体,固体用正庚烷(10ml)洗,干燥,得到浅黄色固体化合物(2.3g,收率65%),esi-ms m/z:353.0[m+h]
+
。
[0449]
步骤5:化合物49-5的合成
[0450]
将化合物49-4(353mg,1.0mmol)溶于dcm中(10ml)中,冰浴冷却下,加入m-cpba(377mg,2.0mmol),r.t.反应3h,lc-ms监测反应完毕,反应液直接用于下一步反应。esi-ms m/z:385.0[m+h]
+
。
[0451]
步骤6:化合物49的合成
[0452]
将化合物49-5(理论量,1.0mmol)的反应液中,加入dipea(520mg,4.0mmol),加入化合物17-5a(220mg,1.0mmol),于50℃下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到黄色固体化合物49(100mg,收率19%)。
[0453]1h nmr(400mhz,dmso-d6)δ:9.93(s,1h),8.68(s,1h),7.58-7.40(m,3h),7.08(d,j=2.5hz,1h),6.92(dd,j=8.6,2.5hz,1h),6.63(d,j=8.6hz,1h),4.26-4.11(m,1h),3.83(dd,j=10.6,8.7hz,1h),3.33-3.23(m,1h),3.10-3.01(m,1h),2.90-2.81(m,2h),2.64-2.52(m,1h),2.43(s,3h),2.36(s,3h),2.26-2.18(m,1h),1.92-1.87(m,1h);esi-ms m/z:524.1[m+h]
+
.
[0454]
实施例50:化合物50
[0455][0456]
合成路线:
[0457][0458]
以化合物49-4和化合物18-8a为原料,按照实施例23相似的合成方法,得到化合物50。
[0459]1h nmr(400mhz,dmso-d6)δ:9.87(s,1h),8.79(s,1h),7.56-7.38(m,3h),7.05(d,j=2.1hz,1h),6.92(dd,j=8.2,2.1hz,1h),6.63(d,j=8.2hz,1h),3.63-3.53(m,1h),3.33-3.22(m,2h),3.13-3.00(m,2h),2.91-2.81(m,1h),2.65-2.51(m,1h),2.46(s,3h),2.36(s,3h),2.25(s,3h),2.25-2.16(m,1h),1.88-1.79(m,1h);esi-ms m/z:537.1[m+h]
+
.
[0460]
实施例51:化合物51
[0461][0462]
合成路线:
[0463][0464]
以化合物51-1(合成参照wo2018133829)和化合物17-5a为原料,按照实施例23相似的合成方法,得到化合物51。
[0465]1h nmr(400mhz,cdcl3)δ:8.75(s,1h),7.58(s,1h),7.33(s,1h),6.82-6.67(m,3h),6.72(d,j=8.6hz,1h),6.64(d,j=8.5hz,1h),5.71-5.56(m,1h),5.05-4.93(m,2h),4.68(d,j=6.8hz,2h),4.15(dd,j=10.3,2.6hz,1h),3.95(dd,j=10.4,8.9hz,1h),3.78(s,3h),3.42(d,j=9.8hz,1h),3.20(t,j=10.0hz,1h),2.86(d,j=11.5hz,1h),2.76(t,j=14.4hz,2h),2.35(s,3h),2.25-2.10(m,1h),1.91-1.85(m,1h);esi-ms m/z:501.2[m+h]
+
.
[0466]
实施例52:化合物52
[0467][0468]
合成路线:
[0469][0470]
以化合物51-1和化合物18-8a为原料,按照实施例23相似的合成方法,得到化合物52。
[0471]1h nmr(400mhz,cdcl3)δ:8.73(s,1h),7.56(s,1h),7.30(s,1h),6.83-6.66(m,3h),6.70(d,j=8.5hz,1h),6.63(d,j=8.5hz,1h),5.70-5.53(m,1h),5.03-4.92(m,2h),4.66(d,j=6.9hz,2h),3.76(s,3h),3.63-3.54(m,1h),3.31-3.20(m,2h),3.12-3.02(m,2h),2.92-2.82(m,1h),2.65-2.53(m,1h),2.46(s,3h),2.29(s,3h),2.23-2.10(m,1h),1.80-1.71(m,1h);esi-ms m/z:514.2[m+h]
+
。
[0472]
实施例53:化合物53
[0473][0474]
合成路线:
[0475][0476]
步骤1:化合物53-1的合成
[0477]
将2-烯丙基-6-(甲硫基)-1,2-二氢-3h-吡唑并[3,4-d]嘧啶-3-酮(合成参照wo2017075629,2.2g,10mmol),2-溴-6-(2,2,2-三氟乙氧基)吡啶(合成参照us20120225061,2.56g,10mmol),cui(1.9g,10mmol),k2co3(2.8g,20mmol),n,n'-二甲基乙二胺(880mg,10mmol)加入到1,4-dioxane(100ml)中,ar保护下,升温100℃反应过夜。lc-ms监测反应完毕,过滤,滤液浓缩,残留物柱层析(dcm/meoh=100/1to 30/1)得到浅黄色固体化合物53-1(1.2g,收率30%),esi-ms m/z:398.1[m+h]
+
。
[0478]
步骤2:化合物53的合成
[0479]
将化合物53-1(255mg,0.64mmol)溶于甲苯(10ml)中,冰浴,加入m-cpba(241mg,1.28mmol),r.t.反应3h,tlc监测反应完毕,反应液中加入dipea(332mg,2.56mmol)和化合物17-5a(150mg,0.64mmol),于80℃下反应过夜,lc-ms监测反应完毕,直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到化合物53(黄色固体150mg,收率41%)。
[0480]1h nmr(400mhz,cdcl3)δ:8.74(s,1h),7.57(s,1h),7.33(s,1h),6.82-6.67(m,3h),6.71(d,j=8.9hz,1h),6.62(d,j=8.8hz,1h),5.71-5.57(m,1h),5.02-4.94(m,2h),4.72(s,2h),4.60(d,j=6.2hz,2h),4.16(dd,j=10.1,2.6hz,1h),3.96(dd,j=10.2,8.8hz,1h),3.42(d,j=9.1hz,1h),3.21(t,j=10.0hz,1h),2.87(d,j=10.5hz,1h),2.75(t,j=12.4hz,2h),2.34(s,3h),2.26-2.11(m,1h),1.92-1.86(m,1h);esi-ms m/z:569.2[m+h]
+
.
[0481]
实施例54:化合物54
[0482][0483]
合成路线:
[0484][0485]
以化合物53-1和化合物18-8a为原料,按照实施例23相似的合成方法,得到化合物54。
[0486]1h nmr(400mhz,cdcl3)δ:8.75(s,1h),7.58(s,1h),7.31(s,1h),6.80-6.68(m,3h),6.70(d,j=8.6hz,1h),6.60(d,j=8.5hz,1h),5.70-5.55(m,1h),5.01-4.93(m,2h),4.71(s,2h),4.58(d,j=6.5hz,2h),3.60-3.50(m,1h),3.30-3.19(m,2h),3.08-3.00(m,2h),2.91-2.80(m,1h),2.62-2.51(m,1h),2.45(s,3h),2.30(s,3h),2.23-2.12(m,1h),1.85-1.72(m,1h);esi-ms m/z:582.2[m+h]
+
。
[0487]
实施例55:化合物55
[0488][0489]
合成路线:
[0490][0491]
将化合物17-5a(220mg,1.0mmol)和化合物55-1(合成参照journal of medicinal chemistry,2009,52(16),5152-5163;397mg,1.0mmol)溶于dmf(10ml)中,加入pd(oac)2(23mg,0.1mmol),binap(75mg,0.12mmol),k2co3(415mg,3.0mmol),ar保护下,升温80℃反应过夜,lc-ms监测反应完毕,过滤,滤液直接浓缩,残留物经柱层析(dcm/meoh=100/1to 10/1)得到黄色固体化合物(200mg,收率40%)。
[0492]1h nmr(400mhz,dmso-d6)δ:9.45(s,1h),8.42(s,1h),8.13(d,j=4.5hz,1h),7.12(d,j=2.3hz,1h),6.96(dd,j=8.0,2.3hz,1h),6.65(d,j=8.0hz,1h),4.32(s,3h),4.17(dd,j=10.5,2.8hz,1h),3.98(dd,j=10.5,8.9hz,1h),3.46(d,j=8.9hz,1h),3.21(t,j
=10.0hz,1h),2.90-2.80(m,4h),2.75-2.65(m,4h),2.34(s,3h),2.23-2.15(m,1h),1.95-1.85(m,1h),1.35(s,6h);esi-ms m/z:489.2[m+h]
+
.
[0493]
实施例56:化合物56
[0494][0495]
合成路线:
[0496][0497]
以化合物55-1和化合物18-8a为原料,按照实施例55类似的合成方法,得到化合物56。
[0498]1h nmr(400mhz,dmso-d6)δ:9.41(s,1h),8.40(s,1h),8.11(d,j=4.5hz,1h),7.10(d,j=2.3hz,1h),6.96(dd,j=8.0,2.3hz,1h),6.63(d,j=8.0hz,1h),4.33(s,3h),3.65-3.55(m,1h),,3.33-3.23(m,2h),3.12-3.02(m,2h),2.90-2.80(m,3h),2.65-2.55(m,4h),2.45(s,3h),2.27(s,3h),2.20-2.10(m,1h),1.85-1.75(m,1h),1.32(s,6h);esi-ms m/z:502.3[m+h]
+
.
[0499]
实施例57:化合物抑制wee-1酶活性测定
[0500]
运用lanthra screen wee-1激酶试剂盒(invitrogen),测定化合物抑制wee-1激酶活性。dmso梯度稀释的化合物5μl,5μl wee-1激酶(终浓度5nm),5μl eu-anti-gst antibody(终浓度2nm)混合物和5μl kinase tracer 178(终浓度50nm)充分混合后,在室温孵育一小时后,读板。与dmso溶剂对照组相比,计算化合物抑制wee-1激酶活性的ic
50
。
[0501]
表1.本发明化合物抑制wee1激酶活性的ic
50
[0502]
[0503][0504]
从表1数据可以看出,本发明化合物对wee1激酶具有很强的抑制作用。
[0505]
实施例58:ht29抗细胞增殖活性测定
[0506]
3000个ht29细胞种植于384孔板(fisher 142762)中,过夜贴壁后,加入梯度稀释的化合物,加入化合物72h后,加入cell titer-lumi(碧云天c0068xl)测量细胞中atp的含量,评价细胞生长的情况,计算化合物抑制细胞生长的ic
50
。
[0507]
表2.本发明化合物抑制ht-29细胞生长的ic
50
[0508]
[0509][0510]
从表2数据可以看出,本发明化合物对ht-29细胞具有很强的抗增殖活性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- SPNP‑I在制备Nav1.7通道工具试剂中的应用的制造方法与工艺
- SPNP‑I在制备Nav1.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- SGLT‑2糖尿病抑制剂及其中间体的制备方法与流程