基于双匙解锁机制检测miRNA的试剂盒及应用的制作方法
本发明属于检测用试剂盒领域,具体涉及一种基于“双匙解锁机制”检测mirna的试剂盒及应用。
背景技术:
微小rna(mirna)是一种具有短长度(约22个核苷酸)的内源性非编码小分子,并与信使rna结合以参与转录后水平的基因表达调控。大量的研究表明,多种mirna的异常表达与各种疾病,特别是人类肿瘤和癌症密切相关。例如,mirna-21和mirna-141是常见人类癌症中过表达的上皮相关mirna,包括乳腺癌,肺癌和前列腺癌等。实现mirna的高通量同检有助于提高检测的准确性。目标mirrna-21和mirna-141作为重要肿瘤标志物可用于肿瘤的的诊断,治疗和预后,具有重要的临床意义。然而,由于其低浓度,小尺寸和高同源性等特征,实现其简单、准确、特异及灵敏的检测仍是一项巨大的挑战。
技术实现要素:
本发明的目的在于克服现有技术中的缺陷,提供一种基于“双匙解锁机制”检测mirna的试剂盒及应用。
本发明为实现上述目的,采用以下技术方案:
一种基于“双匙解锁机制”检测mirna的试剂盒,包括荧光编码“锁状”探针、信号富集探针以及双链特异性核酸酶;所述的荧光编码“锁状”探针为氨基化茎环dna(dna-21:cctcaacatcagtctgataagctagttgaggttttttttttt-nh2,dna-141:attgtgacagaccatttctaccacaattttttttttttt-nh2)与羧基化荧光编码纳米微球(北京华泰昕,红色:cat.no.qdscf20050,绿色:cat.no.qdscf10050)偶联得到;所述的信号富集探针为氨基化单链dna(生工,ssdna-21:aaaacctcaacc-nh2,ssdna-141:aaaaattgtttt-nh2)与羧基化聚苯乙烯微球(天津倍思乐色谱技术开发中心,cat.no.6–3-1000)偶联得到。偶联剂为edc。
所述的试剂盒采用下述方法使用:
1)“双钥解锁”及靶标循环回收:mirna与所述的荧光编码“锁状”探针中的茎环dna互补配对,然后加入双链特异性核酸酶特异性切割杂交链中的dna,在mirna/dsn“双钥”作用下,解锁荧光编码“锁状”探针,并引发靶标循环反应,实现信号放大;
2)信号富集扩增及流式微球定量:解锁的荧光编码探针中的dna单链与所述的信号富集探针中dna单链互补配对,将荧光信号富集于比表面积较大的聚苯乙烯微球表面,实现信号富集扩增;无需多次清洗纯化步骤,直接将富集荧光信号的聚苯乙烯微球进行流式分析,实现定量检测。
优选的,所述的荧光编码“锁状”探针的制备具体的包括下述步骤:将羧基化荧光纳米球、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐水溶液按照摩尔比为1:1-4比例混合于磷酸缓冲液中,涡旋仪上低速旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应15-30分钟,然后加入氨基化茎环dna,室温下反应过夜;反应结束后,采用离心分离进行纯化,用pbs缓冲液至少清洗三次以除去未反应的茎环dna,得到荧光编码“锁状”探针。
优选的,所述的信号富集探针采用下述方法制备:(1)将羧基化聚苯乙烯微球、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐水溶液按照摩尔比为1:1-4比例混合于磷酸缓冲液中,涡旋仪上低速旋转使其混匀,然后将上述混合溶液置于旋转混合架上,室温下反应15-30分钟,然后加入氨基化单链dna,室温下反应过夜;反应结束后,采用离心分离进行纯化,用pbs缓冲液至少清洗三次以除去未反应的单链dna,得到信号富集探针。
优选的,“双钥解锁”及靶标循环回收的具体步骤为:将荧光编码“锁状”探针、待检mirna按照体积比为1-3:1比例混合于磷酸缓冲液中,加入0.1-0.6u双链特异性核酸酶及10×双链特异性核酸酶缓冲液,涡旋仪上低速旋转使其混匀,然后将上述混合溶液置于金属浴中,35-60℃下反应20-120分钟,实现靶标循环回收及信号放大。反应结束后,加入终止液,45℃反应5分钟,使酶失活。
优选的,富集扩增及流式微球定量的具体步骤为:加入信号富集探针加入5-30微升,使dna进行互补配对,实现荧光信号富集,并用流式进行微球荧光定量分析。
本申请还包括一种所述的基于“双匙解锁机制”检测mirna的试剂盒的应用,用于检测mirna-21、mirna-141或者混合同检。
与现有技术相比,本发明的有益效果是:
本发明基于dsn-mirna双重解锁机制及信号富集扩增策略,结合流式荧光微球编码技术,实现了mirna-21及mirna-41的分检以及同检研究。
双链特异性核酸酶dsn是一种热稳定性核酸酶,能够选择性地切割降解双链dna和dna-rna杂交体中的dna,而对rna或者单链dna几乎没有作用。此外,这种降解作用仅针对于至少12个完全匹配的核苷酸序列,因此它具有高度特异性。本申请设计了荧光纳米球标记的分子信标作为“锁”结构,只有dsn-mirna“双钥”存在时,mirna基于碱基互补配对打开分子信标成为直链结构,此时dsn才能够特异性切割分子信标,将“锁”结构打开,标记荧光纳米球dna释放,保证了实验的特异性。
而基于dsn辅助靶标循化回收及信号富集扩增策略,提高了检测的灵敏度;基于流式微球编码技术,实现待检物的高通量同检研究。该方法操作简便,无需复杂的清洗分离等步骤,且具有低基质效应,为肿瘤的早期监测及预后治疗提供了良好的应用前景。
本发明制备的一种基于“双钥解锁机制”的mirna高通量检测研究及应用优势在于:1、本发明构建了一种“双钥解锁”微纳生物传感器,基于dsn-mirna双重解锁,保证了实验的特异性;2、基于dsn辅助靶标循化回收及信号富集扩增策略,提高了检测的灵敏度;3、基于流式微球编码技术,实现待检物的高通量同检研究。4、该传感操作简便,无需复杂的清洗分离等步骤,且具有低基质效应,成功应用于乳腺癌病人全血样品的分析检测,为肿瘤的早期监测及预后治疗提供了良好的应用前景。
附图说明
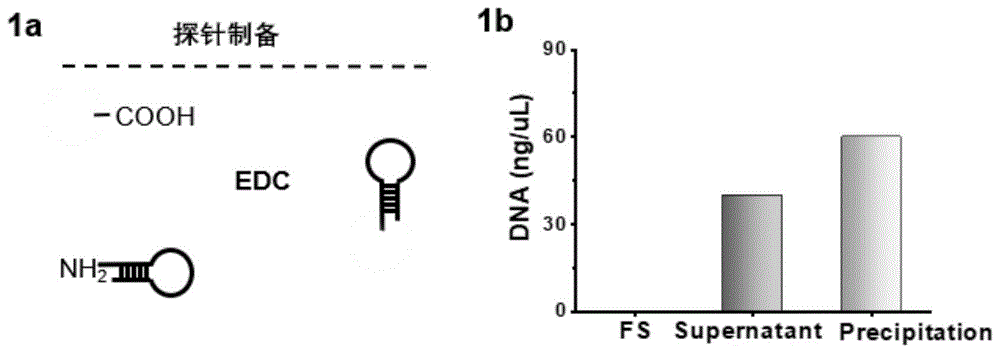
图1为本发明制备的进行mirna-21的检测的红色荧光编码“锁状”探针示意图以及dna-21含量图。
图2为本发明基于不同双链特异性核酸酶的酶量进行mirna-21检测图。
图3为本发明基于不同信号富集探针量进行mirna-21检测图。
图4为本发明实施例12用于mirna-21的检测图。图4a为荧光强度值变化对,mirna-21的定量检测;图4b为mirna-21检测的标准曲线。
图5为本发明实施例15用于mirna-21与mirna-141的单独与同时检测研究。
具体实施方式
为了使本技术领域的技术人员更好地理解本发明的技术方案,下面结合附图和最佳实施例对本发明作进一步的详细说明。
实施例1:
将羧基化荧光纳米球(红色,cat.no.qdscf20050,市购)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐水溶液按照摩尔比为1:4比例混合于磷酸缓冲液中,室温下反应15-30分钟,然后加入氨基化茎环dna-21(5’-3’,cctcaacatcagtctgataagctagttgaggttttttttttt-nh2),室温下反应过夜;
(2)反应结束后,采用离心分离进行纯化,用pbs缓冲液至少清洗三次以除去未反应的茎环dna-21,得到红色荧光编码“锁状”探针。
(3)将探针沉淀及上清于nanodrop进行dna-21浓度检测,探究探针dna-21偶联量。
(4)将羧基化聚苯乙烯微球(cat.no.6–3-1000,市购)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐水溶液按照摩尔比为1:4比例混合于磷酸缓冲液中,室温下反应15-30分钟,然后加入氨基化单链dna(ssdna-21:5’-3,aaaacctcaacc-nh2),室温下反应过夜;反应结束后,采用离心分离进行纯化除去未反应的ssdna-21,得到信号富集探针-21。
图1a是本发明制备的进行mirna-21的检测的红色荧光编码“锁状”探针的原理图解,图1b是探针偶联dna-21量的测定。由图1b可以看出,荧光编码纳米球本身不含有dna-21,偶联后探针含有dna-21,说明纳米球表面已成功偶联dna-21;离心上清也含有dna-21,说明在此浓度下,可获得dna-21在纳米球的最大偶联量。
(4)将红色荧光编码“锁状”探针、待检mirna按照体积比为1:1比例混合于磷酸缓冲液中,加入0.1u双链特异性核酸酶及10×双链特异性核酸酶缓冲液,涡旋仪上低速旋转使其混匀,然后将上述混合溶液置于金属浴中,35-60℃下反应20-120分钟,实现靶标循环回收及信号放大。反应结束后,加入终止液,45℃反应5分钟,将双链特异性核酸酶灭活。加入信号富集探针-21(实施例1制备得到)20微升,使dna进行互补配对,实现荧光信号富集,并用流式进行微球荧光定量分析,实现mir-21的定量检测。
由图2可知,加入0.1u双链特异性核酸酶,荧光值较低,此酶量不是最佳反应量。
实施例2:
将羧基化荧光纳米球(绿色,cat.no.qdscf10050)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐水溶液按照摩尔比为1:4比例混合于磷酸缓冲液中,室温下反应15-30分钟,然后加入氨基化茎环dna-141(5’-3’,attgtgacagaccatttctaccacaattttttttttttt-nh2),室温下反应过夜;
(2)反应结束后,采用离心分离进行纯化,用pbs缓冲液至少清洗三次以除去未反应的茎环dna-141,得到绿色荧光编码“锁状”探针。
(3)将羧基化聚苯乙烯微球(cat.no.6–3-1000,市购)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐水溶液按照摩尔比为1:4比例混合于磷酸缓冲液中,室温下反应15-30分钟,然后加入氨基化单链dna(ssdna-141:5’-3,aaaaattgtttt-nh2),室温下反应过夜;反应结束后,采用离心分离进行纯化,除去未反应的ssdna-141,得到信号富集探针-141。
(4)将绿色荧光编码“锁状”探针、待检mirna按照体积比为1:1比例混合于磷酸缓冲液中,加入0.1u双链特异性核酸酶及10×双链特异性核酸酶缓冲液,涡旋仪上低速旋转使其混匀,然后将上述混合溶液置于金属浴中,35-60℃下反应20-120分钟,实现靶标循环回收及信号放大。反应结束后,加入终止液,45℃反应5分钟,将双链特异性核酸酶灭活。加入信号富集探针-141(实施例1制备得到)20微升,使dna进行互补配对,实现荧光信号富集,并用流式进行微球荧光定量分析,实现mir-141的定量检测。
实施例3-7:实施例3-7与实施例1的红色荧光编码“锁状”探针的制备方法相同,区别仅在于,双链特异性核酸酶的加入量不同。实施例3为对应0.2u双链特异性核酸酶;实施例4对应0.3u双链特异性核酸酶;实施例5对应0.4u双链特异性核酸酶;实施例6对应0.5u双链特异性核酸酶;实施例7对应0.6u双链特异性核酸酶;如图2示,当加入双链特异核酸酶0.5u时,获得荧光强度达到最大值,酶量加大至0.6u时,荧光强度未明显增高,且趋于平台趋势。因此,0.5u双链特异性核酸酶为最佳酶量,用于后续实验。
实施例8-14:实施例8-13与实施例6的区别仅在于信号富集探针的加入量不同,实施例8对应加入5微升信号富集探针、实施例9对应加入5微升信号富集探针、实施例10对应加入10微升信号富集探针、实施例11对应加入15微升信号富集探针、实施例12对应加入20微升信号富集探针、实施例13对应加入25微升信号富集探针,实施例14对应加入30微升信号富集探针,由图3可知,在信号富集实验加入信号富集探针20微升(即实施例12),荧光强度达到最大值,20微升信号富集探针为最佳用量,用于后续实验。
实施例15:
(1)将红色荧光编码“锁状”探针(实施例1制备得到)、绿色荧光编码“锁状”探针(实施例2制备得到)、空白样品按照体积比为1:1:2比例混合于磷酸缓冲液中,加入0.5u双链特异性核酸酶及10×双链特异性核酸酶缓冲液,涡旋仪上低速旋转使其混匀,然后将上述混合溶液置于金属浴中,35c-60℃下反应20-120分钟,实现靶标循环回收及信号放大。反应结束后,加入终止液,45℃反应5分钟,将双链特异性核酸酶灭活。加入信号富集探针-21(实施例1制备得到)、信号富集探针-141(实施例2制备得到)各20微升,使dna进行互补配对,实现荧光信号富集,并用流式进行微球荧光定量分析。
(2)将红色荧光编码“锁状”探针(实施例1制备得到)、绿色荧光编码“锁状”探针(实施例2制备得到)、mirna-21样品、空白样品按照体积比为1:1:1:1比例混合于磷酸缓冲液中,加入0.5u双链特异性核酸酶及10×双链特异性核酸酶缓冲液,涡旋仪上低速旋转使其混匀,然后将上述混合溶液置于金属浴中,35-60℃下反应20-120分钟,实现靶标循环回收及信号放大。反应结束后,加入终止液,45℃反应5分钟,将双链特异性核酸酶灭活。加入信号富集探针-21(实施例1制备得到)、信号富集探针-141(实施例2制备得到)各20微升,使dna进行互补配对,实现荧光信号富集,并用流式进行微球荧光定量分析。
(3)将红色荧光编码“锁状”探针(实施例1制备得到)、绿色荧光编码“锁状”探针(实施例2制备得到)、空白样品、mirna-141样品按照体积比为1:1:1:1比例混合于磷酸缓冲液中,加入0.5u双链特异性核酸酶及10×双链特异性核酸酶缓冲液,涡旋仪上低速旋转使其混匀,然后将上述混合溶液置于金属浴中,35c-60℃下反应20-120分钟,实现靶标循环回收及信号放大。反应结束后,加入终止液,45℃反应5分钟,将双链特异性核酸酶灭活。加入信号富集探针-21(实施例1制备得到)、信号富集探针-141(实施例2制备得到)各20微升,使dna进行互补配对,实现荧光信号富集,并用流式进行微球荧光定量分析。
(4)将红色荧光编码“锁状”探针(实施例1制备得到)、绿色荧光编码“锁状”探针(实施例2制备得到)、mirna-21、mirna-141样品按照体积比为1:1:1:1比例混合于磷酸缓冲液中,加入0.5u双链特异性核酸酶及10×双链特异性核酸酶缓冲液,涡旋仪上低速旋转使其混匀,然后将上述混合溶液置于金属浴中,35-60℃下反应20-120分钟,实现靶标循环回收及信号放大。反应结束后,加入终止液,45℃反应5分钟,将双链特异性核酸酶灭活。加入信号富集探针-21(实施例1制备得到)、信号富集探针-141(实施例2制备得到)各20微升,使dna进行互补配对,实现荧光信号富集,并用流式进行微球荧光定量分析。
由图5可知,当只加入空白样品,未加入mirna-21与mirna-141时,fl1、fl2两通道均未检出荧光信号,两种mirna含量均未检出;当加入只mirna-21时,只有检测mirna-21含量的fl1通道荧光值达到2300,而检测mirna-141含量的fl2通道荧光值极低,说明可成功用于mirna-21的检测;当加入只mirna-141时,只有检测mirna-141含量的fl2通道荧光值达到700,而检测mirna-21含量的fl2通道荧光值极低,说明可成功用于mirna-141的检测;当同时加入mirna-21与mirna-141时,两通道均检测出荧光,且与单独加入时荧光强度相差不大,说明可成功应用于mirna-21与mirna-141的同时检测。
本发明基于“双钥解锁机制”实现了对mirna-21和mirna-141的同检研究。本研究设计了荧光纳米球标记的分子信标作为“锁”结构,只有dsn-mirna“双钥”存在时,mirna基于碱基互补配对打开分子信标成为直链结构,此时dsn才能够特异性切割分子信标,将“锁”结构打开,标记荧光纳米球dna释放,保证了实验的特异性。解锁后,待检物mirna不被割游离出来,dsn辅助靶标循环,实现信号第一重放大;而标记荧光纳米球的dna富集在微球载体上,实现信号的第二重放大,提高了检测的灵敏度。最后基于流式荧光微球编码及检测技术,实现了mirna的高通量定量检测。本发明能够很好地区分了微小rna家族成员之间的差异;整个检测过程,操作简便,快速检测,适合高危人群的社区肿瘤筛选,建立了一种肿瘤检测的新方法,并且可用于肿瘤与癌症的的诊断,治疗和预后,在生物医学研究和临床诊断中具有很大的应用价值。
以上内容仅为本发明的较佳实施例,对于本领域的普通技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处,本说明书内容不应理解为对本发明的限制。
- 还没有人留言评论。精彩留言会获得点赞!