信使RNA的纯化方法与流程
本申请是申请号为201580019400.x、申请日为2015年4月24日、发明名称为“信使rna的纯化方法”的中国发明专利申请的分案申请,原申请为国际申请号为pct/us2015/027563的pct国际申请的中国国家阶段申请,该pct国际申请要求申请日为2014年4月25日,申请号为61/984,503的美国临时专利申请的优先权,该申请以引用的方式整体并入本文中。
背景
信使rna疗法正成为日益重要的治疗各种疾病的方法。信使rna疗法涉及向需要该疗法的患者施用信使rna(mrna)并在患者体内生成由mrna编码的蛋白质。因此,非常需要大规模生成适于治疗用途的高纯度且安全的mrna产物。
序列表
本说明书参考了序列表(于2015年4月24日以命名为“序列表.txt”的.txt文件以电子方式提交)。该.txt文件生成于2015年4月22日,并且大小为11,184字节。序列表的全部内容通过引用并入本文。
发明概述
本发明提供了用于有效纯化信使rna(mrna)—尤其是适于治疗用途的体外合成的mrna—的改进的方法。本发明部分地基于意外发现沉淀mrna接着膜过滤这一非常不同寻常的组合的结果是出乎意料成功地大规模生成高质量mrna。
因此,一方面,本发明提供了纯化信使rna(mrna)的方法,其包括如下步骤:(a)从不纯制剂中沉淀mrna;(b)使含经沉淀的mrna的不纯制剂经历涉及膜过滤的纯化过程,使得通过膜捕获经沉淀的mrna;以及(c)通过重新溶解mrna从膜洗脱捕获的经沉淀的mrna,从而得到经纯化的mrna溶液。在一些实施方案中,适于本发明的涉及膜过滤的纯化过程是切向流过滤。在一些实施方案中,适于本发明的涉及膜过滤的纯化过程是直接流过滤。
在一些实施方案中,沉淀mrna的步骤包括用含选自由以下组成的组的试剂的溶液处理所述不纯制剂:氯化锂、氯化钠、氯化钾、氯化胍、硫氰酸胍、异硫氰酸胍、乙酸铵及其组合。在一些实施方案中,合适的试剂是硫氰酸胍。
在一些实施方案中,适于mrna经沉淀的溶液包含浓度为以下的硫氰酸胍:约1m或更高、约2m或更高、约3m或更高、约4m或更高、约5m或更高、约6m或更高,约7m或更高、约8m或更高、约9m或更高或约10m或更高。在一些实施方案中,适于mrna经沉淀的溶液包含浓度为约4m的硫氰酸胍。在一些这样的实施方案中,合适的溶液还包含月桂基肌氨酸钠和/或柠檬酸钠。例如,在某些实施方案中,适于mrna经沉淀的溶液包含4m硫氰酸胍、0.5%十二烷基肌氨酸钠和25mm柠檬酸钠。在某些实施方案中,适于mrna经沉淀的溶液包含4m硫氰酸胍和0.5%月桂基肌氨酸钠。在某些实施方案中,适于mrna经沉淀的溶液包含4m硫氰酸胍和25mm柠檬酸钠。
在一些实施方案中,沉淀mrna的步骤还包括用无水乙醇处理不纯制剂的步骤。
在一些实施方案中,沉淀mrna的步骤还包括用异丙醇处理不纯制剂的步骤。
在一些实施方案中,适于本发明的膜由选自由如下的材料组成的组制成:聚醚砜(mpes)(未改性的)、聚醚砜(mpes)中空纤维膜、聚偏二氟乙烯(pvdf)、乙酸纤维素、硝化纤维素、mce(混合纤维素酯)、超高mw聚乙烯(upe)、聚四氟乙烯(ptfe)、尼龙及其组合。
在一些实施方案中,本发明的方法还包括在洗脱之前洗涤捕获的经沉淀的mrna。在一些实施方案中,洗涤步骤包括使用含胍缓冲液和乙醇的洗液接着约70-80%乙醇(例如,约70%、75%或80%乙醇)进行多个冲洗循环。在一些实施方案中,适于本发明的多个冲洗循环为至少5个或多于5个循环(例如,约5至10个循环或约5、6、7、8、9或10个循环)。
在一些实施方案中,洗脱步骤包括用无rna酶的水重新溶解捕获的经沉淀的mrna。在一些实施方案中,将无rna酶的水再循环约5至10分钟(例如,约5、6、7、8、9或10分钟)。
在一些实施方案中,本发明的方法还包括透析经纯化的mrna溶液的步骤。在一些实施方案中,用100kda分子量截留(mwco)膜以1mm柠檬酸钠透析经纯化的mrna溶液。
在各实施方案中,本发明可用于从含体外mrna合成反应混合物的不纯制剂中纯化体外合成的mrna。在一些实施方案中,所述不纯制剂包含提前中断rna序列和/或用于体外合成的酶试剂。
在一些实施方案中,经纯化的mrna溶液包含少于约5%(例如,少于约4.5%、4%、3.5%、3%、2.5%、2%、1.5%、1%、0.5%、0.1%)的提前中断rna序列和/或用于体外合成的酶试剂。在某些实施方案中,经纯化的mrna溶液包含少于约1%(例如,少于约0.9%、0.8%、0.7%、0.6%、0.5%)的提前中断rna序列和/或用于体外合成的酶试剂。在某些实施方案中,经纯化的mrna溶液包含少于约0.5%(例如,少于约0.4%、0.3%、0.2%或0.1%)的提前中断rna序列和/或用于体外合成的酶试剂。在一些实施方案中,经纯化的mrna溶液包含少于约0.1%的提前中断rna序列和/或用于体外合成的酶试剂。在一些实施方案中,经纯化的mrna溶液基本上不含提前中断rna序列和/或用于体外合成的酶试剂。
在一些实施方案中,通过银染、凝胶电泳、高效液相色谱(hplc)、超高效液相色谱(uplc)和/或毛细管电泳测量提前中断rna序列和/或用于体外合成的酶试剂。
在一些实施方案中,提前中断rna序列包含少于15个碱基(例如,少于14、13、12、11、10、9、8、7、6、5、4或3个碱基)。在一些实施方案中,提前中断rna序列包含约8至15、8至14、8至13、8至12、8至11或8至10个碱基。
在一些实施方案中,用于体外合成的所述酶试剂包含t7rna聚合酶、dna酶i、焦磷酸酶和/或rna酶抑制剂。
在一些实施方案中,以大于1克、5克、10克、15克、20克、25克、30克、35克、40克、45克、50克、75克、100克、150克、200克、250克、300克、350克、400克、450克、500克、550克、600克、650克、700克、750克、800克、850克、900克、950克、1kg、2.5kg、5kg、7.5kg、10kg、25kg、50kg、75kg或100kg/批的规模纯化mrna。如下文的实施例所示,利用本发明的方法可容易地获得10克或更多(25克或更多)的量的含经纯化的mrna的批次(batch)。
在一些实施方案中,在向mrna加帽和/或尾之前纯化mrna。在一些实施方案中,在向mrna加帽和/或尾之后纯化mrna。在一些实施方案中,在加帽之后纯化mrna。在一些实施方案中,在向mrna加帽和/或尾之前和之后纯化mrna。
在一些实施方案中,mrna的长度为约1kb、1.5kb、2kb、2.5kb、3kb、3.5kb、4kb、4.5kb、5kb、6kb、7kb、8kb、9kb、10kb、11kb、12kb、13kb、14kb、15kb或20kb或更长。
在一些实施方案中,mrna包含一个或多个修饰以增强稳定性。在一些实施方案中,所述一个或多个修饰包含经修饰的核苷酸和/或经修饰的糖磷酸骨架。在一些实施方案中,mrna未经修饰。
在一些实施方案中,经纯化的mrna的完整性为约95%或更大(例如,为或高于约96%、97%、98%或99%)。在一些实施方案中,经纯化的mrna的完整性为约98%或更大。在一些实施方案中,经纯化的mrna的完整性为99%或更大。
在一些实施方案中,本发明提供了信使rna(mrna)的纯化方法,所述方法包括:(a)从不纯制剂中沉淀mrna;(b)使含经沉淀的mrna的不纯制剂经历切向流过滤,使得通过滤膜捕获经沉淀的mrna,同时通过渗透弃除杂质;和(c)通过重新溶解经沉淀的mrna洗脱捕获的经沉淀的mrna,得到经纯化的mrna溶液。
在另一个方面,本发明提供了用于制备信使rna(mrna)的方法,所述方法包括体外合成mrna;和利用本文所述方法纯化体外合成的mrna。
本发明还提供了利用本文所述方法纯化的信使rna(mrna)。
在另一个方面,本发明还提供了一个适于施用于人类受试者的含有5克或更多的单一mrna种类的经纯化的mrna的批次。在一些实施方案中,所述批次包含10克或更多的单一mrna种类。在一些实施方案中,所述批次包含25克或更多的单一mrna种类。在一些实施方案中,所述批次基本上不含来自mrna合成过程的杂质。在一些实施方案中,所述批次基本上不含用于体外合成单一mrna种类的提前中断rna序列、dna模板和/或酶试剂。在一些实施方案中,经纯化的mrna包含少于约5%的用于体外合成的酶试剂。在一些实施方案中,经纯化的mrna的完整性大于约95%。
在另一个方面,本发明还提供了含利用本文所述方法纯化的信使rna的组合物。
在另一个方面,本发明还提供了含体外合成的信使rna的组合物,其中所述组合物含少于1%的提前中断rna序列和/或用于体外合成的酶。
在另一个方面,本发明还提供了含体外合成的信使rna(mrna)的组合物,其中所述mrna的完整性为95%或更大。
在本申请中使用的术语“约”和“大约”作为等同形式使用。本申请中使用的任何数值,在有或无约/大约的情况下,意指涵盖相关领域中的普通技术人员理解的任何正常变动。
在随后的详细描述中,本发明的其它特征、目的和优点显而易见。然而,应理解,详细描述虽然表明本发明的实施方案,但仅以示例说明而非限制的方式给出。基于详细描述,在本发明范围内的各种变化和修改对本领域技术人员而言将变得显而易见。
附图简述
以下图仅是出于示例说明目的而非限制。
图1描绘了用于大规模纯化mrna的示例性过程,其涉及加载、洗涤和洗脱步骤。例如,可以将经沉淀的mrna加载到膜,使得经沉淀的mrna可作为渗余物(retentate)而被捕获,而可溶性杂质以及小于0.22um的不溶性的那些则通过渗透弃除。捕获以后,将固体沉淀用多种缓冲液洗涤,随后重新溶解并洗脱得到纯信使rna产物。
图2示出根据所提供的方法(有三次洗脱)来自初始1克体外转录(ivt)反应的改性囊性纤维化跨膜传导调节蛋白(cftr)mrna和存在于ivt反应中的对照酶的示例性银染蛋白质凝胶。
图3示出根据所提供的方法(有六次洗脱)来自初始1.5克体外转录(ivt)反应的改性cftrmrna和存在于ivt反应中的对照酶的示例性银染蛋白质凝胶。
图4示出如琼脂糖凝胶电泳所示,根据所提供的方法纯化和过滤的改性cftrmrna的体外转录(ivt)样品中示例性mrna的长度。大规模沉淀后改性cftrmrna保留全部完整性。
图5示出根据所提供的方法(有五次洗脱)来自初始1克体外转录(ivt)反应的精氨琥珀酸合成酶(ass1)mrna和存在于ivt反应中的对照酶的示例性银染蛋白质凝胶。
图6示出根据所提供的方法(有五次洗脱)来自初始1克体外转录(ivt)反应的精氨琥珀酸合成酶(ass1)mrna和存在于ivt反应中的对照酶的示例性sypro-染蛋白质凝胶。
图7示出如琼脂糖凝胶电泳所示,根据所提供的方法纯化和过滤的ass1mrna的体外转录(ivt)样品中示例性mrna的长度。大规模沉淀后ass1mrna保留全部完整性。
图8示出根据所提供的方法(有单或双沉淀)来自初始体外转录(ivt)反应的萤火虫荧光素酶(ffl)mrna和存在于ivt反应中的对照酶的示例性银染蛋白质凝胶。
图9示出根据所提供的方法(有单或双沉淀)来自初始体外转录(ivt)反应的萤火虫荧光素酶(ffl)mrna和存在于ivt反应中的对照酶的示例性sypro-染蛋白质凝胶。
图10示出如琼脂糖凝胶电泳所示,根据所提供的方法纯化和过滤的萤火虫荧光素酶(ffl)mrna的体外转录(ivt)样品中示例性mrna的长度。大规模沉淀和再沉淀后fflmrna保留全部完整性。
图11示出来自最终加帽和加尾反应(有三次洗脱)的精氨琥珀酸合成酶(ass1)mrna和存在于该加帽和加尾反应中的对照酶的示例性银染蛋白质凝胶。
图12示出如琼脂糖凝胶电泳所示,根据所提供的方法纯化和过滤的示例性最终ass1mrna的长度。大规模沉淀和再沉淀后ass1mrna保留全部完整性。
图13示出经fflmrna处理的hek293t细胞的细胞裂解物中观察到的示例性发光。转染后24小时收获细胞。示出对供应商来源的mrna与离心柱经纯化的mrna(市售试剂盒,commercialkit)与沉淀-tff经纯化的fflmrna翻译能力的比较。
图14示出经hcftrmrna转染的hek293t细胞的细胞裂解物中观察到的示例性cftr蛋白质水平。转染后24小时收获细胞。示出对tff经纯化的mrna与离心柱(市售试剂盒)hcftrmrna翻译能力的比较。
图15示出来自根据所提供的方法纯化和过滤的精氨琥珀酸合成酶(ass1)mrna的体外转录(ivt)样品的示例性mrna的长度。大规模(5g)沉淀后ass1mrna保留全部完整性。
图16示出来自根据所提供的方法纯化和过滤的精氨琥珀酸合成酶(ass1)mrna(预-和后-加帽/加尾)的体外转录(ivt)样品的示例性mrna的长度。大规模(5g)沉淀后ass1mrna保留全部完整性。
图17示出根据所提供的方法最终纯化(5g)后精氨琥珀酸合成酶(ass1)mrna的示例性银染蛋白质凝胶以及存在于反应中的对照酶。
图18示出经ass1mrna处理的hek293t细胞的细胞裂解物中观察到的示例性人ass1蛋白质生成。转染后24小时收获细胞。示出对离心柱经纯化的mrna(市售试剂盒)与沉淀-tff经纯化的ass1mrna(5g)翻译能力的比较。
图19示出如琼脂糖凝胶电泳所示,根据所提供的方法纯化和过滤的囊性纤维化跨膜传导调节蛋白(cftr)mrna(预-和后-加帽/加尾)的体外转录(ivt)样品中示例性mrna的长度。大规模(10g)沉淀后cftrmrna保留全部完整性。
图20示出根据所提供的方法最终纯化(10g)后囊性纤维化跨膜传导调节蛋白(cftr)mrna和反应中存在的对照酶的示例性银染蛋白质凝胶。
图21示出来自大规模生成和经纯化的经hcftrmrna转染的hek293t细胞的细胞裂解物中观察到的示例性cftr蛋白质水平。转染后24小时收获细胞。
图22示出以25g规模生成的精氨琥珀酸合成酶(ass1)mrna的体外转录(ivt)样品中的示例性mrna的长度。大规模(25g)分离后ass1mrna保留全部完整性。
定义
为了使本发明更易于理解,首先定义某些术语如下。对以下术语及其它术语的其它定义在整个说明书中进行阐述。
动物:本文所用术语“动物”是指动物界的任何成员。在一些实施方案中,“动物”是指处于任何发育阶段的人类。在一些实施方案中,“动物”是指处于任何发育阶段的非人类动物。在某些实施方案中,非人类动物是哺乳动物(例如,啮齿动物、小鼠、大鼠、兔、猴、狗、猫、羊、牛、灵长类动物和/或猪)。在一些实施方案中,动物包括但不限于,哺乳动物、鸟类、爬行动物、两栖动物、鱼、昆虫和/或蠕虫。在一些实施方案中,动物可以是转基因动物、基因工程动物和/或克隆。
大约或约:本文所用术语“大约”或“约”在应用于一个或多个相关的值时是指与所指的值相似的值。在某些实施方案中,除非另有说明或者从上下文显而易见有所不同(除了此类数值将超过可能值的100%的情况之外),否则术语“大约”或“约”是指以任一方向落在(大于或小于)所述参考值的25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小的范围内的值。
生物活性:本文所用短语“生物活性”是指在生物体系中,特别是在生物体中具有活性的任何药剂的特征。例如,在向生物体施用时对该生物体具有生物学效应的药物被视为具有生物活性。
表达:本文所用核酸序列的“表达”是指将mrna翻译成多肽、将多个多肽组装成完整蛋白质和/或将多肽或完全组装的蛋白质翻译后修饰。在本申请中,术语“表达”和“生成”以及及其语法等同变化形式可互换使用。
功能性:本文所用“功能性”生物分子是处于其呈现出其特征性的性质和/或活性的形式的生物分子。
改进、提高或降低:本文所用术语“改进”、“提高”或“降低”或者语法等同变化形式表明相对于基线测量值例如在开始本文所述的处理之前在相同个体中的测量值或者在没有本文所述的治疗下在对照受试者(或多个对照受试者)中的测量值的值。“对照受试者”是罹患与接受治疗的受试者相同的疾病形式的受试者,其与该接受治疗的受试者的年龄大约相同。
杂质:本文所用术语“杂质”是指限定量的液体、气体或固体内,不同于靶材料或化合物的化学组成的物质。杂质也称为污染物。
体外:本文所用术语“体外”是指发生在人工环境中,例如,在试管或反应容器中,在细胞培养物等中而不是在多细胞生物体内的事件。
体内:本文所用术语“体内”是指发生在多细胞生物体例如人和非人类动物内的事件。在基于细胞的系统的上下文中,该术语可以用来指发生在活细胞(与例如体外系统相对)内的事件。
分离的:本文所用术语“分离的”是指物质和/或实体,其已经(1)与在最初产生(无论在自然界中和/或在试验环境中)时与它结合的组分中的至少一些分离,和/或(2)通过人工进行生产、制备和/或制造。分离的物质和/或实体可以从与它们最初结合的其它组分的约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或者大于约99%分离。在一些实施方案中,分离的试剂(agent)是约80%、约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或者大于约99%纯度。在本文中使用时,若物质基本上不含有其它组分,则它是“纯的”。在本文中使用时,分离的物质和/或实体的百分比纯度的计算不应该包括赋形剂(例如,缓冲剂、溶剂、水等)。
信使rna(mrna):本文所用术语“信使rna(mrna)”是指编码至少一种多肽的多核苷酸。本文所用mrna涵盖经修饰的和未经修饰的rna。mrna可以包括一个或多个编码区和非编码区。
mrna完整性:本文所用术语“mrna完整性”通常是指mrna的质量。在一些实施方案中,mrna完整性是指在纯化过程(例如,切向流过滤)后未降解的mrna的百分比。可使用本领域公知的方法,例如通过rna琼脂糖凝胶电泳(例如,ausubel等,johnweley&sons,inc.,1997,currentprotocolsinmolecularbiology)测定mrna完整性。
核酸:本文所用术语“核酸”广义上是指是多核苷酸链或者可以被包括在多核苷酸链中的任何化合物和/或物质。在一些实施方案中,核酸是通过磷酸二酯键被包括在多核苷酸链中的化合物和/或物质或者是可以通过磷酸二酯键被包括在多核苷酸链中的化合物和/或物质。在一些实施方案中,“核酸”是指单个的核酸残基(例如,核苷酸和/或核苷)。在一些实施方案中,“核酸”是指包含单个的核酸残基的多核苷酸链。在一些实施方案中,“核酸”涵盖rna以及单链和/或双链的dna和/或cdna。此外,术语“核酸”、“dna”、“rna”和/或类似的术语包括核酸类似物,即,具有除磷酸二酯骨架之外的类似物。例如,所谓的“肽核酸”是本领域已知的,并且在骨架中具有肽键而不是磷酸二酯键,被视为在本发明的范围内。术语“编码氨基酸序列的核苷酸序列”包括彼此的简并形式和/或编码相同氨基酸序列的所有核苷酸序列。编码蛋白质和/或rna的核苷酸序列可以包括内含子。核酸可以从天然来源进行纯化,利用重组表达系统产生,并任选地进行纯化,化学合成等。在适当的情况中,例如,在化学合成的分子的情况下,核酸可以包括核苷类似物如具有经化学修饰的碱基或糖、骨架修饰等的类似物。除非另外指明,否则核酸序列以5’至3’方向表示。在一些实施方案中,核酸是或者包括天然核苷(例如,腺苷、胸苷、鸟苷、胞苷、尿苷、脱氧腺苷、脱氧胸苷、脱氧鸟苷和脱氧胞苷);核苷类似物(例如,2-氨基腺苷、2-硫代胸苷、肌苷、吡咯并嘧啶、3-甲基腺苷、5-甲基胞苷、c-5丙炔基-胞苷、c-5丙炔基-尿苷、2-氨基腺苷、c5-溴尿苷、c5-氟尿苷、c5-碘尿苷、c5-丙炔基-尿苷、c5-丙炔基-胞苷、c5-甲基胞苷、2-氨基腺苷、7-去氮杂腺苷、7-去氮杂鸟苷、8-氧代腺苷、8-氧代鸟苷、o(6)-甲基鸟苷和2-硫代胞苷);化学修饰的碱基;生物修饰的碱基(例如甲基化的碱基);嵌入碱基;经修饰的糖(例如,2’-氟核糖、核糖、2’-脱氧核糖、阿拉伯糖和己糖);和/或经修饰的磷酸基(例如,硫代磷酸酯和5’-n-亚磷酰胺键)。在一些实施方案中,本发明具体地涉及“未经修饰的核酸”,意指尚未为了促进或实现递送而进行化学修饰的核酸(例如,多核苷酸和残基,包括核苷酸和/或核苷)。
患者:本文所用术语“患者”或“受试者”是指为了例如试验、诊断、预防、美容和/或治疗目的可以向其施用提供的组合物的任何生物体。通常患者包括动物(例如,哺乳动物如小鼠、大鼠、兔、非人灵长类动物和/或人)。在一些实施方案中,患者是人。人包括产前和产后的形式。
药学上可接受的:本文所用术语“药学上可接受的”是指物质在合理的医学判断的范围内适合用于与人类和动物的组织接触而没有过度的毒性、刺激、变态反应或其它问题或并发症,与合理的利益/风险比相匹配。
提前中断的rna序列:本文所用术语“提前中断rna序列”是指mrna合成反应(例如,体外合成反应)的不完全产物。出于各种原因,rna聚合酶并不总是完成dna模板的转录,即rna合成提前终止。rna合成提前终止的可能原因包括dna模板的质量、模板中存在的特定聚合酶的聚合酶终止序列、降解缓冲液、温度、核糖核苷酸的损耗及mrna二级结构。提前中断的rna序列可为小于所需转录产物预期长度的任何长度。例如,提前中断的mrna序列可小于1000个碱基、小于500个碱基、小于100个碱基、小于50个碱基、小于40个碱基、小于30个碱基、小于20个碱基、小于15个碱基、小于10个碱基或更少。
盐:本文所用术语“盐”是指由或可能由酸与碱之间的中和反应产生的离子化合物。
受试者:本文所用术语“受试者”是指人或者任何非人动物(例如,小鼠、大鼠、兔、狗、猫、牛、猪、羊、马或灵长动物)。人包括产前和产后的形式。在许多实施方案中,受试者是人类。受试者可以是患者,其是指向医疗提供方寻求疾病的诊断或治疗的人。本文中使用的术语“受试者”与“个体”或“患者”可互换地使用。受试者可以罹患或者易患疾病或病症但是可能或可能不呈现出该疾病或病症的症状。
基本上:本文所用术语“基本上”是指展现出完全或接近完全范围或程度的相关特征或性质的定性状态。任何生物学领域普通技术人员可理解生物和化学现象很少,难得彻底完成和/或持续完成或者获得或避免绝对结果。因此,术语“基本上”在本文中用来表现固有存在于许多生物和化学现象中的完全性的潜在缺乏。
基本上无:本文所用术语“基本上无”是指相对少量或没有要去除的物质(例如,提前中断的rna序列)存在的状态。例如,“基本上无提前中断的rna序列”意指提前中断的rna序列以低于杂质的大约5%、4%、3%、2%、1.0%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或更少(w/w)的水平存在。可选地,“基本上无提前中断的rna序列”意指提前中断的rna序列以低于约100ng、90ng、80ng、70ng、60ng、50ng、40ng、30ng、20ng、10ng、1ng、500pg、100pg、50pg、10pg或更少的水平存在。
详述
本发明尤其提供了基于涉及沉淀mrna接着膜过滤(例如,切向流过滤)的过程从不纯制剂(例如,体外合成反应混合物)纯化mrna的改进方法。
在以下章节中对本发明的各方面进行了详细描述。章节的使用并非意在限制本发明。每个章节可以应用于本发明的任何方面。在本申请中,除非另外说明,否则“或”的使用意指“和/或”。
mrna的合成
本发明可用于纯化任何mrna。mrna通常被认为是将信息从dna携带到核糖体的rna类型。mrna的存在通常非常短暂并且包括加工和翻译,接着是降解。通常,在真核生物中,mrna加工包括在n(5’)末端加“帽”和在c(3’)末端加“尾”。典型的帽为7-甲基鸟苷帽,其为通过5’-5’-三磷酸键与第一个转录核苷酸连接的鸟苷。帽的存在在提供对大多数真核细胞内存在的核酸酶的抗性中很重要。尾通常为聚腺苷酸化事件,由此向mrna分子的3’末端添加多聚腺苷酰基部分。这种“尾”的存在有助于保护mrna免受核酸外切酶降解。信使rna由核糖体翻译成一系列构成蛋白质的氨基酸。
根据本发明的mrna可根据各种已知方法中的任一种合成。例如,根据本发明的mrna可经由体外转录(ivt)合成。简言之,通常用含有启动子的线性或环状dna模板、核糖核苷三磷酸池、可包括dtt和镁离子的缓冲体系和适当的rna聚合酶(例如,t3、t7或sp6rna聚合酶)、dna酶i、焦磷酸酶和/或rna酶抑制剂进行ivt。确切条件将根据特定应用变化。这些试剂的存在根据几个实施方案在最终产物中不合需要并且因此可称为杂质并且含有这些杂质中的一种或多种的制剂可称为不纯制剂。
根据各个实施方案,本发明可用于纯化各种长度的体外合成mrna。在一些实施方案中,本发明可用于纯化长度为约1kb、1.5kb、2kb、2.5kb、3kb、3.5kb、4kb、4.5kb、5kb、6kb、7kb、8kb、9kb、10kb、11kb、12kb、13kb、14kb、15kb或20kb或更长的体外合成mrna。在一些实施方案中,本发明可用于纯化长度为1至20kb、约1至15kb、约1至10kb、约5至20kb、约5至15kb、约5至12kb、约5至10kb、约8至20kb或约8至15kb的体外合成的mrna。例如,典型的mrna的长度可以为约1kb至约5kb。更通常而言,mrna将具有约1kb至约3kb的长度。然而,在一些实施方案中,本发明的组合物中的mrna更长(大于约20kb)。在一些实施方案中,本发明可用于纯化含有通常增强稳定性的一个或多个修饰的mrna。在一些实施方案中,一个或多个修饰选自经修饰的核苷酸、经修饰的糖磷酸骨架、5’和/或3’非翻译区。在一些实施方案中,本发明可用于纯化未经修饰的体外合成mrna。
通常,mrna经修饰以增强稳定性。mrna的修饰可包括,例如rna的核苷酸的修饰。因此根据本发明经修饰的mrna可包括,例如骨架修饰、糖修饰或碱基修饰。在一些实施方案中,可由天然存在的核苷酸和/或核苷酸类似物(经修饰的核苷酸),包括但不限于嘌呤(腺嘌呤(a)、鸟嘌呤(g))或嘧啶(胸腺嘧啶(t)、胞嘧啶(c)、尿嘧啶(u)),及嘌呤和嘧啶的经修饰核苷酸类似物或衍生物,例如1-甲基-腺嘌呤、2-甲基-腺嘌呤、2-甲基硫代-n-6-异戊烯-腺嘌呤、n6-甲基-腺嘌呤、n6-异戊烯-腺嘌呤、2-硫代-胞嘧啶、3-甲基-胞嘧啶、4-乙酰基-胞嘧啶、5-甲基-胞嘧啶、2,6-二氨基嘌呤、1-甲基-鸟嘌呤、2-甲基-鸟嘌呤、2,2-二甲基-鸟嘌呤、7-甲基-鸟嘌呤、肌苷、1-甲基-肌苷、假尿嘧啶(5-尿嘧啶)、二氢-尿嘧啶、2-硫代-尿嘧啶、4-硫代-尿嘧啶、5-羧甲基氨甲基-2-硫代-尿嘧啶、5-(羧基羟甲基)-尿嘧啶、5-氟-尿嘧啶、5-溴-尿嘧啶、5-羧甲基氨甲基-尿嘧啶、5-甲基-2-硫代-尿嘧啶、5-甲基-尿嘧啶、n-尿嘧啶-5-羟乙酸甲酯、5-甲基氨甲基-尿嘧啶、5-甲氧基氨甲基-2-硫代-尿嘧啶、5'-甲氧羰基甲基-尿嘧啶、5-甲氧基-尿嘧啶、尿嘧啶-5-羟乙酸甲酯、尿嘧啶-5-羟乙酸(v)、1-甲基-假尿嘧啶、q核苷(queosine)、β.-d-甘露糖基-q核苷、怀丁氧苷(wybutoxosine)和氨基磷酸酯、硫代磷酸酯、肽核苷酸、甲基膦酸酯、7-去氮鸟苷、5-甲基胞嘧啶和肌苷合成编码抗体的mrna(例如,编码重链和轻链mrna)。例如由美国专利第4,373,071号、美国专利第4,401,796号、美国专利第4,415,732号、美国专利第4,458,066号、美国专利第4,500,707号、美国专利第4,668,777号、美国专利第4,973,679号、美国专利第5,047,524号、美国专利第5,132,418号、美国专利第5,153,319号、美国专利第5,262,530和5,700,642号,本领域中的技术人员已知此类类似物的制备,这些专利的公开内容通过引用全部包括在本文中。
通常,mrna合成包括在n(5’)末端加“帽”和在c(3’)末端加“尾”。帽的存在在提供对大多数真核细胞内存在的核酸酶的抗性中很重要。“尾”的存在有助于保护mrna免受核酸外切酶降解。
因此,在一些实施方案中,mrna包括5’帽结构。通常按照如下添加5’帽:首先,rna末端磷酸酶从5’核苷酸去除一个末端磷酸基团,留下两个末端磷酸;然后经由鸟苷酸转移酶向末端磷酸添加三磷酸鸟苷(gtp),生成5’5’5三磷酸键;然后通过甲基转移酶甲基化鸟嘌呤的7-氮。帽结构的实例包括但不限于m7g(5')ppp(5'(a,g(5')ppp(5')a和g(5')ppp(5')g。
虽然由体外转录反应提供的mrna可能在一些实施方案中满足需要,但是其它mrna来源被视为在本发明的范围之内,包括由细菌、真菌、植物和/或动物生成的野生型mrna。
在一些实施方案中,mrna包括5’和/或3’非翻译区。在一些实施方案中,5’非翻译区包括影响mrna的稳定性或翻译的一个或多个元件,例如铁反应元件。在一些实施方案中,5’非翻译区长度可介于约50和500个核苷酸之间。
在一些实施方案中,3’非翻译区包括聚腺苷酸化信号序列、影响mrna在细胞内定位的稳定性的蛋白质的结合位点或mirna的一个或多个结合位点中的一个或多个。在一些实施方案中,3’非翻译区的长度可介于约50和500个核苷酸之间或更长。
本发明可用于纯化编码各种蛋白质的mrna。在实施例部分详细描述了纯化编码萤火虫荧光素酶、精氨琥珀酸合成酶、因子ix和cftr的mrna的非限制性实例。
通常,本发明用于纯化单一mrna种类,即,待经纯化的mrna制剂包含来自单个基因或单个合成或表达构建体的mrna。与此相反,从细胞经纯化的总mrna包含多个mrna种类。
本发明的纯化过程可以在合成期间或者合成以后进行。例如,可以在帽和/或尾被添加到mrna之前按照本文所述纯化mrna。在一些实施方案中,在将帽和/或尾被添加到mrna之后纯化mrna。在一些实施方案中,在加帽后纯化mrna。在一些实施方案中,在帽和/或尾被添加到mrna之前和之后均纯化mrna。一般而言,本文所述纯化步骤可在mrna合成的每一步骤之后进行,任选伴随其他纯化过程,例如透析。例如,可以对mrna进行透析以在初始合成后除去短聚物(shortmers)(例如,有或没有尾),然后对其进行本文所述沉淀和纯化,然后在加帽和/或尾之后,通过沉淀和纯化再次纯化。
mrna的沉淀
根据本发明,可利用本领域中已知的多种沉淀方法从不纯制剂(例如体外合成反应混合物)中沉淀mrna。本文所用术语“沉淀”(或其任何语法等同变化形式)是指在溶液中形成固体。当与mrna结合使用时,术语“沉淀”是指在液体中形成不溶的或固体形式的mrna。
适于沉淀mrna的任何和全部方法均可用于实施本发明。通常,mrna沉淀涉及变性条件。本文所用术语“变性条件”是指可能会导致mrna的天然构象破坏的任何化学或物理条件。因为分子的天然构象通常最具水溶性,破坏分子的二级和三级结构可引起溶解性变化并且可导致mrna从溶液中沉淀。
例如,从不纯制剂中沉淀mrna的合适方法涉及用变性剂处理不纯制剂使得mrna沉淀。适于本发明的示例性变性剂包括但不限于氯化锂、氯化钠、氯化钾、氯化胍、硫氰酸胍、异硫氰酸胍、乙酸铵及其组合。合适的试剂可以以固体形式或以溶液提供。
作为非限制性实例,可以用硫氰酸胍来沉淀mrna。通常,硫氰酸胍可以在溶液中以如下浓度提供:约1m或更大、约2m或更大、约3m或更大、约4m或更大、约5m或更大、约6m或更大、约7m或更大、约8m或更大、约9m或更大或约10m或更大。在一些实施方案中,适于mrna经沉淀的溶液含浓度为约4m的硫氰酸胍。
除了变性剂,用于mrna经沉淀的合适溶液还可包含其它盐、表面活性剂和/或缓冲剂。例如,合适的溶液还可包含月桂基肌氨酸钠和/或柠檬酸钠。作为非限制性实例,适于mrna经沉淀的溶液可包含4m硫氰酸胍、0.5%十二烷基肌氨酸钠和25mm柠檬酸钠;或4m异硫氰酸胍和0.5%月桂基肌氨酸钠;或4m硫氰酸胍和25mm柠檬酸钠。
通常,期望用本文所述一种或更多种变性剂于允许显著量的mrna经沉淀的期望的温度下孵育不纯制剂一段时间。例如,可以在室温或环境温度下孵育不纯制剂与变性剂的混合物一段时间。通常,合适的孵育时间是约2、3、4、5、6、7、8、9、10、15、20、25、30、40、50或60分钟或更长。在一些实施方案中,合适的孵育时间是约60、55、50、45、40、35、30、25、20、15、10、9、8、7、6或5分钟或更短。在一些实施方案中,将混合物在室温下孵育约5分钟。通常、“室温”或“环境温度”是指与约20至25℃的范围内的温度、例如约20℃、21℃、22℃、23℃、24℃或25℃。在一些实施例中,也可以在高于室温(例如,约30至37℃或者尤其是约30℃、31℃、32℃、33℃、34℃、35℃、36℃或37℃)或低于室温(例如,约15至20℃或尤其是约15℃、16℃、17℃、18℃、19℃或20℃)孵育不纯制剂与变性剂的混合物。孵育时间可以基于孵育温度进行调节。通常,更高的孵育温度需要更短的孵育时间。
可选地或另外,可使用的溶剂来促进mrna的沉淀。合适的示例性溶剂包括但不限于:异丙醇、丙酮、甲基乙基酮、甲基异丁基酮、乙醇、甲醇、地那铵及其组合。例如,溶剂(例如,无水乙醇)可以与变性剂一起添加到不纯制剂中或者在添加变性剂并按照本文所述孵育后添加到不纯制剂中,以进一步增强和/或加速mrna沉淀。通常,添加适当的溶剂(例如,无水乙醇)后,可将混合物在室温下再孵育一段时间。通常,合适的孵育时间是约2、3、4、5、6、7、8、9、10、15、20、25、30、40、50或60分钟或更长。在一些实施方案中,合适的孵育时间是约60、55、50、45、40、35、30、25、20、15、10、9、8、7、6或5分钟或更短。通常,将该混合物在室温下再孵育约5分钟。可以采用高于或低于室温的温度并对孵育时间进行适当调整。另外,孵育可发生在4℃或-20℃以进行沉淀。
通常,本文所述的方法结果是从不纯制剂沉淀显著量的mrna。在一些实施方案中,本文所述的方法结果是从不纯制剂沉淀至少约80%、85%、90%、95%、96%、97%、98%或99%的总mrna。在一些实施方案中,本文所述的方法结果是从不纯制剂沉淀基本上100%的总mrna。
膜过滤
根据本发明,可以使含经沉淀的mrna的不纯制剂经历涉及膜过滤的纯化过程,该膜过滤例如用膜捕获或保留经沉淀的mrna。因而,在一些实施方案中,使不纯制剂经历膜过滤接着沉淀而无需预处理以除去不溶物。
可以采用多种类型的膜过滤来捕获或保留经沉淀的mrna。通常,膜过滤涉及使用一张或多张插入的渗透膜从流体中分离出固体。膜过滤也可用于从气态样品中过滤颗粒。一般而言,存在两种主要的膜过滤形式,仅仅由于溶解-扩散进行的被动过滤,和使用正压或负压(即真空)迫使液体或气体穿过所述膜的主动过滤。
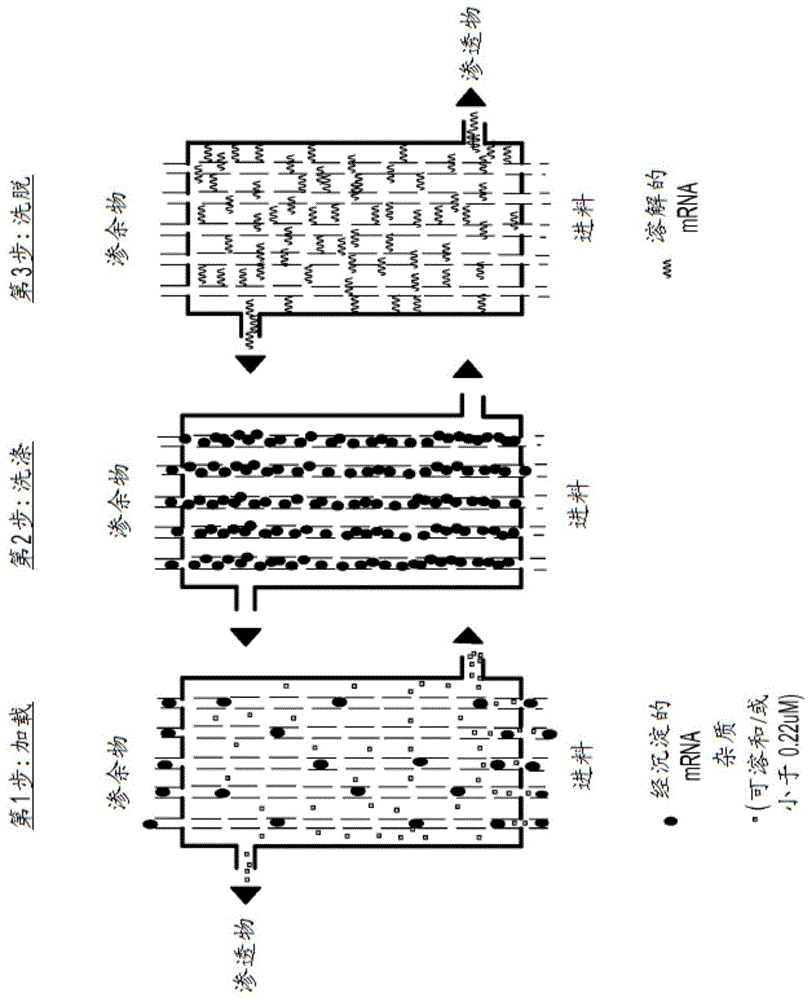
涉及用于纯化mrna的膜过滤的一个示例性过程示于图1中。通常,这样的过程涉及加载、洗涤和洗脱步骤。
加载
通常,加载步骤涉及将进料(例如,含经沉淀的mrna的不纯制剂)加载至膜上并通过正压或负压推动,将渗余物捕获或保留在膜上。本文所用术语“渗余物”是指由膜保留的任何未渗透的溶质和/或不溶物。根据本发明,经沉淀的mrna作为渗余物被膜捕获。本文所用术语“膜”是指任何多孔层或片材。在本申请中,术语“膜”与过滤器可互换使用。
在一些实施方案中,合适的膜的孔径适于捕获或保留经沉淀的mrna,同时使杂质(包括可溶性杂质和尺寸小于孔径的不溶性杂质)作为渗透物通过。在一些实施方案中,合适的膜的平均孔径大于约0.10μm、0.20μm、0.22μm、0.24μm、0.26μm、0.28μm、0.30μm、0.40μm、0.5μm或1.0μm。在一个特定实施方案中,合适的膜的平均孔径为约0.22μm。在一些实施方案中,可以通过经沉淀的mrna的标称分子量极限(nominalmolecularweightlimits,nmwl)来确定用于保留经沉淀的mrna的合适的孔径,所述标称分子量极限也称为截留分子量(mwco)。通常,使用孔径小于经沉淀的mrna的nmwl或mwco的膜。在一些实施方案中,使用孔径低于经沉淀的mrna的nmwl或mwco的2至6(例如,2、3、4、5或6)倍的膜。在一些实施方案中,用于本发明的合适的膜可具有如下孔径:为或大于约100道尔顿(kda)、300kda、500kda、1,000kda、1,500kda、2,000kda、2,500kda、3,000kda、3,500kda、4,000kda、4,500kda、5,000kda、5,500kda、6,000kda、6,500kda、7,000kda、7,500kda、8,000kda、8,500kda、9,000kda、9,500kda或10,000kda。
适于本发明的膜可由任何材料制成。示例性膜材料包括但不限于聚醚砜(mpes)(未改性的)、聚醚砜(mpes)中空纤维膜、聚偏二氟乙烯(pvdf)、乙酸纤维素、硝化纤维素、mce(混合纤维素酯)、超高分子量聚乙烯(upe)、聚四氟乙烯(ptfe)、尼龙、聚砜、聚醚砜、聚丙烯腈、聚丙烯、聚氯乙烯及其组合。
适于本发明的膜可具有各种表面积。在一些实施方案中,合适的膜具有足够大的表面积以促进大量生成mrna。例如,合适的膜可具有如下表面积:为约2,000cm2、2,500cm2、3,000cm2、3,500cm2、4,000cm2、4,500cm2、5,000cm2、7,500cm2、10,000cm2、5m2、10m2、12m2、15m2、20m2、24m2、25m2、30m2或50m2或更大。
可以以多种形式进行膜过滤以捕获经沉淀的mrna。在一些实施方案中,膜过滤可以作为切向流过滤(tff)的一部分进行。
切向流过滤(tff),也称为错流过滤,是其中待过滤材料切向穿过过滤器,而不是通过过滤器的一类过滤。在tff中,不需要的渗透物通过过滤器,而所需渗余物(例如,经沉淀的mrna)经过过滤器并且在下游被捕获在或保留在过滤器或膜上。
切向流过滤的主要优点是改为沿着过滤器的表面运送在传统“死端”过滤期间可在过滤器内聚集并阻塞过滤器的非渗透性渗余物(有时称为“滤饼”)。该优点允许切向流过滤,尤其适于大规模纯化经沉淀的mrna。在一些实施方案中,每一批次可应用为约1克、10克、50克、100克、200克、300克、400克、500克、600克、700克、800克、900克、1kg、5kg、10kg、50kg或100kg或更多的mrna加载。
在典型tff过程中重要的至少三个过程变量:跨膜压差、进料速率和渗透物的流速。跨膜压差是推动流体带着渗透性分子一起通过过滤器的力。在一些实施方案中,跨膜压差介于1和30磅/平方英寸(psi)之间,包括1和30磅/平方英寸。
进料速率(也称为错流速度)是溶液流过进料通道并穿过过滤器的速率。进料速率决定了清除可能以其它方式填塞或污损过滤器并从而限制滤液流速的分子的力。在一些实施方案中,进料速率为1至500ml/分钟。在一些实施方案中,进料速率为50至800ml/分钟。在一些实施方案中,进料速率为50至750ml/分钟。在一些实施方案中,进料速率为50至300ml/分钟。在一些实施方案中,进料速率为50至200ml/分钟。在一些实施方案中,进料速率为75至200ml/分钟。在一些实施方案中,进料速率为100至200ml/分钟。在一些实施方案中,进料速率为125至175ml/分钟。在一些实施方案中,进料速率为130ml/分钟。在一些实施方案中,进料速率为60ml/分钟至220ml/分钟。在一些实施方案中,进料速率为60ml/分钟或更高。在一些实施方案中,进料速率为100ml/分钟或更高。在一些实施方案中,进料速率为150ml/分钟或更高。在一些实施方案中,进料速率为200ml/分钟或更高。在一些实施方案中,进料速率为220ml/分钟或更高。
渗透物的流速是从体系中去除渗透物的速率。对于恒定进料速率而言,增加渗透物流速可增加穿过过滤器的压力,导致过滤速率提高,同时还可能增加过滤器堵塞或污损的风险。michaels等,"tangentialflowfiltration"inseparationstechnology,pharmaceuticalandbiotechnologyapplications(w.p.olson编,interpharmpress,inc.,buffalogrove,ill.1995)中描述了用于tff的原理、理论和装置。对代表对tff的改进的高性能切向流过滤(hp-tff)的描述还见美国专利第5,256,294和5,490,937号。在一些实施方案中,流速为1至100ml/分钟。在一些实施方案中,流速为10至100ml/分钟。在一些实施方案中,流速为10至90ml/分钟。在一些实施方案中,流速为10至80ml/分钟。在一些实施方案中,流速为10至70ml/分钟。在一些实施方案中,流速为10至60ml/分钟。在一些实施方案中,流速为10至50ml/分钟。在一些实施方案中,流速为10至40ml/分钟。在一些实施方案中,流速为20至40ml/分钟。在一些实施方案中,流速为30ml/分钟。
可使用本文所述的各种工艺变量的任何组合。在一些实施方案中,以大约100至200ml/分钟(例如,大约100至180ml/分钟、100至160ml/分钟、100至140ml/分钟、110至190ml/分钟、110至170ml/分钟或110至150ml/分钟)的进料速率和/或大约10至50ml/分钟(例如,大约10至40ml/分钟、10至30ml/分钟、20至50ml/分钟或20至40ml/分钟)的流速进行切向流过滤。在一些实施方案中,以大约100、110、120、130、140、150、160、170、180、190或200ml/分钟的进料速率和/或大约10、20、30、40或50ml/分钟的流速进行切向流过滤。在另一些实施方案中,以大约500、750ml/分钟、1、2、3、4或5l/分钟的进料速率和/或大约100、200、250、500、750ml/分钟或1l/min的流速进行切向流过滤。
洗涤
通常,可以在洗脱以除去保留在膜上的杂质之前洗涤捕获的不溶性mrna。在一些实施方案中,洗涤步骤包括使用一种或更多种洗液进行多个冲洗循环。例如,可以通过使用胍缓冲液和乙醇接着70%至80%乙醇(例如,约70%、75%或80%乙醇)的多个冲洗循环来实施洗涤步骤。在某些实施方案中,该多个冲洗循环为多于2次、多于3次、多于4次、多于5次、多于6次、多于7次、多于8次、多于9次或多于10次循环。
洗脱
通常,可以通过将经沉淀的mrna重新溶解于溶液中来洗脱捕获或保留的mrna。例如,可以用无rna酶的水洗脱捕获的mrna。在某些实施方案中,洗脱捕获的mrna涉及再循环无rna酶的水。例如,可以将无rna酶的水循环约5至30分钟(例如,约5至25分钟、约5至20分钟或约5至15分钟)。在一些特定实施方案中,将无rna酶的水再循环约5至10分钟(例如,约5、6、7、8、9或10分钟)。
在一些实施方案中,可以将重新溶解的mrna透析入期望浓度的期望制剂。多种制剂可用于透析。在一些实施方案中,用1mm柠檬酸钠透析经纯化的mrna溶液。在一些实施方案中,用柠檬酸钠、碳酸铵、碳酸氢铵、乙酸吡啶、甲酸吡啶、醋酸铵、脲、氯化钾等透析经纯化的mrna溶液。根据目的mrna的大小,可以使用具有适当的截留分子量(mwco)的透析膜。例如,合适的透析膜可具有如下mwco:约50kda、60kda、70kda、80kda、90kda、100kda、150kda、200kda、250kda、300kda、350kda、400kda、450kda或500kda。
经纯化的mrna的表征
本发明提供的一个特别优点是以大规模或商业规模纯化mrna,尤其是体外合成的mrna的能力。例如,可以以如下规模纯化体外合成的mrna:每个批次为约1克、10克、50克、100克、200克、300克、400克、500克、600克、700克、800克、900克、1kg、5kg、10kg、50kg或100kg或更多。在一个特定实施方案中,可以以每个批次10克的规模纯化体外合成的mrna。在另一特定实施方案中,可以以每个批次100克的规模纯化体外合成的mrna。在又一特定实施方案中,可以以每个批次1kg的规模纯化体外合成的mrna。
在各个实施方案中,根据本发明经纯化的mrna基本上不含来自于mrna合成过程的杂质,包括但不限于提前中断的rna序列、dna模板和/或用于体外合成的酶试剂。
特别地,本发明去除或消除高度的提前中断rna序列(也称为“短聚物”)。在一些实施方案中,本发明所述的方法去除多于约90%、95%、96%、97%、98%、99%或基本上全部提前中断rna序列。在一些实施方案中,根据本发明经纯化的mrna基本上不含提前中断的rna序列。在一些实施方案中,根据本发明经纯化的mrna含有少于约5%(例如,少于约4%、3%、2%或1%)的提前中断rna序列。在一些实施方案中,根据本发明经纯化的mrna含有少于约1%(例如,少于约0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%或0.1%)的提前中断rna序列。在一些实施方案中,如通过(例如)溴化乙锭和/或考马斯亮蓝染色测定的,根据本发明经纯化的mrna含有不可检测的提前中断rna序列。在一些实施方案中,提前中断的rna序列包含少于15个碱基(例如,少于14、13、12、11、10、9、8、7、6、5、4或3个碱基)。在一些实施方案中,提前中断的rna序列包含约8至15、8至14、8至13、8至12、8至11或8至10个碱基。
在一些实施方案中,本发明所述的方法去除或消除高度的用于体外合成的酶试剂,包括但不限于t7rna聚合酶、dna酶i、焦磷酸酶和/或rna酶抑制剂。在一些实施方案中,本发明对去除t7rna聚合酶特别有效。在一些实施方案中,本发明所述的方法去除多于约90%、95%、96%、97%、98%、99%或基本上全部用于体外合成的酶试剂(包括)。在一些实施方案中,根据本发明经纯化的mrna基本上不含用于体外合成的酶试剂(包括)。在一些实施方案中,根据本发明经纯化的mrna含有少于约5%(例如,少于约4%、3%、2%或1%)的用于体外合成的酶试剂(包括)。在一些实施方案中,根据本发明经纯化的mrna含有少于约1%(例如,少于约0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%或0.1%)的用于体外合成的(包括)酶试剂。在一些实施方案中,包括如通过例如溴化乙锭和/或考马斯亮蓝染色测定的,根据本发明经纯化的mrna含有不可检测的用于体外合成的酶试剂。
可以使用本领域中已知的各种方法测量经纯化的mrna中的提前中断的rna序列和/或酶试剂的水平。例如,可以通过银染、凝胶电泳、高效液相色谱(hplc)、超高效液相色谱(uplc)和/或毛细管电泳测量提前中断rna序列和/或用于体外合成的酶试剂。
在各个实施方案中,根据本文所述的方法纯化的mrna保持高度完整性。本文所用术语“mrna完整性”通常是指纯化后mrna的质量。在一些实施方案中,mrna完整性是指在切向流过滤后未降解的mrna的百分比。可使用本领域中已知的方法例如通过rna琼脂糖凝胶电泳(例如,ausubel等,johnweley&sons,inc.,1997,currentprotocolsinmolecularbiology)测定mrna完整性。在一些实施方案中,根据本发明经纯化的mrna的完整性高于约95%(例如,高于约96%、97%、98%、99%或更高)。在一些实施方案中,根据本发明经纯化的mrna的完整性高于98%。在一些实施方案中,根据本发明经纯化的mrna的完整性高于99%。在一些实施方案中,根据本发明经纯化的mrna的完整性为大约100%。
大规模批量生成用于治疗应用的mrna
本发明解决了对大规模生成治疗应用所需具有高纯度和完整性的经纯化的mrna的迫切需求。现有方法通常规模小而且不能扩大规模到适合足够经济有效地施用于人类受试者的商业生成mrna所需的程度。相比之下,本发明的方法如实施例中所证明的可充分扩大规模并且允许经济有效地大规模生成药物级mrna。
根据本发明生成的经纯化的mrna的各批次包含5克或更多的适合施用于人类受试者的单一mrna种类。在一些实施方案中,单一批次包含10克或更多的单一mrna种类。在一个特定实施方案中,单一批次包含25克或更多的单一mrna种类。
本发明的方法产生基本上不含来自mrna合成过程的杂质的经纯化的mrna批次。在一些实施方案中,该批次基本上不含用于单一mrna种类体外合成的提前中断rna序列、dna模板和/或酶试剂。例如,根据本发明生成的经纯化的mrna批次包含少于约5%的用于体外合成的酶试剂。各批次中的经纯化的mrna的完整性大于约95%。
根据本发明方法生成的mrna批次可用于制备治疗剂,需要一个或多个下游处理步骤。通常,例如通过将mrna包封入可施用于患者的脂质纳米颗粒、脂质体、聚合物基聚合复合物等来配制每个mrna批次。典型的施用途径非排他地包括静脉内或肺部递送经纯化的mrna。
本发明还包括以下实施方案:
实施方案1.一种纯化信使rna(mrna)的方法,其包括:
(a)从不纯制剂沉淀mrna;和
(b)使含经沉淀的mrna的所述不纯制剂经历涉及膜过滤的纯化过程,使得通过膜捕获所述经沉淀的mrna;以及
(c)通过重新溶解所述mrna从所述膜洗脱所述捕获的经沉淀的mrna,从而得到经纯化的mrna溶液。
实施方案2.根据实施方案1所述的方法,其中所述涉及膜过滤的纯化过程是切向流过滤。
实施方案3.根据实施方案1所述的方法,其中所述涉及膜过滤的纯化过程是直接流过滤。
实施方案4.根据实施方案1、2或3所述的方法,其中所述沉淀mrna的步骤包括用含选自由以下组成的组的试剂的溶液处理所述不纯制剂:氯化锂、氯化钾、氯化胍、硫氰酸胍、异硫氰酸胍、乙酸铵及其组合。
实施方案5.根据实施方案4所述的方法,其中所述试剂是硫氰酸胍。
实施方案6.根据实施方案5所述的方法,其中所述溶液包含4m硫氰酸胍、0.5%十二烷基肌氨酸钠和25mm柠檬酸钠。
实施方案7.根据实施方案5所述的方法,其中所述溶液包含4m硫氰酸胍和0.5%十二烷基肌氨酸钠。
实施方案8.根据实施方案5所述的方法,其中所述溶液包含4m硫氰酸胍和25mm柠檬酸钠。
实施方案9.根据前述实施方案中任一项所述的方法,其中所述沉淀mrna的步骤还包括用无水乙醇处理所述不纯制剂的步骤。
实施方案10.根据前述实施方案中任一项所述的方法,其中所述膜选自由以下组成的组:聚醚砜(mpes)(未改性的)、聚醚砜(mpes)中空纤维膜、聚偏二氟乙烯(pvdf)、乙酸纤维素、硝化纤维素、mce(混合纤维素酯)、超高mw聚乙烯(upe)、聚四氟乙烯(ptfe)、尼龙及其组合。
实施方案11.根据前述实施方案中任一项所述的方法,其中所述方法还包括在洗脱之前洗涤所述捕获的经沉淀的mrna。
实施方案12.根据实施方案11所述的方法,其中所述洗涤步骤包括使用含胍缓冲液和乙醇的洗液接着约70-80%乙醇进行多个冲洗循环。
实施方案13.根据实施方案12所述的方法,其中所述多个冲洗循环为多于5个循环。
实施方案14.根据前述实施方案中任一项所述的方法,其中所述洗脱步骤包括用无rna酶的水重新溶解所述捕获的经沉淀的mrna。
实施方案15.根据实施方案14所述的方法,其中将所述无rna酶的水再循环5至10分钟。
实施方案16.根据前述实施方案中任一项所述的方法,其中所述方法还包括透析所述经纯化的mrna溶液的步骤。
实施方案17.根据实施方案16所述的方法,其中用100kda分子量截留(mwco)膜以1mm柠檬酸钠透析所述经纯化的mrna溶液。
实施方案18.根据前述实施方案中任一项所述的方法,其中体外合成所述mrna,并且所述不纯制剂包含体外mrna合成反应混合物。
实施方案19.根据实施方案18所述的方法,其中所述不纯制剂包含提前中断rna序列和/或用于体外合成的酶试剂。
实施方案20.根据实施方案19所述的方法,其中所述经纯化的mrna溶液包含少于约1%的提前中断rna序列和/或用于体外合成的酶试剂。
实施方案21.根据实施方案19所述的方法,其中所述经纯化的mrna溶液包含少于0.5%的提前中断rna序列和/或用于体外合成的酶试剂。
实施方案22.根据实施方案19所述的方法,其中所述经纯化的mrna溶液包含少于0.1%的提前中断rna序列和/或用于体外合成的酶试剂。
实施方案23.根据实施方案19所述的方法,其中所述经纯化的mrna溶液基本上不含提前中断rna序列和/或用于体外合成的酶试剂。
实施方案24.根据实施方案23所述的方法,其中通过银染、凝胶电泳、hplc、uplc和/或毛细管电泳测量所述提前中断rna序列和/或用于体外合成的酶试剂。
实施方案25.根据实施方案19至24中任一项所述的方法,其中所述提前中断rna序列包含少于15个碱基。
实施方案26.根据实施方案19至24中任一项所述的方法,其中所述提前中断rna序列包含约8至12个碱基。
实施方案27.根据实施方案19至24中任一项所述的方法,其中所述用于体外合成的酶试剂包含t7rna聚合酶、dna酶i、焦磷酸酶和/或rna酶抑制剂。
实施方案28.根据前述实施方案中任一项所述的方法,其中以1克、10克、100克、1kg、10kg或100kg/批或更多的规模纯化所述mrna。
实施方案29.根据前述实施方案中任一项所述的方法,其中在向所述mrna加帽和尾之前纯化所述mrna。
实施方案30.根据实施方案1至28中任一项所述的方法,其中在向所述mrna加帽和尾之后纯化所述mrna。
实施方案31.根据实施方案1至28中任一项所述的方法,其中在加帽之后纯化所述mrna。
实施方案32.根据实施方案1至28中任一项所述的方法,其中在向所述mrna加帽和/或尾之前和之后纯化所述mrna。
实施方案33.根据前述实施方案中任一项所述的方法,其中所述mrna的长度为约1kb、1.5kb、2kb、2.5kb、3kb、3.5kb、4kb、4.5kb、5kb、6kb、7kb、8kb、9kb、10kb、11kb、12kb、13kb、14kb、15kb或20kb或更长。
实施方案34.根据前述实施方案中任一项所述的方法,其中所述mrna包含一个或多个修饰以增强稳定性。
实施方案35.根据实施方案34所述的方法,其中所述一个或多个修饰包含经修饰的核苷酸和/或经修饰的糖磷酸骨架。
实施方案36.根据实施方案1至33中任一项所述的方法,其中所述mrna未经修饰。
实施方案37.根据前述实施方案中任一项所述的方法,其中所述经纯化的mrna的完整性为95%或更大。
实施方案38.根据前述实施方案中任一项所述的方法,其中所述经纯化的mrna的完整性为98%或更大。
实施方案39.根据前述实施方案中任一项所述的方法,其中所述经纯化的mrna的完整性为99%或更大。
实施方案40.一种纯化信使rna(mrna)的方法,其包括:
(a)从不纯制剂中沉淀mrna;和
(b)对含经沉淀的mrna的所述不纯制剂进行切向流过滤,使得通过滤膜捕获所述经沉淀的mrna,同时通过渗透弃除杂质;以及
(c)通过重新溶解所述经沉淀的mrna洗脱所述捕获的经沉淀的mrna,得到经纯化的mrna溶液。
实施方案41.一种生产信使rna(mrna)的方法,其包括:
体外合成mrna;和
使用根据前述实施方案中任一项所述的方法纯化所述体外合成的mrna。
实施方案42.一种信使rna(mrna),其使用根据前述实施方案中任一项所述的方法纯化。
实施方案43.一个适于施用于人类受试者的经纯化的mrna的批次,其包含5克或更多的单一mrna种类。
实施方案44.根据实施方案43所述的批次,其包含10克或更多的单一mrna种类。
实施方案45.根据实施方案43所述的批次,其包含25克或更多的单一mrna种类。
实施方案46.根据实施方案42至45中任一项所述的批次,其基本上不含来自mrna合成过程的杂质。
实施方案47.根据实施方案46所述的批次,其中所述批次基本上不含用于体外合成所述单一mrna种类的提前中断rna序列、dna模板和/或酶试剂。
实施方案48.根据实施方案43至47中任一项所述的批次,其中所述经纯化的mrna包含少于约5%的用于体外合成的酶试剂。
实施方案49.根据实施方案43至48中任一项所述的批次,其中所述经纯化的mrna的完整性大于约95%。
实施方案50.一种组合物,其包含利用根据前述实施方案任一项所述的方法纯化的信使rna。
实施方案51.一种组合物,其包含体外合成的信使rna,其中所述组合物包含少于1%的提前中断rna序列和/或用于体外合成的酶试剂。
实施方案52.一种组合物,其包含体外合成的信使rna(mrna),其中所述mrna的完整性为95%或更大。
实施例
实施例1.信使rna(mrna)的产生和纯化
信使rna合成
通过以下所述合成萤火虫荧光素酶(ffl)、精氨琥珀酸合成酶(ass1)和人囊性纤维化跨膜传导调节蛋白(cftr)信使rna:由编码基因的质粒dna模板进行体外转录,然后添加5’帽结构(帽1)(fechter,p.;brownlee,g.g.“recognitionofmrnacapstructuresbyviralandcellularproteins”j.gen.virology2005,86,1239-1249)和如通过凝胶电泳测定的长度为大约200个核苷酸的3’poly(a)尾。每个mrna产物中存在的5’和3’未翻译区分别表示为x和y,并按照所述定义(参见下文)。靶信使rna构建体的合成涉及两步过程,其中合成由侧接5’和3’未翻译区的编码序列组成的起始链。纯化未加帽和未加尾的构建体并通过加帽步骤进一步处理,接着进行添加poly-a尾的步骤。以与起始纯化过程相似的方式在加尾反应结束时进行第二纯化步骤。
示例性密码子优化的囊性纤维化跨膜传导调节蛋白(cftr)mrna
构建体设计:
x1-seqidno:1-y1
示例性密码子优化的萤火虫荧光素酶(ffl)mrna
构建体设计:
x1-seqidno:2-y1
示例性密码子优化的人精氨琥珀酸合成酶(ass1)mrna
构建体设计:
x1-seqidno:3-y2
5’和3’utr序列
mrna的合成
在以下每个实施例中,在完全无rna酶的条件下进行mrna的合成。除非另外明确表明,否则要求所有管、小瓶、移液管枪头、移液管、缓冲液等均无核酸酶。
在下列实施例中,除非另有描述,否则由线性化dna模板经由体外转录合成mrna。为生成所需mrna前体(ivt)构建体,用无rna酶的水制备约8mg线性化dna、rntp(7.25mm)、dtt(10mm)、t7rna聚合酶、rna酶抑制剂、焦磷酸酶和反应缓冲液(10x,800mmhepes(ph8.0)、20mm亚精胺、250mmmgcl2,ph7.7)的混合物至180ml的最终体积。在37℃下孵育反应混合物20分钟至60分钟的时间。完成后,再用dna酶i处理混合物15分钟并相应地猝灭。
5’帽和3’尾的添加
使来自前述ivt步骤(也可能来自初始tff过滤)的纯化mrna产物在65℃下变性10分钟。单独地,将成份的gtp(1.0mm)、s-腺苷甲硫氨酸、rna酶抑制剂、2’-o-甲基转移酶和鸟苷酸转移酶与反应缓冲液(10x,500mmtris-hcl(ph8.0)、60mmkcl、12.5mmmgcl2)混合在一起至1.6l的终浓度。变性后,在冰上冷却mrna,然后添加到反应混合物中。在37℃下孵育合并的溶液25至90分钟的时间。完成后,添加等分试样的atp(2.0mm)、polya聚合酶和加尾反应缓冲液(10x,500mmtris-hcl(ph8.0)、2.5mnacl、100mmmgcl2)并进一步在37℃下孵育总反应混合物20至45分钟的时间。完成后,猝灭最终反应混合物并相应地纯化。
mrna的纯化
mrna的沉淀
可以采用多种方法沉淀信使rna。例如,使用氯化锂、氯化钾、氯化胍、硫氰酸胍、异硫氰酸胍、乙酸铵及其它盐提供从反应混合物中高效沉淀mrna。
切向流过滤
在以下实施例中,除非另有描述,否则切向流过滤(tff)系统由滤膜和蠕动泵(spectrumsystem)组成,流体以约130ml/分钟的进料速率穿过膜切向循环,渗透物的流速为30ml/分钟。采用的tff膜为midikros500kdampes115cm2(spectrumlabs)。使用之前,用无核酸酶的水洗涤滤筒并用0.2nnaoh进一步清洗。最后用无核酸酶的水清洗系统直至渗透物和渗余物的ph达到ph为约6。经tff分离mrna可按照图1所描绘完成。
萤火虫荧光素酶mrna的纯化
在mrna经纯化的示例性实例中,通过体外方法转录1克批次的萤火虫荧光素酶(ffl)mrna以生成前述没有帽和polya尾的中间构建体。该反应维持约180ml的总体积并在通过添加dna酶i(约9.0ku)完成后淬灭。用4m硫氰酸胍、0.5%十二烷基肌氨酸钠和25mm柠檬酸钠(1500ml)的均匀溶液处理所得溶液,使总体积达到1.68l。将所得混合物在环境温度下保持约5分钟,接着用1.1l无水乙醇进一步处理。mrna缓慢沉淀,将混悬液在环境温度下保持约5分钟。完成之后,采用切向流过滤(tff)将全部不均匀的混悬液泵送通过滤膜。
在该实例中,采用表面积为2600cm2的改性聚醚砜(mpes)中空纤维膜。将所得不均匀的混合物(沉淀后)以750ml/分钟的流速泵送通过过滤器系统,按份进行大约8分钟。完成之后,用胍缓冲液/乙醇合并缓冲液接着用80%乙醇(500ml,750ml/分钟)冲洗所得捕获的沉淀,并重复多次(>5x)。一旦完成洗涤,用无rna酶水(250ml)处理膜上分布的固体mrna,并再循环5至10分钟以确保溶解。重复该过程直至不再能回收到mrna。完成之后,使用100kdamwco膜用1mm柠檬酸钠(ph6.4)进一步透析所得mrna溶液以除去任何残留乙醇并得到适当储液中的最终mrna产物。通过260nm(λmax)处的吸光度确定终浓度。通过uv吸光度(260/280比例)及蛋白质凝胶(银染、sypro染色、考马斯亮蓝等)确定信使rna纯度。通过凝胶电泳以及蛋白质生成的体外/体外分析来确定信使rna完整性。
ass1mrna的纯化
在mrna经纯化的第二代表性实例中,通过体外方法转录1克批次的ass1mrna以生成前述没有帽和polya尾的中间构建体。该反应维持约180ml的总体积并在通过添加dna酶i(约9.0ku)完成后淬灭。用4m硫氰酸胍、0.5%十二烷基肌氨酸钠和25mm柠檬酸钠(1500ml)的均匀溶液处理所得溶液,使总体积达到1.68l。将所得混合物在环境温度下保持约5分钟,接着用1.1l无水乙醇进一步处理。信使rna缓慢沉淀,将混悬液在环境温度下保持约5分钟。完成之后,采用切向流过滤(tff)将全部不均匀的混悬液泵送通过滤膜并按照如上所述分离。
cftrmrna的纯化
在mrna经纯化的第三代表性实例中,通过体外方法转录1.5克批次的改性cftrmrna以生成前述没有帽和polya尾的中间构建体。该反应维持约270ml的总体积并在通过添加dna酶i(约13.5ku)完成后淬灭。用4m硫氰酸胍、0.5%十二烷基肌氨酸钠和25mm柠檬酸钠(1500ml)的均匀溶液处理所得溶液,使总体积达到1.77l。将所得混合物在环境温度下保持约5分钟,接着用1.1l无水乙醇进一步处理。mrna缓慢沉淀,将混悬液在环境温度下保持约5分钟。完成之后,采用切向流过滤(tff)将全部不均匀的混悬液泵送通过滤膜并按照如上所述分离。
实施例2.经纯化的mrna的分析
测试经纯化的mrna中酶的存在
sypro染色凝胶
进行标准sypro染色蛋白质凝胶以确定在纯化之前和之后存在的任何残留试剂酶的存在。以200v跑胶35分钟。
银染凝胶
采用制造商的规程用
经由琼脂糖凝胶电泳测定评估mrna完整性
除非另有描述,否则经由凝胶电泳评估mrna大小和完整性。采用自流式1.0%琼脂糖凝胶或invitrogene-gel预制1.2%琼脂糖凝胶。信使rna按每孔1.0至1.5μg的量加载。完成后,使用溴化乙锭使mrna条带可见。
体外mrna完整性评估
除非另有描述,否则使用hek293t细胞进行萤火虫荧光素酶(ffl)、精氨琥珀酸合成酶(ass1)mrna和cftrmrna的体外转染。在单独的孔内使用lipofectamine进行1微克各mrna构建体的转染。在所选时间点(例如4小时、8小时等)收获细胞并分析各自的蛋白质产量。对于fflmrna而言,经由生物发光测定分析细胞裂解产物的荧光素酶产量。对于ass1mrna而言,经由elisa测定分析细胞裂解产物的ass1产量。对于cftrmrna而言,经由western印迹规程分析细胞裂解物的cftr产量。
荧光素酶测定
使用promega荧光素酶测定系统(item#e1500)进行生物发光测定。通过向荧光素酶测定底物中添加10ml的荧光素酶测定缓冲液并经由涡旋混合制备荧光素酶测定试剂。向96孔板上加载大约20μl的匀浆样品,接着向每份样品加载20μl板对照。单独地,向96孔平底板的每个孔加载120μl的荧光素酶测定试剂(如上所述制备)。然后使用moleculardeviceflexstation仪器将每张板插入适当腔室内并测量发光(按相对光度单位(rlu)测量)。
ass1elisa测定
按照标准的elisa规程,用小鼠抗ass12d1-2e12igg作为捕获抗体,用兔抗ass1#3285igg作为第二(检测)抗体(shirehumangenetictherapies)。使用缀合辣根过氧化物酶(hrp)的山羊抗兔igg活化3,3',5,5'-四甲基联苯胺(tmb)底物溶液。20分钟后使用2nh2so4淬灭反应。用moleculardevicespectramax仪器通过吸光度(450nm)监测检测。分别使用未经处理的小鼠血清和器官和人ass1蛋白质作为阴性对照和阳性对照。
cftrwestern印迹分析
对使用免疫沉淀法(dynabeadsg)获得的蛋白质样品进行western印迹。一般而言,加工细胞或组织匀浆物并用预先结合至抗人cftr抗体(r&dsystems,mab25031)的dynabeadsg处理。使用ab570完成人cftr蛋白质的检测。
实施例3.纯化结果
该实施例说明,利用沉淀接着切向流过滤同时除去酶促试剂及短聚物成功地纯化了萤火虫荧光素酶(ffl)mrna、精氨琥珀酸合成酶(ass1)mrna和囊性纤维化跨膜传导调节蛋白(cftr)mrna。许多典型的离液条件成功地被用于沉淀如上所列mrna。
为了证明该成功,使大规模生成(约1克)的改性cftrmrnaivt反应混合物经历4m胍缓冲液(上述)。然后用无水乙醇处理所得混合物并在室温下孵育5分钟。按照上述经tff实现经沉淀的mrna的分离。图2显示银染的蛋白质凝胶,其示出采用前述条件的tff后分离的所得mrna。完成后不存在可检测的酶(t7聚合酶、dna酶i、焦磷酸酶、rna酶抑制剂)。洗脱1(e1)、洗脱2(e2)和洗脱3(e3)后泳道1至3包含改性cftr。泳道4-7包含存在于ivt反应中的对照酶。图3显示银染的蛋白质凝胶,其示出得自大规模(1.5克批次)沉淀和过滤过程的纯mrna,未示出残留酶。洗脱1至6后,泳道1至6包含mrna。泳道7至10包含存在于ivt反应中的对照酶(t7聚合酶、dna酶i、rna酶抑制剂和焦磷酸酶)。图4证明改性cftrmrna在这样的纯化后完全完整。其示出经由沉淀和过滤纯化后改性cftrmrna的琼脂糖(1.0%)凝胶电泳的结果。泳道1包含riborulerhr梯(ladder)。泳道2至7包含经由沉淀或过滤经纯化的改性cftrmrna。
该过程广泛适用于多种不同的mrna构建体。例如,使用该方法合成和纯化第二mrna构建体。在这种情况下,使用上述方法生成和沉淀精氨琥珀酸合成酶(ass1)mrna。将固体沉淀加载至tff系统并根据所述过程分离。图5显示所得分离的ass1mrna的银染分析,其示出不存在残留酶(t7聚合酶、dna酶i、rna酶抑制剂、焦磷酸酶)。洗脱1-5后,泳道1至5包含mrna。泳道6至9包含存在于ivt反应中的对照酶。泳道10包含rna酶a作为对照,这是因为在加载之前用rna酶a对mrna样品进行了预处理。如图5所表明的,大量暴露于银染显色后不存在酶。如图6所示,利用sypro染残留酶对其进行了进一步确认。利用该方法,可以再次证实使用该过程分离的ass1mrna的纯度。洗脱1至5后,泳道1至5包含mrna。泳道6至9包含存在于ivt反应中的对照酶。除此之外,rna凝胶电泳表明,该过程之后,ass1mrna完整性得以维持,全长ass1mrna完全完整(图7)。在图7中,洗脱1至5后,泳道1包含riborulerhr梯,泳道2至6包含ass1mrna。
为了进一步证实该纯化技术广泛适用于多种不同的mrna构建体,利用该方法合成fflmrna并纯化。使用4m胍缓冲体系沉淀mrna并过滤。图8显示所得分离的fflmrna的银染分析,其示出不存在残留酶。泳道1至4包含经由单沉淀(xl1)或双沉淀(xl2)经纯化的fflmrna,泳道2至4包含来自二次沉淀回收的不同洗脱物。泳道6至9包含存在于ivt反应中的对照酶。如图8所示,大量暴露于银染显色后不存在酶。此外,可见单次沉淀似乎足以去除全部不希望的残留酶。使用图9所示的对残留酶的sypro染色对其进行了进一步确认。利用该方法,可再次证实利用该过程分离的fflmrna的纯度。在图9中,泳道1至4包含经由单沉淀(xl1)或双沉淀(xl2)经纯化的fflmrna,泳道2至4包含来自二次沉淀回收的不同洗脱物。泳道6至9包含存在于ivt反应中的对照酶。除此之外,rna凝胶电泳表明,该过程之后,fflmrna完整性得以维持,全长fflmrna完全完整(图10)。另外,在多次再沉淀之后,mrna显示出无差异。在图10中,泳道1包含riborulerhr梯,泳道2至5包含经由单沉淀(xl1)或双沉淀(xl2)纯化的fflmrna。
在使该分离的mrna进一步经受提供加帽和加尾的终产物后,进一步采用tff法纯化最终靶mrna。图11证实,沉淀接着采用切向流过滤捕获和洗脱成功地得到纯mrna终产物。在图11中,泳道1至3含经由单沉淀(e1-3=洗脱1-3)纯化的来自帽/尾反应的ass1mrna。泳道4至6包含存在于两个反应步骤中的关键对照酶。泳道7包含rna酶i对照,因为在加载之前用rna酶i对mrna样品进行了预处理。除此之外,rna凝胶电泳表明得以维持fflmrna完整性,全长fflmrna在该过程后完全完整(图12)。在图12中,泳道1至3包含加帽和加尾的ass1mrna。
虽然这样的表征提供了关于纯度和mrna大小/完整性的信息,但是mrna质量的真正度量在于其生成期望的蛋白质的能力。因此,对每种分离fflmrna构建体(tff与离心柱)进行比较。将以下所列3种构建体中的每一种转染到hek293t细胞内并在暴露于萤光素后呈ffl发光形式经由ffl蛋白质活性评估相应的ffl蛋白质产量(同上)。转染24小时后收获细胞。
ffl构建体:
1.购自外部供应商的fflmrna
2.经市售试剂盒纯化的fflmrna
3.经沉淀-tff法纯化的fflmrna
图13中描绘了由每一种生成的ffl蛋白质发光输出的比较。在所述条件下在整个沉淀和切向流过滤过程中保持经tff纯化的fflmrna的完整性。
此外,通过采用前述过程分离的hcftrmrna的转染实现了人cftr蛋白质的成功检测。图14示出经市售试剂盒或前述tff基沉淀法纯化的hcftrmrna转染后人cftr蛋白质的成功生成。cftr蛋白的该“c-带”的可视化—其指示全长,适当定位cftr蛋白—通过所述条件支持分离的mrna的充分完整性和活性性质。例如,采用该方法以5克的规模合成单独的mrna构建体并纯化。在这种情况下,采用上述方法生成精氨琥珀酸合成酶(ass1)mrna并沉淀。将固体沉淀加载到tff体系上并根据所述过程分离。
利用两种不同的方法证实制造的mrna药物的完整性。图15示出来自根据所提供的方法纯化和过滤的精氨琥珀酸合成酶(ass1)mrna的体外转录(ivt)样品的示例性mrna的长度。经琼脂糖芯片(chip)上电泳证实mrna的长度。使用凝胶电泳(图16)确认ivt前体及最终加尾和加帽的构建体二者的完整和全长mrna。大规模(5g)沉淀后ass1mrna保留完全完整性。
如此前所证实的,图17示出沉淀,接着采用切向流过滤捕获和洗脱成功地得到纯的mrna终产物。泳道1包含来自经单沉淀纯化的帽/尾反应的ass1mrna。泳道2至8包含存在于两个反应步骤中的关键对照酶。泳道9包含rna酶i对照,因为在加载之前用rna酶i预处理mrna样品。该银染法表明不存在残留酶。
虽然这样的表征提供了关于纯度和mrna大小/完整性的信息,但是mrna质量的真正度量还在于其生成期望的蛋白质的能力。因此,对分离的ass1mrna构建体(tff与离心柱)进行比较(图18)。将以下所列构建体中的每一种转染到hek293t细胞内并经由elisa法评估相应的ass1蛋白质产量。转染后约18小时收获细胞。
采用该方法以10克的规模合成和纯化cftrmrna来实现规模可扩性的进一步证实。在这种情况下,采用上述方法生成囊性纤维化跨膜传导调节蛋白(cftr)mrna并沉淀。将固体沉淀加载到tff体系上并根据所述过程分离。利用琼脂糖凝胶电泳证实制造的mrna药物的完整性。确认ivt前体及最终加尾和加帽的构建体二者的完整和全长mrna(图19)。大规模(10g)沉淀后cftrmrna保留完全完整性。
再次,如图20所示,经银染证实了以10克规模制造的产物的纯度。泳道1包含来自经单沉淀纯化的帽/尾反应的cftrmrna。泳道2至8包含存在于两个反应步骤中的关键对照酶。泳道9包含rna酶i对照,因为在加载之前用rna酶i预处理mrna样品。该银染法表明不存在残留酶。
如上所述,虽然这样的表征提供了关于纯度和mrna大小/完整性的信息,但是mrna质量的真正度量还在于其生成期望的蛋白质的能力。因此,将多种量的cftrmrna转染入hek293t细胞,并经western印迹法评估相应cftr蛋白质产量(图21)。转染后约18小时收获细胞。
在另一实施方案中,采用该方法以25克的规模合成和纯化ass1mrna来实现规模可扩性的进一步证实。在这种情况下,采用上述方法生成精氨琥珀酸合成酶(ass1)mrna并沉淀。将固体沉淀加载到tff体系上并根据所述过程分离。利用琼脂糖凝胶电泳证实制造的mrna药物的完整性。确认大规模(25g)沉淀后ass1mrna的完整和全长mrna(图22)。
等同形式和范围
仅仅使用常规实验,本领域技术人员将认识到,或者能够确定,本文所述的本发明的具体实施方案的许多等同形式。本发明的范围无意受限于以上描述,而是如权利要求书中所述。
序列表
<110>夏尔人类遗传性治疗公司
<120>信使rna的纯化方法
<130>023236-8044cn02
<150>61/984,503
<151>2014-04-25
<160>6
<170>patentin3.5版
<210>1
<211>4443
<212>rna
<213>人工序列
<220>
<223>合成多核苷酸
<400>1
augcagcgguccccgcucgaaaaggccagugucguguccaaacucuucuucucauggacu60
cggccuauccuuagaaagggguaucggcagaggcuugaguugucugacaucuaccagauc120
cccucgguagauucggcggauaaccucucggagaagcucgaacgggaaugggaccgcgaa180
cucgcgucuaagaaaaacccgaagcucaucaacgcacugagaaggugcuucuucuggcgg240
uucauguucuacgguaucuucuuguaucucggggaggucacaaaagcaguccaaccccug300
uuguugggucgcauuaucgccucguacgaccccgauaacaaagaagaacggagcaucgcg360
aucuaccucgggaucggacuguguuugcuuuucaucgucagaacacuuuuguugcaucca420
gcaaucuucggccuccaucacaucgguaugcagaugcgaaucgcuauguuuagcuugauc480
uacaaaaagacacugaaacucucgucgcggguguuggauaagauuuccaucggucaguug540
gugucccugcuuaguaauaaccucaacaaauucgaugagggacuggcgcuggcacauuuc600
guguggauugccccguugcaagucgcccuuuugaugggccuuauuugggagcuguugcag660
gcaucugccuuuuguggccugggauuucugauuguguuggcauuguuucaggcugggcuu720
gggcggaugaugaugaaguaucgcgaccagagagcggguaaaaucucggaaagacucguc780
aucacuucggaaaugaucgaaaacauccagucggucaaagccuauugcugggaagaagcu840
auggagaagaugauugaaaaccuccgccaaacugagcugaaacugacccgcaaggcggcg900
uauguccgguauuucaauucgucagcguucuucuuuuccggguucuucguugucuuucuc960
ucgguuuugccuuaugccuugauuaaggggauuauccuccgcaagauuuucaccacgauu1020
ucguucugcauuguauugcgcauggcagugacacggcaauuuccgugggccgugcagaca1080
ugguaugacucgcuuggagcgaucaacaaaauccaagacuucuugcaaaagcaagaguac1140
aagacccuggaguacaaucuuacuacuacggagguaguaauggagaaugugacggcuuuu1200
ugggaagaggguuuuggagaacuguuugagaaagcaaagcagaauaacaacaaccgcaag1260
accucaaauggggacgauucccuguuuuucucgaacuucucccugcucggaacacccgug1320
uugaaggacaucaauuucaagauugagaggggacagcuucucgcgguagcgggaagcacu1380
ggugcgggaaaaacuagccucuugauggugauuaugggggagcuugagcccagcgagggg1440
aagauuaaacacuccgggcguaucucauucuguagccaguuuucauggaucaugcccgga1500
accauuaaagagaacaucauuuucggaguauccuaugaugaguaccgauacagaucgguc1560
auuaaggcgugccaguuggaagaggacauuucuaaguucgccgagaaggauaacaucguc1620
uugggagaaggggguauuacauugucgggagggcagcgagcgcggaucagccucgcgaga1680
gcgguauacaaagaugcagauuuguaucugcuugauucaccguuuggauaccucgacgua1740
uugacagaaaaagaaaucuucgagucgugcguguguaaacuuauggcuaauaagacgaga1800
auccuggugacaucaaaaauggaacaccuuaagaaggcggacaagauccugauccuccac1860
gaaggaucguccuacuuuuacggcacuuucucagaguugcaaaacuugcagccggacuuc1920
ucaagcaaacucauggggugugacucauucgaccaguucagcgcggaacggcggaacucg1980
aucuugacggaaacgcugcaccgauucucgcuugagggugaugccccgguaucguggacc2040
gagacaaagaagcagucguuuaagcagacaggagaauuuggugagaaaagaaagaacagu2100
aucuugaauccuauuaacucaauucgcaaguucucaaucguccagaaaacuccacugcag2160
augaauggaauugaagaggauucggacgaaccccuggagcgcaggcuuagccucgugccg2220
gauucagagcaaggggaggccauucuuccccggauuucggugauuucaaccggaccuaca2280
cuucaggcgaggcgaaggcaauccgugcucaaccucaugacgcauucgguaaaccagggg2340
caaaacauucaccgcaaaacgacggccucaacgagaaaagugucacuugcaccccaggcg2400
aauuugacugaacucgacaucuacagccguaggcuuucgcaagaaaccggacuugagauc2460
agcgaagaaaucaaugaagaagauuugaaagaguguuucuuugaugacauggaaucaauc2520
ccagcggugacaacguggaacacauacuugcguuacaucacggugcacaaguccuugauu2580
uucguccucaucuggugucucgugaucuuucucgcugaggucgcagcgucacuugugguc2640
cucuggcugcuugguaauacgcccuugcaagacaaaggcaauucuacacacucaagaaac2700
aauuccuaugccgugauuaucacuucuacaagcucguauuacguguuuuacaucuacgua2760
ggaguggccgacacucugcucgcgauggguuucuuccgaggacucccacucguucacacg2820
cuuaucacugucuccaagauucuccaccauaagaugcuucauagcguacugcaggcuccc2880
auguccaccuugaauacgcucaaggcgggagguauuuugaaucgcuucucaaaagauauu2940
gcaauuuuggaugaccuucugccccugacgaucuucgacuucauccaguuguugcugauc3000
gugauuggggcuauugcaguagucgcuguccuccagccuuacauuuuugucgcgaccguu3060
ccggugaucguggcguuuaucaugcugcgggccuauuucuugcagacgucacagcagcuu3120
aagcaacuggagucugaagggaggucgccuaucuuuacgcaucuugugaccaguuugaag3180
ggauuguggacguugcgcgccuuuggcaggcagcccuacuuugaaacacuguuccacaaa3240
gcgcugaaucuccauacggcaaauugguuuuuguauuugaguacccuccgaugguuucag3300
augcgcauugagaugauuuuugugaucuucuuuaucgcggugacuuuuaucuccaucuug3360
accacgggagagggcgagggacgggucgguauuauccugacacucgccaugaacauuaug3420
agcacuuugcagugggcagugaacagcucgauugauguggauagccugaugagguccguu3480
ucgagggucuuuaaguucaucgacaugccgacggagggaaagcccacaaaaaguacgaaa3540
cccuauaagaaugggcaauugaguaagguaaugaucaucgagaacagucacgugaagaag3600
gaugacaucuggccuagcgggggucagaugaccgugaaggaccugacggcaaaauacacc3660
gagggagggaacgcaauccuugaaaacaucucguucagcauuagccccggucagcgugug3720
ggguugcucgggaggaccgggucaggaaaaucgacguugcugucggccuucuugagacuu3780
cugaauacagagggugagauccagaucgacggcguuucgugggauagcaucaccuugcag3840
caguggcggaaagcguuuggaguaaucccccaaaaggucuuuaucuuuagcggaaccuuc3900
cgaaagaaucucgauccuuaugaacaguggucagaucaagagauuuggaaagucgcggac3960
gagguuggccuucggaguguaaucgagcaguuuccgggaaaacucgacuuuguccuugua4020
gaugggggaugcguccugucgcaugggcacaagcagcucaugugccuggcgcgauccguc4080
cucucuaaagcgaaaauucuucucuuggaugaaccuucggcccaucuggacccgguaacg4140
uaucagaucaucagaaggacacuuaagcaggcguuugccgacugcacggugauucucugu4200
gagcaucguaucgaggccaugcucgaaugccagcaauuucuugucaucgaagagaauaag4260
guccgccaguacgacuccauccagaagcugcuuaaugagagaucauuguuccggcaggcg4320
auuucaccauccgauagggugaaacuuuuuccacacagaaauucgucgaagugcaagucc4380
aaaccgcagaucgcggccuugaaagaagagacugaagaagaaguucaagacacgcgucuu4440
uaa4443
<210>2
<211>1653
<212>rna
<213>人工序列
<220>
<223>合成多核苷酸
<400>2
auggaagaugccaaaaacauuaagaagggcccagcgccauucuacccacucgaagacggg60
accgccggcgagcagcugcacaaagccaugaagcgcuacgcccuggugcccggcaccauc120
gccuuuaccgacgcacauaucgagguggacauuaccuacgccgaguacuucgagaugagc180
guucggcuggcagaagcuaugaagcgcuaugggcugaauacaaaccaucggaucguggug240
ugcagcgagaauagcuugcaguucuucaugcccguguugggugcccuguucaucggugug300
gcuguggccccagcuaacgacaucuacaacgagcgcgagcugcugaacagcaugggcauc360
agccagcccaccgucguauucgugagcaagaaagggcugcaaaagauccucaacgugcaa420
aagaagcuaccgaucauacaaaagaucaucaucauggauagcaagaccgacuaccagggc480
uuccaaagcauguacaccuucgugacuucccauuugccacccggcuucaacgaguacgac540
uucgugcccgagagcuucgaccgggacaaaaccaucgcccugaucaugaacaguaguggc600
aguaccggauugcccaagggcguagcccuaccgcaccgcaccgcuuguguccgauucagu660
caugcccgcgaccccaucuucggcaaccagaucauccccgacaccgcuauccucagcgug720
gugccauuucaccacggcuucggcauguucaccacgcugggcuacuugaucugcggcuuu780
cgggucgugcucauguaccgcuucgaggaggagcuauucuugcgcagcuugcaagacuau840
aagauucaaucugcccugcuggugcccacacuauuuagcuucuucgcuaagagcacucuc900
aucgacaaguacgaccuaagcaacuugcacgagaucgccagcggcggggcgccgcucagc960
aaggagguaggugaggccguggccaaacgcuuccaccuaccaggcauccgccagggcuac1020
ggccugacagaaacaaccagcgccauucugaucacccccgaaggggacgacaagccuggc1080
gcaguaggcaagguggugcccuucuucgaggcuaaggugguggacuuggacaccgguaag1140
acacugggugugaaccagcgcggcgagcugugcguccguggccccaugaucaugagcggc1200
uacguuaacaaccccgaggcuacaaacgcucucaucgacaaggacggcuggcugcacagc1260
ggcgacaucgccuacugggacgaggacgagcacuucuucaucguggaccggcugaagagc1320
cugaucaaauacaagggcuaccagguagccccagccgaacuggagagcauccugcugcaa1380
caccccaacaucuucgacgccggggucgccggccugcccgacgacgaugccggcgagcug1440
cccgccgcagucgucgugcuggaacacgguaaaaccaugaccgagaaggagaucguggac1500
uauguggccagccagguuacaaccgccaagaagcugcgcggugguguuguguucguggac1560
gaggugccuaaaggacugaccggcaaguuggacgcccgcaagauccgcgagauucucauu1620
aaggccaagaagggcggcaagaucgccguguaa1653
<210>3
<211>1239
<212>rna
<213>人工序列
<220>
<223>合成多核苷酸
<400>3
augagcagcaagggcagcguggugcuggccuacagcggcggccuggacaccagcugcauc60
cugguguggcugaaggagcagggcuacgacgugaucgccuaccuggccaacaucggccag120
aaggaggacuucgaggaggcccgcaagaaggcccugaagcugggcgccaagaagguguuc180
aucgaggacgugagccgcgaguucguggaggaguucaucuggcccgccauccagagcagc240
gcccuguacgaggaccgcuaccugcugggcaccagccuggcccgccccugcaucgcccgc300
aagcagguggagaucgcccagcgcgagggcgccaaguacgugagccacggcgccaccggc360
aagggcaacgaccaggugcgcuucgagcugagcugcuacagccuggccccccagaucaag420
gugaucgcccccuggcgcaugcccgaguucuacaaccgcuucaagggccgcaacgaccug480
auggaguacgccaagcagcacggcauccccauccccgugacccccaagaaccccuggagc540
auggacgagaaccugaugcacaucagcuacgaggccggcauccuggagaaccccaagaac600
caggccccccccggccuguacaccaagacccaggaccccgccaaggcccccaacaccccc660
gacauccuggagaucgaguucaagaagggcgugcccgugaaggugaccaacgugaaggac720
ggcaccacccaccagaccagccuggagcuguucauguaccugaacgagguggccggcaag780
cacggcgugggccgcaucgacaucguggagaaccgcuucaucggcaugaagagccgcggc840
aucuacgagacccccgccggcaccauccuguaccacgcccaccuggacaucgaggccuuc900
accauggaccgcgaggugcgcaagaucaagcagggccugggccugaaguucgccgagcug960
guguacaccggcuucuggcacagccccgagugcgaguucgugcgccacugcaucgccaag1020
agccaggagcgcguggagggcaaggugcaggugagcgugcugaagggccagguguacauc1080
cugggccgcgagagcccccugagccuguacaacgaggagcuggugagcaugaacgugcag1140
ggcgacuacgagcccaccgacgccaccggcuucaucaacaucaacagccugcgccugaag1200
gaguaccaccgccugcagagcaaggugaccgccaaguga1239
<210>4
<211>140
<212>rna
<213>人工序列
<220>
<223>合成多核苷酸
<400>4
ggacagaucgccuggagacgccauccacgcuguuuugaccuccauagaagacaccgggac60
cgauccagccuccgcggccgggaacggugcauuggaacgcggauuccccgugccaagagu120
gacucaccguccuugacacg140
<210>5
<211>105
<212>rna
<213>人工序列
<220>
<223>合成多核苷酸
<400>5
cggguggcaucccugugaccccuccccagugccucuccuggcccuggaaguugccacucc60
agugcccaccagccuuguccuaauaaaauuaaguugcaucaagcu105
<210>6
<211>105
<212>rna
<213>人工序列
<220>
<223>合成多核苷酸
<400>6
ggguggcaucccugugaccccuccccagugccucuccuggcccuggaaguugccacucca60
gugcccaccagccuuguccuaauaaaauuaaguugcaucaaagcu105
- 还没有人留言评论。精彩留言会获得点赞!