一种异佛尔酮类硫化氢荧光探针及其制备方法与应用与流程
本发明涉及一种硫化氢荧光探针,具体涉及一种异佛尔酮类硫化氢荧光探针及其制备方法与应用,属于有机发光材料领域。
背景技术:
硫化氢(h2s)是有机体内一种重要的气体信号传递介质,在体内主要以两种形式存在(1/3h2s,2/3nahs),处于动态平衡,保持着机体的正常ph范围。硫化氢是继一氧化氮(no)和一氧化碳(co)之后的人体内第三大气体信号分子,在生命体内,硫化氢参与了细胞内氧化还原反应和多种信号传导过程,包括血管舒张、心肌收缩、神经传递和胰岛素分泌等。而当细胞内硫化氢处于非正常水平时将导致一系列生理疾病,例如阿尔兹海默、肝硬化、胃粘膜损伤、动脉和肺高血压等。因此,有效地检测或监控生物样品或环境样品中的硫化氢已成为近年来相关领域的研究热点。
小分子硫化氢荧光探针法是利用荧光探针与硫化氢发生特异性识别的原理进行检测的,探针在与硫化氢分子发生反应之后会释放出荧光母核产生荧光,在荧光分光光度计的激发下,显示出荧光发射光谱,进而对荧光强度与硫化氢的浓度进行分析。此方法快速、灵敏以及较为准确,还可结合激光共聚焦成像技术,实现实时、原位的硫化氢检测,并显示出空间分布信息。
近红外硫化氢探针因具有较大的发射波长,可以有效地避免许多生物组织的自荧光现象,消除背景干扰,使其灵敏度及准确性都大大增强。一个合格的近红外探针不仅需要发射波长处于近红外区域,还需具有较大的斯托克斯位移(组织穿透能力强、光损伤小),较高的荧光量子产率(大于0.1)以及较低的检测限,满足体内外一定浓度范围内的硫化氢含量检测。因此,设计一种快速、灵敏、检测波长相对较长的荧光探针对于硫化氢的检测具有十分重要的意义。
技术实现要素:
本发明的目的之一是提供一种异佛尔酮类硫化氢荧光探针,具有相对较长的荧光发射波长,检测限低,响应时间短。
为实现上述目的,本发明提供的异佛尔酮类硫化氢荧光探针,结构如式i所示:
本发明的目的之二是提供式i所示的异佛尔酮类硫化氢荧光探针的制备方法,合成路线短,反应条件简单。
为实现上述目的,本发明提供的异佛尔酮类硫化氢荧光探针的制备方法,包括以下步骤:
(1)式ii化合物的制备:惰性气体保护下,将异佛尔酮(3,5,5-三甲基-2-环己烯酮)、丙二腈、哌啶加入反应瓶中,乙醇为溶剂,加热搅拌回流,tlc跟踪至反应结束,将反应液降至室温后倒入冰水中析出沉淀,抽滤,用正己烷对滤渣进行重结晶处理,得到式ii化合物;其中,所述的异佛尔酮与丙二腈的摩尔比为1:1~1:2;
(2)式iii化合物的制备:惰性气体保护下,将式ii化合物、对羟基苯甲醛及哌啶加入反应瓶中,乙醇为溶剂,加热搅拌回流,tlc跟踪至反应结束,将反应液降至室温,浓缩反应液,采用硅胶柱层析提纯,得到式iii化合物;其中,所述的式ii化合物与对羟基苯甲醛的摩尔比为1:1~2:1;
(3)式iv化合物的制备:惰性气体保护下,将式iii化合物、乌洛托品(六亚甲基四胺)加入反应瓶中,三氟乙酸为溶剂,加热搅拌回流,tlc跟踪至反应结束,将反应液降至室温后倒入6mhcl中搅拌10min,再用二氯甲烷进行萃取,饱和食盐水洗涤2~3次,取二氯甲烷层,用无水硫酸钠干燥,浓缩得粗品,采用硅胶柱层析提纯,得到式iv化合物;其中,所述的式iii化合物与乌洛托品的摩尔比为1:1~1:2;
(4)式i化合物的制备:将式iv化合物与2-噻吩甲酰氯、三乙胺加入反应瓶中,二氯甲烷为溶剂,室温搅拌反应,tlc跟踪至反应结束,浓缩反应液,采用硅胶柱层析提纯,得到式i所示的荧光探针纯品;其中,所述的式iv化合物与2-噻吩甲酰氯的摩尔比为1:1~1:2。
反应路线如下:
优选的,步骤(1)中tlc所用的展开剂是体积比为5:1的石油醚和乙酸乙酯的混合溶剂;步骤(2)中tlc所用的展开剂是体积比为30:1的二氯甲烷和乙酸乙酯的混合溶剂;步骤(3)中tlc所用的展开剂是体积比为2:1的石油醚和乙酸乙酯的混合溶剂;步骤(4)中tlc所用的展开剂是体积比为3:1的石油醚和乙酸乙酯的混合溶剂。
优选的,步骤(2)中硅胶柱层析所用的洗脱剂是体积比为50:1的二氯甲烷和乙酸乙酯的混合溶剂;步骤(3)中硅胶柱层析所用的洗脱剂是体积比为10:1的石油醚和乙酸乙酯的混合溶剂;步骤(4)中硅胶柱层析所用的洗脱剂是体积比为8:1的石油醚和乙酸乙酯的混合溶剂。
本发明的目的之三是提供式i所示的异佛尔酮类硫化氢荧光探针在检测生物硫化氢中的应用。
通过以下步骤实现:在待检测体系中加入式i所示的荧光探针,使其终浓度为10μm,37℃下孵育1小时,通过检测体系荧光强度实现检测目的;待检测体系选用血浆、匀浆液或细胞培养基,当待检体系为血浆或匀浆液时,通过荧光分光光度计记录荧光强度;当待检测体系为细胞培养基时,通过激光共聚焦显微镜观察活细胞荧光成像。
与现有技术相比,本发明具有如下有益效果:
(1)探针具有较大的荧光发射波长(662nm),能够有效避免来自生物大分子背景荧光的干扰,具有较大的斯托克斯位移(224nm),组织穿透能力强、光损伤小;
(2)探针本身无荧光,只有在与硫化氢反应后才有荧光,检测限低(48nm),灵敏度高,且响应时间短(15min);
(3)具有优秀的选择性,不受生命体中一些氨基酸等物质的干扰,能特异性地检测生物中的硫化氢;
(4)探针在不同ph条件下的稳定性好,且光稳定性好,能够长期保存使用;
(5)能自主进入ht22细胞,具有良好的生物膜通透性和低细胞毒性,适用于活细胞中硫化氢的检测;
(6)本发明的荧光探针合成路线短,反应条件温和,产率高,具有很大的实用价值。
附图说明
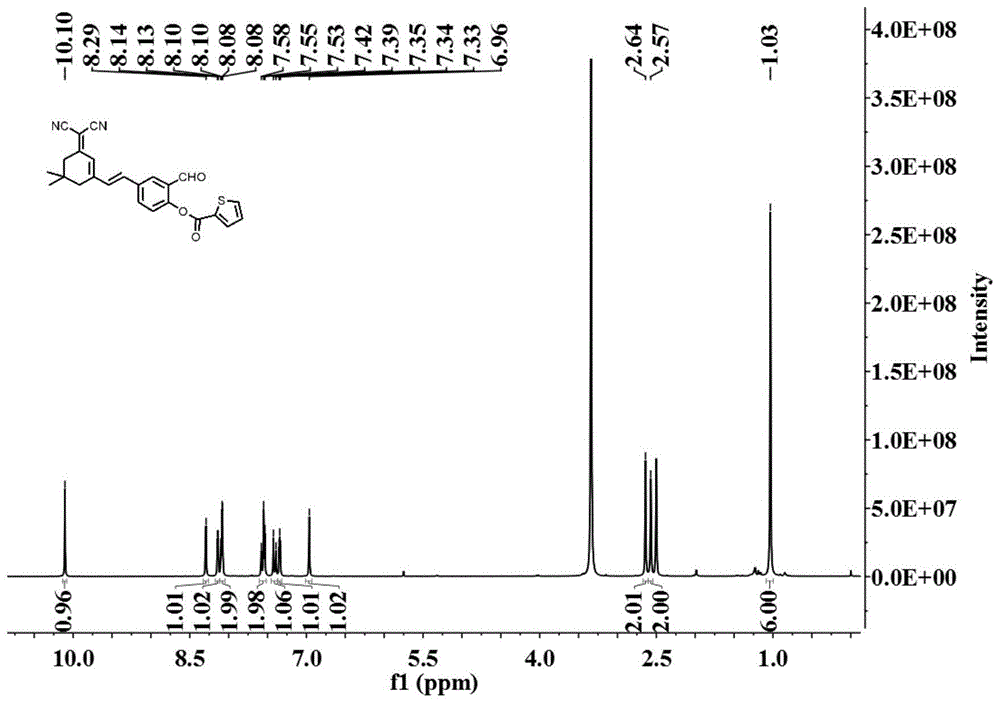
图1是本发明的荧光探针sfp-cho-thp的核磁共振氢谱图;
图2是本发明的荧光探针sfp-cho-thp的核磁共振碳谱图;
图3是本发明的荧光探针sfp-cho-thp的高分辨质谱图;
图4是本发明的荧光探针与硫化氢反应的机理示意图;
图5是本发明的荧光探针对生命体中一些含硫氨基酸等物质的选择性;
图6是本发明的荧光探针对生命体中一些不含硫氨基酸等物质的选择性;
图7是本发明的荧光探针对生命体中其他离子的选择性;
图8是本发明的荧光探针的荧光强度和硫化氢浓度变化的光谱图;
图9是本发明的荧光探针的荧光强度和硫化氢浓度变化的线性图;
图10是本发明的荧光探针的荧光强度和硫化氢反应时间变化的光谱图;
图11是本发明的荧光探针的荧光强度和硫化氢反应时间变化的线性图;
图12是本发明的荧光探针的荧光强度和ph变化的关系图;
图13是本发明的荧光探针与硫化氢反应前后的斯托克斯位移图;
图14是本发明的荧光探针光稳定性测试图;
图15是本发明的荧光探针在细胞培养24h后的细胞存活率图。
具体实施方式
下面结合附图和具体实施例对本发明作进一步详细说明。
实施例1异佛尔酮类硫化氢荧光探针的制备
(1)式ii化合物的制备
在50ml反应瓶中,依次加入丙二腈(1.90g,28.76mmol)、无水乙醇(30ml)以及哌啶(1.22g,14.38mmol),反应5-10min,加入异佛尔酮(2.00g,14.38mmol),在n2保护下,65℃反应,tlc监测(石油醚:乙酸乙酯=5:1,v/v),直至反应结束。8h后,反应结束,将反应液冷却至室温,倒入80ml冰水中,搅拌,有固体析出,抽滤,干燥,正己烷重结晶,得灰白色固体1.8g,即式ii化合物纯品,产率为66.6%。
(2)式iii化合物的制备
在50ml反应瓶中,依次加入式ii化合物(0.79g,4.24mmol)、无水乙醇(25ml)以及哌啶(0.81g,2.12mmol),反应5-10min,在n2保护下加入对羟基苯甲醛(780mg,6.36mmol),60℃反应,tlc监测(二氯甲烷:乙酸乙酯=30:1,v/v),直至反应结束。12h后,反应基本结束,将反应液直接旋干制沙,进行柱层析分离,洗脱剂为v(二氯甲烷):v(乙酸乙酯)=50:1,得到砖红色固体0.96g,即式iii化合物,产率为78.0%。
(3)式iv化合物的制备
称取式iii化合物(0.15g,0.52mmol)和乌洛托品(0.11g,0.78mmol)于25ml反应瓶中,以三氟乙酸(10ml)为反应溶剂,在惰性气体n2保护条件下,75℃回流反应,tlc监测(石油醚:乙酸乙酯=2:1,v/v),直至反应结束。6h后,反应基本结束,将反应液倒入盛有25ml6mhcl的烧杯中,搅拌10min,再用二氯甲烷进行萃取,饱和食盐水洗涤、搅拌,取二氯甲烷部分,无水硫酸钠干燥,旋干制沙,柱层析分离,洗脱剂为v(石油醚):v(乙酸乙酯)=10:1,得到黄色固体0.95g,即式iv化合物,产率为59.4%,命名为荧光母核sfp-cho-oh。
(4)式i化合物的制备
称取荧光母核式iv化合物(0.5g,1.57mmol)以及2-噻吩甲酰氯(0.46g,3.14mmol)于25ml反应瓶中,加入反应溶剂无水二氯甲烷(10ml),并且加入催化剂三乙胺(0.32g,3.14mmol),常温下进行反应,tlc监测(石油醚:乙酸乙酯=3:1),直至反应完全结束。8h后,反应基本结束,将反应液直接旋干制沙,柱层析分离,洗脱剂为v(石油醚):v(乙酸乙酯)=8:1,得到浅黄色固体0.48g,即为目标探针式i化合物,产率为72.0%,命名为探针sfp-cho-thp。
图1所示为制得的探针sfp-cho-thp的氢谱:1hnmr(500mhz,dmso)δ10.10(s,1h),8.29(s,1h),8.14(d,j=4.3hz,1h),8.09(dd,j=8.5,2.1hz,2h),7.55(t,j=11.5hz,2h),7.41(d,j=16.2hz,1h),7.37–7.32(m,1h),6.96(s,1h),2.64(s,2h),2.57(s,2h),1.03(s,6h).
图2所示为制得的探针sfp-cho-thp的碳谱:13cnmr(126mhz,dmso)δ189.41(s),170.33(s),159.74(s),155.26(s),150.65(s),135.73(s),134.99(d,j=26.9hz),134.84–134.77(m),134.21(s),131.22(s),130.44(s),128.82(s),128.42(s),124.56(s),123.64(s),113.74(s),112.92(s),77.22(s),42.29(s),38.16(s),31.71(s),27.47(s).
图3所示为制得的探针sfp-cho-thp的高分辨质谱:hrms(esi)calculatedforc25h19n2o3s-(m-h+)427.1116,found427.1121.
实施例2光学性能检测方法
(1)光学性能检测所需的溶液配制
荧光母核的储存液配制:使用十万分之一的分析天平称取荧光母核3.2mg,将其倒入10ml容量瓶中,dmso定容,将其配制成浓度为1.0mmol的荧光母核储存液,并将其放置于冰箱中低温避光保存。
荧光探针的储存液的配制:使用十万分之一的分析天平称取荧光探针4.3mg,将其倒入10ml容量瓶中,dmso定容,将其配制成浓度为1.0mmol的荧光探针储存液,并将其放置于冰箱中低温避光保存。
其它干扰性生物学物质储存液的配制:将l-半胱氨酸(cys)、谷胱甘肽(gsh)、高半胱氨酸(hcy)、so32-,s2o32-,so42-,na2s4,hso3-,ser,pro,val,arg,leu,gly,tyr,phe,met,his,trp,thr,ala,glu,gln,thr,na+,mg2+,ca2+,k+,al3+,fe3+,f-,cl-,i-,clo-,scn-,no3-,co32-,hco3-,h2po4-,no2-等按照类似的方法配制,但溶剂使用双蒸水。配制成1.0mmol的储存液,放置在冰箱中低温避光保存。
硫化氢钠(na2s)溶液的配制:使用十万分之一的分析天平称取24.0mg的九水硫化钠,将其迅速倒入10ml容量瓶中,双蒸水快速定容,将其配制成10mmol的溶液,再根据需要将其稀释成所需要的浓度。现配现用,保证其质量。
500ml的pbs磷酸盐缓冲液(10mm)的配制:分别称取nacl(4g),kcl(0.1g),na2hpo4(0.72g)以及kh2po4(0.12g)溶解到500ml烧杯中,蒸馏水定容,得10mm的pbs磷酸盐缓冲溶液。用1mm的naoh和hcl溶液调节所需ph(3-10)。
(2)探针sfp-cho-thp对硫化氢的选择性
向纯探针溶液中加入l-半胱氨酸(cys)、谷胱甘肽(gsh)、高半胱氨酸(hcy)、so32-,s2o32-,so42-,na2s4,hso3-等含硫干扰物质,37℃下孵育1h后分别在荧光分光光度计上进行测定,测试结果如图5所示。
探针sfp-cho-thp在诸多含硫氨基酸等物质中,只与硫化钠反应在最大发射波长662nm左右放出荧光,其它物质基本不响应。当干扰物质的浓度增加到1mm,探针也不与它们响应,且在高浓度干扰物质与硫化钠同时存在下,探针sfp-cho-thp与硫化钠反应之后的荧光强度基本没有什么变化。
向纯探针溶液中加入ser,pro,val,arg,leu,gly,tyr,phe,met,his,trp,thr,ala,glu,gln,thr,na+,mg2+,ca2+,k+,al3+,fe3+,f-,cl-,i-,clo-,scn-,no3-,co32-,hco3-,ch3coo-,h2po4-,no2-,o2-,-oh,h2o2等不含硫氨基酸干扰物质,37℃下孵育15min后分别在荧光分光光度计上进行测定,测试结果如图6、图7所示。
其它干扰物质如无机盐离子(no3-,al3+,scn-等)、其它氨基酸(phe,leu,arg等)以及活性物质(o2-,h2o2等)都不与探针sfp-cho-thp发生响应。
以上结果都说明探针sfp-cho-thp对硫化氢具有非常好的选择性,它可以不受生物体内复杂的背景或其它物质的干扰,能够有效的检测硫化氢的含量变化。
反应机制是荧光探针分子中的2-噻吩甲酰基与硫化氢分子发生专一性化学反应后,2-噻吩甲酰基从母核分子脱离,荧光母核的荧光性质恢复(如图4所示)。
(3)探针sfp-cho-thp与硫化氢响应的浓度线性关系及检测限的测定
首先是空白样品(即未加入na2s的探针sfp-cho-thp溶液)的荧光光谱测量,连续检测10次,并计算出其10次荧光强度数值的标准偏差(σ)。之后测定了探针sfp-cho-thp与不同浓度的硫化钠(0-100μm)在37℃恒温水浴锅中反应之后的荧光光谱变化,整个测定过程中探针sfp-cho-thp的浓度为10μm。
如图8所示,随着硫化钠的浓度逐渐增加,探针sfp-cho-thp与硫化钠反应之后的荧光强度不断增强,荧光强度与浓度成正向增加关系。
由图9还可看出,在硫化钠浓度为0-20μm的浓度范围内,荧光强度与硫化氢浓度呈现非常好的线性关系,相关系数r2为0.99854。
根据文献的检测限计算公式:检测限=3σ/k(k为此线性回归方程的斜率),得出探针sfp-cho-thp具有非常低的检测限(48nm),由此可看出,此探针足以用于检测生理浓度或病理浓度下的硫化氢含量变化。
(4)探针sfp-cho-thp与硫化氢的反应时间线性关系及响应时间的测定
测定了探针sfp-cho-thp与硫化钠在37℃恒温水浴锅中分别反应0,1,2,3,4,5,6,7,8,9,10,11,12,13,14和15分钟之后的荧光光谱变化,整个测定过程中探针sfp-cho-thp的浓度为10μm,硫化钠的浓度为100μm。
如图10和图11所示,随着反应时间逐渐增加,探针sfp-cho-thp与硫化钠反应之后的荧光强度不断增强,且荧光强度在15分钟后基本不发生变化,说明探针sfp-cho-thp在15分钟内与硫化氢已经反应完全。由此可看出,探针sfp-cho-thp具有非常快的响应时间(15min)。
(5)探针sfp-cho-thp与硫化氢在不同ph条件下的响应检测
测定了探针sfp-ch-thp在较广ph范围(3-10)内的pbs磷酸盐缓冲液中与硫化氢反应之后的荧光光谱。
如图12所示,在ph为3-7的范围内,探针与硫化氢反应之后的荧光强度逐渐增强,且变化较大。而当ph在生理范围内,探针sfp-cho-thp能够正常检测硫化氢。此外,探针sfp-cho-thp在生理ph范围内,不加入硫化钠时基本不发生荧光,相对稳定,几乎不受ph的影响。这些结果说明,探针sfp-cho-thp在生理或偏碱条件下可以检测硫化氢的含量变化,且探针本身在不同ph条件下具有较好的稳定性。
(6)探针sfp-cho-thp的斯托克斯位移研究
测定了探针sfp-cho-thp与硫化氢反应之后的斯托克斯位移。
如图13所示,探针与硫化钠反应之后的最大吸收波长在438nm左右,最大发射波长在662nm左右,可得出其斯托克斯位移为224nm,数值很大。由此说明,探针sfp-cho-thp具有很大的斯托克斯位移,抗背景干扰能力强,具有较大的生物学应用价值。
(7)探针sfp-cho-thp的光稳定性
检测了探针sfp-cho-thp在紫外(uv)和可见光照射下的稳定性。由图14所示,在30min之内,单独探针的荧光值基本没变化,且在30min之后,探针加入na2s孵育,探针在uv和可见光的荧光值都基本达到了最大值,且强度基本一致。由此说明,探针sfp-cho-thp的光稳定性较好。
实施例3探针sfp-cho-thp的细胞毒性实验(cck-8法)
为保证探针sfp-cho-thp在组织成像和组织硫化氢的检测,本申请采用cck-8法对探针进行了细胞(ht22)毒性方面的检测。首先进行实验准备,将探针sfp-cho-thp稀释成不同浓度,留取待用,每个浓度设置6个复孔。将ht22细胞(由徐州医科大学神经生物学研究中心提供)接种于96孔板里,每孔的细胞为5000,100μl/孔,培养条件为5%co2,37℃。待ht22细胞长至合适的密度时,向孔中加入事先准备好的不同浓度的探针,进行孵育,时间为24h。孵育过后,向每个孔中加入10μl的cck8溶液进行孵育(1-4h),当孵育结束后,通过酶标仪(elx808iu,bio-tekinstrumentsinc,usa)在450nm处测定各个孔的吸光度,最终处理数据,绘制曲线。测定三次,每个样品设有6个复孔。
细胞存活率的公式:细胞活力(%)=[a(加药)-a(空白)]/[a(0加药)-a(空白)]×100,式中,
a(加药):具有细胞、cck-8溶液和药物溶液的孔的吸光度
a(空白):具有培养基和cck-8溶液而没有细胞的孔的吸光度
a(0加药):具有细胞、cck-8溶液而没有药物溶液的孔的吸光度
细胞活力:细胞增殖活力或细胞毒性活力
如图15所示,在不同浓度(5,10,20,40和80μm)探针sfp-cho-thp的孵育下,小鼠海马神经元细胞(ht22)的存活率都较高,与control组相比没有统计学差异,表明探针在此浓度范围内对小鼠海马神经元细胞(ht22)几乎没有毒性。
- 还没有人留言评论。精彩留言会获得点赞!