一株产多种广谱抗菌代谢物的植物乳杆菌及其应用的制作方法
本发明属于微生物技术领域,涉及一株产多种广谱抗菌代谢物的植物乳杆菌及其应用。
背景技术:
鲜切水果,尤其是水果拼盘和水果沙拉,因其方便、美味、新鲜、营养,且安全、健康,越来越受到人们的青睐,市场额逐年增长至十几亿美元。在我国,尽管鲜切水果工业起步晚,但近年来,随着人们生活水平的提高、生活节奏的加快,以及冷链系统、餐饮业和零售业的快速发展,鲜切水果市场占有率也正快速地上升。然而,一些研究表明,鲜切水果可能比新鲜水果具有更高的食源性疾病风险。因此,鲜切水果消费量增加的同时,由他们引起的食源性疾病爆发风险也随之增加。在我国每年发生的细菌性食物中毒占中毒事件的30%-90%。鲜切水果中的食源性致病菌包括沙门属(salmonellaspp.)、致病性大肠杆菌(escherichiacoli)、单核细胞增生李斯特菌(listeriamonocytogenes)、金黄色葡萄球菌(staphylococcusaureus)、假单胞菌属(pseudomonasspp.)、弯曲杆菌属(campylobacterspp.)、阪崎肠杆菌(cronobacter)、小肠结肠炎耶尔森氏菌(yersiniaenterocolitica)和其他致病性肠杆菌属等。其中,由沙门属、致病性大肠杆菌和单核细胞增生李斯特菌引起的食源性疾病爆发频率最高,疾病预防控制中心(cdc)将其列为鲜切水果中最受关注致病菌。这些食源性致病菌严重影响了鲜切水果的安全性。随着人们安全意识的逐渐增强,控制鲜切产品中致病菌的生长和繁殖成为亟待解决的关键问题。
鲜切产品工业普遍使用含氯物质进行消毒,如naocl、clo2、cl2等。但是,一方面,含氯物质并不能完全有效地失活致病菌;另一方面,氯易与洗涤液中的有机质发生反应,生成三氯甲烷、卤乙酸等致癌有毒物质。一些欧洲国家,如丹麦、德国、荷兰,已禁止在鲜切产品工业使用氯。因此,鲜切果蔬工业需要一种可替代氯的高效、安全、健康的消毒剂,以控制食源性致病菌,保障鲜切果蔬食品安全。
乳酸菌是一类“gras”安全等级微生物,乳酸菌代谢物通常也被认为具有“gras”安全等级。乳酸菌通过产生双乙酰、细菌素、有机酸、过氧化氢等物质抑制腐败菌和病原菌的生长达到延缓食品腐败、延长食品保藏期的目的,在我国已经具有悠久的使用历史。关于乳酸菌抑菌代谢物的研究已经很多,绝大多数都是乳酸菌发酵过程中分泌到培养液里面的成分,如双乙酰、细菌素、有机酸、环二肽等。
技术实现要素:
本发明的目的之一在于提供一株乳酸菌,菌体本身及其代谢物具有广谱抗菌活性;目的之二在于提供该乳酸菌的抗菌代谢物的制备方法;目的之三在于提供该乳酸菌及其抗菌代谢物的用途。
经研究,本发明提供如下技术方案:
1.植物乳杆菌(lactobacillusplantarum)ms031,保藏编号为cgmccno.17711。
本发明的植物乳杆菌ms031是从家庭自制传统发酵的泡菜水中分离获得,于2019年5月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号),保藏编号为cgmccno.17711,分类命名为植物乳杆菌(lactobacillusplantarum)。
2.植物乳杆菌ms031或其菌悬液或其发酵液在制备抗菌或/和防腐产品中的应用。
进一步,所述抗菌或/和防腐产品同时抑制革兰氏阳性菌和革兰氏阴性菌。
进一步,所述抗菌或/和防腐产品抑制大肠埃希氏菌(escherichiacoli)、铜绿假单胞菌(pseudomonasaeruginosa)、沙门氏菌(salmonella)、阪崎克罗诺肠杆菌(enterobactersakazakii)、单核细胞增生李斯特菌(listeriamonocytogenes)、金黄色葡萄球菌(staphylococcusaureus)和粪肠球菌(enterococcusfaecalis)中的任一种或多种。
其中,大肠埃希氏菌、铜绿假单胞菌、沙门氏菌、阪崎克罗诺肠杆菌为革兰氏阴性菌,单核细胞增生李斯特菌、金黄色葡萄球菌和粪肠球菌为革兰氏阳性菌。
3.植物乳杆菌ms031产生的细菌素类物质,采用以下方法获得:将植物乳杆菌ms031接种到mrs液体培养基中静置培养,所得菌悬液使用ph吸附—甲醇解析法或ph吸附—ph解析法制取细菌素类物质;
所述ph吸附—甲醇解析法是将菌悬液调节ph值至5.5-6.2,搅拌使细菌素吸附到菌体表面,离心,获得的菌体沉淀悬浮于90-98vol%甲醇中,调节ph值至1.8-2.2,搅拌,离心,分别收集上清液和菌体沉淀,菌体沉淀再重复上述甲醇解析操作0-2次,合并上清液,调节ph值至4.0-5.0,除去甲醇,即得细菌素类物质;
所述ph吸附—ph解析法是将菌悬液70℃水浴加热以杀死菌体和钝化酶活,调节ph值至5.5-6.2,搅拌使细菌素吸附到菌体表面,离心,获得的菌体沉淀悬浮于缓冲液中,调节ph值至1.8-2.2,搅拌,离心,分别收集上清液和菌体沉淀,菌体沉淀再重复上述ph解析操作0-2次,合并上清液,调节ph值至4.0-5.0,即得细菌素类物质。
进一步,所述ph吸附—甲醇解析法是将菌悬液调节ph值至5.9,搅拌使细菌素吸附到菌体表面,离心,获得的菌体沉淀悬浮于95vol%甲醇中,调节ph值至2.0,搅拌,离心,分别收集上清液和菌体沉淀,菌体沉淀再重复上述甲醇解析操作1次,合并2次上清液,调节ph值至5.0,除去甲醇,即得细菌素类物质。
进一步,所述ph吸附—ph解析法是将菌悬液70℃水浴加热以杀死菌体和钝化酶活,调节ph值至5.9,搅拌使细菌素吸附到菌体表面,离心,获得的菌体沉淀悬浮于0.2m柠檬酸溶液中,调节ph值至2.0,搅拌,离心,分别收集上清液和菌体沉淀,菌体沉淀再重复上述ph解析操作2次,合并3次上清液,调节ph值至5.0,即得细菌素类物质。
4.植物乳杆菌ms031的菌体表面吸附代谢物,采用以下方法获得:将植物乳杆菌ms031接种到mrs液体培养基中静置培养,离心,获得的菌体沉淀使用93-98vol%甲醇提取,离心,分别收集上清液和菌体沉淀,菌体沉淀再重复上述甲醇提取操作0-2次,合并上清液,除去甲醇,即得植物乳杆菌ms031的菌体表面吸附代谢物。
进一步,所述植物乳杆菌ms031的菌体表面吸附代谢物采用以下方法获得:将植物乳杆菌ms031接种到mrs液体培养基中静置培养,离心,获得的菌体沉淀使用95vol%甲醇提取,离心,分别收集上清液和菌体沉淀,菌体沉淀再重复上述甲醇提取操作1次,合并2次上清液,除去甲醇,即得植物乳杆菌ms031的菌体表面吸附代谢物。
5.植物乳杆菌ms031分泌到发酵液中的代谢物,采用以下方法获得:将植物乳杆菌ms031接种到mrs液体培养基中静置培养,离心,上清液用乙酸乙酯萃取,收集中间层,除去乙酸乙酯,即得植物乳杆菌ms031分泌到发酵液中的代谢物。
6.植物乳杆菌ms031产生的细菌素类物质或/和植物乳杆菌ms031的菌体表面吸附代谢物或/和植物乳杆菌ms031分泌到发酵液中的代谢物在制备抗菌或/和防腐产品中的应用。
进一步,所述抗菌或/和防腐产品抑制革兰氏阳性菌或/和革兰氏阴性菌。
进一步,所述抗菌或/和防腐产品抑制鲜切果蔬食源性致病菌或/和腐败菌。
进一步,所述鲜切果蔬食源性致病菌包括但不限于沙门氏菌、大肠杆菌和单核细胞增生李斯特菌。
本发明的有益效果在于:本发明公开了植物乳杆菌(lactobacillusplantarum)ms031,菌体本身具有广谱抗菌活性,还能够产生多种抗菌活性代谢物,包括能够抑制革兰氏阳性菌的细菌素类物质和能够同时抑制革兰氏阳性菌和革兰氏阴性菌的广谱抗菌代谢物,可用于制备抗菌或/和防腐产品。这些广谱抗菌代谢物分别吸附于菌体表面和分泌到发酵液中,能够有效抑制鲜切果蔬中单核细胞增生李斯特菌、沙门氏菌、大肠杆菌等多种食源性致病菌的生长,且对革兰氏阴性菌的抑制作用强于革兰氏阳性菌,该特点能够弥补目前大多数抗菌剂对革兰氏阴性菌无作用的缺点,具有良好的应用前景。
附图说明
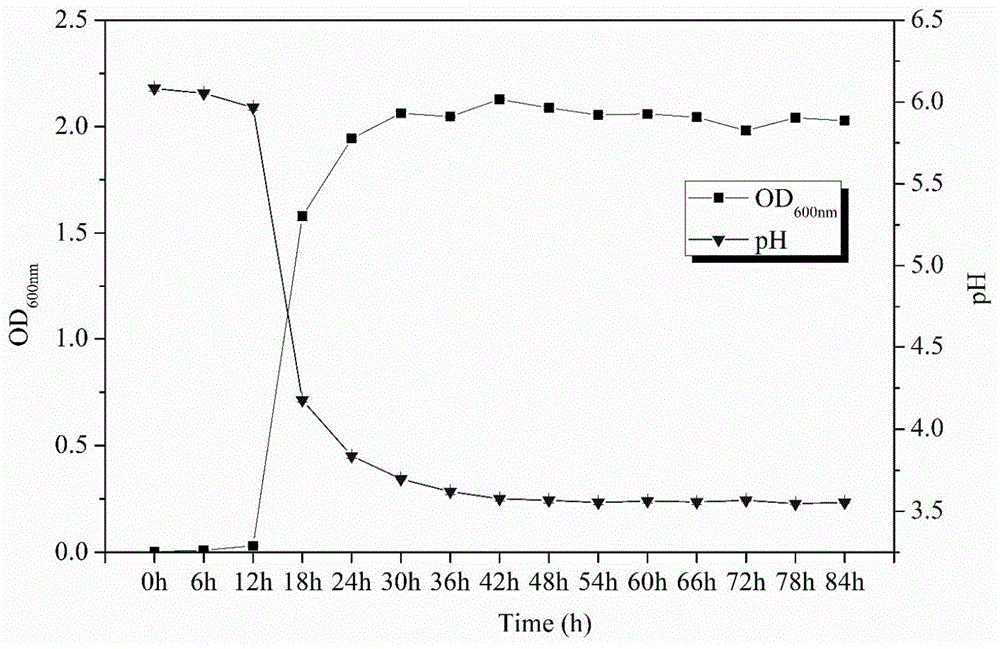
图1为植物乳杆菌ms031生长曲线及发酵液ph值的变化。
图2为植物乳杆菌ms031菌体对7种致病菌的抑菌活性。其中a为指示菌金黄色葡萄球菌,代表g+细菌;b为指示菌大肠杆菌,代表g-细菌;c为7种致病菌的抑菌圈统计,标注不同英文字母(a、b、c)的数据之间存在显著差异(p<0.05)。
图3为植物乳杆菌ms031细菌素类物质、菌体表面吸附代谢物和分泌到发酵液中代谢物的抑菌活性。其中a为指示菌金黄色葡萄球菌,代表g+细菌;b为指示菌大肠杆菌,代表g-细菌;“ph”是指发酵液ph吸附-ph解析法制得的细菌素类物质;“甲醇”是指发酵液ph吸附-甲醇解析法制得的细菌素类物质;“菌体”是指发酵液离心后菌体用甲醇萃取获得的菌体表面吸附代谢物;“乙酸乙酯”是指除去菌体后的发酵液使用乙酸乙酯萃取获得的分泌到发酵液中代谢物。
图4为植物乳杆菌ms031广谱抗菌代谢物混合物对鲜切水果致病菌混合物的抑制作用。其中a为菌落总数;b为大肠杆菌活菌数;c为单核细胞增生李斯特菌活菌数;d为沙门氏菌活菌数。
具体实施方式
为了使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明的优选实施例进行详细的描述。
实施例1:乳酸菌的分离与鉴定
(1)微生物菌株的分离
用灭菌生理盐水以10倍的稀释梯度对泡菜水样品进行稀释。分别取100μl10-2、10-3、10-4、10-5稀释度的泡菜水稀释液涂布到mrs固体培养基上,37℃恒温培养48h。挑取乳酸菌单菌落,进一步采用划线分离法对特征菌落进行反复地分离纯化,记录各菌落的形态特征并采用革兰氏染色镜检,观察。
所述mrs固体培养基按质量百分含量计由以下成分组成:葡萄糖2%、蛋白胨1%、牛肉膏1%、酵母膏0.5%、乙酸钠0.5%、吐温800.1%、柠檬酸氢二胺0.1%、硫酸镁0.02%、硫酸锰0.005%、琼脂粉1.5%、余量为蒸馏水。
ms031菌株菌落形态特征:在mrs琼脂平板上菌落形状为圆形、表面光滑且稍微凸起,菌落颜色为浅乳白色。
ms031菌株个体形态特征:革兰氏阳性(g+),短杆状,单个或成对,无芽孢,无鞭毛。
(2)ms031菌株的生长曲线
挑取ms031菌株单菌落接种于10ml液体mrs培养基中,37℃、150rpm过夜培养,作为种子菌。以0.1wt%的接种量将种子菌接种到3l液体mrs培养基中,30℃静置培养72h。培养期间,每隔6h取样100ml,测定菌悬液的ph值,同时使用分光光度计测定od600nm吸光值。
结果如图1所示,ms031菌株具有典型的生长曲线,在前12h处于延迟期,12-24h处于对数生长期,24h以后进入稳定期。在整个发酵过程中,发酵液的ph值从ph6.1逐步降低,最后稳定在ph3.5左右。
(3)微生物菌株的鉴定:
将ms031菌株接种于mrs液体培养基中,37℃培养12h。按
获得的ms031菌株的16srdna序列如seqidno.3所示,在ncbi数据库中进行blast比对分析,结果显示,ms031菌株与植物乳杆菌(lactobacillusplantarum)的identity=99%(>97%)。因此,ms031菌株为植物乳杆菌(lactobacillusplantarum),将其命名为ms031,于2019年5月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号),保藏号为cgmccno.17711。
实施例2:植物乳杆菌ms031的抗菌活性
(1)菌体的抗菌活性
使用双层划线法测定菌体的抗菌活性。将植物乳杆菌ms031接种到mrs液体培养基中培养至od600nm=0.8,用接种环将菌悬液划线到mrs琼脂平板上(2条平行线,长度约2cm),37℃恒温培养12h,再将10ml含有106cfu/ml指示菌(金黄色葡萄球菌、单核细胞增生李斯特菌、粪肠球菌、大肠杆菌、沙门氏菌、铜绿假单胞菌、阪崎克罗诺肠杆菌)的lb琼脂培养基(0.7wt%琼脂)倾注到mrs琼脂平板表面,37℃恒温培养24h,观察抑菌圈大小。
结果如图2所示,植物乳杆菌ms031对测定的3株革兰氏阳性致病菌和4株革兰氏阴性致病菌均展现出强抑菌圈,抑菌活性强弱大致为:大肠杆菌>沙门氏菌>阪崎克罗诺肠杆菌>单核细胞增生李斯特菌>铜绿假单胞菌>粪肠球菌>金黄色葡萄球菌,说明植物乳杆菌ms031菌体本身具有广谱抗菌活性。
(2)细菌素类物质、菌体表面吸附代谢物和分泌到发酵液中代谢物的抗菌活性
挑取植物乳杆菌ms031单菌落接种于5mlmrs液体培养基中,37℃、150rpm过夜培养,作为种子菌;以0.1wt%的接种量将种子菌接种到200mlmrs液体培养基中,30℃静置培养60h;所得菌悬液分成2份,分别使用ph吸附—甲醇解析法和ph吸附—ph解析法制取细菌素类物质:
①ph吸附—甲醇解析法:取100ml菌悬液,使用5mnaoh调节ph值至5.9,过夜搅拌使细菌素吸附到菌体表面,离心(4℃,9000rpm,15min),菌体沉淀悬浮于95vol%甲醇中,调节ph值至2.0,搅拌,离心,分别收集上清液和菌体沉淀,菌体沉淀重复上述甲醇解析操作1次,合并2次上清液,调节ph值至5.0,旋转蒸发除去甲醇,即得细菌素类物质;
②ph吸附—ph解析法:取100ml菌悬液,70℃水浴加热20min以杀死菌体和钝化酶活,使用5mnaoh调节ph值至5.9,过夜搅拌使细菌素吸附到菌体表面,离心(4℃,9000rpm,15min),菌体沉淀悬浮于0.2m柠檬酸缓冲溶液中,调节ph值至2.0,搅拌,离心(4℃,9000rpm,15min),分别收集上清液和菌体沉淀,菌体沉淀再重复上述ph解析操作2次,合并3次上清液,调节ph值至5.0,即得细菌素类物质。
挑取植物乳杆菌ms031单菌落接种于5mlmrs液体培养基中,37℃、150rpm过夜培养,作为种子菌;以0.1wt%的接种量将种子菌接种到300mlmrs液体培养基中,30℃静置培养60h,离心(4℃,8000rpm,15min),菌体沉淀使用95vol%甲醇提取,离心,分别收集上清液和菌体沉淀,菌体沉淀再重复上述甲醇提取操作1次,合并2次上清液,旋转蒸发除去甲醇,获得菌体表面吸附代谢物。
挑取植物乳杆菌ms031单菌落接种于5mlmrs液体培养基中,37℃、150rpm过夜培养,作为种子菌;以0.1wt%的接种量将种子菌接种到100mlmrs液体培养基中,30℃静置培养60h,离心(4℃,8000rpm,15min),上清液用乙酸乙酯萃取,收集中间层乳白液,旋转蒸发除去乙酸乙酯,获得分泌到发酵液中代谢物。
以金黄色葡萄球菌和大肠杆菌为指示菌,使用牛津杯法测定植物乳杆菌ms031细菌素类物质、菌体表面吸附代谢物和分泌到发酵液中代谢物的抗菌活性。结果如图3所示,植物乳杆菌ms031产生的细菌素类物质只对革兰氏阳性菌金黄色葡萄球菌有抑菌活性,而对革兰氏阴性菌大肠杆菌并未展现出抑菌活性,该结果与已商业化细菌素nisin类似;其菌体表面吸附代谢物对金黄色葡萄球菌和大肠杆菌都具有明显的抑菌活性;分泌到发酵液中代谢物也同时抑制金黄色葡萄球菌和大肠杆菌,说明植物乳杆菌ms031的菌体表面吸附代谢物和分泌到发酵液中代谢物均具有广谱抗菌活性。
实施例3:植物乳杆菌ms031广谱抗菌代谢物混合物对鲜切水果中多种食源性致病菌的抑制作用
采用实施例2中所述方法分别制备植物乳杆菌ms031的菌体表面吸附代谢物和分泌到发酵液中代谢物,将二者混合,用树脂脱色后,获得植物乳杆菌ms031广谱抗菌代谢物混合物,按照如下步骤测定其控制鲜切水果中多种致病菌的能力:
(1)在本地超市购买新鲜水果进行切块处理,分别称取500g放入9个2l烧杯中;
(2)将植物乳杆菌ms031广谱抗菌代谢物混合物的浓度调节到1mic浓度;
(3)将培养至od600nm=0.1的单核细胞增生李斯特菌、沙门氏菌和大肠杆菌分别重新悬浮到pbs缓冲液中至浓度为106cfu/ml,再将这3种菌悬液按照体积比1:1:1混合,获得致病菌混合物;
(4)取步骤(1)中6个装有鲜切水果的烧杯,分别倒入步骤(3)的致病菌混合物,浸泡5min后捞出鲜切水果;其中3份含致病菌的鲜切水果用步骤(2)的广谱抗菌代谢物混合物浸泡10min,为抗菌物处理组;另外3份含致病菌的鲜切水果用等体积的pbs缓冲液浸泡10min,为无抗菌物处理组;步骤(1)中剩余的3份鲜切水果用pbs缓冲液浸泡15min,为对照组;
(5)从第0天开始,每隔24h取样检测1次,每组每份水果取样20g,一共检测10天;检测方法为:将水果样品使用无菌剪刀剪碎后放在离心管中,并在离心管中加入10ml无菌生理盐水,然后在涡旋振荡仪上震荡1分钟,取1ml样液到2ml离心管中,用生理盐水进行10倍梯度稀释,每个样品稀释到10-7;3组分别选择4个合适的稀释度,吸取50μl稀释液分别涂布于lb培养基;同时,将抗菌物处理组和无抗菌物处理组的稀释液分别涂布于沙门氏菌选择性培养基(亚硫酸铋琼脂培养基)、大肠杆菌选择性培养基(麦康凯培养基)和单核细胞增生李斯特菌选择性培养基(palcam培养基),每个稀释度重复3个平板,涂布完成后,将平板放至37℃培养12-24h,选择30-300个菌落之间的稀释度进行菌落计数。
结果如图4所示,对于菌落总数(图4a),对照组的鲜切水果随着贮藏时间的延长,菌落总数逐渐增加并接近无抗菌物处理组;与无抗菌物处理组相比,抗菌物处理组的菌落总数在第0天和第1天位于检测限以下,第2-10天始终稳定地减少了大于3log10cfu/ml,即抗菌物处理能够减少大于99.9%的菌落总数。对于大肠杆菌(图4b),无抗菌物处理组随着贮藏时间的增加,大肠杆菌活菌数略微降低,但始终保持在较高水平,而抗菌物处理组,在10天贮藏期内,大肠杆菌活菌数始终保持在检测限以下。对于单核细胞增生李斯特菌(图4c),抗菌物处理组的单核细胞增生李斯特菌活菌数在0-5天贮藏期内逐渐增加,6-10天趋于稳定,最终和无抗菌物处理组相比,减低了1.68log10cfu/ml活菌数。对于沙门氏菌(图4d),无抗菌物处理组随着贮藏时间的增加,沙门氏菌活菌数略微降低,但始终保持在较高水平,而抗菌物处理组,在10天贮藏期内,沙门氏菌活菌数始终保持在检测限以下。由此可见,植物乳杆菌ms031广谱抗菌代谢物混合物能够完全抑制革兰氏阴性致病菌(大肠杆菌、沙门氏菌)的生长,而对革兰氏阳性致病菌(单核细胞增生李斯特菌)具有一定程度的抑制作用。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管通过参照本发明的优选实施例已经对本发明进行了描述,但本领域的普通技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离所附权利要求书所限定的本发明的精神和范围。
序列表
<110>西南大学
<120>一株产多种广谱抗菌代谢物的植物乳杆菌及其应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
agagtttgatcctggctcag20
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
ctacggctaccttgttacga20
<210>3
<211>1181
<212>dna
<213>植物乳杆菌ms031(lactobacillusplantarumms031)
<400>3
ccccaatgggggcgtgctaatacatgcaagtcgaacgaactctggtattgattggtgctt60
gcatcatgatttacatttgagtgagtggcgaactggtgagtaacacgtgggaaacctgcc120
cagaagcgggggataacacctggaaacagatgctaataccgcataacaacttggaccgca180
tggtccgagtttgaaagatggcttcggctatcacttttggatggtcccgcggcgtattag240
ctagatggtggggtaacggctcaccatggcaatgatacgtagccgacctgagagggtaat300
cggccacattgggactgagacacggcccaaactcctacgggaggcagcagtagggaatct360
tccacaatggacgaaagtctgatggagcaacgccgcgtgagtgaagaagggtttcggctc420
gtaaaactctgttgttaaagaagaacatatctgagagtaactgttcaggtattgacggta480
tttaaccagaaagccacggctaactacgtgccagcagccgcggtaatacgtaggtggcaa540
gcgttgtccggatttattgggcgtaaagcgagcgcaggcggttttttaagtctgatgtga600
aagccttcggctcaaccgaagaagtgcatcggaaactgggaaacttgagtgcagaagagg660
acagtggaactccatgtgtagcggtgaaatgcgtagatatatggaagaacaccagtggcg720
aaggcggctgtctggtctgtaactgacgctgaggctcgaaagtatgggtagcaaacagga780
ttagataccctggtagtccataccgtaaacgatgaatgctaagtgttggagggtttccgc840
ccttcagtgctgcagctaacgcattaagcattccgcctggggagtacggccgcaaggctg900
aaactcaaaggaattgacgggggcccgcacaagcggtggagcatgtggttttaattcgaa960
gctacgcgaagaaaccttaccaggtctttgacatactatgcaatctaagagattagacgt1020
ttcctttcggggacatggatacagtgtgcatggatgtcgttcagctcgtgtcgtgagatg1080
tgggttaagtcccgcaacgagaccgcaactctttattatcagttagccaagcaatagttg1140
gtcacctcctgggtgagactggcggtgaacaaaacccgtac1181
- 还没有人留言评论。精彩留言会获得点赞!