一种RNA检测与定量的方法与流程
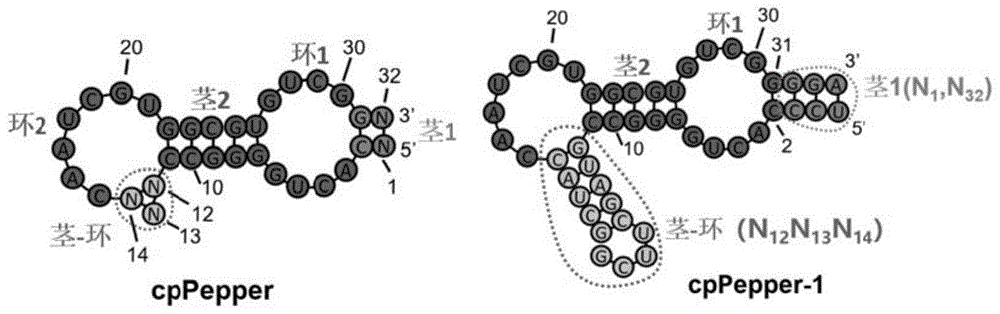
本发明涉及一种适配体核酸分子,该适配体核酸分子用于检测细胞内或者细胞外的rna、dna或者其他靶分子的方法,以及包含该适配体的试剂盒。本发明的适配体可以特异性结合一种荧光团小分子,并显著提高其在合适波长光激发下的荧光强度。
背景技术:
:在所有的生物大分子中,rna展示出了种类最为繁多的细胞生物学功能。在生物的中心法则中,rna作为遗传物质的传递者(信使rna)、蛋白质合成的模板(核糖体rna)和氨基酸运输工具(转移rna),组成了一连串的生理过程,最终实现基因的转录与表达。过去的几十年里,rna在多种生命活动中发挥至关重要的功能被科学家们逐渐发掘出来,包括很多rna-蛋白质复合体,如端粒酶、剪接酶、核酶和核糖开关等。此外,近些年来一些非编码rna,如短链干扰rna(sirna)、小微rna(microrna)和长链非编码rna(lncrna)等,在转录后水平上对于基因表达的调控发挥着不可替代的作用。实时监测细胞中rna的运输和代谢过程对于研究rna的定位与基因表达以及细胞调控过程的关系是至关重要的。目前有科学家们已经鉴定出了几种机理可以导致rna的不同亚细胞定位,如主动运输、被动扩散,锚定等。在很多极性细胞特别是神经细胞中,mrna的空间特异性表达与神经元的可塑性、学习和记忆都密切相关。因此,rna的这些调控过程一旦被损坏就会引起神经元功能紊乱和神经系统疾病。生物大分子标记技术是生物分子成像的关键。在科学历史上,人们利用荧光蛋白“点亮”细胞内蛋白质,实现了生命动态过程中蛋白质分子的可视化。荧光蛋白技术是当代生物科学研究中最重要的研究工具之一;在短短十余年内,其研究即被授予诺贝尔奖。rna同样具有独特的结构、种类繁多的生物学功能以及复杂的时间空间分布。与蛋白质相比,rna种类更多,大部分种类结构功能尚未鉴定,被称为基因组中的“暗物质”。不同种类的rna及其修饰形式的鉴定、功能与调控研究现已经成为了国际前沿。rna研究也迫切需要一种类似于荧光蛋白这样的颠覆性标记技术,这是深入研究rna功能机制极为有用的工具。rna荧光原位杂交技术是长期以来被广泛用于来研究rna在细胞内水平与分布的方法,它是通过分子杂交对特异rna分子进行荧光标记,进而进行成像的技术。然而其操作较复杂且含有洗脱步骤,只能用于固定化细胞亦即死细胞的研究,不能用于实时监测活细胞中rna的动态变化过程。分子信标技术是最早发展起来的活细胞rna成像技术。它是利用在5’和3’末端自身形成发夹结构的茎环双标记寡核苷酸探针,当其与靶标rna结合后,标记在一端的淬灭基团对荧光基团的淬灭作用消除,荧光基团产生荧光,或者两端荧光基团的fret消失。然而分子信标存在着荧光信号偏低、进细胞困难、易降解、较严重的细胞核内非特异性聚集、易受rna二级结构的影响且需要对每条rna专门定制寡核苷酸探针等缺点,这些缺点限制了该技术的广泛应用。目前用于活细胞rna成像的方法主要是利用rna结合蛋白与荧光蛋白融合技术,其中最典型的是mcp-fps系统,mcp-fps可以特异性识别结合融合了多拷贝ms2序列的mrna分子,通过检测荧光蛋白的信号实时监测mrna的合成及分布(ozawaetal.naturemethods2007.4:413-419)。但由于未结合mrna分子的mcp-fps会产生很高的本底荧光,使得该方法的信噪比很低。随后,科学家们将mcp-fps融合蛋白加上核定位信号,使得没有与mrna分子结合的gfp-ms2定位细胞核中,一定程度降低了细胞浆中的非特异荧光,增加了检测的信噪比,但依然存在一定的非特异性荧光。除了rna结合蛋白-荧光蛋白技术检测细胞rna外,科学家们一直在寻找一个类似gfp的rna荧光标签用于rna成像。科学家们构建了一个荧光团-淬灭剂结合体,当荧光团的适配体(aptamer)与荧光团结合时,淬灭剂就不能将荧光团的荧光信号淬灭,此时适配体-荧光团-淬灭剂构成的复合物是有荧光的。当荧光团的适配体不存在时,荧光团的荧光信号就会被淬灭剂淬灭。基于这样的原理,科学家们实现了对细菌中mrna的成像(aroraetal.nucleicacidsresearch2015.21:e144)。此外,人们还开发了一个称为image(intracellularmultiaptamergenetic)的标签,它由两种不同的适配体-小分子复合物构成。当小分子结合到rna序列中的适配体上时,相邻的两个小分子所携带的荧光团就会发生荧光共振能量转移(fret)现象,通过检测荧光信号的变化就可以检测细胞中rna情况。然而这两种方法目前均没有在哺乳动物细胞中实现对rna的实时监测。2011年s.jaffrey课题组获得了一个称为“spinach”的核酸适配体,它可以特异性结合一个荧光团(3,5-difluoro-4-hydroxybenzyli-deneimidazolinone,dfhbi),使得其荧光得到显著增加(paigeetal.science2011.333:642-646;stracketal.naturemethods2013.10:1219-1224)。“spinach”的突变体“spinach2”有着更好的稳定稳定性,它提供了一个很好的工具用于遗传编码标记活细胞中的rna。该课题组将”spinach”中的一个茎环结构换成可以特异性结合细胞代谢物的核酸适配体,开发了基于spinach-dfhbi复合物的可以检测细胞代谢物的工具(paigeetal.science2012.335:1194)。到目前为止,该方法已被成功用于分监测和分析细菌、酵母和哺乳动物细胞中的rna动态变化。随后,该课题组还开发了corn-dfho复合物用于检测哺乳动物细胞rna聚合酶iii启动子的活性检测(songetal.naturechemicalbiology2017.13:1187-1194)。然而,该方法还存在以下缺点大大限制了它的广泛应用:(1)适配体-荧光团复合物的结合能力较弱,其解离常数(kd)为几十到几百nm;(2)适配体-荧光团形成的复合物的荧光信号不稳定,极容易发生淬灭,使得其荧光信号不宜被检测(hanetal.journaloftheamericanchemicalsociety2013.135:19033-19038);(3)目前为止,光谱只有绿色和黄色,缺乏更长波长的光谱对活体动物体内的rna进行成像(songetal.journaloftheamericanchemicalsociety2014.136:1198-1201);(4)corn为二聚体,可能会干扰靶标rna的功能;(5)目前还没有其他的适配体-荧光团复合物,不能同时监测细胞中的多条rna。综上所述,目前使用的rna标记技术都存在各自的明显的缺点。mcp-fps标记技术存在着非结合的本底荧光强,信噪比低。基于单荧光团-核酸适配体的rna标记技术看起来是非常完美的rna标记技术,然而受限于当前的荧光团(dfhbi,dfhbi-1t,dfho)与核酸适配体形成的复合体的性质不理想,该技术也没有被广泛使用。因此,科研界和产业界一直都需要更加有效的荧光团-核酸适配体复合物,能克服此前荧光团-核酸适配体复合物的缺点,用于活细胞中的rna或dna的实时标记。发明的简述本发明提供了一种核酸适配体分子,编码该核酸适配体分子的dna分子,一种核酸适配体分子与荧光团分子的复合物,以及该复合物的用途。本发明提供的技术方案如下:1.本发明涉及一种核酸适配体分子,所述适配体分子包含下述核苷酸序列(a)、(b)或(c):(a)核苷酸序列n1cacuggcgccn12-n13-n14caaucguggcgugucggn32(称为通式cppepper结构),其中n1、n12、n13、n14和n32代表长度≧1个的核苷酸片段,并且n1与n32核苷酸序列中至少有一对碱基形成互补配对,n12与n14核苷酸序列中至少有一对碱基形成互补配对;(b)与(a)限定的核苷酸序列具有至少70%同一性的核苷酸序列;(c)在(a)限定的核苷酸序列中不包括n1、n12、n13、n14和n32的位置,经过一个或几个核苷酸的取代、缺失和/或添加,且具有适配体功能的由(a)衍生的核酸适配体分子。2.根据(1)所述的核酸适配体分子,其中与(a)所述的cppepper结构核苷酸序列具有至少75%,76%,78%,80%,82%,85%,87%,90%,93%,95%,96%,97%,98%,99%或100%同一性的序列。3.根据(1)所述的核酸适配体分子,其中核苷酸序列(c)是在(a)限定的cppepper结构核苷酸序列中不包括n1、n12、n13、n14和n32的位置,经过10个、9个、8个、7个、6个、5个、4个、3个、2个或1个核苷酸的取代、缺失和/或添加而得到的核酸适配体分子。4.根据(3)所述的核酸适配体分子,其中核苷酸序列(c)是在(a)限定的核苷酸序列中不包括n1、n12、n13、n14和n32的位置,经过7个、6个、5个、4个、3个、2个或1个核苷酸的取代而得到的核酸适配体分子。5.根据(1)所述的核酸适配体分子,其中核苷酸序列(a)中的n1与n32互补配对时,n1核苷酸序列的方向为5’-3’,n32核苷酸序列的方向为3’-5’;n12与n14互补配对时,n12核苷酸序列的方向为5’-3’,n14核苷酸序列的方向为3’-5’。6.根据(5)所述的核酸适配体分子,其中当n1与n32中的至少一条片段的长度≥5个核苷酸碱基时,则n1与n32核苷酸序列中至少有两对碱基形成互补配对;当n12与n14中的至少一条片段的长度≥5个核苷酸碱基时,则n12与n14核苷酸序列中至少有两对碱基形成互补配对。7.根据(1)-(6)任一项所述的核酸适配体分子,其中对通式cppepper结构的核苷酸取代选自下组中的一种:c8g、c8u、g9u、c10g、c10u、c11a、c11u、c15a、c15u、a16u、a16g、a16c、a17g、a17c、u18a、u18g、u18c、c19a、c19u、g20c、u21a、g23a、g23u、c24g、c24a、c24u、g25c、u26a、u26g、c29u、g30u、g30c、c2a/g31u、c2u/g31a、c2g/g31c、c11u/g22a、c11g/g22c、c11a/g22u、c2g/g31c/c15a、c2g/g31c/a16c、c2g/g31c/a17c、c2g/g31c/g20c、c2g/g31c/c24u、c2g/g31c/u26g、c2g/g31c/c8u、c2g/g31c/c10g、c2g/g31c/c11u、c2g/g31c/c11u/g22a、c2g/g31c/c11g/g22c、c2g/g31c/c11a/g22u、c2a/g31u/c11u/g22a、c2a/g31u/c11g/g22c、c2a/g31u/c11a/g22u、c2u/g31a/c11u/g22a、c2u/g31a/c11g/g22c、c2u/g31a/c11a/g22u、c2g/g31c/c11g/g22c/c15a、c2g/g31c/c11g/g22c/a16c、c2g/g31c/c11g/g22c/a17c、c2g/g31c/c11g/g22c/g20c、c2g/g31c/c11g/g22c/c24u、c2g/g31c/c11g/g22c/u26g、c2g/g31c/c11g/g22c/c8u、c2g/g31c/c11g/g22c/c10g、c2g/g31c/c11g/g22c/u18g/c8u、c2g/g31c/c11a/g22u/u18g/c8u、c2g/g31c/c11g/g22c/u21a/u26g/c8u和c2g/g31c/c11a/g22u/u21a/u26g/c8u。8.根据(7)所述的核酸适配体分子,其中对通式cppepper结构的核苷酸取代选自下组中的一种:c15a、c15u、a16c、a17c、c19u、g20c、u21a、c24g、c24u、u26g、c8u、c10g、c11u、c2a/g31u、c2u/g31a、c2g/g31c、c11u/g22a、c11g/g22c、c11a/g22u、c2g/g31c/c15a、c2g/g31c/a16c、c2g/g31c/a17c、c2g/g31c/g20c、c2g/g31c/c24u、c2g/g31c/u26g、c2g/g31c/c8u、c2g/g31c/c10g、c2g/g31c/c11u、c2g/g31c/c11u/g22a、c2g/g31c/c11g/g22c、c2g/g31c/c11a/g22u、c2a/g31u/c11u/g22a、c2a/g31u/c11g/g22c、c2a/g31u/c11a/g22u、c2u/g31a/c11u/g22a、c2u/g31a/c11g/g22c、c2u/g31a/c11a/g22u、c2g/g31c/c11g/g22c/c15a、c2g/g31c/c11g/g22c/a16c、c2g/g31c/c11g/g22c/a17c、c2g/g31c/c11g/g22c/g20c、c2g/g31c/c11g/g22c/c24u、c2g/g31c/c11g/g22c/u26g、c2g/g31c/c11g/g22c/c8u、c2g/g31c/c11g/g22c/c10g、c2g/g31c/c11g/g22c/u18g/c8u和c2g/g31c/c11a/g22u/u18g/c8u。9.根据(8)所述的核酸适配体分子,其中对通式cppepper结构的核苷酸取代选自下组中的一种:c15a、c15u、a16c、a17c、c19u、g20c、u21a、c24g、c24u、u26g、c8u、c10g、c11u、c2a/g31u、c2u/g31a、c2g/g31c、c11u/g22a、c11g/g22c、c11a/g22u、c2g/g31c/c15a、c2g/g31c/a16c、c2g/g31c/a17c、c2g/g31c/g20c、c2g/g31c/c24u、c2g/g31c/u26g、c2g/g31c/c8u、c2g/g31c/c10g、c2g/g31c/c11u、c2g/g31c/c11u/g22a、c2g/g31c/c11g/g22c、c2g/g31c/c11a/g22u、c2a/g31u/c11u/g22a、c2a/g31u/c11g/g22c、c2a/g31u/c11a/g22u、c2u/g31a/c11u/g22a、c2u/g31a/c11g/g22c和c2u/g31a/c11a/g22u。10.根据(1)-(9)所述的核酸适配体分子,其中核苷酸序列(a)中的n1与n32处的核苷酸序列为f30或trna脚手架rna序列。11.根据前述任一项所述的核酸适配体分子,其中的适配体分子是rna分子或经碱基修饰的rna分子。12.根据前述任一项所述的核酸适配体分子,其中的适配体分子是dna-rna杂交分子或经碱基修饰的dna-rna分子。13.根据前述任一项所述的核酸适配体分子,其中的n12-n13-n14包含一个可以识别靶标分子的核苷酸序列。14.根据(13)所述的核酸适配体分子,其中的靶标分子包括但不限于:蛋白质,核酸,脂质分子,碳水化合物,激素,细胞因子,趋化因子,代谢物金属离子。15.根据(13)或(14)所述的核酸适配体分子,其中的n12-n13-n14为可以识别gtp和腺苷分子的核苷酸序列。16.根据前述任一项所述的核酸适配体分子,所述的适配体功能是指核酸适配体能提高荧光团分子在合适波长激发光下的荧光强度至少2倍,至少5-10倍,至少20-50倍,至少100-200倍或者提高至少500-1000倍。17.据(1)所述的核酸适配体分子,其中还可包含可以结合多个荧光团分串联体,所述串联体通过适当长度的间隔序列连在一起,个数可以是2、3、4、5、6、7、8或者更多。所述串联体的核苷酸可选自但不限于序列seqidno:6、7、8,9、10、11、12、13、14或15。18.根据任一项所述的核酸适配体分子,其中的核酸适配体分子具有序列seqidno:1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,21,22,23或24。19.一种核酸适配体分子与荧光团分子的复合物,其中所述的核酸适配体分子为(1)-(17)任一项所述核酸适配体分子,所述的荧光团分子具有下述式(i)所述的结构:其中:d-为x1o-或n(x2)(x3)-;x1、x2、x3各自独立地选自氢、1-10个碳的直链或支链烷基和改性烷基,x2、x3任选相互连接为饱和或不饱和的环;r-选自氢、氰基、羧基、酰胺基、酯基、羟基、1-10个碳的直链或支链烷基或改性烷基;ar1、ar2各自独立地选自单环芳亚基、单环杂芳亚基,或由单环芳基、单环杂芳基中的一种或两种稠合组成的具有2-3个环结构的芳香亚基;其中:ar1、ar2中的氢原子可以独立地被f、cl、br、i、羟基、硝基、醛基、羧基、氰基、磺酸基、硫酸基、磷酸基、氨基、伯氨基、仲氨基、1-10个碳的直链或支链烷基和改性烷基取代;其中:以上所述改性烷基为烷基的任意碳原子被选自f、cl、br、i、-o-、-oh、-co-、-no2、-cn、-s-、-so2-、-(s=o)-、叠氮基、亚苯基、伯氨基、仲氨基、叔氨基、季铵盐基、环氧乙烷、琥珀酸酯、异氰酸酯、异硫氰酸酯、酰氯、磺酰氯、饱和或不饱和的单环或双环亚环羟基、桥联酯杂环中的至少一种基团置换所得的基团,所述改性烷基具有1-10个碳原子,其中碳碳单键任选独立地被碳碳双键或碳碳三键置换;其中,复合物中的核酸适配体分子与荧光团分子分别存在于单独的溶液中,或者核酸适配体分子与荧光团分子在同一溶液中。20.如19所述的荧光团分子的复合物,所述改性烷基含有选自-oh、-o-、乙二醇单元、单糖单元、二糖单元、-o-co-、-nh-co-、-so2-o-、-so-、me2n-、et2n-、-s-s-、-ch=ch-、f、cl、br、i、-no2和氰基中的至少一种基团;可选地,荧光团分子含有的芳香环选自下式(ⅱ-1)~(ⅱ-15)中的结构:可选地,荧光团分子选自下式化合物:21.根据(20)所述的复合物,其中的荧光团分子选自iii-1、iii-2、iii-3、iii-4、iii-5、iii-6、iii-7、iii-8、iii-9、iii-10、iii-11、iii-12、iii-13、iii-14、iii-15、iii-16、iii-17、iii-18、iii-19、iii-20和iii-21。22.根据(19)-(21)任一项所述的复合物,其中复合物中的适配体分子包含核苷酸序列seqidno:1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,21,22,23或24。23.一种(19)-(22)任一项所述的复合物用于体外或体内目标核酸分子的检测或标记。24.一种(19)-(22)任一项所述的复合物用于细胞外或细胞内靶标分子的检测或标记。25.一种(19)-(22)任一项所述的复合物用于对基因组dna进行成像。26.一种(19)-(22)任一项所述的复合物用于检测细胞中mrna与蛋白质含量的关系。27.一种dna分子,其转录(1)-(18)任一项所述的核酸适配体分子。28.一种表达载体,其包含(27)所述的dna分子。29.一种宿主细胞,其包含(28)所述的表达系统。30.一种试剂盒,包含技术方案1-18任一项所述的核酸适配体分子和/或技术方案28所述的表达载体和/或技术方案29所述的宿主细胞和/或技术方案19-22任一项所述的复合物。31.一种检测靶标分子的方法,包括步骤:a)在包含靶标分子的溶液中加入技术方案(19)-(22)任一项任一项所述的复合物;b)用合适波长的光激发复合物;c)检测复合物的荧光。32.一种检测基因组dna的方法,包含技术方案(19)-(22)任一项所述复合物对基因组dna进行成像。33.一种提取与纯化rna的方法,包含利用技术方案(19)-(22)任一项所述复合物提取与纯化rna。本发明人设计了全新的核酸适配体分子,并合成全新的荧光团分子,组成全新的荧光团-核酸适配体复合物,适配体分子结合荧光团分子之后可以显著提高荧光团分子在合适波长激发光下的荧光强度,能有效用于活细胞中的rna/dna实时标记。本发明的核酸适配体对荧光团分子具有很强的亲和力,并展现出了不同的荧光光谱和很好的光与温度稳定性。这些核酸适配体-荧光团分子复合物可以对原核和真核细胞中rna/dna进行实时标记与成像,或用于rna的提取与纯化的标签等作用。附图说明图1.核酸适配体分子的二级结构预测。左图为预测的cppepper的通用结构,包括可以形成茎结构的n1和n32,可以形成茎环结构的n12、n13和n14。右图为预测的cppepper-1的结构,n1和n32的碱基序列如图中茎1所对应的虚线框所示,n12、n13和n14的碱基序列如茎环所对应的虚线框所示。图2.f30-cppepper-1的二级结构预测。图3.trna-cppepper-2的二级结构预测。图4.f30-cppepper-1-iii-3复合物的荧光激发光谱和发射光谱。图5.不同碱基修饰的cppepper对iii-3的激活效果。“对照”是利用缓冲液替换cppepper-3或cppepper-4适配体。图6.不同cppepper串联体对iii-3的激活效果。(a)按照“串联1”方式获得cppepper串联体;(b)不同按照“串联1”方式获得cppepper串联体对iii-3的激活效果;(c)按照“串联2”方式获得cppepper串联体;(d)不同按照“串联2”方式获得cppepper串联体对iii-3的激活效果;(e)按照“串联3”方式获得cppepper串联体;(f)不同按照“串联3”方式获得cppepper串联体对iii-3的激活效果。图7.f30-cppepper-1-iii-3复合物用于细菌中rna的标记效果;图8.f30-cppepper-1-iii-3复合物用于酵母细胞中rna的标记效果;图9.cppepper与iii-3及其类似物用于哺乳动物细胞中rna的标记的标记效果(a)f30-cppepper-1-iii-3复合物用于哺乳动物细胞中rna的标记效果;(b)f30-8cppepper-5与iii-3类似物在哺乳动物细胞中标记rna的效果。图10.基于cppepper-1的探针构建。(a)腺苷探针的检测效果;(b)gtp探针的检测效果。图11.cppepper用于示踪细胞中rna定位。(a)cppepper用于检测gapdhmrna的定位;(b)cppepper用于检测tmed2mrna的定位。图12.cppepper用于检测基因组dna的成像结果。图13.cppepper可用于rna的提取与纯化的标签的检测结果。发明详述本发明在此通过对使用下述定义和实施例的引用进行详细描述。所有在本文中提及的专利和公开文献的内容,包括在这些专利和公开中披露的所有序列,明确地通过提述并入本文。下文中,“核苷酸”与“核苷酸碱基”互换使用,表示相同意思。核酸适配体分子本发明所述的“核酸适配体分子”也称为“适配体分子”。该核酸适配体分子包含(a)核苷酸序列为n1cacuggcgccn12-n13-n14caaucguggcgugucggn32(对应于图1的通式cppepper结构);或(b)与(a)所述的核苷酸序列具有至少70%同一性的序列;其中n1与n32核苷酸序列中至少有一对碱基形成反向互补配对,即n1核苷酸序列的方向为5’-3’,n32核苷酸序列的方向为3’-5’。当n1与n32至少一条核苷酸碱基长度≤4时,需要至少一对碱基形成互补配对;当n1与n32至少一条核苷酸碱基长度≥5时,需要至少两对碱基形成互补配对。其中n12与n14核苷酸序列中至少有一对碱基形成反向互补配对,即n12核苷酸序列的方向为5’-3’,n14核苷酸序列的方向为3’-5’。当n12与n14至少一条核苷酸碱基长度≤4时,需要至少一对碱基形成互补配对;当n12与n14至少一条核苷酸碱基长度≥5时,需要至少两对碱基形成互补配对。其中n13为任意长度任意组成的核苷酸碱基;或(c)在所述的核苷酸序列(a)的任一位置经过1-7个核苷酸的取代、缺失和/或增加。核酸适配体分子包含对通式cppepper结构的核苷酸的取代,该取代选自下组中的一种:c8g、c8u、g9u、c10g、c10u、c11a、c11u、c15a、c15u、a16u、a16g、a16c、a17g、a17c、u18a、u18g、u18c、c19a、c19u、g20c、u21a、g23a、g23u、c24g、c24a、c24u、g25c、u26a、u26g、c29u、g30u、g30c、c2a/g31u、c2u/g31a、c2g/g31c、c11u/g22a、c11g/g22c、c11a/g22u、c2g/g31c/c15a、c2g/g31c/a16c、c2g/g31c/a17c、c2g/g31c/g20c、c2g/g31c/c24u、c2g/g31c/u26g、c2g/g31c/c8u、c2g/g31c/c10g、c2g/g31c/c11u、c2g/g31c/c11u/g22a、c2g/g31c/c11g/g22c、c2g/g31c/c11a/g22u、c2a/g31u/c11u/g22a、c2a/g31u/c11g/g22c、c2a/g31u/c11a/g22u、c2u/g31a/c11u/g22a、c2u/g31a/c11g/g22c、c2u/g31a/c11a/g22u、c2g/g31c/c11g/g22c/c15a、c2g/g31c/c11g/g22c/a16c、c2g/g31c/c11g/g22c/a17c、c2g/g31c/c11g/g22c/g20c、c2g/g31c/c11g/g22c/c24u、c2g/g31c/c11g/g22c/u26g、c2g/g31c/c11g/g22c/c8u、c2g/g31c/c11g/g22c/c10g、c2g/g31c/c11g/g22c/u18g/c8u、c2g/g31c/c11a/g22u/u18g/c8u、c2g/g31c/c11g/g22c/u21a/u26g/c8u和c2g/g31c/c11a/g22u/u21a/u26g/c8u(即表1中的适配体分子结构)。这些突变体能特异性结合荧光团分子,并在结合之后可以显著提高荧光团分子在合适波长激发光下的荧光强度。其中核苷酸的位置序列对应于图1中的位置。上述的突变表示在通式cppepper结构的适配体核苷酸序列的相应位点发生核苷酸替换,如c15a表示cppepper的第3位胞嘧啶核苷酸c被取代为腺嘌呤核苷酸a,也即表1中的cppepper(c15a);c2g/g31c表示cppepper的第2位c被取代为g,同时第31位g被取代为c,也即表1中的cppepper(c2g/g31c)。表1:cppepper通式结构经过7个、6个、5个、4个、3个、2个或1个核苷酸取代的适配体结构适配体分子是单链核酸分子,它们有着一个或多个碱基配对区域(茎)以及一个或多个非配对的区域(环)构成的二级结构(图1)。本发明所述的核酸适配体分子包含一个如图1所预测的二级结构。该二级结构含有2个环结构、2个茎结构和一个茎-环结构,其中茎1是起到稳定整个核酸适配体分子结构的作用,可以被替换成其他可以形成茎结构的任意长度任意组成的核苷酸碱基对。所述茎1结构的5’端或3’端可以与任意目标rna分子融合,用于细胞外或细胞内检测目标rna分子。在本发明一优选的实施方案中,核酸适配体分子的5’端融合5srna序列(genebank:nr_023377.1);在本发明另一优选的实施方案中,核酸适配体分子的5’端融合gapdhrna序列(genebank:bc009081)。图1中的茎-环结构起到稳定整个核酸适配体分子结构的作用,可以被替换成其他可以形成茎-环结构的任意长度任意组成的核苷酸碱基对。本发明所述的适配体分子还可包含插入到n12-n13-n14位置的其他核苷酸序列,该插入的核苷酸序列替换图1中的茎-环结构。所述核苷酸序列可以特异性识别/结合靶标分子。当靶标分子不存在时,所述适配体分子与荧光团分子的结合能力弱,导致荧光团分子显示弱荧光;当靶标分子存在时,靶标分子与所述适配体的结合会促进所述适配体与荧光团分子的结合,显著提高荧光团分子在合适波长激发光下的荧光。所述靶标分子可以是一种小分子、一种细胞表面的信号分子等。这些核酸适配体与特定的靶标分子通过非共价结合,这种非共价结合主要是依赖分子间的离子力、偶极力、氢键、范德华力、正负电子相互作用、堆积作用或者以上几种作用力的结合。所述茎-环结构可被替换成识别靶标分子的rna序列,用于细胞外或细胞内检测靶标分子。在本发明一优选的实施方案中,适配体分子的茎-环结构可以结合gtp分子;在本发明另一优选的实施方案中,茎-环结构可以结合腺苷分子。本发明优选的实施方案中,所述核酸适配体分子优选为seqidno:1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,21,22,23或24,或者可以结合荧光团分子显著提高其在合适波长激发光下荧光的它们的突变序列。本发明所述的核酸适配体分子还可包含一段增加其稳定性的核苷酸序列。在本发明的一优选的实施方案中,采用f30脚手架rna(序列2),其与所述核酸适配体分子的连接方式如图2所示;在在本发明的另一优选的实施方案中,采用trna脚手架rna(序列3),其与所述核酸适配体分子的连接方式如图3所示。本发明中所述的“核酸适配体分子”是一种rna分子,或者部分核苷酸被替换成脱氧核糖核苷酸的dna-rna杂交分子。其中的核苷酸可以是它们的d和l对映体形式,同时也包含它们的衍生物,包括但不限于2’-f,2’-氨基,2’-甲氧基,5’-iodo,5’-溴-修饰的多聚核苷酸。核酸包含各种修饰的核苷酸。同一性“同一性”在本发明中描述两个核苷酸序列之间的相关性。本发明的两个适配体核苷酸序列的同一性计算中不包括(a)序列中的n1、n12、n13、n14、n32。就本发明而言,两个核苷酸序列之间的同一性程度使用如emboss软件包(emboss:theeuropeanmolecularbiologyopensoftwaresuite,rice等,2000,trendsingenetics16:276-277)的needle程序,优选3.0.0版或更高版本中执行的needleman-wunsch算法(needleman和wunsch,1970,j.mol.biol.48:443-453)来确定。使用的任选参数为缺口罚分(gappenalty)10,缺口延伸罚分(gapextensionpenalty)0.5和eblosum62取代矩阵(blosum62的emboss版)。使用needle标记为“最高同一性(longestidentity)”(使用-nobrief选项获得)的输出结果作为百分比同一性,并计算如下:(相同的残基×100)/(比对长度-比对中缺口的总数)。如本发明表1中cppepper(c15a)和cppepper(c15u)的序列为n1cacuggcgccn12-n13-n14aaaucguggcgugucggn32和n1cacuggcgccn12-n13-n14uaaucguggcgugucggn32,对它们同一性比对的时候,按照本发明的定义,应不包含n1、n12-n13-n14和n32的核苷酸碱基,因此它们的序列同一性比对结果为96.3%(相差1个核苷酸)。荧光团分子本发明所述的“荧光团分子”也称为“荧光团”或“荧光分子”。“荧光团分子”在本发明中是一类可被条件性激活的荧光团分子。它们在没有核酸适配体的情况下显示出较低的量子产率。在具体的实施方式中,当没有与特定适配体结合时,荧光团的量子产率低于0.1,更优的低于0.01,最优的低于0.001;当荧光团被特定适配体结合后,荧光团的量子产率提高2倍以上,更优的提高10倍以上,最优的提高100倍以上。荧光团分子优选水溶性的,对细胞无毒且易穿透膜的。本发明的荧光团优选能够通过主动运输或者被动扩散通过细胞膜或细胞壁进入细胞浆或细胞周质。在本发明的实施方式中,荧光团可以透过革兰氏阴性菌的外膜和内膜,植物细胞的细胞壁和细胞膜,真菌和细胞壁和细胞膜,动物细胞的细胞膜,以及活体动物的gi和内皮细胞膜。本发明所述的核酸适配体分子可以特异性结合一种荧光团,显著增加其在特定波长激发下的荧光值。所述荧光团分子选自结构(ⅰ):(ι)其中:d-为x1o-或n(x2)(x3)-,x1、x2、x3各自独立地选自氢、1-10个碳的直链或支链烷基和改性烷基,x2、x3任选相互连接为饱和或不饱和的环;r-选自氢、氰基、羧基、酰胺基、酯基、羟基、1-10个碳的直链或支链烷基或改性烷基;ar1、ar2各自独立地选自单环芳亚基、单环杂芳亚基,或由单环芳基、单环杂芳基中的一种或两种稠合组成的具有2-3个环结构的芳香亚基;其中:ar1、ar2中的氢原子可以独立地被f、cl、br、i、羟基、硝基、醛基、羧基、氰基、磺酸基、硫酸基、磷酸基、氨基、伯氨基、仲氨基、1-10个碳的直链或支链烷基和改性烷基取代;其中:以上所述改性烷基为烷基的任意碳原子被选自f、cl、br、i、-o-、-oh、-co-、-no2、-cn、-s-、-so2-、-(s=o)-、叠氮基、亚苯基、伯氨基、仲氨基、叔氨基、季铵盐基、环氧乙烷、琥珀酸酯、异氰酸酯、异硫氰酸酯、酰氯、磺酰氯、饱和或不饱和的单环或双环亚环羟基、桥联酯杂环中的至少一种基团置换所得的基团,所述改性烷基具有1-10个碳原子,其中碳碳单键任选独立地被碳碳双键或碳碳三键置换;可选地,上述荧光团分子含有的改性烷基为含有选自-oh、-o-、乙二醇单元、单糖单元、二糖单元、-o-co-、-nh-co-、-so2-o-、-so-、me2n-、et2n-、-s-s-、-ch=ch-、f、cl、br、i、-no2、氰基中的至少一种基团;可选地,上述荧光团分子含有的芳香环选自下式(ⅱ-1)~(ⅱ-15)中的结构:可选地,上述荧光团分子选自下式化合物:本发明优选的实施方案中,所述荧光团分子包含iii-1、iii-2、iii-3、iii-4、iii-5、iii-6、iii-7、iii-8、iii-9、iii-10、iii-11、iii-12、iii-13、iii-14、iii-15、iii-16、iii-17、iii-18、iii-19、iii-20和iii-21。“提高荧光信号”、“荧光增加”、“提高荧光强度”、“增加荧光强度”在本发明中指合适波长激发光照射下荧光团量子产率的提高,或者荧光信号最大发射峰的迁移(相对乙醇或者水溶液中荧光团本身的发射峰),或者摩尔消光系数的增加,或者以上的两种或更多。在本发明一优选实施方式中,量子产率的增加至少是2倍;在本发明另一优选实施方式中,量子产率的增加至少是5-10倍;在本发明另一更优选实施方式中,量子产率的增加至少是20-50倍;在本发明另一更优选实施方式中,量子产率的增加至少是100-200倍;在本发明另一更优选实施方式中,量子产率的增加至少是500-1000倍;在本发明另一更优选实施方式中,量子产率的增加至少是1000-10000倍;在本发明另一更优选实施方式中,量子产率的增加大于10000倍;用于激发荧光团产生荧光信号的光源可以是任意合适的光照设备,如包括led灯、白炽灯、荧光灯、激光;激发光既可以是直接从这些设备中发出,也可以间接通过其他荧光团获取,如fert的供体荧光团,或bret的供体发光团。靶标分子本发明所述的靶标分子可以是任意的生物材料或者小分子,包括但不限于:蛋白质,核酸(rna或者dna),脂质分子,碳水化合物,激素,细胞因子,趋化因子,代谢物金属离子等。靶标分子可以是与疾病或者病原菌感染相关的分子。通过在本发明所述的适配体分子,如图1左图所示的结构中,该插入的核苷酸序列替换了图1左图中的n12、n13、n14的茎-环结构,该核苷酸序列可以特异性识别/结合靶标分子。当靶标分子不存在时,适配体分子与荧光团分子不结合或结合能力弱,不能显著提高荧光团分子在合适波长激发光下的荧光;当靶标分子存在时,靶标分子与所述核苷酸序列的结合会促进适配体分子与荧光团分子的结合,显著提高荧光团分子在合适波长激发光下的荧光,实现对靶标分子的检测、成像和定量分析。靶标分子也可以是整个细胞或表达在整个细胞表面的分子。典型的细胞包括但不限于癌症细胞、细菌细胞,真菌细胞以及正常动物细胞。靶标分子也可以是病毒颗粒。目前很多的上述靶标分子的适配体被鉴定出来,它们可以被整合本发明中的多价核酸适配体中。目前已报道的可以结合靶标分子的rna适配体包括但不限于:t4rna聚合酶适配体,hiv逆转录酶适配体,噬菌体r17衣壳蛋白适配体。在本发明的一个优选的实施方案中,靶标分子为腺苷(adenosine),其对应的识别靶标分子的探针序列如seqidno:16;本发明的一个优选的实施方案中,靶标分子为gtp,其对应的识别靶标分子的探针序列如seqidno:17。目标核酸分子“目标核酸分子”又称“靶标核酸分子”是指待检测的核酸分子,可以是细胞内的,也可以是细胞外的;包括目标rna分子和目标dna分子。本发明通过将目标核酸分子与所述核酸适配体分子连接,通过荧光团分子与核酸适配体分子结合,显著提高荧光团分子在合适波长激发光下的荧光值,进而实现检测目标核酸分子的含量与分布的目的。“目标rna分子”在本发明中包括任意的rna分子,包括但不限于pre-mrna,编码细胞本身或外源表达产物的mrna,pre-rrna,rrna,trna,hnrna,snrna,mirna,sirna,shrna,sgrna,crrna,长链非编码rna,噬菌体衣壳蛋白mcp识别结合序列ms2rna、噬菌体衣壳蛋白pcp识别结合序列pp7rna,λ噬菌体转录终止蛋白n识别结合序列boxbrna等。靶标rna可以融合在本发明rna适配体分子的5’端或3’端或n12-n13-n14的位置。“sgrna”在本发明中指crispr/cas9系统中将tracrrna和crrna经改造后形成的单一的引导rna(singleguiderna,sgrna),其5’端20nt左右的序列通过碱基对互补来靶向dna位点,促使cas9蛋白在该位点诱发dna双链断裂。核酸适配体的串联体本发明所述的核酸适配体分子进一步还可包含可以结合多个荧光团分子的串联体。所述串联体通过适当长度的间隔序列连在一起,串联的cppepper结构的个数可以是2,3,4,5,6,7,8,9,10或者更多。串联体的形式可以有多种,在本发明一优选的实施方案中,串联的形式为“串联1”,如图6a所示,优选的核苷酸序列为seqidno:6、7、8或9;其中的2cppepper-5表示具有2个cppepper-5结构的串联体1;在本发明另一优选的实施方案中,串联的形式为“串联2”,如图6c所示,优选的核苷酸序列为seqidno:10、11或12;其中的2×cppepper-6表示具有2个pepper-6结构的串联体2;在本发明另一优选的实施方案中,串联的形式为“串联3”,如图6e所示,优选的核苷酸序列为seqidno:13、14或15;其中的2×2cppepper-5表示具有4个cppepper-5结构的串联体3;无论何种形式,串联体之间的间隔序列可以进行更换。本发明所述的单体形式的适配体是指仅含有1个cppepper结构的适配体,也就是含2个茎结构,2个环结构和1个茎环结构(图1左)的适配体。多聚体形式的适配体是指含有1个以上cppepper结构的适配体,包含但不限于图6所示的几种串联形式构成的适配体。适配体-荧光团复合物本发明的适配体-荧光团复合物包含1个核酸适配体分子以及1个或多个荧光团分子。在本发明的一具体实施方式中,包含1个核酸分子以及1个荧光团分子的分子复合物为f30-cppepper-1-iii-3、f30-cppepper-1-iii-7、f30-cppepper-1-iii-6、f30-cppepper-1-iii-8、f30-cppepper-1-iii-4、f30-cppepper-1-iii-15、f30-cppepper-1-iii-18和f30-cppepper-1-iii-21。在本发明的另一具体实施方式中,串联体的核酸分子与多个荧光团分子的形成复合物,例如以“串联1”方式形成的包含8个适配体单元的f30-8cppepper-5与8个荧光体分子iii-3形成的复合物8cppepper-5-8×(iii-3)、8cppepper-5-8×(iii-7)、8cppepper-5-8×(iii-6)、8cppepper-5-8×(iii-8)、8cppepper-5-8×(iii-4)、8cppepper-5-8×(iii-15)、8cppepper-5-8×(iii-18)和8cppepper-5-8×(iii-21)。所述分子复合物可以在体外以单独的两种溶液形式存在,或者在同一种溶液中存在,也可以存在于细胞内。核酸适配体功能本发明的适配体功能指可以显著提高荧光团分子在合适波长激发光下的荧光强度,可以采用具体实施例中的常用实验方法(五)核酸适配体的功能检测来对适配体进行检测。在本发明的一个优选实施方式中,荧光强度的增加至少是2倍(荧光强度按照实验方法(五)进行检测);在本发明另一优选实施方式中,荧光强度的增加至少是5-10倍;在本发明另一更优选实施方式中,荧光强度的增加至少是20-50倍;在本发明另一更优选实施方式中,荧光强度的增加至少是100-200倍;在本发明另一更优选实施方式中,荧光强度的增加至少是500-1000倍;在本发明另一更优选实施方式中,荧光强度的增加至少是1000-10000倍;在本发明另一更优选实施方式中,荧光强度的增加大于10000倍。核酸适配体二级结构本专利中的核酸适配体的二级结构是利用mfold在线分析软件模拟预测得到的(http://unafold.rna.albany.edu/?q=mfold)。二级结构中的茎结构是指核酸适配体分子单链内某些区域靠氢键互补配对形成局部双链结构。一般情况下,双链结构的形成并不需要该段区域内的所有核苷酸均发生互补配对;一般情况下,n1与n32,以及n12与n14中其中一段序列的至少50%的核苷酸与另一片段发生发生互补配对即可形成茎结构。如果n1与n32是单个核苷酸,则需要n1与n32完全互补才能形成茎结构(如图1左所示)。表达核酸适配体的dna分子所述dna分子包含可以编码本发明的核酸适配体分子的dna序列。所述dna分子包含核苷酸序列r1cacuggcgccr12-r13-r14caaucguggcgugucggr32,以及其具有至少70%同一性的核苷酸序列。其中r1编码通式cppepper结构中的n1,r12编码通式cppepper结构中的n12,r13编码通式cppepper结构中的n13,r14编码通式cppepper结构中的n14,r32编码通式cppepper结构中的n32。所述dna分子还可包含一个控制dna转录的启动子,启动子与编码核酸适配体的dna序列之间可操作性连接。在本发明的一具体实施方式中,dna分子包含u6启动子;在本发明的另一具体实施方式中,dna分子包含cmv启动子。dna分子包含所述dna分子进一步还可包含编码任意目标核酸分子的dna。在本发明的另一具体实施方式中,编码目标rna的dna分子包含编a序列。在本发明的一具体实施方式中,编码目标rna的dna分子包含编码甘油醛-3-磷酸脱氢酶(gapdh)和跨膜emp24域含有蛋白质2(tmed2)的dna序列(嵌合rna的序列分别为seq19、20,tagbfp的dna序列(嵌合rna的序列分别为seqidno:24)。启动子“启动子”在本发明中包括真核细胞与原核细胞启动子。真核细胞的启动子序列与原核细胞的启动子序列完全不同。一般地,真核启动子不能被原核细胞中的rna聚合酶所识别介导rna的转录。同理,原核启动子也不能被真核细胞中的rna聚合酶所识别介导rna的转录。不同启动子的强度差别很大(强度指介导转录的能力)。根据实际应用的不同,可以使用强启动子达到高水平转录。比如当用于标记的话,高水平表达就比较好,而如果评估转录行为,较低水平的转录可以允许细胞及时的处理转录过程。根据宿主细胞的不同,可以选用一种或者多种合适的启动子。例如,当在大肠杆菌细胞中使用时,t7噬菌体启动子,lac启动子,trp启动子,reca启动子,核糖体rna启动子,λ噬菌体中的pr和pl启动子,以及其他启动子,但不限于:lacuv5启动子,ompf启动子,bla启动子,lpp启动子等。此外,一个杂交的trp-lacuv5启动子(tac启动子)或者其他通过重组或合成dna技术得到的大肠杆菌启动子,均可用于转录本发明所述的rna适配体。细菌中本身的一些操作子序列可以与启动子序列结合在一起构成诱导型启动子,此时需要加入特定的诱导物才能诱导dna分子的转录。比如lac操作子需要加入乳糖或者乳糖类似物(iptg)诱导其表达,其他的操作子还有trp,pro等。如上所述,dna分子编码序列的5’端的调控序列是启动子。无论是体外转录获得rna适配体,还是在培养的细胞或组织中表达适配体,都需要依据启动子的强度选择合适的启动子。由于体内表达适配体可以被遗传操作,另一类型的启动子就是响应特定环境诱导dna转录的诱导型启动子,如表达在特定的组织,特定的时间,特定的发育阶段等。这些不同的启动子可以被rna聚合酶i,ii或iii识别。真核细胞中转录的启动也需要合适的启动子,包括但不限于β-球蛋白启动子,cag启动子,gapdh启动子,β-肌动蛋白启动子,肌动蛋白启动子,cstf2t启动子,sv40启动子,pgk启动子,mmtv启动子,腺病毒ela启动子,cmv启动子等。真核细胞中转录的终止依赖于rna序列中特定的切割位点。同样的,rna聚合酶转录基因的不同,其转录终止子也差别很大。然而,筛选合适的3’转录终止子区域是本领域人源日常的实验技能就能实现。表达系统本发明的“表达系统”,也称为“表达载体”,包含整合有表达核酸适配体的dna分子。本发明的表达系统,可以是一个质粒,也可以是病毒颗粒。“表达载体”重组病毒可以通过将质粒转染进入感染病毒的细胞中获得。合适的载体包括但不限于病毒载体如λ载体系统gt11,gtwes.tb,charon4,质粒载体包括pbr322,pbr325,pacyc177,pacyc184,puc8,puc9,puc18,puc19,plg399,pr290,pkc37,pkc101,pbluescriptiisk+/-或ks+/-(见stratagene克隆系统),pet28系列,pacycduet1,pcdfduet1,prset系列,pbad系列,pqe,pih821,pgex,piiiex426rpr等。大量的宿主表达系统可以用于表达本发明所述的dna分子。主要地,载体系统必须要与所用的宿主细胞相容,宿主载体系统包括但不限于:转化的噬菌体dna,或质粒dna,或考斯质粒dna的细菌;包含酵母载体的酵母;感染病毒的哺乳动物细胞(如腺病毒,腺相关病毒,逆转录病毒);感染病毒的昆虫细胞(如杆状病毒);感染细菌或者通过粒子轰击转化的植物细胞。所述的载体中的表达元件的强度和特性差异很大。根据使用的宿主-载体系统选用任意一种或多种合适的转录元件。一旦构建的dna分子被克隆到载体系统中,很容易将它们转入宿主细胞中。根据不同的载体或宿主细胞系统,方法包括但不限于转化,转导,接合,固定,电转等。在本发明的一具体实施方式中,提供含编码f30-cppepper-1rna的dna分子的表达质粒pet28a-t7-f30-cppepper-1、plko.1-f30-cppepper-1和pyes2.1-f30-cppepper-1。在本发明的另一具体实施方式中,提供含编码f30-8cppepper-5rna的dna分子的表达质粒plko.1-f30-8cppepper-5。在本发明的另一具体实施方式中,提供含编码bfp-4cppepper-8、gapdh-4cppepper-8和tmed2-4cppepper-8的dna分子的表达质粒pcdna3.1hygro(+)-bfp-4cppepper-8、pcdna3.1hygro(+)-gapdh-4cppepper-8和pcdna3.1hygro(+)-tmed2-4cppepper-8。在本发明的另一具体实施方式中,提供含编码sgrna-cppepper-9(loop1)、sgrna-cppepper-9(tetraloop)、sgrna-cppepper-9(loop1和tetraloop)的dna分子的表达质粒psgrna-cppepper-9(loop1)、psgrna-cppepper-9(tetraloop)和psgrna-cppepper-9(loop1和tetraloop)。本发明也提供整合了编码核酸适配体dna分子,但目标rna分子编码dna序列空缺的表达载体,目标rna分子的编码dna序列空缺是让用户可以自行选择所需检测的目标rna分子的dna序列,例如gapdhmrna对应的编码dna序列,用标准的重组dna技术将dna序列插入本发明的这种表达载体中,将获得的表达载体导入到(转染、转化、感染等)宿主细胞,检测目标rna的含量及分布。宿主细胞“宿主细胞”在本发明中包括但不限于细菌,酵母,哺乳动物细胞,昆虫细胞,植物细胞,斑马鱼细胞,果蝇细胞,线虫细胞。宿主细胞更优选培养的体外细胞或整个体内活体组织。本发明中的宿主细胞,其包含的哺乳动物细胞包括但不限于297t,cos-7,bhk,cho,hek293,hela,h1299,受精卵干细胞,诱导全能干细胞,从哺乳动物组织中直接分离的原代细胞等;其包含的大肠杆菌细胞包括但不限于bl21(de3)、bl21(de3,star)、top10、mach1、dh5α;其包含的酵母细胞包含但不限于by4741,by4742,ah109。检测阵列本发明所述的检测阵列包含一个或多个本发明的核酸适配体分子,其中核酸适配体分子被锚定在阵列表面的离散位置,阵列表面是由固体支撑物构成,包括但不限于玻璃、金属、陶瓷等。将本发明所述核酸适配体分子锚定到阵列表面可通过但不限于以下方法:(1)利用生物素标记所述核酸适配体分子的5’或3’端,将链霉亲和素包被在阵列表面,通过生物素与链霉亲和素的特异性结合将所述核酸适配体分子进行锚定;(2)将噬菌体衣壳蛋白mcp识别结合序列ms2、噬菌体衣壳蛋白pcp识别结合序列pp7或λ噬菌体转录终止蛋白n识别结合序列boxbrna序列融合在所述核酸适配体分子的5’、3’或茎环结构,将它们识别结合的蛋白mcp、pp7或λn蛋白包被在阵列表面,通过ms2与mcp蛋白、pp7与pcp蛋白或boxbrna与λn蛋白的特异性作用将所述核酸适配体分子进行锚定;(3)将一段rna或dna序列融合在所述核酸适配体分子的5’或3’端,将与该段rna序列互补配对的rna序列或与该段dna序列互补配对的dna序列锚定在阵列表面,通过分子杂交的原理将所述核酸适配体分子锚定在阵列表面。所述检测阵列可用于检测靶标分子的存在与否以及浓度高低,因此,只有在靶标分子存在下,所述核酸适配体分子才会与荧光团分子结合,显著提高其在合适激发光波长下的荧光强度,且在一定范围内,靶标分子的浓度越高,荧光强度越高。试剂盒本发明的试剂盒,包含本发明所述的核酸适配体分子和/或荧光团分子,及相应的说明书;或者包含表达所述核酸适配体分子的表达系统和/或荧光团分子,及相应的说明书;或者包含表达核酸适配体分子表达系统的宿主细胞和/或荧光团分子,及相应的说明书。试剂盒中的核酸适配体分子与荧光团分子分别存在于单独的溶液中,或者核酸适配体分子与荧光团分子在同一溶液中。具体实施方式以下用实施例对本发明作进一步阐述。这些实施例仅仅用于举例说明,而不对本发明的范围构成任何限制。实施例中主要采用常规的基因工程分子生物学克隆方法,这些方法是本领域普通技术人员所熟知的,例如:简·罗斯凯姆斯等的《分子生物学实验参考手册》和j.萨姆布鲁克,d.w.拉塞尔著,黄培堂等译:《分子克隆实验指南》(第三版,2002年8月,科学出版社出版,北京)中的有关章节。本领域普通技术人员按照以下实施例,不难根据具体情况略作修改和变换而成功实施本发明。实施例中所用的pcdna3.1hygro(+)质粒载体购自invitrogen公司,plko.1-puro质粒载体购自sigma公司,pet28a质粒载体购自novagen公司,pyes2.1topota质粒载体购自invitrogen。所有用于pcr的引物均由上海杰瑞生物工程技术有限公司合成、纯化和经质谱法鉴定正确。实施例中构建的表达质粒都经过序列测定,序列测定由杰李测序公司完成。各实施例所用的taqdna聚合酶购自上海翊圣生物科技有限公司,primestardna聚合酶购自takara公司,三种聚合酶购买时都附带赠送对应聚合酶缓冲液和dntp。ecori、bamhi、bglii、hindiii、ndei、xhoi、saci、xbai、spei等限制性内切酶、t4连接酶、t4磷酸化酶(t4pnk)、t7rna聚合酶购自fermentas公司,购买时附带有相对应的缓冲液等。实施例中所用的hieffclonetmonestep克隆试剂盒购自上海翊圣生物科技有限公司。除非特别声明,无机盐类化学试剂均购自国药集团上海化学试剂公司。卡那霉素(kanamycin)购自ameresco公司;氨苄青霉素(amp)购自ameresco公司;384孔和96孔荧光检测黑板购自grenier公司。dfhbi-1t和dfho购自lucerna公司。gtp和sam购自sigma公司。实施例中所用的dna纯化试剂盒购自bbi公司(加拿大),普通质粒小抽试剂盒购自天根生化科技(北京)有限公司。bl21(de3,star)菌株购自invitrogen公司。293t/17细胞和cos-7细胞购自中国科学院典型培养物保藏委员会细胞库。by4741酵母菌株购自上海唯地生物技术有限公司。实施例中用到的主要仪器:synergyneo2多功能酶标仪(美国bio-tek公司),x-15r高速冷冻离心机(美国beckman公司),microfuge22r台式高速冷冻离心机(美国beckman公司),pcr扩增仪(德国biometra公司),活体成像系统(美国kodak公司),光度计(日本和光公司),核酸电泳仪(申能博彩公司)。缩写词意义如下:“h”指小时,“min”指分钟,“s”指秒,“d”指天,“μl”指微升,“ml”指毫升,“l“指升,“bp”指碱基对,“mm”指毫摩尔,“μm”指微摩尔。实施例中常用实验方法及材料(一)核酸适配体分子制备:利用含t7启动子的引物对待检测rna对应的cdna进行扩增,利用t7rna聚合酶(购自fermentas公司)以回收得到的双链cdna为模板转录获得rna。在20μl的转录体系中加入10μl3mnaac,115μldepc水,混匀后加入150μl酚氯仿-异丙醇混合液(苯酚:氯仿:异丙醇=25:24:1),振荡混匀,10000rpm离心5min后取上清。加入等体积氯仿溶液,振荡混匀,10000rpm离心5min后取上清,反复一次。在上清中加入2.5倍体积的无水乙醇,-20℃冰箱放置30min,4℃12000rpm离心5min,弃上清,利用75%预冷的无水乙醇清洗沉淀2次。待乙醇挥发完后,加入适当量的筛选缓冲液重悬沉淀,75℃处理5min,室温放置10min以上,用于后续实验。(二)细胞培养及转染:本实施例中的细胞均在co2培养箱中用含10%胎牛血清(fbs)及链霉素和青霉素高糖培养基(dmem)培养,生长达到80-90%汇合度时将细胞传代培养。转染时,用(购自promega)按照说明书进行操作。(三)荧光成像:实施例中主要的成像实验是利用leicasp8共聚焦激光显微镜进行拍摄,使用hcxplapo63.0x1.47油镜和hyd检测器。为了拍摄pepepr-iii-3复合物荧光,使用488nm激光器。为了拍摄cppepper-iii-7、cppepper-iii-6、cppepper-iii-8、cppepper-iii-4、cppepper-iii-15、cppepper-iii-18和cppepper-iii-21的荧光,分别使用458nm、458nm、488nm、488nm、488nm、561nm、561nm的激光器。(四)基于同源重组方法的重组质粒构建1.制备线性化载体:选择合适的克隆位点,并对载体进行线性化,可采用酶切或反向pcr扩增制备线性化载体。2.pcr扩增制备插入片段:通过在插入片段正、反向pcr引物的5’端引入15-25bp(不包括酶切位点)的线性化载体末端同源序列,使得插入片段pcr产物5’和3’末端分别带有与线性化载体两末端对应的完全一致的序列。3.线性化载体与插入片段浓度测定:将线性化载体和插入片段扩增产物做数个等体积稀释梯度,原始产物和稀释后产物各取1μl进行琼脂糖凝胶电泳,与dna分子量标准(dnamarker)比较条带亮度以确定其近似浓度。4.重组反应重组反应体系最适载体使用量为0.03pmol;最适载体与插入片段摩尔比为1:2-1:3,即最适插入片段使用量为0.06-0.09pmol。x和y分别是根据公式计算得到线性化载体和插入片段用。体系配制完成后,混匀各组分,置于50℃反应20min。当插入片段>5kb时,可将孵育温度延长至25min。待反应完成后,建议将反应管置于冰上冷却5min。反应产物可直接进行转化,也可储存于-20℃,待需要时解冻转化。(五)核酸适配体的功能检测按照常用实验方法(一)制备cppepper或cppepper突变体核酸适配体分子,将5μm核酸适配体分子与1μm荧光团分子在检测缓冲液(40mmhepes,ph7.4,125mmkcl,5mmmgcl2,5%dmso)中孵育,利用synergyneo2多功能酶标仪检测获取核酸适配体-荧光团分子复合物荧光的最大激发峰和最大发射峰。再利用synergyneo2多功能酶标仪检测核酸适配体-荧光团分子复合物在其最大激发和发射条件下的荧光强度,对照样品(不含核酸适配体的1μm荧光团分子)也在相同的条件进行测定,计算荧光强度的比值。如5μmf30-cppepper-1核酸适配体与1μmiii-3荧光团分子形成的复合物的荧光最大激发峰为486nm,最大发射峰为531。利用synergyneo2多功能酶标仪检测该复合物在485±10nm激发、530nm±10nm发射条件下的荧光强度为31000,而对照(1μmiii-3荧光团分子)在相同检测条件下的荧光强度为10,那么f30-cppepper-1核酸适配体对iii-3荧光团分子的激活倍数为3100倍。实施例1.cppepper核酸适配体分子的二级结构利用mfold在线rna结构分析软件分析cppepper核酸适配体的二级结构。cppepper包含2个茎结构,2个环结构和1个茎环结构(图1左)。对于其中一种茎1和茎环的序列,cppepper-1(seqidno:1)预测的二级结构为图1右。实施例2.cppepper-iii-3复合物的荧光光谱性质鉴定为了检测cppepper-iii-3复合物的光谱性质,按照常用实验方法(一)制备f30-cppepper-1(seqidno:2)rna。将1μmiii-3与5μmf30-cppepper-1孵育。检测结果显示,f30-cppepper-1-iii-3复合物的最大激发光为486nm,最大发射光为531nm(图4)。实施例3.不同cppepper突变体对iii-3荧光团分子的荧光激活效果。为了检测不同cppepper突变体对iii-3荧光团分子的荧光激活效果,对f30-cppepper-1中cppepper-1序列进行如表1所示的点突变,按照常用实验方法(一)制备含不同碱基突变的cppepper突变体rna,将1μmiii-3分别与5μm不同的f30-cppepper-1突变体rna孵育,按照常用实验方法(五)它们对iii-3荧光团分子的荧光激活倍数。检测结果显示,大部分含单个碱基突变的f30-cppepper-1突变体保留对iii-3的较强的荧光激活效果(>10倍)(表2)。部分含2-7个碱基突变的f30-cppepper-1突变体仍保留对iii-3的较强的荧光激活效果(>100倍)(表3)。综上,cppepper的很多单碱基和多碱基突变体仍保留激活iii-3荧光团分子的适配体功能。表2含单碱基突变的cppepper突变体对iii-3的激活效果突变体激活倍数突变体激活倍数突变体激活倍数f30-cppepper-13100g22a365g20c875c15g256g22c652a3u65c15a2314g23u986a3g458c15u1854g23a1125a3c96a16u1562g23c165c4g32a16g1265c24g1758c4a462a4c1953c24a215g7u362a17g987c24u1874c8g1574a17c1654g25u265c8a98u18a1722g25a768c8u2953u18g1980g25c1324g9u542u18c1236u26a1189g9a21c19a544u26g2745g9c96c19u1265g27c5c10g1825g19c2654u28a12c20u1236g20a154u28g47c10a6u21a1684c29a26c11g65u21c35c29u1164c11u1786g22u651g30u963c11a1635注:表2中的f30-cppepper-1是序列为seqidno:2的核酸适配体;其它的适配体是在f30-cppepper-1的cppepper-1序列中与图1右的cppepper对应核苷酸位置做的点突变。表3含多碱基突变的cppepper突变体对iii-3的激活效果实施例4.碱基修饰的cppepper对iii-3的激活效果为了检测经碱基修饰的cppepper对iii-3的激活效果,合成含碱基修饰的cppepper-3(seqidno:4,该序列gggcccacuggcgccguagcuucggcuaccaaucguggcgugucggggccc中带下划线的碱基为脱氧核糖核苷酸碱基)和cppepper-4(seqidno:5,该序列gggcccacuggcgccguagcuucggcuaccaaucguggcgugucggggccc中带下划线的碱基为经2’-f修饰的碱基)(由上海吉玛制药技术有限公司合成),它们分别含茎-环结构碱基替换为脱氧核糖核苷酸和部分碱基经2’-f修饰。按照常用实验方法(五)检测这些碱基修饰的cppepper对iii-3荧光团分子的荧光激活效果。检测结果显示,经碱基修饰的cppepper-3和cppepper-4依然可以显著激活iii-3荧光团分子的荧光(图5)。实施例5.cppepper串联体为了检测cppepper串联体对iii-3荧光的激活效果,将cppepper按照不同的形式进行串联,包含以下三种:(1)“串联1”方式(图6a),将cppepper结构上的“头”和“尾”按照“头-尾”连接的方式进行连接,以此获得ncppepper(其中n为可为任意拷贝的cppepper)。在本实施例中,分别全基因合成f30-2cppepper-5、f30-4cppepper-5、f30-8cppepper-5和f30-16cppepper-5的编码cdna(编码rna适配体的序列分别为seqidno:6,seqidno:7,seqidno:8,seqidno:9),pcr扩增后,按照常用实验方法(一)制备核酸适配体rna,将0.1μmrna适配体与10μmiii-3孵育后,按照常用实验方法(五)检测荧光强度。检测结果显示,随着n的增加,ncppepper-iii-3的荧光也随之增加(图6b),说明可以通过“串联1”方式提高cppepper-iii-3复合物的荧光强度。(2)“串联2”方式(图6c),将cppepper作为一个结构单元进行串联,以此获得nxcppepper(其中n为可为任意拷贝的cppepper)。在本实施例中,分别全基因合成2×cppepper-6、4×cppepper-6和8xcppepper-6的编码cdna(编码rna适配体的序列分别为seqidno:10,seqidno:11,seqidno:12,按照常用实验方法(一)制备核酸适配体rna,将0.1μmrna适配体与10μmiii-3孵育后,按照常用实验方法(五)检测荧光强度。检测结果显示,随着n的增加,n×cppepper-iii-3的荧光也随之增加(图6d),说明可以通过“串联2”方式提高cppepper-iii-3复合物的荧光强度。(3)“串联3”方式(图6e),是将上述“串联1”与“串联2”结合起来,将“串联1”得到的ncppepper作为一个结构单元按照“串联2”的方式进行串联,以此获得n1×n2cppepper(其中n1和n2为可为任意拷贝的cppepper)。在本实施例中,分别全基因合成2×2cppepper-5、4×2cppepper-5、8×2cppepper-5的编码cdna(编码rna适配体的序列分别为seqidno:13,seqidno:14,seqidno:15),按照常用实验方法(一)制备核酸适配体rna,将0.1μmrna适配体与20μmiii-3孵育后,按照常用实验方法(五)检测荧光强度。检测结果显示,这种通过“串联3”方式得到的cppepper串联体-iii-3的荧光强度要显著高于cppepper-iii-3(图6f),说明可以通过“串联3”方式提高cppepper-iii-3复合物的荧光强度。实施例6.iii-3类似物的性质鉴定按照常用实验方法(一)制备f30-cppepper-1rna适配体分子,利用其检测iii-3类似物与cppepper结合的基本性质,包括荧光光谱、摩尔消光系数、量子产率和荧光激活倍数和结合常数(kd),检测结果如表4所示,从表中数据可以看出,f30-cppepper-1可以不同程度地激活iii-3类似物的荧光强度。表4:f30-cppepper-1rna适配体分子与不同荧光分子结合的理化性质测定实施例7.cppepper-iii-3复合物用于细菌中rna的标记为了检测cppepper-iii-3在细菌中的效果,首先构建表达f30-cppepper-1的细菌表达质粒。利用引物对实施例2中的f30-cppepper-1进行扩增,利用引物对pet28a进行扩增去除了启动子和多克隆位点区,将扩增得到的f30-cppepper-1dna片段与pet28a线性化载体按照实验方法(四)进行连接,得到的重组质粒命名为pet28a-t7-f30-cppepper-1。扩增f30-cppepper-1片段所用的引物为:上游引物(p1):5’-tcgatcccgcgaaattaatacgactcactatagggttgccatgtgtatgtggg-3’下游引物(p2):5’-caaggggttatgctattgccatgaatgatccccgacac-3’扩增pet28a载体使其线性化所用的引物为:上游引物(p3):5’-tagcataaccccttggggcctctaaacgggtcttgag-3’下游引物(p4):5’-atttcgcgggatcgagatctcgatcctctacgccggacg-3’将pet28a-t7-f30-cppepper-1重组质粒转化bl21(de3,star)大肠杆菌菌株,挑取单克隆37℃培养,在od600=0.2左右时,加入1mmiptg诱导f30-cppepper-1的表达,4h后收菌,利用含2μmiii-3的pbs溶液重悬。以转化了pet28a空载体的bl21(de3,star)大肠杆菌作为对照。结果显示,只有表达了f30-cppepper-1且在iii-3存在下,细菌才能显示出明亮的黄绿色荧光(图7),表明cppepper-iii-3复合物可以用于细菌中rna的荧光标记。实施例8cppepper-iii-3复合物用于酵母细胞中rna的标记为了检测cppepper-iii-3在酵母中的效果,首先构建表达f30-cppepper-1的酵母表达质粒。利用引物对实施例2中的f30-cppepper-1dna片段进行扩增,按照实验方法(四)将扩增得到的f30-cppepper-1片段插入到pyes2.1topota载体中,得到的重组质粒命名为pyes2.1-f30-cppepper-1。扩增f30-cppepper-1片段所用的引物为:上游引物(p5):5’-ggaatattaagctcgcccttttgccatgtgtatgtggg-3’下游引物(p6):5’-tgacctcgaagctcgcccttgttgccatgaatgatccccgacac-3’将pyes2.1-f30-cppepper-1重组质粒转化by4741菌株,挑取单克隆30℃培养,在od600=0.1左右时,加入1mm半乳糖诱导f30-cppepper-1的表达,10h后收菌,利用含2μmiii-3的pbs溶液重悬。以未经处理的by4741菌株为对照。结果显示,只有表达了f30-cppepper-1且在iii-3存在下,酵母细胞才能显示出明亮的黄绿色荧光(图8),表明cppepper-iii-3复合物可以用于酵母细胞中rna的荧光标记。实施例9cppepper与iii-3及其类似物用于哺乳动物细胞中rna的标记为了检测cppepper与iii-3用于哺乳动物细胞中rna的标记,构建它的哺乳动物细胞表达质粒。分别引物p7和p8扩增实施例2中的f30-cppepper-1,利用实验方法(四)将片段插入到plko.1puro载体中。得到的表达载体命名为plko.1-f30-cppepper-1。将plko.1-f30-cppepper-1质粒转染293t/17细胞,24h后加入1μmiii-3对f30-cppepper-1进行标记,以不表达适配体的细胞作为对照,利用实验方法(三)检测标记效果。结果显示,f30-cppepper-1-iii-3复合物展现出非常明亮的黄绿色荧光,对照则没有明显荧光(图9a),表明cppepper-iii-3可以很好的在哺乳动物细胞中工作。扩增f30-cppepper-1所用的引物为:上游引物(p7):5’-ggaaaggacgaaactctagattgccatgtgtatgtggg-3’下游引物(p8):5’-tgtctcgaggtcgagaattcaaaaaaagttgccatgaatgatccccgacac-3’为了检测cppepper与iii-3类似物用于哺乳动物细胞中rna的标记,构建了表达f30-8cppepper-5的哺乳动物表达质粒。利用本实施例中的引物p7和p8对实施例5中的f30-8cppepper-5片段进行扩增,利用实验方法(四)将这些片段插入到plko.1puro载体中。得到的表达载体命名为plko.1-f30-8cppepper-5。将plko.1-f30-8cppepper-5质粒转染293t/17细胞,24h后加入不同的iii-3类似物进行标记,利用实验方法(三)检测标记效果。结果显示,不同的iii-3类似物均可以特异性标记表达f30-8cppepper-5的细胞,而不标记不表达f30-8cppepper-5的对照细胞(图9b),表明cppepper与iii-3及其类似物可用于哺乳动物细胞中rna的标记。实施例10.基于cppepper的探针构建为了构建基于cppepper的待检测物探针,将cppepper-1(seqidno:2)结构中茎-环结构处的核苷酸更换为可以特异性识别结合腺苷(adenosine)和鸟苷(gtp)的rna适配体,这些适配体与cppepper-1之间利用适当长度和组成的碱基进行连接,按照常用实验方法(一)制备探针rna,将其与iii-3孵育,利用多功能酶标仪分别检测它们在有无腺苷或gtp存在下的荧光强度。检测结果显示,对于腺苷探针,当腺苷存在时探针的荧光显著高于腺苷不存在时(图10a),对应的探针rna序列为seqidno:16。同样地,对于gtp探针,当gtp存在时探针的荧光显著高于gtp不存在时(图10b),对应的探针rna序列为seqidno:17。实施例11.cppepper用于示踪细胞中rna定位为了检测cppepper用于示踪细胞中rna定位,首先构建cppepper与不同rna融合的嵌合rna的表达质粒。全基因合成4cppepper-8的cdna(其编码rna适配体的序列为seqidno:18),利用引物扩增4cppepper-8基因片段,利用同源重组的方法将其插入到经hindiii和xhoi双酶切的pcdna3.1hygro(+)载体,得到pcdna3.1hygro(+)-4cppepper-8重组质粒。全基因合成gapdh和tmed2基因片段(gapdh和tmed2编码基因序列分别为genebank:bc009081,bc025957),分别利用引物对gapdh和tmed2基因片段进行扩增,将它们插入到经nhei和hindiii双酶切的pcdna3.1hygro(+)-4cppepper-8载体中,获得pcdna3.1hygro(+)-gapdh-4cppepper-8和pcdna3.1hygro(+)-tmed2-4cppepper-8重组质粒,它们分别编码gapdh-4cppepper-8和tmed2-4cppepper-8嵌合rna,它们的序列为seqidno:19和20扩增4cppepper-8所用的引物为:上游引物(p9):5’-tagcgtttaaacttaagcttccatcgggcccactggcgc-3’下游引物(p10):5’-acgggccctctagactcgagccatcgggccccgacacgcc-3’扩增gapdh所用的引物为:上游引物(p11):5’-ggagacccaagctggctagcatggggaaggtgaaggtcgg-3’下游引物(p12):5’-cagtgggcccgatggaagcttaaccatgctctagcgagtgttactccttggaggccatgt-3’扩增tmed2所用的引物为:上游引物(p13):5’-ggagacccaagctggctagcatggtgacgcttgctgaact-3’下游引物(p14):5’-cagtgggcccgatggaagcttaaccatgctctagcgagttaaacaactctccggacttc-3’构建完成以上质粒后,均经测序鉴定插入的序列完全正确,用转染级质粒抽提试剂盒提取质粒,用于后续转染实验。将本实施例构建的pcdna3.1hygro(+)-gapdh-4cppepper-8和pcdna3.1hygro(+)-tmed2-4cppepper-8重组质粒分别与pcdna3.1hygro(+)-bfp共转染cos-7细胞,转染24h后按照具体实验方法(三)所述荧光成像方法对细胞进行成像。成像结果显示,gapdh-4cppepper-8-iii-3的荧光主要集中在胞浆中,而tmed2-4cppepper-8-iii-3的荧光则可以观察到内质网富集的现象,这与之前的报道是一致的,与荧光标记的原位杂交技术(fish)结果也是一致的(图11),以上结果显示cppepper可用于示踪rna的定位。实施例12.pepper用于检测基因组dna为了利用cppepper检测基因组dna,首先构建表达cppepper-9与sgrna嵌合rna的重组质粒。全基因合成含着丝粒靶向序列的sgrna-cppepper-9(loop1)、sgrna-cppepper-9(tetraloop)和sgrna-cppepper-9(loop1和tetraloop)的cdna,其编码的rna序列分别为seqidno:21、22和23。利用引物p15和p16扩增上述嵌合rna的cdna,利用引物p17和p18扩增psgrna质粒(shaoetal.nucleicacidsresearch2016.44:e86),利用实验方法(四)将扩增得到的cdna与线性化的psgrna载体连接,得到的质粒分别命名为psgrna-cppepper-9(loop1)、psgrna-cppepper-9(loop2)和psgrna-cppepper-9(loop1和tetraloop)。利用引物p19和p20以pslq1645(dcas9-gfp)(shaoetal.nucleicacidsresearch2016.44:e86)为模板扩增dcas9-gfp基因片段,利用实验方法(四)将其插入到经hindiii和xhoi双酶切的pcdna3.1hygro(+)载体中,得到的质粒命名为pcdna3.1hygro(+)-dcas9-gfp。扩增cppepper与sgrna嵌合rna对应cdna所用的引物为:上游引物(p15):5’-aaaggacgaaacaccgaatctgcaagtggatattgtttgag-3’下游引物(p16):5’-tgatctagaaaaaaagcaccgactcggtgccac-3’扩增psgrna质粒使其线性化的引物为:上游引物(p17):5’-tttttttctagatcataatcagccatacc-3’下游引物(p18):5’-ggtgtttcgtcctttccacaag-3’扩增spdcas9-gfp所用的引物为:上游引物(p19):5’-tagcgtttaaacttaagcttgtgcaggctggcgccaccatggcccc-3’下游引物(p20):5’-acgggccctctagactcgagttacttgtacagctcgtccatgc-3’将pcdna3.1hygro(+)-dcas9-gfp分别与psgrna-cppepper-9(loop1)、psgrna-cppepper-9(loop2)和psgrna-cppepper-9(loop1和tetraloop)重组质粒共转染cos-7细胞,转染24h后,利用1μmiii-21和hoechst对细胞进行标记,利用荧光显微镜观察cppepper-9-iii-21、gfp和hoechst的荧光。成像结果显示,cppepper-9-iii-21的荧光在主要集中在细胞核中,且成点状聚集(着丝粒),与dcas9-gfp的荧光几乎完全吻合(图12),说明cppepper可用于对基因dna的成像。实施例13.cppepper用于rna的提取与纯化的标签为了检测将cppepper用于rna的提取与纯化,分别利用引物p21和p22以easyfusiont2a-h2b-tagbfp(addgene:113086)为模板扩增tagbfp基因片段,将其插入到经nhei和hindiii双酶切的pcdna3.1hygro(+)-gapdh-4cppepper-8载体中,获得pcdna3.1hygro(+)-tagbfp-4cppepper-8重组质粒,它编码tagbfp-4cppepper-8,其rna序列为seqidno:24。扩增tagbfp所用的引物为:上游引物(p21):5’-ggagacccaagctggctagcatgagcgagctgattaagga-3’下游引物(p22):5’-cagtgggcccgatggaagcttctcccaaaccatgctctagcgagtgttaattgagcttgtgcccca-3’将pcdna3.1hygro(+)-tagbfp-4cppepper-8重组质粒转染cos-7细胞,24h后收集细胞,利用40mmhepes,ph7.4,125mmkcl,5mmmgcl2的缓冲液进行重悬。取activatedthiolsepharose4b(gehealthcare)经500μlpbs清洗两次后,加入含10mmtcep(sigma)的pbs室温孵育1h。利用500μlpbs清洗两次后,加入含马来酰胺的iii-3荧光团分子(mal-iii-3)于室温反应30min,利用500μlpbs清洗三次。将重悬的细胞破碎后与上述处理过的微珠室温孵育,30min后4000rpm离心2min,弃上清,利用40mmhepes,ph7.4,125mmkcl,5mmmgcl2的缓冲液清洗琼脂糖微珠6次,每次均离心去上清。用depc水重选微珠,70℃处理10min,4000rpm离心2min,收集上清。在收集的上清中加入1/10体积的naac,2.5倍体积无水乙醇,-80℃冰箱放置20min,4℃条件下14000rpm离心10min,留沉淀,弃上清,利用预冷的70%乙醇溶液清洗沉淀,4℃条件下14000rpm离心10min,留沉淀,弃上清,如此反复一次。将沉淀置于室温下5min,待酒精挥发完后,加入少量体积的depc水重悬沉淀。分别检测细胞破碎后上清,以及最终高温洗脱后的洗脱液(与40mmhepes,ph7.4,125mmkcl,5mmmgcl2缓冲液1:1)与荧光团iii-3孵育后的荧光,以空白细胞的破碎上清为对照。检测结果显示,洗脱液与iii-3孵育后的荧光显著高于上样前的破碎后上清(图13),说明tagbfp-4cppepper-8rna得到很好的富集,表明cppepper可以作为一个标签用于rna的分离与纯化。实施例14.iii-3及其类似物的合成化合物ⅲ-1:4-n,n-二甲基-苯甲醛(0.35g,2.3mmol),4-氰基-苯乙腈(0.4g,2.8mmol)于100ml圆底烧瓶中,加入40ml无水乙醇溶解,加入二滴哌啶,ar保护条件下油浴加热回流2h,反应完毕,冷却至室温,大量固体析出,过滤,冷乙醇冲洗滤饼三次,真空烘干的橙色固体(0.60g,95%)。1hnmr(400mhz,dmso-d6):δ=3.05(s,6h),6.83(d,j=9.2hz,2h,),7.84-7.94(m,6h),8.02ppm(s,1h).hrms(esi-tof):calcd.forc18h16o3[m+h]+:274.1344.found:274.1345.化合物ⅲ-2:参照化合物ⅲ-1的合成方法,(0.34g,89%)。1hnmr(400mhz,dmso-d6):δ=1.23(t,j=7.60hz,6h),3.05(t,j=7.60hz,4h),6.84(d,j=9.2hz,2h,),7.84-7.95(m,6h),8.09ppm(s,1h).hrms(esi-tof):calcd.forc20h20o3[m+h]+:302.1657.found:302.1658.化合物ⅲ-2:参照化合物ⅲ-1的合成方法,(0.34g,89%)。1hnmr(400mhz,dmso-d6):δ=1.23(t,j=7.60hz,6h),3.05(t,j=7.60hz,4h),6.84(d,j=9.2hz,2h,),7.84-7.95(m,6h),8.09ppm(s,1h).hrms(esi-tof):calcd.forc20h20o3[m+h]+:302.1657.found:302.1658.化合物ⅲ-3:参照化合物ⅲ-1的合成方法,(0.33g,95%)。1hnmr(400mhz,dmso-d6):δ=7.96(s,1h),7.85(d,j=16.0hz,6h),6.81(d,j=8.0hz,2h),4.77(s,1h),3.55(d,j=28.0hz,4h),3.04(s,1h).lr-hrms(esi-tof):calcd.forc19h18n3o[m+h]+:304.1450.found:304.1451.化合物ⅲ-4:化合物ⅲ-3(0.61g,2.0mmol)于40ml干燥dcm中,加入tea(0.25g,2.2mmol),0℃条件下缓慢加入对甲苯磺酰氯的(0.38g,2.0mmol)的10mldcm溶液,ar保护条件下缓慢升至室温,反应完毕,加入2ml水淬灭反应,分出有机相,na2so4干燥,减压条件下除去有机溶剂,残余物不经进一步处理,直接用于下一步。残余物溶于20ml乙腈中,加入1ml甲胺的甲醇溶液,体系在ar保护条件下油浴加热回流过夜,反应完毕,加压除去溶剂,体系溶于50mldcm中,分别用水、饱和食盐水洗涤(2×100ml),有机相用na2so4干燥,加压除去溶剂,残余物经柱色谱分离得橙红色固体(0.54g,82%)。1hnmr(400mhz,cdcl3):δ=7.88(d,j=9.0hz,2h),7.74–7.65(m,4h),7.48(s,1h),6.73(d,j=9.1hz,2h),3.60–3.55(m,2h),3.08(s,3h),2.57–2.52(m,2h),2.34(s,6h).lr-ms(esi-tof):calcd.forc21h23n4[m+h]+:331.1923.found:331.1925.化合物ⅲ-5:4-羟基-3,5-二氟-苯甲醛(0.32g,2.0mmol),4-氰基-苯乙腈(0.35g,2.4mmol)于100ml圆底烧瓶中,加入40ml无水乙醇溶解,加入二滴哌啶,ar保护条件下油浴加热回流2h,反应完毕,冷却至室温,大量固体析出,过滤,冷乙醇冲洗滤饼三次,真空烘干的橙色固体。1hnmr(400mhz,cdcl3):δ=7.80(d,j=9.0hz,2h),7.74–7.66(m,4h),7.48(s,1h).lr-ms(esi-tof):calcd.forc16h9f2n2o[m+h]+:283.0683.found:283.0684.化合物5-(n-甲基-n-羟乙基)氨基-吡嗪-2-甲醛:4-n-甲基-n-羟乙基胺(2.6g,35mmol),5-氯-吡嗪-2-甲醛(0.50g,3.5mmol)于100ml圆底烧瓶中,加入20ml无水乙腈溶解,加入k2co3(0.71g,5.3mmol),ar保护条件下油浴加热回流24h,反应完毕,冷却至室温,过滤,真空除去溶剂,残余物溶于100mldcm中,分别用水、饱和食盐水洗涤(2×100ml),有机相用na2so4干燥,除去有机溶剂,残余物经柱色谱分离得5-(n-甲基-n-羟乙基)-吡嗪-2-醛(0.48g,76%)。1hnmr(400mhz,cdcl3):δ9.88(s,1h),8.62(d,j=1.2hz,1h),8.14(d,j=1.1hz,1h),3.92(m,2h),3.88–3.83(m,2h),3.28(s,3h).lr-ms(esi-tof):calcd.forc8h12n3o2[m+h]+:182.1.found:182.1.化合物ⅲ-6:参照化合物ⅲ-1的合成方法,(0.36g,96%)。1hnmr(400mhz,cdcl3):δ8.39(s,1h),8.30(s,1h),7.80(d,j=8.5hz,2h),7.72(d,j=8.4hz,2h),7.51(s,1h),3.93(t,j=4.9hz,2h),3.88–3.83(m,2h),3.29(s,3h).lr-hrms(esi-tof):calcd.forc17h16n5o[m+h]+:306.1355.found:306.1357.化合物ⅲ-7:参照化合物ⅲ-4的合成方法,(0.21g,67%)。1hnmr(400mhz,dmso-d6):δ8.37(d,j=5.2hz,2h),8.06(s,1h),8.00–7.85(m,4h),3.77(t,j=6.5hz,2h),3.20(s,3h),2.56(m,2h),2.23(s,6h).lr-hrms(esi-tof):calcd.forc19h21n6[m+h]+:333.1828.found:333.1829.化合物6-(n-甲基-n-羟乙基)氨基-吡嗪-3-醛:按照化合物5-(n-甲基-n-羟乙基)氨基-吡嗪-2-醛的合成方法,(0.45g,68%)。1hnmr(400mhz,cdcl3):δ=9.69(s,1h),8.43(d,j=2.1hz,1h),7.86(dd,j=9.0,2.3hz,1h),6.56(d,j=9.1hz,1h),3.86–3.79(m,4h),3.15(s,3h).lr-ms(esi-tof):calcd.forc9h13o2n2[m+h]+:181.1.found:181.1.化合物ⅲ-8:参照化合物ⅲ-1的合成方法,(0.39g,89%)。1hnmr(400mhz,dmso-d6):δ=8.54(d,j=4.0hz,1h),8.30(dd,j=9.3,2.5hz,1h),8.03(s,1h),7.92(d,j=8.0hz,2h),7.85(d,j=8.0hz,2h),6.84(d,j=8.0hz,1h),4.77(t,j=5.4hz,1h),3.67(t,j=5.3hz,2h),3.60(q,j=5.4hz,2h),3.15(s,3h).lr-hrms(esi-tof):calcd.forc18h27n4o[m+h]+:305.1402.found:305.1401.化合物ⅲ-9:参照化合物ⅲ-4的合成方法,(0.31g,92%)。1hnmr(400mhz,dmso-d6):δ=8.55(d,j=4.0hz,1h),8.31(dd,j=9.3,2.5hz,1h),8.05(s,1h),7.93(d,j=8.0hz,2h),7.84(d,j=8.0hz,2h),6.85(d,j=8.0hz,1h),4.78(t,j=5.4hz,1h),3.67(t,j=5.3hz,2h),3.60(q,j=5.4hz,2h),3.17(t,j=8.0hz,4h),1.17(t,j=8.0hz,6h).lr-hrms(esi-tof):calcd.forc22h26n5[m+h]+:360.2188.found:360.2187.4-n,n-二甲基-6醛基-吡啶:参照化合物4-n-甲基-n-(2-n’,n’-二甲基-乙基)-苯甲醛的合成方法,(0.31g,49%)。1hnmr(400mhz,dmso-d6):δ=9.86(d,j=0.6hz,1h),8.17(d,j=2.9hz,1h),7.83(d,j=8.9hz,1h),6.94(dd,j=8.8,2.9hz,1h),3.10(s,6h).lr-hrms(esi-tof):calcd.forc8h11n2o[m+h]+:151.1.found:151.1.化合物ⅲ-10:参照化合物ⅲ-1的合成方法,(0.36g,96%)。1hnmr(400mhz,dmso-d6):δ=9.86(d,j=0.6hz,1h),8.26(s,1h),8.17(d,j=2.9hz,1h),7.83(d,j=8.9hz,1h),7.46(m,4h),6.94(dd,j=8.8,2.9hz,1h),3.10(s,6h).lr-hrms(esi-tof):calcd.forc17h15n4[m+h]+:275.1297.found:275.1298.2-(n-甲基-n-羟乙基)氨基-5-醛基-嘧啶:参照化合物4-n-甲基-n-(2-n’,n’-二甲基-乙基)-苯甲醛的合成方法,(0.42g,72%)。1hnmr(400mhz,dmso-d6):δ=9.89(s,1h),8.73(s,2h),3.64(t,j=8.9hz,2h),3.45(t,j=8.8hz,2h),3.10(s,3h).lr-ms(esi-tof):calcd.forc8h12n3o[m+h]+:182.1.found:182.1.化合物ⅲ-11:参照化合物ⅲ-1的合成方法,(0.36g,96%)。1hnmr(400mhz,dmso-d6):δ=8.26(s,1h),8.73(s,2h),7.64(m,4h),3.64(t,j=8.9hz,2h),3.44(t,j=8.8hz,2h),3.11(s,3h).lr-hrms(esi-tof):calcd.forc17h16n5o[m+h]+:306.1355.found:306.1356.5-(n-甲基-n-羟乙基)氨基-2-醛基-嘧啶:参照化合物4-n-甲基-n-(2-n’,n’-二甲基-乙基)-苯甲醛的合成方法,(0.42g,72%)。1hnmr(400mhz,dmso-d6):δ=9.98(s,1h),8.21(s,2h),3.64(t,j=8.9hz,2h),3.44(t,j=8.8hz,2h),3.12(s,3h).lr-ms(esi-tof):calcd.forc8h12n3o2[m+h]+:182.1.found:182.1.1-氰基-1-(4-苯乙腈)-2-2-(5-(n-甲基-n-羟乙基)氨基-)嘧啶-乙烯:参照化合物ⅲ-1的合成方法,(0.56g,89%)。1hnmr(400mhz,dmso-d6):δ=8.21(s,2h),7.99(s,1h),7.64(s,4h),3.64(t,j=8.9hz,2h),3.44(t,j=8.8hz,2h),3.12(s,3h).lr-ms(esi-tof):calcd.forc17h16n5o[m+h]+:306.1.found:306.1.化合物ⅲ-12:参照化合物ⅲ-4的合成方法,(0.36g,96%)。1hnmr(400mhz,dmso-d6):δ=8.21(s,2h),7.99(s,1h),7.64(s,4h),3.77(t,j=6.5hz,2h),3.20(s,3h),2.56(m,2h),2.23(s,6h).lr-hrms(esi-tof):calcd.forc19h21n6[m+h]+:333.1828.found:333.1829.2-乙腈-5-氰基-吡啶:2-溴甲基-5-氰基吡啶(0.50g,2.5mmol)于100ml圆底烧瓶中,加入50mlthf溶解,ar保护条件下加入10mlnacn的2m的水溶液,油浴加热回流12h,反应完毕,体系冷却至室温,dcm萃取(3×100ml),合并有机相,分别用水、饱和食盐水洗涤(2×100ml),有机相用naso4干燥,减压除去溶剂,残余物经柱色谱纯化分离得2-乙腈-5-氰基吡啶(0.19g,56%)。1hnmr(400mhz,dmso-d6):δ=8.78(s,1h),7.95(m,1h),7.56(m,1h),4.01(s,2h).lr-ms(esi-tof):calcd.forc8h6n3[m+h]+:144.1.found:144.1.化合物ⅲ-13:参照化合物ⅲ-1的合成方法,(0.45g,95%)。1hnmr(400mhz,dmso-d6):δ=8.78(s,1h),8.21(s,1h),7.94(m,1h),7.86(d,j=8.0hz,2h),7.57(m,1h),6.80(d,j=8.0hz,2h),3.64(t,j=8.9hz,2h),3.44(t,j=8.8hz,2h),3.12(s,3h).lr-ms(esi-tof):calcd.forc18h17n4o[m+h]+:305.1402.found:305.1403.2-氰基-5-乙腈-吡嗪:2-氯-吡嗪-5-乙腈(0.32g,2.0mmol)、cucn(0.93g,10.0mmol)于100ml圆底烧瓶中,加入30ml干燥dmso溶解,ar保护条件下80℃油浴加热12h,反应完毕,体系倒入100ml水中,dcm萃取(4×50ml),合并有机相,分别用水、饱和食盐水洗涤(2×100ml),有机相用na2so4干燥,减压除去有机溶剂,残余物经柱色谱分离得2-氰基-吡嗪-5-乙腈(0.20g,69%)。1hnmr(400mhz,dmso-d6):δ=8.60(s,1h),8.48(s,1h),3.92(s,2h).lr-ms(esi-tof):calcd.forc7h5n4[m+h]+:145.1.found:145.1.化合物ⅲ-14:参照化合物ⅲ-1的合成方法,(0.25g,91%)。1hnmr(400mhz,dmso-d6):δ=8.60(s,1h),8.48(s,1h),8.11(s,1h),7.81(d,j=8.2hz,2h),6.84(d,j=8.2hz,2h),3.60(t,j=9.2hz,2h),3.46(t,j=9.2hz,2h),3.12(s,3h).lr-ms(esi-tof):calcd.forc17h16n5o[m+h]+:306.1355.found:306.1354.化合物ⅲ-15:参照化合物ⅲ-1的合成方法,(0.25g,91%)。1hnmr(400mhz,dmso-d6):δ=8.22(s,1h),8.00(d,j=9.1hz,1h),7.77–7.69(m,1h),7.43–7.34(m,1h),6.88(d,j=9.1hz,1h),4.81(t,j=5.2hz,1h),3.64–3.52(m,3h),3.09(s,1h).lr-hrms(esi-tof):calcd.forc19h18n3o2[m+h]+:320.1399.found:320.1397.化合物ⅲ-16:参照化合物ⅲ-1的合成方法,(0.29g,94%)。1hnmr(400mhz,dmso-d6):δ=8.11(2h,d,j=10.4hz),7.99(3h,dd,j=8.6,3.0hz),7.54(1h,dd,j=8.0,8.0hz),7.44(1h,dd,j=8.0,8.0hz),6.88(2h,d,j=9.2hz),4.82(1h,bt,t,j=5.2hz),3.60(2h,t,j=5.2hz),3.56(2h,t,j=5.2hz),3.09(3h,s).lr-hrms(esi-tof):calcd.forc19h18n3os[m+h]+:336.1171.found:336.1170.6-甲胺-苯并[b]噻吩-2-甲醛:6-溴苯并[b]噻吩-2-甲醛(0.42g,1.7mmol)、二甲基乙胺(40%水溶液,1g,8.9mmol)、cui(13.9mg,0.073mmol)、k3po4·h2o(155.4mg,0.73mmol)、甲胺(33%水溶液,1g)于100ml耐压瓶中,密封条件下60℃油浴加热12h,体系冷却至室温,加入50ml水,dcm萃取(3×100ml),合并有机相,na2so4干燥,减压除去有机溶剂,残余物经柱色谱分离纯化(0.23g,68%)。1hnmr(400mhz,dmso-d6):δ=9.92(1h,s),8.14(1h,s),7.82(1h,d,j=9.1hz),7.18(1h,d,j=2.1hz),7.01(1h,dd,j=9.1,2.3hz),3.05(3h,s).lr-ms(esi-tof):calcd.forc10h10nos[m+h]+:192.0.found:192.0.化合物ⅲ-17:参照化合物ⅲ-1的合成方法,(0.29g,94%)。1hnmr(400mhz,dmso-d6):δ=8.45(s,1h),7.92(d,j=8.6hz,2h),7.85(d,j=8.3hz,3h),7.73(dd,j=8.6,3.9hz,1h),7.21(d,j=1.9hz,1h),7.21(d,j=1.9hz,1h),6.96(dd,j=9.1,2.3hz,1h),3.05(s,3h).lr-hrms(esi-tof):calcd.forc19h14n3s[m+h]+:360.1171.found:360.1173.6-n-甲基-n-羟乙基-苯并[b]噻吩-2-甲醛:参照化合物6-甲胺-苯并[b]噻吩-2-甲醛的合成方法,(0.54g,79%)。1hnmr(400mhz,dmso-d6):δ=9.91(s,1h),8.14(s,1h),7.81(d,j=5.2hz,1h),7.17(d,j=2.0hz,1h),7.01(dd,j=2.0,8.8hz,1h),4.76(t,j=5.6hz,1h),3.58(t,j=4.2hz,2h),3.52(t,j=4.2hz,2h),3.04(s,3h).ms(esi):m/zcalcd.forc12h14no2s,[m+h]+:235.1.found236.1.化合物ⅲ-18:参照化合物ⅲ-1的合成方法,(0.21g,95%)。1hnmr(400mhz,dmso-d6):δ=8.45(s,1h),7.92(d,j=8.6hz,2h),7.85(d,j=8.3hz,3h),7.73(dd,j=8.6,3.9hz,1h),7.21(d,j=1.9hz,1h),7.21(d,j=1.9hz,1h),6.96(dd,j=9.1,2.3hz,1h),3.63–3.57(m,2h),3.52(t,j=5.7hz,2h),3.05(s,3h).lr-hrms(esi-tof):calcd.forc21h19n3os[m+h]+:360.1171.found:360.1173.5-n,n-二甲胺-2-醛基并二噻吩:参照化合物6-n-甲基-n-羟乙基-苯并[b]噻吩-2-甲醛的合成方法,(0.54g,79%)。1hnmr(400mhz,dmso-d6):δ=9.66(s,1h),8.05(s,1h),6.30(s,1h),4.88(bt,1h),3.07(s,6h).ms(esi):m/zcalcd.forc9h12nos2[m+h]+:214.0;found214.0.化合物ⅲ-19:参照化合物ⅲ-1的合成方法,(0.31g,90%)。1hnmr(400mhz,dmso-d6):δ=8.34(s,1h),7.86(d,j=8.0hz,2h),7.81(s,1h),7.77(d,j=8.0hz,2h),6.32(s,1h),4.88(t,j=4.0hz,1h),3.08(s,6h).lr-hrms(esi-tof):calcd.forc18h14n3s2[m+h]+:336.0629.found:336.0630.5-n,n-二乙胺-2-醛基并二噻吩:参照化合物6-n-甲基-n-羟乙基-苯并[b]噻吩-2-甲醛的合成方法,(0.44g,75%)。1hnmr(400mhz,dmso-d6):δ=9.78(s,1h),8.09(s,1h),6.30(s,1h),4.87(bt,1h),3.27(t,j=8.4hz,4h),1.26(t,j=8.4hz,4h).ms(esi):m/zcalcd.forc9h12nos2[m+h]+:214.0;found214.0.化合物ⅲ-20:参照化合物ⅲ-1的合成方法,(0.31g,90%)。1hnmr(400mhz,dmso-d6):δ=8.34(s,1h),7.86(d,j=8.0hz,2h),7.81(s,1h),7.77(d,j=8.0hz,2h),6.32(s,1h),4.88(t,j=4.0hz,1h),3.27(t,j=8.4hz,4h),1.26(t,j=8.4hz,4h).lr-hrms(esi-tof):calcd.forc20h18n3s2[m+h]+:364.0942.found:364.0943.实施例21:5-(n-甲基-n-羟乙基)氨基-2-醛基并二噻吩:参照化合物6-n-甲基-n-羟乙基-苯并[b]噻吩-2-甲醛的合成方法,(0.44g,75%)。1hnmr(400mhz,dmso-d6):δ=9.66(s,1h),8.05(s,1h),6.30(s,1h),4.88(bt,1h),3.64(t,j=5.6hz,2h),3.44(t,j=5.6hz,2h),3.07(s,3h).ms(esi):m/zcalcd.forc10h12no2s2[m+h]+:241.0;found242.0.化合物ⅲ-21:参照化合物ⅲ-1的合成方法,(0.31g,90%)。1hnmr(400mhz,dmso-d6):δ8.34(s,1h),7.86(d,j=8.0hz,2h),7.81(s,1h),7.77(d,j=8.0hz,2h),6.32(s,1h),4.88(t,j=4.0hz,1h),3.65(q,j=5.5hz,2h),3.44(t,j=5.5hz,2h),3.34(s,1h),3.08(s,3h).lr-hrms(esi-tof):calcd.forc19h16n3os2[m+h]+:366.0735.found:366.0736.应该理解,本说明书各实施例中的用量、反应条件等除非特别注明均为近似值,可根据实际情况略作改变而获得类似结果。除专门定义外,本文所使用的所有专业与科学用语与本领域技术人员所理解的含意相同。本文提及的所有文献都引入本申请作为参考。本说明书中描述的是作为示范用的优选实施方案,本领域技术人员可采用与本文所述相似的方法及材料实施本发明获得相同或相似的结果,对本发明所作的各种改动或修改仍属于本申请所附权利要求书限定的范围内。sequencelisting<110>华东理工大学<120>一种rna检测与定量的方法<130>2019-09-23<160>24<170>patentinversion3.3<210>1<211>47<212>rna<213>syntheticsequence<400>1ucccacuggcgccguagcuucggcuaccaaucguggcgugucgggga47<210>2<211>99<212>rna<213>syntheticsequence<400>2uugccauguguauguggguucgcccacauacucugaugaucccacuggcgccguagcuuc60ggcuaccaaucguggcgugucggggaucauucauggcaa99<210>3<211>112<212>rna<213>syntheticsequence<400>3gcccggauagcucagucgguagagcagcgcugcacuggcgccguagcuucggcuaccaau60cguggcgugucggcagcgcggguccaggguucaagucccuguucgggcgcca112<210>4<211>51<212>rna<213>syntheticsequence<400>4gggcccacuggcgccguagcuucggcuaccaaucguggcgugucggggccc51<210>5<211>51<212>rna<213>syntheticsequence<400>5gggcccacuggcgccguagcuucggcuaccaaucguggcgugucggggccc51<210>6<211>136<212>rna<213>syntheticsequence<400>6uugccauguguauguggguucgcccacauacucugaugaucccacuggcgccguagccac60uggcgccguagcuucggcuaccaaucguggcgugucgggcuaccaaucguggcgugucgg120ggaucauucauggcaa136<210>7<211>210<212>rna<213>syntheticsequence<400>7uugccauguguauguggguucgcccacauacucugaugaucccacuggcgccguagccac60uggcgccguagccacuggcgccguagccacuggcgccguagcuucggcuaccaaucgugg120cgugucgggcuaccaaucguggcgugucgggcuaccaaucguggcgugucgggcuaccaa180ucguggcgugucggggaucauucauggcaa210<210>8<211>358<212>rna<213>syntheticsequence<400>8uugccauguguauguggguucgcccacauacucugaugaucccacuggcgccguagccac60uggcgccguagccacuggcgccguagccacuggcgccguagccacuggcgccguagccac120uggcgccguagccacuggcgccguagccacuggcgccguagcuucggcuaccaaucgugg180cgugucgggcuaccaaucguggcgugucgggcuaccaaucguggcgugucgggcuaccaa240ucguggcgugucgggcuaccaaucguggcgugucgggcuaccaaucguggcgugucgggc300uaccaaucguggcgugucgggcuaccaaucguggcgugucggggaucauucauggcaa358<210>9<211>654<212>rna<213>syntheticsequence<400>9uugccauguguauguggguucgcccacauacucugaugaucccacuggcgccguagccac60uggcgccguagccacuggcgccguagccacuggcgccguagccacuggcgccguagccac120uggcgccguagccacuggcgccguagccacuggcgccguagccacuggcgccguagccac180uggcgccguagccacuggcgccguagccacuggcgccguagccacuggcgccguagccac240uggcgccguagccacuggcgccguagccacuggcgccguagcuucggcuaccaaucgugg300cgugucgggcuaccaaucguggcgugucgggcuaccaaucguggcgugucgggcuaccaa360ucguggcgugucgggcuaccaaucguggcgugucgggcuaccaaucguggcgugucgggc420uaccaaucguggcgugucgggcuaccaaucguggcgugucgggcuaccaaucguggcgug480ucgggcuaccaaucguggcgugucgggcuaccaaucguggcgugucgggcuaccaaucgu540ggcgugucgggcuaccaaucguggcgugucgggcuaccaaucguggcgugucgggcuacc600aaucguggcgugucgggcuaccaaucguggcgugucggggaucauucauggcaa654<210>10<211>130<212>rna<213>syntheticsequence<400>10ggggccccacuggcgccguagcuucggcuaccaaucguggcgugucgggggcccccuagc60uacuagcuagcaucgggggccccacuggcgccguagcuucggcuaccaaucguggcgugu120cgggggcccc130<210>11<211>280<212>rna<213>syntheticsequence<400>11ggggccccacuggcgccguagcuucggcuaccaaucguggcgugucgggggcccccuagc60uacuagcuagcaucgggggccccacuggcgccguagcuucggcuaccaaucguggcgugu120cgggggcccccuagcuacuagcuagcaucgggggccccacuggcgccguagcuucggcua180ccaaucguggcgugucgggggcccccuagcuacuagcuagcaucgggggccccacuggcg240ccguagcuucggcuaccaaucguggcgugucgggggcccc280<210>12<211>580<212>rna<213>syntheticsequence<400>12ggggccccacuggcgccguagcuucggcuaccaaucguggcgugucgggggcccccuagc60uacuagcuagcaucgggggccccacuggcgccguagcuucggcuaccaaucguggcgugu120cgggggcccccuagcuacuagcuagcaucgggggccccacuggcgccguagcuucggcua180ccaaucguggcgugucgggggcccccuagcuacuagcuagcaucgggggccccacuggcg240ccguagcuucggcuaccaaucguggcgugucgggggcccccuagcuacuagcuagcaucg300ggggccccacuggcgccguagcuucggcuaccaaucguggcgugucgggggcccccuagc360uacuagcuagcaucgggggccccacuggcgccguagcuucggcuaccaaucguggcgugu420cgggggcccccuagcuacuagcuagcaucgggggccccacuggcgccguagcuucggcua480ccaaucguggcgugucgggggcccccuagcuacuagcuagcaucgggggccccacuggcg540ccguagcuucggcuaccaaucguggcgugucgggggcccc580<210>13<211>200<212>rna<213>syntheticsequence<400>13ggggcccacuggcgccguagccacuggcgccguagcuucggcuaccaaucguggcguguc60gggcuaccaaucguggcgugucggggcccccuagcuacuagcuagcaucgggggcccacu120ggcgccguagccacuggcgccguagcuucggcuaccaaucguggcgugucgggcuaccaa180ucguggcgugucggggcccc200<210>14<211>420<212>rna<213>syntheticsequence<400>14ggggcccacuggcgccguagccacuggcgccguagcuucggcuaccaaucguggcguguc60gggcuaccaaucguggcgugucggggcccccuagcuacuagcuagcaucgggggcccacu120ggcgccguagccacuggcgccguagcuucggcuaccaaucguggcgugucgggcuaccaa180ucguggcgugucggggcccccuagcuacuagcuagcaucgggggcccacuggcgccguag240ccacuggcgccguagcuucggcuaccaaucguggcgugucgggcuaccaaucguggcgug300ucggggcccccuagcuacuagcuagcaucgggggcccacuggcgccguagccacuggcgc360cguagcuucggcuaccaaucguggcgugucgggcuaccaaucguggcgugucggggcccc420<210>15<211>860<212>rna<213>syntheticsequence<400>15ggggcccacuggcgccguagccacuggcgccguagcuucggcuaccaaucguggcguguc60gggcuaccaaucguggcgugucggggcccccuagcuacuagcuagcaucgggggcccacu120ggcgccguagccacuggcgccguagcuucggcuaccaaucguggcgugucgggcuaccaa180ucguggcgugucggggcccccuagcuacuagcuagcaucgggggcccacuggcgccguag240ccacuggcgccguagcuucggcuaccaaucguggcgugucgggcuaccaaucguggcgug300ucggggcccccuagcuacuagcuagcaucgggggcccacuggcgccguagccacuggcgc360cguagcuucggcuaccaaucguggcgugucgggcuaccaaucguggcgugucggggcccc420cuagcuacuagcuagcaucgggggcccacuggcgccguagccacuggcgccguagcuucg480gcuaccaaucguggcgugucgggcuaccaaucguggcgugucggggcccccuagcuacua540gcuagcaucgggggcccacuggcgccguagccacuggcgccguagcuucggcuaccaauc600guggcgugucgggcuaccaaucguggcgugucggggcccccuagcuacuagcuagcaucg660ggggcccacuggcgccguagccacuggcgccguagcuucggcuaccaaucguggcguguc720gggcuaccaaucguggcgugucggggcccccuagcuacuagcuagcaucgggggcccacu780ggcgccguagccacuggcgccguagcuucggcuaccaaucguggcgugucgggcuaccaa840ucguggcgugucggggcccc860<210>16<211>75<212>rna<213>syntheticsequence<400>16ggggcccacuggcgccucagggaagaaacuguggcacuucggugccagcugacaaucgug60gcgugucggggcccc75<210>17<211>67<212>rna<213>syntheticsequence<400>17ggggcccacuggcgccuaauagaagagcacguauacgcaaauuacaaucguggcgugucg60gggcccc67<210>18<211>172<212>rna<213>syntheticsequence<400>18ccaucgggcccacuggcgccguagccacuggcgccguagccacuggcgccguagccacug60gcgccguagcuucggcuaccaaucguggcgugucgggcuaccaaucguggcgugucgggc120uaccaaucguggcgugucgggcuaccaaucguggcgugucggggcccgaugg172<210>19<211>1203<212>rna<213>syntheticsequence<400>19auggggaaggugaaggucggagucaacggauuuggucguauugggcgccuggucaccagg60gcugcuuuuaacucugguaaaguggauauuguugccaucaaugaccccuucauugaccuc120aacuacaugguuuacauguuccaauaugauuccacccauggcaaauuccauggcaccguc180aaggcugagaacgggaagcuugucaucaauggaaaucccaucaccaucuuccaggagcga240gaucccuccaaaaucaaguggggcgaugcuggcgcugaguacgucguggaguccacuggc300gucuucaccaccauggagaaggcuggggcucauuugcaggggggagccaaaagggucauc360aucucugcccccucugcugaugcccccauguucgucaugggugugaaccaugagaaguau420gacaacagccucaagaucaucagcaaugccuccugcaccaccaacugcuuagcaccccug480gccaaggucauccaugacaacuuugguaucguggaaggacucaugaccacaguccaugcc540aucacugccacccagaagacuguggauggccccuccgggaaacuguggcgugauggccgc600ggggcucuccagaacaucaucccugccucuacuggcgcugccaaggcugugggcaagguc660aucccugagcugaacgggaagcucacuggcauggccuuccguguccccacugccaacgug720ucagugguggaccugaccugccgucuagaaaaaccugccaaauaugaugacaucaagaag780guggugaagcaggcgucggagggcccccucaagggcauccugggcuacacugagcaccag840guggucuccucugacuucaacagcgacacccacuccuccaccuuugacgcuggggcuggc900auugcccucaacgaccacuuugucaagcucauuuccugguaugacaacgaauuuggcuac960agcaacagggugguggaccucauggcccacauggccuccaaggaguaacucgcuagagca1020ugguuaagcuuccaucgggcccacuggcgccguagccacuggcgccguagccacuggcgc1080cguagccacuggcgccguagcuucggcuaccaaucguggcgugucgggcuaccaaucgug1140gcgugucgggcuaccaaucguggcgugucgggcuaccaaucguggcgugucggggcccga1200ugg1203<210>20<211>571<212>rna<213>syntheticsequence<400>20ugggaaauacacauuugcugcucacauggauggaacauacaaauuuuguuuuaguaaccg60gauguccaccaugacuccaaaaauagugauguucaccauugauauuggggaggcuccaaa120aggacaagauauggaaacagaagcucaccagaacaagcuagaagaaaugaucaaugagcu180agcaguggcgaugacagcuguaaagcacgaacaggaauacauggaaguccgggagagaau240acacagagccaucaacgacaacacaaacagcagagugguccuuugguccuucuuugaagc300ucuuguucuaguugccaugacauugggacagaucuacuaccugaagagauuuuuugaagu360ccggagaguuguuuaacucgcuagagcaugguuaagcuuccaucgggcccacuggcgccg420uagccacuggcgccguagccacuggcgccguagccacuggcgccguagcuucggcuacca480aucguggcgugucgggcuaccaaucguggcgugucgggcuaccaaucguggcgugucggg540cuaccaaucguggcgugucggggcccgaugg571<210>21<211>142<212>rna<213>syntheticsequence<400>21gaaucugcaaguggauauuguuugagagcuaggccccacuggcgccguagcuucggcuac60caaucguggcgugucgggggccuagcaaguucaaauaaggcuaguccguuaucaacuuga120aaaaguggcaccgagucggugc142<210>22<211>142<212>rna<213>syntheticsequence<400>22gaaucugcaaguggauauuguuugagagcuagaaauagcaaguucaaauaaggcuagucc60guucucaacuuggccccacuggcgccguagcuucggcuaccaaucguggcgugucggggg120ccaaguggcaccgagucggugc142<210>23<211>189<212>rna<213>syntheticsequence<400>23gaaucugcaaguggauauuguuugagagcuaggccccacuggcgccguagcuucggcuac60caaucguggcgugucgggggccuagcaaguucaaauaaggcuaguccguuaucaacuugg120ccccacuggcgccguagcuucggcuaccaaucguggcgugucgggggccaaguggcaccg180agucggugc189<210>24<211>911<212>rna<213>syntheticsequence<400>24augagcgagcugauuaaggagaacaugcacaugaagcuguacauggagggcaccguggac60aaccaucacuucaagugcacauccgagggcgaaggcaagcccuacgagggcacccagacc120augagaaucaagguggucgagggcggcccucuccccuucgccuucgacauccuggcuacu180agcuuccucuacggcagcaagaccuucaucaaccacacccagggcauccccgacuucuuc240aagcaguccuucccugagggcuucacaugggagagagucaccacauacgaagacgggggc300gugcugaccgcuacccaggacaccagccuccaggacggcugccucaucuacaacgucaag360aucagaggggugaacuucacauccaacggcccugugaugcagaagaaaacacucggcugg420gaggccuucaccgagacgcuguaccccgcugacggcggccuggaaggcagaaacgacaug480gcccugaagcucgugggcgggagccaucugaucgcaaacaucaagaccacauauagaucc540aagaaacccgcuaagaaccucaagaugccuggcgucuacuauguggacuacagacuggaa600agaaucaaggaggccaacaacgagaccuacgucgagcagcacgagguggcaguggccaga660uacugcgaccucccuagcaaacuggggcacaagcucaauuaacacucgcuagagcauggu720ugguaccguagucaagcuuccaucgggcccacuggcgccguagccacuggcgccguagcc780acuggcgccguagccacuggcgccguagcuucggcuaccaaucguggcgugucgggcuac840caaucguggcgugucgggcuaccaaucguggcgugucgggcuaccaaucguggcgugucg900gggcccgaugg911当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1