一株防治西洋参土传病害和提高产量的木霉菌株HB20111及其应用的制作方法
本发明涉及一株防治西洋参土传病害的菌株、防治病害、促生长提高西洋参出苗率和鲜重等方面的应用,属于菌株及其应用
技术领域:
,具体为一株防治西洋参土传病害和提高产量的木霉菌株hb20111及其应用。
背景技术:
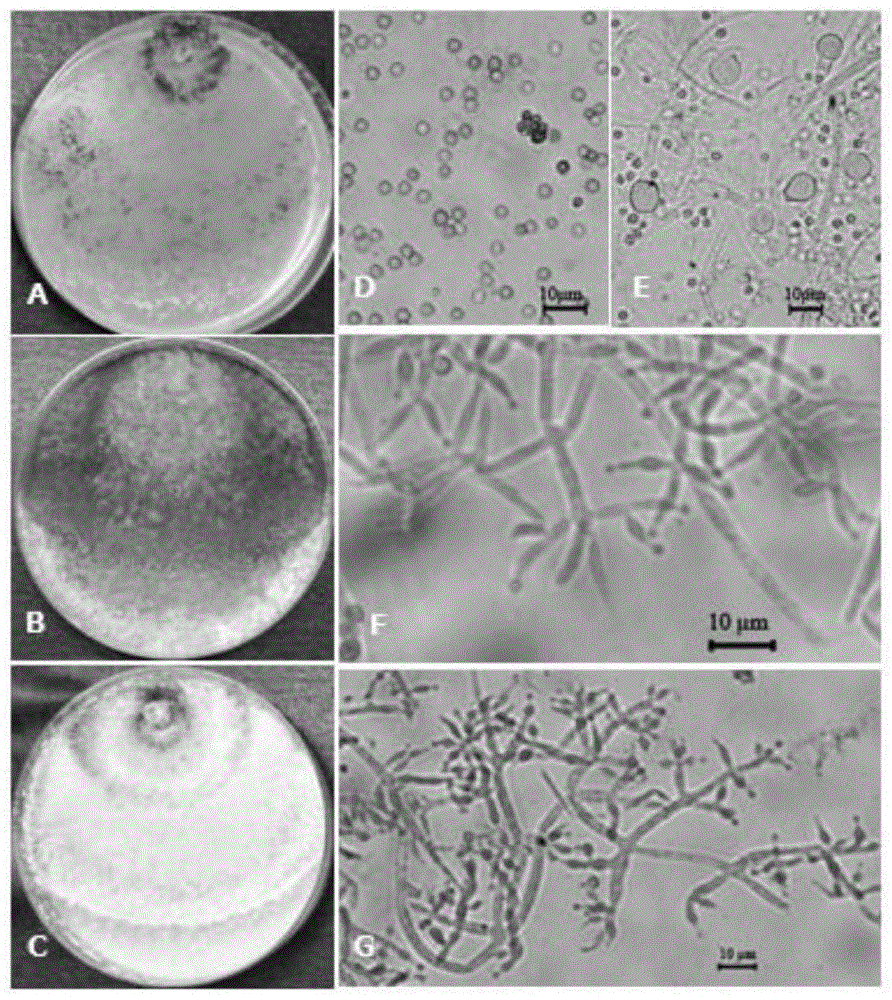
:西洋参(panaxquinquefoliuml.)是五加科人参属植物,多年生草本。是药食同源性食物,属名贵的高级保健品,临床研究表明,西洋参具有提高免疫力、保护心脑血管系统、调节中枢神经功能和抗肿瘤、降血压等多方面的药理活性。但连作障碍带来的西洋参病虫害发生严重,产量明显降低甚至绝产;而化学农药的过量施用导致西洋参成品药物残留超标,使其品质下降,从而造成产量与品质下降。连作障碍已成为制约西洋参产业发展的主要阻力。研究表明,造成西洋参连作障碍的主要因素之一是根际微生态环境失衡以及病虫害等因素,因此,筛选具有平衡根际微生态环境、防治土传病害等功能的微生物菌株,研发微生物菌剂及应用技术,成为解决西洋参连作障的绿色、生态、环保技术。木霉菌(trichodermaspp.)已作为一种防治土传病害、生物安全、无污染、无残留的高效生防菌株被业界认可,本研究室曾研究发现木霉菌ltr-2具有消除草酸的作用,进而降低灰霉病原菌的致病力;因此,本研究通过筛选能够消解酚酸类物质、防治立枯病、锈腐病、根腐病等病原菌、并通过田间小区试验进而筛选具有平衡根际微生态环境的木霉菌株,研发木霉菌菌剂及应用技术,构建木霉菌绿色防控西洋参土传病害和解除西洋参连作障碍的技术体系,为西洋参产业健康、可持续发展和乡村振兴计划提供技术支撑。技术实现要素:针对现有技术西洋参连作障碍造成的土传病害、产量降低等一系列问题,本发明提供一株木霉菌株hb20111及其应用,本发明的木霉菌株具体为一株防治西洋参土传病害的木霉菌株hb20111,木霉菌株hb20111是从滨州黄河边采集的土样中分离获得的,具有防治立枯病、锈腐病、根腐病等多种土传病害的能力。本发明的技术方案为:一株木霉菌株hb20111,在中国微生物菌种保藏管理委员会普通微生物中心保藏,其保藏编号是:cgmccno.16963,保藏日期为2018年12月5日,地址:北京市朝阳区北辰西路1号院3号,邮编:100101,分类命名:深绿木霉trichodermaatroviride。经形态学与its序列分析,将hb20111鉴定为深绿木霉(t.atroviride)。木霉菌株hb20111具有广谱抗性,在pda平板上对供试8种病原真菌均有拮抗作用。本发明的木霉菌株hb20111在防治西洋参土传病害的应用。进一步的,该木霉菌株hb20111用于防治西洋参的立枯病、锈腐病、根腐病。进一步的,该木霉菌株hb20111用于拮抗西洋参病原真菌。进一步的,该木霉菌株hb20111用于拮抗西洋参立枯病菌(rhizoctoniasolanikuehn)、西洋参黑斑病菌(alternariapanaxwhetz)、西洋参疫病菌(phytophthoracactorum)、西洋参猝倒病菌(pythiumdelaryanumhess)、西洋参锈腐病菌(cylindrocarpondestructans)、西洋参灰霉病菌(botrytiscinerea)、西洋参炭疽病菌(colletotrichumpanacicolauyedaettakim)、西洋参根腐病菌(fusariumsolani)。本发明的木霉菌株hb20111在西洋参促生长方面的应用。进一步的,采用木霉菌株hb20111发酵培养获得的分生孢子防治西洋参土传病害或促西洋参生长;具体为采用分生孢子母药或由分生孢子母药制备得到的菌剂,用于土壤处理、拌种、蘸根、灌根和喷雾。所述的分生孢子母药的制备方法为,(1)斜面培养:采用pda培养基,将菌株hb20111接种在试管培养基上,28℃培养2-3d;(2)三角瓶培养:采用pdb培养基,将试管菌种接种在液体三角瓶中,置于摇床上28℃振荡培养1d;(3)液体培养:采用液体发酵培养基,115℃灭菌30min,将菌种接种到发酵罐,接种量0.1%(v/v),28℃培养,通气量1:0.5-1.0,搅拌速度为160r/min,培养1-2d;(4)固体培养:采用固体发酵培养基,121℃灭菌30min,在拌料罐中将液体菌种与固体培养基混合均匀,接种量为2-5%(v/v),接种完毕转移到固体培养室,培养基厚度为3-4cm,料温控制在28±2℃,室温控制在22-25℃,培养室空气的相对含水量为95-100%,培养时间为3-4d;(5)孢子收集:培养后用生理盐水洗脱分生孢子,5000r/min以上离心10min,收集沉淀,得到分生孢子;(6)分生孢子母药制备:将上述分生孢子与硅藻土按照1:10进行充分混匀,过80筛后备用;步骤(3)中,液体发酵培养基为,玉米粉2%,葡萄糖0.5%,豆饼粉4%,k2hpo40.2%,kh2po40.3%,余量为水,ph6.0-6.5。步骤(4)中,固体发酵培养基为,玉米粉1.0%,麸皮42.2%,稻壳5.0%,余量为水。进一步的,菌剂的制备方法为,将上获得的分生孢子母药按照羧甲基纤维素钠3%,木霉母药2%,用麦饭石或硅藻土补足至100%。该菌剂优选为可湿性粉剂。本发明的有益效果在于,木霉菌株hb20111对西洋参立枯病的小区效果显著,与其它处理间存在显著性差异(p<0.05),第1年拌种处理对西洋参立枯病的防治效果、单株参增重率及总参增重率分别达71.81%、33.54%和92.75%;第2年蘸根处理对西洋参立枯病的防治效果、单株参增重率及总参增重率分别达91.04%、158.06%和1369.34%。示范区(荣成市大疃镇贺家庄村)现场调查一年生参苗,清水、木霉菌株hb20111菌剂、2.5%咯菌腈拌种,次年西洋参出苗率分别达到50.77%,89.23%,79.62%,木霉hb20111菌剂防治立枯病效果达到78.12%,2.5%咯菌腈防治效果58.60%。总之,本发明采用木霉菌株hb20111,解决了西洋参连作障碍造成的土传病害、产量降低等一系列问题,为西洋参土传病害绿色种植提供解决方案。附图说明为了更清楚地说明本发明实施例或现有技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1木霉菌株hb20111的形态学特征。注:a-c:25℃培养7d的菌落特征(a:sna,b:pda,c:cmd);d分生孢子;e厚垣孢子;f-g分生孢子梗和瓶梗;标尺10μm。图2木霉菌株hb20111的系统发育进化树。图3木霉菌株hb20111的抑菌谱。图4木霉菌株hb20111对病原真菌5d的平板抑制作用。图5木霉菌株hb20111对病原真菌7d的平板抑制作用。图6木霉菌株hb20111、清水拌种后一年生西洋参对照图(左:清水,右:木霉拌种)。具体实施方式为了使本
技术领域:
的人员更好地理解本发明中的技术方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。实施例1木霉hb20111的分离与鉴定菌株hb20111是利用木霉选择性培养基pdam(pda+300mg/l氯霉素+100mg/l链霉素+20mg/l玫瑰红+0.05%tritonx-100),从滨州黄河边采集的土样中分离获得的。称取10g土样,放入添加90ml0.9%nacl的盐水三角瓶中,28℃,160r/min,振荡1h充分混匀,取1ml混入含9ml0.9%nacl的盐水试管中,涡旋震荡混匀,依次进行梯度稀释,各梯度取1ml加入90mm的培养皿中。pda培养基冷却至60℃以下,加入300mg/l氯霉素,100mg/l链霉素,20mg/l玫瑰红和0.05%tritonx-100,每个培养皿中倒入约20ml培养基,轻轻旋转混匀使培养皿中样品均匀分散在培养基中,28℃培养3-4d,分离筛选疑似木霉的菌株进行鉴定。木霉菌株hb20111的形态特征见图1。菌株hb20111在sna培养基上20℃、25℃、30℃、35℃培养72h,菌落半径分别为15.0-17.0mm、26.0-28.5mm、30.0-32.0mm、2.5-4.0mm,高于40℃不生长,最适生长温度为25-30℃。在sna培养基上25℃培养7d,菌落表面气生菌丝疏松,分生孢子绿色,产生锯齿状同心轮纹,边缘有绿色产孢簇,基质中无水溶性色素分布,菌落反面无色。在pda培养基上20℃、25℃、30℃、35℃培养72h,菌落半径分别为43.0-44.5mm、56.5-58.5mm、40.0-42.0mm、2.0-3.5mm,高于40℃不生长,最适生长温度为25-30℃。在pda培养基上25℃培养7d,菌落表面呈丝绒状,边界清晰,中央有一菌丝相对致密的圆盘状结构,是分生孢子的主要产生区域,分生孢子绿色浓密,菌落反面白色,有椰香味气体产生。在cmd培养基上25℃培养7d,菌落表面呈粉尘颗粒状,菌丝疏松、有两圈绿色同心轮纹,菌落边缘分布直径为2.0-3.0mm的产孢簇,分生孢子绿色,菌落反面白色,基质中无水溶性色素产生,有椰子气味。分生孢子梗分枝特征与深绿木霉(t.atroviride)一致,为典型的单侧分枝,分枝角度近似90°,但也常见成对着生分枝。瓶梗长度(4.2-)6.0-9.7(-15.0)μm,长宽比例(1.1-)1.8-3.5(-6.3),基部宽度为(1.2-)1.7-2.5(-3.5)μm,无间生瓶梗。分生孢子绿色,亚球型或卵圆形,表面光滑,(2.3-)2.8-3.5(-4.0)μm,长宽比例为(0.8-)1.0-1.3(-1.6)。在cmd培养基上25℃培养7d可产生大量的厚垣孢子,球形至亚球形,端生或间生,直径为(5.0-)8.5-7.5(-11.0)μm。菌株hb20111的its序列为608bp,在genbank上的登录号为eu272523.1,经www.isth.info中的trichokey进行比对,分别在73、94、241、399、503处发现了木霉的5个dna寡核苷酸条形编码,种类鉴定结果表明菌株hb20111为深绿木霉(t.atroviride)。将its序列提交ncbi进行比对,菌株hb20111与t.atroviride菌株accc32886[mf871543.1]同源性最高,为100.0%。选取ncbi中与菌株hb20111的its同源性较高的序列构建系统发育进化树,结果见图2。进化树中hb20111与t.atroviride位于同一分枝,同源性最高,故hb20111应为t.atroviride。实施例2木霉hb20111抑菌谱测定病原真菌为西洋参立枯病菌(rhizoctoniasolanikuehn)、西洋参黑斑病菌(alternariapanaxwhetz)、西洋参疫病菌(phytophthoracactorum)、西洋参猝倒病菌(pythiumdelaryanumhess)、西洋参锈腐病菌(cylindrocarpondestructans)、西洋参灰霉病菌(botrytiscinerea)、西洋参炭疽病菌(colletotrichumpanacicolauyedaettakim)、西洋参根腐病菌(fusariumsolani)。利用对峙实验测定木霉的抑菌谱,pda平板直径两端距中心35mm处分别接种直径5mm的木霉菌株和病原真菌,以只接种病原真菌为对照,25℃培养7d,对于生长缓慢的病原真菌,预培养1-2d后再接种木霉对峙培养,记录病原真菌对峙方向生长半径,计算抑制率。抑制率%=100%×(r02-r2)/r02其中r0为对照病菌生长半径,r为与木霉对峙培养的病菌生长半径。木霉菌株hb20111在pda平板上对供试8种西洋参病原真菌均有拮抗作用,对不同病原真菌的抑制率间存在极显著性差异(p<0.01),其中对r.solani、f.solani、b.cinerea、p.delaryanum、c.panacicola抑制效果最好,25℃对峙培养6d的抑制率均达到了98.5%以上,结果见图3、图4及图5。实施例3木霉hb20111菌剂的制备(1)斜面培养:采用pda培养基,将菌株hb20111接种在试管培养基上,28℃培养2-3d;(2)三角瓶培养:采用pdb培养基,将试管菌种接种在液体三角瓶中,置于摇床上28℃振荡培养1d;(3)液体培养:采用液体发酵培养基,115℃灭菌30min,将菌种接种到发酵罐,接种量0.1%(v/v),28℃培养,通气量1:0.5-1.0,搅拌速度为160r/min,培养1-2d;(4)固体培养:采用固体发酵培养基,121℃灭菌30min,在拌料罐中将液体菌种与固体培养基混合均匀,接种量为2-5%(v/v),接种完毕转移到固体培养室,培养基厚度为3-4cm,料温控制在28±2℃,室温控制在22-25℃,培养室空气的相对含水量为95-100%,培养时间为3-4d;(5)孢子收集:培养后用生理盐水洗脱分生孢子,5000r/min以上离心10min,收集沉淀,得到分生孢子;(6)母药制备:将上述分生孢子与硅藻土按照1:10进行充分混匀,过80筛后备用。(7)菌剂制备:将上述母药按照羧甲基纤维素钠3%,木霉母药2%,用麦饭石或硅藻土补足至100%。步骤(3)中,液体发酵培养基为,玉米粉2%,葡萄糖0.5%,豆饼粉4%,k2hpo40.2%,kh2po40.3%,余量为水,ph6.0-6.5。步骤(4)中,固体发酵培养基为,玉米粉1.0%,麸皮42.2%,稻壳5.0%,余量为水。实施例4木霉hb20111菌剂拌种处理对西洋参立枯病的小区防治效果试验试验于2015.10.30-2016.11.7,在山东省荣成市上庄镇东上庄村西洋参种植地进行,该地块上年立枯病发病率中等偏上。试验设5个处理:1#,ck(清水对照);2#,化学药剂,2.5%咯菌腈悬浮种衣剂,10ml稀释5倍后拌种2-3kg西洋参种子;3#,hb20111可湿性粉剂,200-300g稀释5倍拌种10kg西洋参种子;4#,qt21979可湿性粉剂,200-300g稀释5倍拌种10kg西洋参种子;5#,tw21990可湿性粉剂,200-300g稀释5倍拌种10kg西洋参种子。其中qt21979和tw21990是本实验室筛选的另2株生防木霉,小区面积10m2,设保护行,随机分布,每处理设3个重复,常规管理。西洋参完全出苗后28d调查出苗率,每处理随机抽取5行进行调查,计算防治效果。于2016.10.20-11.10期间挖出参苗,统计1年生单参鲜重和每个处理的总参重,计算增重率。死苗率%=100%×(1-出苗率)防治效果%=100%×(对照死苗率-处理死苗率)/对照死苗率1年单参增重率%=100%×(处理组单参重-对照组单参重)/对照组单参重1年总参增重率%=100%×(处理组总参重-对照组总参重)/对照组总参重结果见表1和图6。木霉处理和化学包衣处理对西洋参立枯病均有一定的防治效果,木霉hb20111效果最好,与化学包衣处理间存在极显著性差异(p<0.01),与其它2株木霉间也存在显著性差异(p<0.05),hb20111拌种处理后防治效果达到了71.81%。木霉对西洋参有促生长作用,其中菌株hb20111效果最好,与其它处理间存在显著性差异(p<0.05),对1年生西洋参的单株参增重率和总参增重率分别达33.54%和92.75%。表1木霉可湿性粉剂拌种处理对西洋参立枯病的小区防治效果(1年生参)注:采用spss21.0统计软件中的duncan’s方法进行分析,结果为3次重复的平均值±标准差,不同小写字母表示各处理间在0.05水平上存在显著性差异,不同大写字母表示各处理间在0.01水平上存在极显著性差异。实施例5木霉hb20111菌剂蘸根处理对西洋参立枯病的小区防治效果试验试验期为2016.11.7-2017.10.11,在实施例6的基础上,挖取1年生参苗,蘸根后栽植。试验设5个处理:1#,ck(清水对照);2#,化学药剂对照,33.5g/l精甲霜灵+25g/l咯菌腈10g兑水30kg蘸根1min;3#,hb20111可湿性粉剂稀释50倍蘸根10min;4#,qt21979可湿性粉剂稀释50倍蘸根10min;5#,tw21990可湿性粉剂稀释50倍蘸根10min。小区面积5m2,设保护行,随机分布,每处理设3个重复,常规管理。第二年出苗后30-40d后调查出苗率,每处理随机抽取5行进行调查,计算防治效果;参苗种植2年后调查单株参鲜重及小区总参重,计算增重率。死苗率%=100%×(1-出苗率)防治效果%=100%×(对照死苗率-处理死苗率)/对照死苗率2年单参增重率%=100%×(处理组单参重-对照组单参重)/对照组单参重2年总参增重率%=100%×(处理组总参重-对照组总参重)/对照组总参重结果见表2。各处理组的死苗率与清水对照间存在极显著性差异(p<0.01),但木霉qt21979处理与与化学包衣间无差异,木霉tw21990处理与与化学包衣间存在显著性差异(p<0.05),木霉hb20111效果最好,与化学包衣间存在极显著性差异(p<0.01),蘸根处理后防治效果达到了91.04%。3株木霉处理后的西洋参单株参鲜重与清水对照及化学包衣间均存在极显著性差异(p<0.01),其中hb20111效果最好,2年生单株参增重率达到了158.06%。3株木霉处理后的西洋参总鲜重与清水对照及化学包衣间均存在极显著性差异(p<0.01),其中hb20111效果最好,2年生总参增重达到了1369.34%。表2木霉可湿性粉剂蘸根处理对西洋参立枯病的小区防治效果(2年生参)注:采用spss21.0统计软件中的duncan’s方法进行分析,结果为3次重复的平均值±标准差,不同小写字母表示各处理间在0.05水平上存在显著性差异,不同大写字母表示各处理间在0.01水平上存在极显著性差异。实施例6木霉hb20111菌剂应用示范示范区位于荣成市大疃镇贺家庄村,西洋参分别用清水、木霉hb20111、2.5%咯菌腈拌种处理,现场调查一年生参苗。结果见表3。清水、木霉hb20111、2.5%咯菌腈处理后,次年西洋参出苗率分别达到50.77%、89.23%和79.62%,各处理间存在极显著性差异(p<0.01),2.5%咯菌腈防治效果58.60%,而木霉hb20111效果最好,对西洋参立枯病的防治效果达到78.12%。表3木霉hb20111菌剂防治西洋参立枯病大田示范结果处理出苗率/%防治效果/%对照50.77±0.677c-hb2011189.23±2.107a78.122.5%咯菌腈79.62±3.477b58.60注:采用spss21.0统计软件中的duncan’s方法进行分析,结果为3次重复的平均值±标准差,不同小写字母表示各处理间在0.05水平上存在显著性差异,不同大写字母表示各处理间在0.01水平上存在极显著性差异。尽管通过参考附图并结合优选实施例的方式对本发明进行了详细描述,但本发明并不限于此。在不脱离本发明的精神和实质的前提下,本领域普通技术人员可以对本发明的实施例进行各种等效的修改或替换,而这些修改或替换都应在本发明的涵盖范围内/任何熟悉本
技术领域:
的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应所述以权利要求的保护范围为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1