细胞的端粒延长方法与流程
本发明涉及细胞的端粒延长方法,更详细地,涉及通过向细胞直接或间接地提供物理性刺激来延长上述细胞的端粒的方法及端粒通过上述方法延长的细胞。
背景技术:
:端粒(telomere)为染色体两末端的dna重复结构(在人类中为ttaggg)。端粒与端粒蛋白复合体(shelterin)相结合而形成具有调节细胞的扩增能力并防止在细胞分裂时染色体之间的结合和遗传信息的缺失的作用的保护套。dna聚合酶无法扩增所有的3'末端,因此每当细胞分裂时端粒变短30bp至200bp。若端粒短于阈值而接近于编码dna且无法维持端粒环(loop)结构,则所暴露的端粒被p53或p16ink4a信号传达体系识别而导致细胞分裂停止,从而导致衰老而凋亡。端粒可由作为逆转录酶的端粒酶(telomerase)延长,人类的端粒酶复合体由作用为端粒合成的模板的作为rna分子的terc、作为催化剂子单元的tert和dkc1及tep1等辅助蛋白构成。在正常情况下,在体细胞中几乎不存在端粒酶活性,而只在需要活跃的分裂能力的干细胞及前体细胞中感测到其高活性。若端粒变短且多个细胞的分裂被中断,则会产生多种问题,尤其,以衰老(aging)和衰退(degeneration)代表的多种症状。据了解,如由皮肤组织衰退引起的先天性角化不良症(dyskeratosiscongenita)及由血液细胞缺乏引起的再生障碍性贫血(aplasticanemia)等在骨髓细胞的再生出现问题的疾病是由端粒酶或包含其的端粒蛋白复合体相关基因的突变等端粒维持功能异常导致的。最近,鉴于患有高血压、代谢综合征、糖尿病、痴呆症等与衰老有关的疾病的患者们的端粒比正常人的端粒短的研究结果,对可通过延长端粒的长度来延迟衰老的可能性的研究具有说服力。并且,在通常几乎没有端粒酶的活性的体细胞中增加端粒酶活性,从而可活跃地进行再生活动,尤其据报道,在由于烧伤、负伤、衰老及疾病而需要补充心肌、肝、角膜、皮肤、血管、软骨及骨等各种组织、免疫细胞、血液细胞等的情况下,具有效果。但是,也有在持续过表达可延长端粒的长度的基因的鼠中大量产生癌细胞的长的端粒会成为导致癌症发病的危险因素的研究结果。因此,可预测到,若只要能够临时延长端粒,则在没有发生癌症危险的情况下,缓解与各种衰老及衰退有关的症状,尤其在再生医学领域中有用。根据如上所述的所预测到的多种效用,研发了用于延长端粒的多种方法。美国公开专利第2018-0280413中公开了包含用于增加端粒酶活性的化合物的药学组合物,为此,需要合成化合物的过程,而且用于使上述组合物产生效果的时间长。并且,这种化合物的效果持续时间相当长,但若端粒酶活性持续高,存在发生癌症的危险。欧洲公开专利第2959005号中公开了编码端粒酶的核酸,这不仅需要合成过程,而且由于核酸为亲水性,因此为了传递至细胞内而需要额外的载体。韩国公开专利第10-2018-0123512号中公开了来源于端粒酶的肽,而这不仅需要合成过程,而且每周注射3次,且注射两个月,而在一个月之后测量时才产生效果,因此繁琐且在费用方面可存在问题。因此,需要在合成等的费用和时间方面更加合理、安全、效率好的端粒延长方法。技术实现要素:发明所要解决的问题本发明为了解决如上所述的问题而提出,根据本发明一实施例的延长端粒的方法的特征在于,包括向细胞直接或间接地提供物理性刺激的步骤;以及培养上述细胞及培养基的混合物规定时间的步骤,上述直接地提供刺激是指向包含细胞的培养基施加物理性刺激,上述间接地提供刺激是指向不包含细胞的培养基施加物理性刺激后混合上述培养基和细胞。并且,本发明一实施例提供端粒通过物理性刺激延长的细胞。本发明所要实现的技术问题并不限定于在上面所提及的技术问题,本发明所属
技术领域:
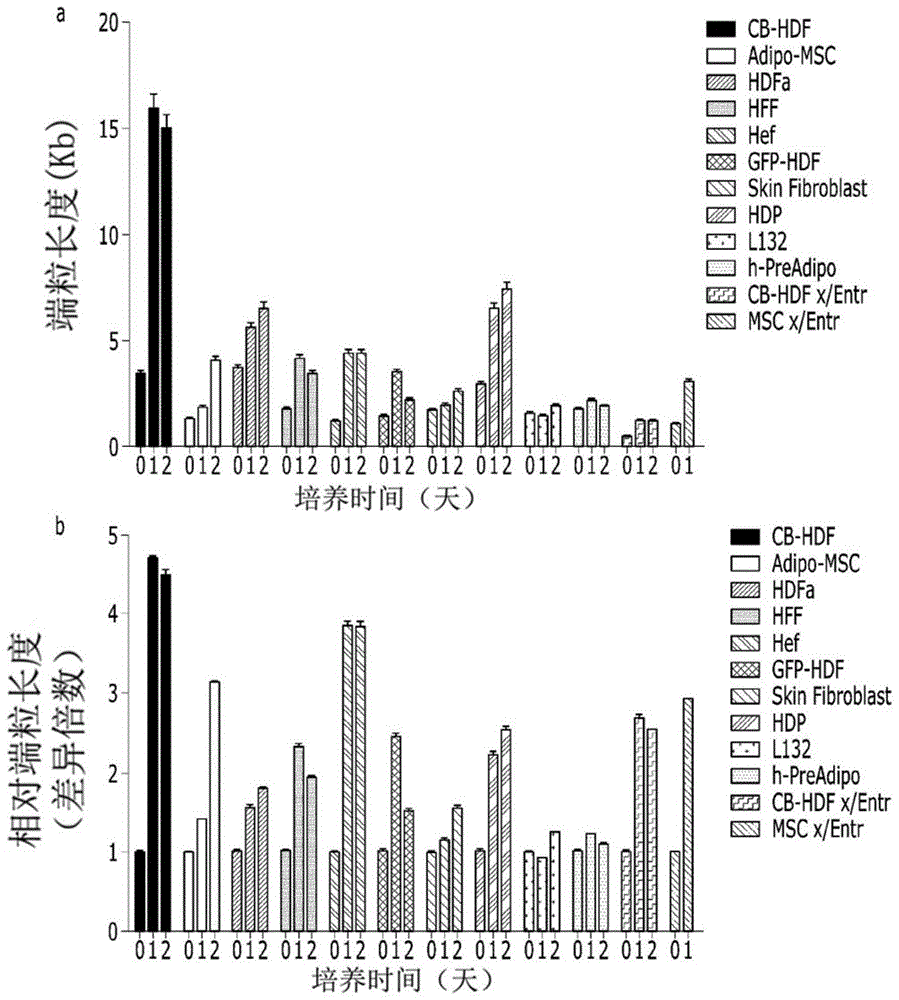
的普通技术人员可通过下面的记载明确理解未提及的或其他技术问题。用于解决问题的方案作为用于实现如上所述的技术问题的技术方案,根据本发明一方面的延长端粒的方法的特征在于,包括:向细胞直接或间接地提供物理性刺激的步骤;以及培养上述细胞及培养基的混合物规定时间的步骤,上述直接地提供刺激是指向包含细胞的培养基施加物理性刺激,上述间接地提供刺激是指向不包含细胞的培养基施加物理性刺激后混合上述培养基和细胞。其中,上述物理性刺激的形式可以为选自超声波刺激、热刺激及光刺激中的一种。根据本发明一方面的延长端粒的方法的特征可在于,上述向细胞直接或间接地提供物理性刺激的步骤可通过选自如下方式中的一种方式进行:混合细胞和培养基后向上述混合物提供物理性刺激;或者向培养基提供物理性刺激后混合上述培养基和细胞;或者向细胞提供物理性刺激后混合上述细胞和培养基;或者在向细胞提供物理性刺激后混合上述细胞和培养基之后,向上述混合物提供物理性刺激;或者在向培养基提供物理性刺激后混合上述培养基和细胞之后,向上述混合物提供物理性刺激;或者分别向细胞和培养基提供物理性刺激后混合上述细胞及上述培养基;或者在分别向细胞和培养基提供物理性刺激后混合上述细胞及上述培养基之后,向上述混合物提供物理性刺激。根据本发明一方面的延长端粒的方法的特征可在于,上述物理性刺激为超声波刺激,上述直接性超声波刺激的强度为0.1w/cm2至3w/cm2,频率为20khz至20mhz,持续时间为0.1秒钟至20分钟,上述间接性超声波刺激的强度为1w/cm2至20w/cm2,频率为20khz至20mhz,持续时间为0.1秒钟至20分钟。根据本发明一方面的延长端粒的方法的特征可在于,上述物理性刺激为热刺激,上述温度变化刺激以将细胞在40℃至50℃的温度条件下暴露1分钟至10分钟后,在0℃至4℃的温度条件下暴露5秒钟至10秒钟的方式进行施加。根据本发明一方面的延长端粒的方法的特征可在于,上述物理性刺激为光刺激,上述光刺激以将选自激光或发光二极管光(light-emittingdiode)中的一种的波长范围为300nm至900nm的脉冲式束照射1秒钟至10秒钟的方式进行施加。根据本发明一方面的延长端粒的方法的特征可在于,上述细胞选自由分别来源于哺乳类的干细胞、前体细胞、纤维芽细胞、角质细胞或器官内组织细胞组成的组中。根据本发明一方面的延长端粒的方法的特征可在于,上述培养基选自用于培养的培养基或用于分化诱导的培养基中。根据本发明一方面的延长端粒的方法的特征可在于,上述混合物的培养时间为1小时至10天。根据本发明一方面的延长端粒的方法的特征可在于,经过上述培养之后,在上述细胞中增加选自tert、terf2、dkc1、terf2ip、rfc1、rad50、terf1、pinx1、tnks1bp1、acd、nbn、hspa1l、parp1、ptges3、smg6、blm、xrcc5、xrcc6、ercc4、prkdc、tep1及β-连环蛋白(β-catenin)中的一种以上的基因的表达。根据本发明一方面的延长端粒的方法的特征可在于,经过上述培养之后,在上述细胞中的端粒酶活性增加。根据本发明一方面的延长端粒的方法的特征可在于,经过上述培养之后,在上述细胞中的β-半乳糖苷酶(β-galactosidase)活性减少。本发明的另一方面提供端粒通过物理性刺激延长的细胞。其中,上述物理性刺激的形式可以为选自超声波刺激、热刺激及光刺激中的一种。应理解,上述技术方案仅为例示性的,而并非限制本发明。除了上述例示性实施例之外,还可在附图及发明的详细说明中存在实施例。发明效果根据本发明一实施例的细胞的端粒延长方法相比于前述的延长端粒的以往的方法不仅简单,而且在费用方面优秀。即,以往的方法为给药化合物的方式,利用化学或生物学方法来合成并纯化这些化合物的过程需要用于这些过程的设备和所要持续投入的材料。在化学合成的情况下,没有特异性且对环境有害,这些缺点虽然可由生物合成克服,但在生物合成的情况下,收率低且难以实现大量生产及质量维持,且由于污染可能性高,因此还需要用于应对其的设备和材料。并且,细胞被双层脂质膜包围,因此,根据所纯化的化合物的化学性质,还需要可将这些化合物传递至细胞内的载体,在此情况下,需要在载体装载化合物的步骤。与此相反,根据本发明一实施例的细胞的端粒延长方法通过向细胞直接处理物理性刺激来产生效果,因此,可将合成、纯化、载体研发、合成、筹备等过程全部省略掉,只要有可施加刺激的设备就可以实施,因此能够以低费用延长端粒。并且,根据本发明一实施例的细胞的端粒延长方法相比于以往公开的延长端粒的方法在时间及效率方面优秀。现有技术的在合成端粒的化合物的合成过程中,投入原料物质,而并非这些中的全部构成产物,而是存在副产物或缓冲物等需要丢弃的部分,与此相反,本发明的方法中没有合成物质的过程,而是以施加物理性刺激的方式进行,因此如上所述的浪费。并且,前述的利用化合物的多种端粒延长方法为了产生充分的效果而需要多次或长时间(至长期)处理高浓度的化合物,与此相反,根据本发明一实施例的细胞的端粒延长方法仅需要进行20分钟以内的短的物理性刺激一次来产生效果。并且,根据本发明一实施例的细胞的端粒延长方法的稳定性高。即,化合物在代谢过程中可能会存在毒性等额外的危险,在前述的现有技术中,化合物的处理量可达mg/kg水准,因此相当高,而且在合成过程中还生成对环境具有负担的废弃物等,但在本发明的方法中并不存在这些问题。并且,本发明的方法通过处理短时间的超声波来临时诱导与端粒延长有关的tert基因的表达增加,上述基因的持续性表达与癌症发生具有相关关系,因此,当以通过这种基因表达增加效果不持续的本发明的方法来使端粒延伸的细胞的治疗作为目的给药时或者将本发明适用于生物体时,可期待在发生癌症危险方面更加安全。进一步地,根据本发明一实施例的细胞的端粒延长方法不仅仅是具有延长端粒的效果,而且还具有诱导细胞分裂且抗衰老的效果,因此,可通过这些效果不仅可以解决由于端粒长度变短而产生的问题,而且还可以期待改善及预防与衰老有关的各种疾病和症状。应理解,本发明的效果并不限定于如上所述的效果,包括可从本发明的详细说明或发明要求保护范围中所记载的发明的结构推论的所有效果。附图说明图1为经过根据本发明实施例1的超声波处理及培养之后基于细胞种类的端粒长度变化分析数据。图2为经过根据本发明实施例1的超声波刺激处理、根据实施例2的热刺激处理、根据实施例3的发光二极管光刺激处理及各培养之后基于各物理性刺激处理的端粒长度变化分析数据。图3为经过根据本发明实施例5的间接性超声波刺激处理及培养之后端粒长度变化分析数据。图4为经过根据本发明实施例1的超声波处理及培养之后基于培养基种类的端粒长度变化分析数据。图5为经过根据本发明实施例1的超声波处理及培养之后基于超声波处理次数的端粒长度变化分析数据。图6为经过根据本发明实施例1的超声波处理及培养之后基于细胞种类的tert基因表达变化分析数据。图7为与cb-hdf及adipo-msc有关的经过根据本发明实施例1的超声波处理及培养之后tert基因表达变化分析数据。图8为与cb-hdf及adipo-msc有关的经过根据本发明实施例1的超声波处理及培养之后β-连环蛋白基因表达变化分析数据。图9为与cb-hdf及adipo-msc有关的经过根据本发明实施例1的超声波处理及培养之后端粒酶活性变化分析数据。图10为与cb-hdf及adipo-msc有关的经过根据本发明实施例1的超声波处理及培养之后端粒fish数据。图11为与cb-hdf有关的经过根据本发明实施例1的超声波处理及培养之后tert及ki67的细胞荧光染色数据。图12为与cb-hdf有关的经过根据本发明实施例1的超声波处理及培养之后与衰老有关的β-半乳糖苷酶活性分析数据。具体实施方式以下,更详细地说明本发明。但是,本发明能够以多种不同的形式实现,本发明并不限定于在这里说明的实施例,本发明由发明要求保护范围定义。另外,本发明中所使用的术语仅为了说明特定实施例而使用,并非用于限定本发明。除非在文脉上另有其他明确的意思,单数的表达包括复数的表达。在本发明的整个说明书中,除非另有特别相反的记载,“包括”某种结构要素是指还可包括其他结构要素,而并不是排除其他结构要素。并且,在本发明中称为基因来使用的各基因的固有名称为公知的基因名、惯用的名称或其基因的产物的名称,例如,编码蛋白质的基因为其蛋白质。本发明的发明人在韩国授权专利第10-1855967号中公开了向细胞及培养基的混合物提供可促进环境流入的物理性刺激,在培养接收上述物理性刺激的混合物规定时间的情况下,可获得重编程的细胞。其中,重编程的方向根据培养基的组成而不同,而与细胞的种类无关。在分析上述细胞重编程方法的效果的过程中确认到,通过施加物理性刺激来使与端粒延长有关的基因组的表达增加。通过对此的进一步的研究确认到,可通过物理性刺激来延长端粒,而与以与所公开的发明不同的方法试验的细胞的种类和培养基的组成无关,从而可做出相比于环境流入更加诱导通过物理性刺激本身来延长端粒的结论,并将其作为新的发明来公开。根据本发明一方面的细胞的端粒延长方法的特征在于,包括:向细胞直接或间接地提供物理性刺激的步骤;以及培养上述细胞及培养基的混合物规定时间的步骤,上述直接地提供刺激是指向包含细胞的培养基施加物理性刺激,上述间接地提供刺激是指向不包含细胞的培养基施加物理性刺激后混合上述培养基和细胞。上述物理性刺激的形式可选自低频率、超声波、高频率、热、光、电波、全波、拉紧(stretch)、压缩(compression)中,优选地,可为选自超声波、热及光中的一种。根据本发明一方面的细胞的端粒延长方法的特征可在于,上述向细胞直接或间接地提供物理性刺激的步骤通过选自如下方式中的一种方式进行:混合细胞和培养基后向上述混合物提供物理性刺激;或者向培养基提供物理性刺激后混合上述培养基和细胞;或者向细胞提供物理性刺激后混合上述细胞和培养基;或者在向细胞提供物理性刺激后混合上述细胞和培养基之后,向上述混合物提供物理性刺激;或者在向培养基提供物理性刺激后混合上述培养基和细胞之后,向上述混合物提供物理性刺激;或者分别向细胞和培养基提供物理性刺激后混合上述细胞及上述培养基;或者在分别向细胞和培养基提供物理性刺激后混合上述细胞及上述培养基之后,向上述混合物提供物理性刺激。这种物理性刺激的提供可利用直接或间接的方法对细胞进行一次以上,端粒延长效果可随着次数的增加按比例增加。当以这种方式提供物理性刺激一次以上时,优选地,各次数之间保留时间间隔,以使细胞能够恢复,上述时间间隔为1天以上,更加优选地,上述时间间隔可以为2天以上。根据本发明一方面的细胞的端粒延长方法的特征可在于,上述物理性刺激为超声波刺激,上述直接性超声波刺激的强度为0.1w/cm2至3w/cm2,频率为20khz至20mhz,持续时间为0.1秒钟至20分钟,上述间接性超声波刺激的强度为1w/cm2至20w/cm2,频率为20khz至20mhz,持续时间为0.1秒钟至20分钟。更加优选地,上述直接性超声波刺激的强度为0.5w/cm2至2w/cm2,频率为20khz至2mhz,持续时间为0.1秒钟至10分钟,上述间接性超声波刺激的强度为2w/cm2至10w/cm2,频率为20khz至2mhz,持续时间为1秒钟至15分钟。根据本发明一方面的细胞的端粒延长方法的特征可在于,上述物理性刺激为热刺激,上述温度变化刺激以将细胞在40℃至50℃的温度条件下暴露1分钟至10分钟后,在0℃至4℃的温度条件下暴露5秒钟至10秒钟的方式进行施加。根据本发明一方面的细胞的端粒延长方法的特征可在于,上述物理性刺激为光刺激,上述光刺激以将选自激光或发光二极管光中的一种的波长范围为300nm至900nm的脉冲式束照射1秒钟至10秒钟的方式进行施加,更加优选地,通过照射3秒钟至7秒钟来进行施加。将根据本发明一实施例的细胞的端粒延长方法适用于多种细胞时均可以延长各细胞的端粒。根据本发明一实施例的细胞的端粒延长方法的特征可在于,上述细胞选自由分别来源于哺乳类的干细胞、前体细胞、纤维芽细胞、角质细胞或器官内组织细胞组成的组中。在将上述端粒所延长的细胞以适用于生物体的目的来使用的情况下,上述细胞可以为同源(autologous)、异源(allogeneic)或异种(heterologous)中的一种,在异种的情况下,可从哺乳类获得。为了降低对免疫排斥反应的可能性,优选地,可使用异源,更加优选地,可使用同源。根据本发明一实施例的细胞的端粒延长方法的特征可在于,上述培养基选自用于培养的培养基或用于分化诱导的培养基中。其中,“用于培养的培养基”为维持特定细胞的均匀性的同时在其细胞的生存中最优化的培养基,是为了细胞的均匀的增殖而使用的培养基。与此相反,“用于分化诱导的培养基”是指用于将特定细胞诱导为具有其他分化能力或功能的细胞的培养基。根据本发明一实施例的细胞的端粒延长方法的特征可在于,上述混合物的培养时间为1小时至10天,优选地,可进行1天至5天。这是因为,若向细胞施加前述的物理性刺激,则使后述的多种基因的表达增加,“基因表达”包括转录和蛋白质合成等生物活性物质的合成和折叠(folding)、上述物质移动至细胞内所需的位置,因此,实际上为了延长端粒而需要时间。根据本发明一实施例的细胞的端粒延长方法的特征可在于,经过上述培养之后,在上述细胞中增加选自tert、terf2、dkc1、terf2ip、rfc1、rad50、terf1、pinx1、tnks1bp1、acd、nbn、hspa1l、parp1、ptges3、smg6、blm、xrcc5、xrcc6、ercc4、prkdc、tep1及β-连环蛋白中的一种以上的基因的表达。公知为,tert(telomerasereversetranscriptase)为具有端粒酶的催化活性的子单元,terf1(telomericrepeatbindingfactor1)及terf2(telomericrepeatbindingfactor2)识别端粒序列。dkc1(dyskerinpseudouridinesynthase1)、rfc1(replicationfactorcsubunit1)、tnks1bp1(tankyrase1bindingprotein1)、nbn(nibrin)、hspa1l(heatshockproteinfamilyamember1like)、parp1(polyadp-ribosepolymerase1)、ptges3(prostaglandinesynthase3)、smg6(smg6homolog,nonsensemediatedmrnadecayfactor)、xrcc5(x-rayrepaircrosscomplementing5)、xrcc6(x-rayrepaircrosscomplementing6)是在端粒的稳定化和维持中所需要的。据报道,terf2ip(terf2interactingprotein)、rad50(rad50homolog,doublestrandbreakrepairprotein)抑制端粒重组,pinx1(pin2/terf1-interactingtelomeraseinhibitor1)介导terf1及tert的核仁(nucleolus)内积累,并有助于trf1与端粒酶结合,对s基抑制端粒酶活性。acd(adrenocorticaldysplasiaproteinhomolog)、ercc4(excisionrepaircross-complementationgroup4)、prkdc(proteinkinase,dna-activated,catalyticsubunit)为了端粒的长度调节及保护所需要的,blm(bloomsyndromeprotein)在dna合成时有助于端粒扩增,tep1(telomeraseassociatedprotein1)形成端粒酶复合体的一部分。β-连环蛋白为促进tert表达的转录调控因子。可将可增加如上所述的基因的表达的根据本发明一方面的延长端粒的方法可利用为后述的多种用途。根据本发明一实施例的细胞的端粒延长方法的特征可在于,经过上述培养之后,在上述细胞中的端粒酶活性增加。在培养2天之后,这种端粒酶活性的增加可以为在培养之前的1.5倍以上,端粒长度可随着如上所述的端粒酶的活性的增加而增加1.2倍以上。根据本发明一实施例的细胞的端粒延长方法的特征可在于,经过上述培养之后,在上述细胞中的β-半乳糖苷酶活性减少。β-半乳糖苷酶为催化使β-半乳糖苷(β-galactoside)水解至单糖类的的酶,溶酶体β-半乳糖苷酶在衰老细胞(senescentcell)中过表达而被积累。其结果,在衰老细胞中,β-半乳糖苷酶的活性高,根据本发明一实施例的细胞的端粒延长方法,上述酶的活性减少,因此具有抗衰老效果。本发明的另一方面提供端粒通过物理性刺激延长的细胞。其中,上述物理性刺激的形式可以为选自超声波刺激、热刺激及光刺激中的一种。这种细胞可通过前述的根据本发明一方面的细胞的端粒延长方法来制备。本发明的发明人发现,当对细胞处理物理性刺激时,不仅tert、terf2、dkc1、terf2ip、rfc1、rad50、terf1、pinx1、tnks1bp1、acd、nbn、hspa1l、parp1、ptges3、smg6、blm、xrcc5、xrcc6、ercc4、prkdc、tep1及β-连环蛋白等与细胞的端粒酶活性有关的基因的表达增加的同时上述细胞的端粒延长,而且包含这种基因的mrna及蛋白质的多量外泌体分泌。装载有mrna及蛋白质等各种因子的外泌体沿着血流移动来向细胞直接传递上述各种因子,从而产生治疗效果,因此,前述的根据本发明一方面的细胞的端粒延长方法、根据本发明另一方面的细胞及来源于这些细胞的外泌体使用于需要这些基因的活性的个体中以用作治疗目的。例如,首先,可以为了治疗或改善先天性角化不良症、再生障碍性贫血、维尔纳综合征(wernersyndrome)、布鲁姆综合征(bloomsyndrome)、共济失调毛细血管扩张症(ataxia-telangiectasia)、奈梅亨断裂综合征(nijmegenbreakagesyndrome)、毛细血管扩张性共济失调综合征(ataxia-telangiectasia-likesyndrome)、肺纤维化等由端粒维持异常引起的疾病而使用。此外,可以为了治疗或改善由细胞的衰老和缺失引起的各种疾病和症状,例如,痴呆症、运动失调、软骨及骨的衰退等各种退行性疾病;包括克隆氏症、慢性阻塞性肺病等的自体免疫性疾病;高血压;代谢综合征;糖尿病;皮肤老化;色素异常、脱发等。而且,可以为了烧伤、创伤、负伤、器官衰竭(organfailure)、器官缺失、溃疡等与各种损伤有关的再生而使用。以下,为了使本发明所属领域的的普通技术人员容易实施,详细说明本发明的实施例。但是,本发明能够以多种不同形式实现,而并不限定于在这里说明的实施例。本发明的所有实施例及实验例中的所有细胞培养均在37℃、5%co2的条件下进行。实施例1.通过直接性超声波刺激来诱导细胞的端粒延长将向1ml的培养基中的1×106个细胞直接施加1w/cm2的(20khz)超声波刺激5秒钟的细胞在培养皿(culturedish)中与同种培养基一起培养1天以上。实施例2.通过直接性热刺激来诱导细胞的端粒延长将1ml的hes培养基中的1×106个细胞放入1.5ml的试管(tube)中并在50℃的温度下暴露5秒钟后在0℃的温度下暴露10秒钟,在培养皿中与同种培养基一起培养1天以上。实施例3.通过直接性发光二极管光刺激来诱导细胞的端粒延长将向1ml的hes培养基中的1×106个细胞直接施加808nm的发光二极管激光刺激(1w,500hz/sec)5秒钟的细胞在培养皿中与同种培养基一起培养1天以上。实施例4.通过间接性超声波刺激来诱导细胞的端粒延长对hes培养基处理0w/cm2、3w/cm2、5w/cm2、10w/cm2的超声波10分钟后,将其与未处理超声波的细胞混合来在培养皿中培养1天以上。实施例5.可通过超声波刺激来诱导细胞的端粒延长的外泌体的制备将向1ml的培养基中的1×106个细胞直接施加1w的(20khz)超声波刺激5秒钟的细胞在培养皿中与同种培养基一起培养1-2天。然后,回收培养液并以3000rpm离心分离5分钟来去除细胞或细胞凋亡体等,仅回收上清液并用0.2μm的过滤器过滤来收集仅包含大小为0.2μm以下的成分的过滤液,向100kda的过滤器放入上述过滤液并以10000xg离心分离30分钟来去除分子量为100kda以下的成分,从而获得浓缩的外泌体。向包含上述浓缩的外泌体的100kda的过滤器放入pbs并以10000xg冲洗(washing)5分钟,将此过程反复进行2次来去除上述外泌体浓缩液中的培养基成分,从而获得外泌体。实验例1.基于细胞种类的端粒延长效果分析为了比较基于细胞种类的实施例1的效果,根据实施例1分别向1ml的dmem培养基(纤维芽细胞培养基)中的1×106个cb-hdf(细胞生物)、adipo-msc(hwangdongyeon教授实验室)、hdfa(invitrogen)、hff(chauniversity)、hef(chauniversity)、gfp-hdf(gfp-hndf,angio-proteomie)、skinfibroblast(60岁脑卒中患者样品,通过irb)、hdp(细胞生物)、l132(atcc)、h-preadipo(atcc)、cb-hdfx/entr及mscx/entr施加超声波刺激后,培养0天、1天及2天,并分析端粒长度(其中,cb-hdfx/entr及mscx/entr为适用由本发明的发明人研究(leeetal.,anultra-effectivemethodofgeneratingextramultipotentcellsfromhumanfibroblastsbyultrasound,biomaterials,2017.)的通过超声波处理的多功能细胞诱导方法来分别从cb-hdf及msc在人胚胎干细胞培养基中诱导的多功能细胞)。此时,适用试剂盒并根据qpcr方法来分析端粒的长度(absolutehumantelomerelengthquantificationqpcrassaykit,catno.8918,sciencelltm)。其结果,如图1及表1所示,端粒均被延长,而与细胞的种类无关。表1实验例2.基于物理性刺激的种类的端粒延长效果分析为了基于物理性刺激的种类的端粒延长效果,利用人胚胎干细胞培养基和cb-hdf并根据实施例1至实施例3来分别施加物理性刺激后,培养0天、1天及2天,根据qpcr方法来分析端粒长度。其结果,如图2所示,通过超声波刺激、热刺激及光刺激均延长端粒。实验例3.基于间接性超声波刺激的端粒延长效果分析为了确认不仅通过直接性物理性刺激延长端粒,而且还通过间接性物理性刺激延长端粒,根据实施例2来向cb-hdf施加间接性超声波刺激后,培养1天,根据qpcr方法来分析端粒长度。其结果,如图3所示,端粒延长效果与所使用的超声波的强度成比例地大。实验例4.基于培养基组成的超声波处理后端粒延长效果分析为了比较基于培养基组成的实施例1的效果,根据实施例1分别向1ml的人胚胎干细胞培养基、神经干细胞培养基、第一次生殖细胞培养基、dmem培养基中的1×106个cb-hdf施加超声波刺激后,培养0天、1天及2天,根据qpcr方法来分析端粒长度。其结果,如图4所示,端粒均被延长,而与培养基组成无关。实验例5.基于超声波处理次数的端粒延长效果分析为了确认当反复进行根据实施例1的超声波处理时是否存在差异,根据实施例1向1ml的dmem培养基中的1×106个cb-hdf施加超声波刺激,并培养1天、3天及6天,此时,首次施加超声波刺激一次或间隔2天施加,根据qpcr方法来分析端粒长度。其结果,如图5所示,端粒长度均增加,而与超声波处理次数无关,超声波处理次数越多,端粒长度的增加的幅度相比于未处理超声波的对照组更大。实验例6.基于细胞种类的超声波处理后tert基因表达分析为了确认根据实施例1的tert基因表达量是否根据细胞种类产生差异,根据实施例1分别向1ml的dmem培养基中的1×106个cb-hdf、adipo-msc、hdfahffhef、gfp-hdf、skinfibroblast、hdp、l132、h-preadipo、cb-hdfx/entr及mscx/entr施加超声波刺激,并培养0天、1天及2天,根据qpcr方法来分析tert基因表达变化。其结果,如图6及表2所示,tert表达量均增加,而与细胞种类无关。并且,如图7所示,在利用cb-hdf及adipo-msc的情况下,tert的表达量在超声波处理后培养第一天时大大增加而在第二天又减少,tert的持续性表达具有发生癌症等的危险,因此通过临时性的tert表达来降低这种危险并可期待由变短的端粒引起的与衰老有关的症状改善。表2细胞种类相比于对照组的tert基因表达变化量(倍)cb-hdf5.4msc19.46hdfa21.61hff16.81hef3.50gfp-hdf3.05skinfibroblast1.53hdp2.66l1326.88h-preadipo11.92cb-hdfx/entr3.08mscx/entr22.20实验例7.基于超声波处理的细胞内β-连环蛋白基因表达变化分析为了通过根据实施例1的端粒延长方法来确认作为tert的转录活性因子的β-连环蛋白对基因产生何种影响,根据实施例1向1ml的dmem培养基中的1×106个cb-hdf及adipo-msc施加超声波刺激,并培养0天、1天及2天,根据qpcr方法来分析β-连环蛋白基因表达变化。其结果,如图8所示,进行实验的两种细胞种类的β-连环蛋白表达量均增加。实验例8.基于超声波处理的细胞内端粒酶活性变化分析为了通过根据实施例1的端粒延长方法来确认对端粒酶活性产生何种影响,根据实施例1向1ml的dmem培养基中的1×106个cb-hdf及adipo-msc施加超声波刺激,并培养0天、1天及2天,根据sciencell的telomeraseactivityquantificationqpcrkit(taq)来分析端粒酶活性。其结果,如图9所示,进行实验的两种细胞种类的端粒酶活性均增加。实验例9.经过超声波处理的细胞的端粒fish为了通过其他方法来确认基于根据实施例1的端粒延长方法的端粒的增加,根据实施例1向1ml的dmem培养基中的1×106个cb-hdf及adipo-msc施加超声波刺激,并培养1天后,利用telgtelomereprobe(ttagggttagggttaggg)来执行fish,通过共聚焦显微镜来分析荧光信号。此时,用hoechst33342进行对照染色。其结果,如图10所示,进行实验的两种细胞种类的端粒量均增加。实验例10.经过超声波处理的细胞的ki67及tert细胞免疫荧光染色为了确认基于根据实施例1的端粒延长方法的tert基因表达是否延续为蛋白质表达增加,根据实施例1向1ml的dmem培养基中的1×106个cb-hdf施加超声波刺激,并培养1天后,利用抗ki67及抗tert抗体进行荧光染色,通过共聚焦显微镜进行分析。此时,利用dapi对游走细胞进行对照染色。其结果,如图11所示,当进行超声波处理时,不仅tert蛋白质的端粒均增加,而且作为细胞分裂标志物的ki67蛋白质的表达也增加。实验例11.与衰老有关的β-半乳糖苷酶活性分析为了确认基于根据实施例1的端粒延长方法的前述的变化对细胞衰老产生何种影响,根据实施例1向1ml的dmem培养基中的1×106个cb-hdf施加超声波刺激,并培养1天及3天后,利用x-gal来执行对与细胞内衰老具有相关关系的β-半乳糖苷酶的活性的试验法,通过位相差显微镜进行分析。此时,首次施加超声波刺激一次或每间隔2天进行。其结果,如图12所示,β-半乳糖苷酶活性减少,因此,根据本发明的端粒延长方法具有抗衰老效果。实验例12.通过细胞分泌外泌体基因rna-seq的细胞的基因表达变化分析本发明的发明人的作为前述的现有发明的第10-1855967号中,可通过超声波处理来诱导细胞的基因表达变化及外泌体分泌。所分泌的外泌体中包含在细胞表达的基因产物,因此,通过从上述细胞分泌的外泌体的基因表达来确认根据实施例1延长端粒的细胞的基因表达变化。rna-seq结果,如表3所示,在实验组细胞分泌的外泌体中,与端粒酶活性有关的基因和与端粒维持及保护有关的基因的表达增加。表3前述的对本发明的说明用于例示,本发明所属领域的普通技术人员可理解,在不变更本发明的技术思想或必要特征的情况下能够容易以其他具体形式进行变形。因此应理解,如上所述的各种实施例在所有方面为例示性,而非限定性。例如,以单一形式说明的各结构要素可通过分散来实施,同样地,以分散形式说明的结构要素也能够以结合的形式实施。应解释为,本发明的范围由发明要求保护范围来表示,从发明要求保护范围的意思、范围及其等同概念导出的所有变更或变形的形式包含在本发明的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1