一种利用σ70非依赖型抗胁迫启动子实现异丁醛稳定高产的方法与流程
本发明涉及一种抗胁迫启动子高产异丁醛的方法,属于生物工程技术领域。
背景技术:
异丁醛工业上主要是加氢生产异丁醇,异丁醇是一种新型生物燃料,具有高能量密度、低吸湿性等优势;此外,异丁醛也用作氨基酸、维生素等药物的中间体;用于合成纤维素酯、香精、香料等;还可用于制造橡胶硫化促进剂和防老剂、异丁酸等。
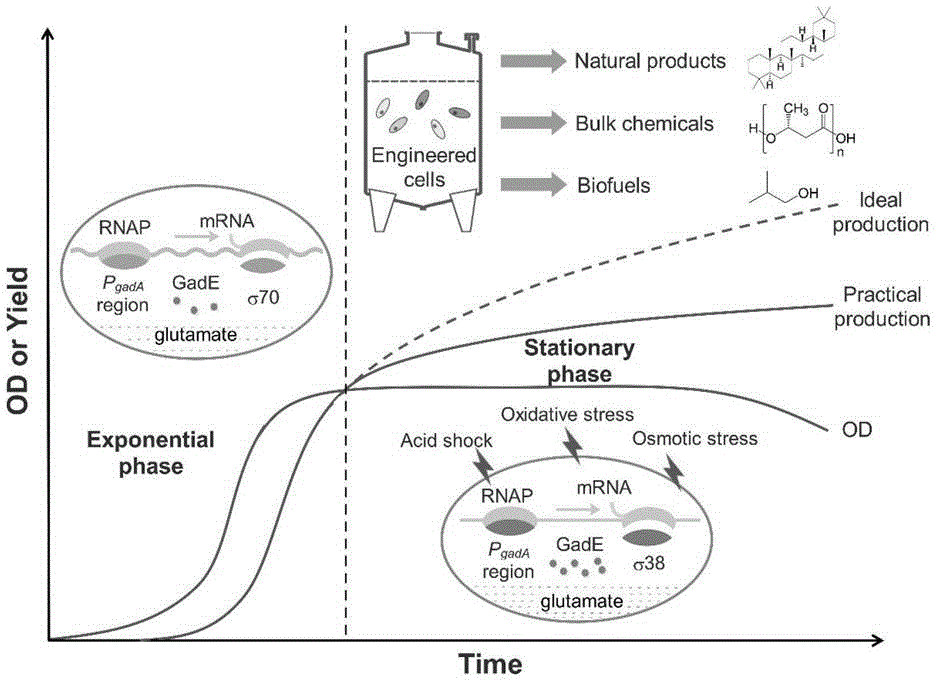
为最大化细胞工厂生产异丁醛的产量并使产率接近理论值,异丁醛合成途径必须能够持续高效地表达,以便最小化菌体生物量的增长及副产物的生成对资源的消耗。理想状况下,菌体只进行一定程度的生长繁殖,在此期间合成异丁醛生产所需的前体物质及辅因子,当细胞数量达到生产需求时生长停止,合成途径开始高效表达。如果消除了生长对资源的竞争,途径酶可将前期累积的全部生产资源直接转化为目标化合物,此时细胞工厂的生产能力达到顶峰。然而,这一高产阶段通常难以维持。这是因为合成途径的表达一般依赖于看家型的σ70因子,这类σ因子主导必需基因的转录,在对数生长期效用最强。当细胞进入稳定期后,胞内与胞外环境胁迫随之出现,此时胁迫响应σ38因子大量生成,与σ70竞争数量有限的rnap核心酶。且稳定期dna超螺旋程度下降,谷氨酸盐类抗胁迫物质累积等胞内环境的变化也更有利于σ38与核心酶的结合。因此,途径基因的转录通常与生长相偶联,一旦细胞生长停滞,合成途径的表达也随即下降,胞内资源开始大量分配给胁迫抵御等生存维持活动。因此,解除合成途径对σ70的唯一性依赖,增强其对σ38的兼容性是实现生产途径持续表达的关键。
以σ70非依赖型抗胁迫启动子gada替代常规的σ70型启动子驱动异丁醛的合成,实现了稳定期和酸胁迫条件下异丁醛合成途径的稳定表达。机理研究发现gada启动子不受菌体生长期转变时胞内σ因子更替的影响,可被σ70及σ38型rnap分别转录,表现出对低ph、谷氨酸盐累积、dna超螺旋松弛等胁迫条件的抵御能力,能够在几乎整个细胞生长周期及胁迫条件下发挥转录活性。
技术实现要素:
本发明的目的在于提供一种实现异丁醛稳定高产的方法,利用σ70非依赖型抗胁迫启动子gada替代常规的σ70型启动子驱动异丁醛的合成,实现了稳定期和酸胁迫条件下异丁醛合成途径的稳定表达,最终通过摇瓶发酵实验确定菌株最终的异丁醛产量,为实现异丁醛稳定高产提供新的方法。
按照本发明提供的技术方案,一种利用σ70非依赖型抗胁迫启动子实现异丁醛稳定高产的方法,采用
以下方法步骤:
1、以大肠杆菌mg1655的基因组为模板,扩增包括上游完整非编码区(–1至–183)的gada启动子pgada183
2、异丁醛合成途径由alss-ilvc/d和kivd两个操纵子组成,分别在psa69和psa65两个质粒上,通过gibsonassembly将pgada183插入至alss-ilvc/d操纵子的rbs上游,替换原始启动子pllaco1,得到质粒pmx1。
3、以类似2、3方法将psa65质粒上的pllaco1替换为pgada183,得到质粒pmx2。
4、以jcl260菌株作为异丁醛生产的底盘宿主,将pmx1、pmx2转入jcl260感受态细胞中,涂于平板上培养。
5、将步骤4中转化得到的单菌落转接到少量培养基中培养得到种子液。
6、将种子液接入发酵培养基中进行发酵验证。
油醇可以从水相中高效萃取异丁醛,培养前在发酵瓶中加入同发酵液体积相同的油醇,监测产量时分别从油相与水相等体积取样。
异丁醛发酵所用m9培养基配方为:6.0g/lna2hpo4,3.0g/lkh2po4,1.0g/lnh4cl,0.5g/lnacl,1mmmgso4,0.1mmcacl2,10mg/lvitaminb1,8.5%葡萄糖,1%酵母提取物,调节ph至7.0。另加入100μg/ml氨苄霉素和50μg/ml卡那霉素。
附图说明
图1:gada启动子是一种生长期独立型抗胁迫启动子,可以在各类生理条件下驱动生物燃料合成途径的高效表达;
图2:葡萄糖添加量,初始ph,发酵液体积,油醇萃取对gada启动子驱动下异丁醛生产的产量(a),葡萄糖消耗量(b),od600(c)及产率(d)的影响。
具体实施方式
下述实例中所使用的实验方法如无特殊说明,均为常规方法。
下述实例中所用的材料、试剂等,如无特殊说明,均可从商业突进获取。
以下实施例是对本发明的进一步说明,并不构成对本发明实质内容的限制。
实施例1、一种利用gada启动子实现异丁醛稳定高产的方法
异丁醛合成途径由alss-ilvc/d和kivd两个操纵子组成,分别装载于psa69和psa65两个骨架上。以大肠杆菌mg1655的基因组为模板,扩增包括上游完整非编码区(–1至–183)的gada启动子pgada183,通过gibsonassembly将其插入至alss-ilvc/d操纵子的rbs上游,替换原始启动子pllaco1,得到质粒pmx1。以类似方法将psa65质粒上的pllaco1替换为pgada60,得到质粒pmx2。
基因pcr体系为:
以前期构建的jcl260菌株作为异丁醛生产的底盘宿主,将pmx1、pmx2两质粒化转jcl260感受态细胞,冰浴30分钟,42℃热激90秒,立刻置于冰上2分钟。加入250μlsoc培养基,于37℃、200rpm摇床中震荡培养1小时。因为pmx1、pmx2含有氨苄青霉素、卡那青霉素抗性基因,取200μl菌液涂于含有氨苄青霉素、卡那青霉素的lb平板上,过夜培养。
将单菌落接种至5mllb培养基,于37℃,250rpm下培养12h,得到种子液。取400μl接种至20ml发酵培养基中(2%v/v),加入诱导剂iptg至终浓度0.1mm,于250ml密闭三角瓶条件,30℃,250rpm下发酵。
采用可以从水相中高效萃取高级醇的油醇进行油提法发酵。油醇用量与发酵液体积相同,在培养前随发酵液一同加入发酵瓶,监测产量时从油相与水相等体积取样。补料连续发酵时,每次取样后补充等体积的新鲜油醇与m9培养基。
样品于4000×g离心5min,吸取上清液,采用气相色谱法检测生成的异丁醛。所用色谱仪为agilent6890,配备火焰离子化检测器,色谱柱为安捷伦db-ffap毛细管柱(30m×0.32mm×0.25μm),氮气为载气。采用分流进样法,吸样量0.2μl,分流比50:1。对于水相中的异丁醇,升温程序为:80℃3min,115℃/min升温至230℃,维持1min,120℃/min升温至235℃,维持2min。对于油相中的异丁醇,升温程序为:90℃0.5min,20℃/min升温至110℃,维持0.5min,120℃/min升温至235℃,维持2min。进样口与检测器温度分别为250℃和280℃。异丁醛标样浓度为1g/l,并以1g/l的正戊醇为内标。
异丁醛发酵所用m9培养基配方为:6.0g/lna2hpo4,3.0g/lkh2po4,1.0g/lnh4cl,0.5g/lnacl,1mmmgso4,0.1mmcacl2,10mg/lvitaminb1,8.5%葡萄糖,1%酵母提取物,调节ph至7.0。另加入100μg/ml氨苄霉素和50μg/ml卡那霉素。
- 还没有人留言评论。精彩留言会获得点赞!