本发明涉及对大肠杆菌dh10b菌株的基因工程改造和对无缝dna组装流程的优化,属于生物工程技术领域。
背景技术:
dna组装技术是分子生物学、代谢工程以及合成生物学中不可或缺的环节。传统的酶切连接方法由于受到酶切位点的限制现已逐渐被淘汰,无缝dna组装技术的出现打破了酶切位点的限制,使得任意dna片段的组装成为可能。无缝dna组装与酶切连接的差别在于待连接的线性dna片段末端带有同源序列,片段之间依靠同源序列的互补配对连接成环。近年来越来越多的无缝dna组装方法被报道,相应的商用试剂盒也陆续被推出,如gibson组装、in-fusion组装等。然而,这些方法均需要将线性dna片段进行体外连接后再转入宿主细胞,操作流程较为繁琐;另外,商用的试剂盒大都价格昂贵,比如:neb公司推出的nebuilder试剂盒平均每个连接反应的成为18.5美元。
为了降低无缝dna组装的实验成本并简化其操作流程,本发明提出了一种基于体内重组进行dna组装的方法。
技术实现要素:
本发明的目的是提供一种高效的重组工程宿主菌株dh10b*,无需进行体外连接,缩短了时长,简化了操作流程,而且大大降低了基因克隆的成本。
本发明的另一个目的是提供对质粒克隆的优化过程,进一步提高克隆效率。具体操作如下:
挑选合适的重组工程宿主菌株dh10b(或top10)
选择五个常用的质粒构建宿主菌株,dh5α、top10、dh10b、bl21、xl-1blue、mach1-t1,分别制作化转感受态细胞,以puc19质粒对其测感受态效率。通过pcr操作得到带有20bp同源末端区域的、含有氯霉素抗性的dna片段2和含有p15aori的片段3,两个片段的长度比约为1:1,故各取200ng转化到这六种菌的感受态细胞中,同时做三组平行实验以减小误差。在氯霉素抗性的平板上过夜培养后计算出平板上每种菌所对应的单菌落平均数,然后以感受态细胞转化效率×105为单位计算cn/te(即(菌落平均数×105)/感受态细胞转化效率),六种菌的cn/te值相差很大,最高的为top10与dh10b,最后在每个板上挑取单菌落进行菌落pcr验证,阳性率为100%。由于top10与dh10b基因型一致,所以选择dh10b作为本次发明使用菌株。
对重组工程的条件优化(以下实验数据均由三组平行实验所得;每组实验所用感受态细胞均由puc19质粒测定转化效率)
①为了验证过表达recet与敲除recbcd对质粒克隆效率的影响,我们做了一下以下实验:
在dna片段接头长度为20bp,转化量为200ng的条件下,首先将含有氯霉素抗性的片段1分别转化dh10b、dh10b*(不加iptg)和dh10b*(加0.8mmiptg)这三种感受态细胞,得到phcy-74a。这三者的cn/te值分别为:51,105,526,表明recet的表达量直接影响克隆效率的高低;然后将长度比为1:1,含有氯霉素抗性的片段2和含有p15aori的片段3分别转化dh10b、dh10b(敲除recbcd后,不加iptg)、dh10b*(不加iptg)三种感受态细胞,cn/te值分别为:34,82,307。结果表明本发明中对dh10b的两步基因改造均为提高克隆效率的必要步骤。
②优化dna片段的同源末端区域长度。
在每个片段的转化量为200ng,iptg加入的终浓度为1mm的条件下,分别采用15bp,20bp,25bp,30bp,35bp,40bp,40bp,60bp接头长度的dna片段2和3转化到dh10b*中,构建phcy-74b,所得cn/te值分别为:2,19,14,31,59,67,66,23,结果表明该发明中质粒克隆的最适接头长度为40bp。
③优化iptg终浓度。
在每个片段的转化量为200ng,接头长度为40bp的条件下,在dh10b*感受态细胞制作过程中加入的iptg终浓度分别定为:0.2mm,0.4mm,0.6mm,0.8mm,1mm,将片段2和片段3分别转化到这五种感受态细胞中。cn/te值分别为:28,51,57,76,32,结果表明该发明中iptg最优终浓度为0.8mm。
④优化片段转化量。
在接头长度为40bp,iptg终浓度0.8mm,片段2和片段3的转化量一致的条件下,分别转化50ng,100ng,200ng,300ng,400ng到dh10b*感受态细胞中,构建phcy-74b质粒。cn/te值分别为:61,142,202,333,320。结果表明该发明中最优转化量为300ng。
对三个片段进行连接
在dna片段接头长度为40bp,iptg加入终浓度为0.8mm的条件下,将长度比为1:1:1,含有氯霉素抗性的dna片段4、含有p15aori的片段5以及含有rfp基因的片段6分别加入200ng进行转化,构建phcy-74c。同时做三组平行实验,在感受态细胞转化效率为4×106时,得到的cpu平均值为21,取10个单菌落做菌落pcr,阳性率为100%,从中取三个进行测序,结果均正确。
表1:本发明所用到的菌株及质粒
附图说明
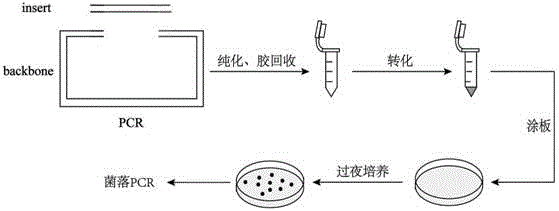
使用该方法构建质粒的操作流程图
具体实施方式
以下实例是对本发明的进一步说明,并不构成对本发明实质内容的限制。
实例:
(1)dh10b*化转感受态细胞的制作:①首先从dh10b*的平板上挑取单菌落,放入5ml的液体lb培养基中于37℃的摇床中进行过夜培养;②从该培养液中取50μl加入到新的50ml液体培养基中在37℃进行培养至od600达到0.3时加入80μl浓度为100mm的iptg,之后放入摇床继续培养至od600达到0.5~0.6;③将该50ml菌液摇晃、冰浴30min,同时打开离心机调节至4℃预冷;④30min后(所有操作在4℃条件下进行)在超净台中将该菌液移入离心管,并在5000rpm,4℃条件下离心2min使菌体沉淀;⑤倒掉上清加入22.5ml0.1mcacl2,经过重悬之后静置5~10min,然后在5000rpm、4℃条件下离心2min使菌体沉淀;⑥在不静置前提下重复步骤⑤;⑦倒掉上清,加入750μl0.1mcacl2和500μl50%的甘油进行重悬;⑧以每管100μl进行分装并放于-80℃冰箱冻存。
(2)构建质粒:由一个dna片段构建质粒phcy-74a,通过pcr操作得到一个含有氯霉素抗性的、带有20bp同源末端区域的dna片段,取200ng转化到dh10b*的感受态细胞中;冰浴30min后,在42℃热激1min,然后立马冰浴2min,再加入1mlsoc并在37℃活化40min,在氯霉素抗性的平板上过夜培养后挑取单菌落进行菌落pcr筛选阳性克隆。
由两个dna片段构建质粒phcy-74b,通过pcr操作得到带有20bp同源末端区域的含有氯霉素抗性的dna片段2和含有p15aori的片段3,两个片段的长度比约为1:1,故各取200ng进行转化(v1=200ng/c1,v2=(l2×200ng)/(l1×c2),(片段1长度最短;转化量不超过400ng))。之后步骤与上述内容一致。
由三个dna片段构建质粒phcy-74c,通过pcr操作得到带有20bp同源末端区域的含有氯霉素抗性的dna片段4、含有p15aori的片段5以及含有rfp基因的片段6,三个片段的长度比约为1:1:1,故各取200ng进行转化(v1=200ng/c1,v2=(l2×200ng)/(l1×c2),v3=((l3×200ng)/(l1×c3)(片段1长度最短;转化量不超过400ng))。在氯霉素抗性的平板上过夜培养后挑取有红色荧光的单菌落进行菌落pcr筛选阳性克隆。
