用于皮肤再生及伤口治愈的含有诱导的外泌体的组合物的制作方法
本发明涉及一种具有皮肤再生及伤口治愈效果的外泌体(exosome)、其制备方法以及含有上述外泌体的组合物。
背景技术:
就作为人体中最大组织的皮肤而言,除了具有接收感觉、合成维生素d、参与体温调节及免疫监视的多种功能之外,作为提供对于疾病及水分蒸发的保护膜的基本的第一道防线而起到重要作用。皮肤的伤口治愈是伴随有止血(hemostasis)、炎症(inflammation)、增殖(proliferation)及重塑(remodeling)的四个步骤的复杂的步骤。在从伤口形成开始数小时内发生的第一个步骤中,发生血液凝固(clotting)及形成临时的伤口基质(provisionalwoundmatrix)的步骤,经过第一个步骤而被激活的炎症步骤中,通过噬中性粒细胞(neutrophil)募集、单核细胞(monocyte)的参与及变性来去除病原体及坏死组织。增殖步骤中,发生肉芽组织(granulationtissue)生成、血管网恢复、向成纤维细胞(fibroblast)表面的移动、再上皮化(reepithelization)、新生血管生成(angiongenesis)等,从伤口形成的21日开始延续至一年以上的成熟(remodeling)步骤中,在增殖步骤中活跃进行的过程缓慢停止,例如,肉芽组织的形成通过细胞凋亡(apoptosis)缓慢停止等,在增殖步骤中大量生成的iii型胶原由更坚韧的i型胶原所代替,肌成纤维细胞多重连接在胶原上,减少疤痕面积。在上述过程中,如果至少有一个步骤没有发挥出适当的作用,则伤口的治愈会延迟或者能使伤口慢性化,在这种情况下,尤其会对作为第一道防线的作用会产生严重的问题,相反,即使实现治愈,也可能由于疤痕增生等而导致外形上的问题。
皮肤附属结构(skinappendages)包括毛根、皮脂腺、手指甲及汗腺。大伤口的治愈过程按物种而有所差异。对于鱼类及两栖类等低等脊椎动物而言,包括鳞、分泌腺等皮肤附属结构的皮肤的再生会非常完整。相反,就哺乳类而言,除了在胚胎阶段之外,皮肤不会完整再生,从而会生成没有皮肤附属结构的疤痕组织,使得无法正常地执行皮肤附属结构的功能(与额外的保护、保温及感觉相关),因此,在美容及心里方面,导致了生活质量的降低。
生物体来源的蛋白质、基因、细胞等作为原料的药品(生物药品(biologics)),与合成药品不同,不会在体内产生代谢产物,由此毒性较低,并且选择性地作用于疾患的病因,从而效果好,副作用较少。最近,随着这种优点受到关注,正在开发以皮肤再生及伤口治愈为目的的生物药品,尤其重点开发利用干细胞的方法,其中,公开了利用干细胞本身、其提取物或培养液的方法等。但是,就利用干细胞的上述组合物而言,共同具有效率性及经济性差的问题(该问题由苛刻的细胞的分离及扩增而导致)。并且,对于干细胞治疗剂而言,存在转移为癌症等风险,而就干细胞提取物而言,从细胞中提纯活性成分并不容易,存在需付出较多的费用和时间的缺点,且对于干细胞培养液而言,除了活性成分之外,还含有从细胞中分泌的排泄物或为了防止污染而添加的抗生素及血清等(这些为未验证用于人体时的风险的物质)。
众所周知,外泌体是自然分泌的30至200nm直径的纳米囊泡,并且,可作为从来源的细胞搬运多种物质的重要的纳米介质而发挥作用。发现外泌体可以通过递送mrna来改变目标细胞的表型之后,多项研究表明外泌体参与细胞分化。最近,人们以多种方式寻求将外泌体以治疗目的而直接用于人体的可能性。尤其,在这种生物药品领域中,相比于小分子、肽、生长因子、抗体、核酸等的生物制药(biopharmaceuticals),外泌体在含有多种蛋白质及核酸,从而可以产生更复杂又持久的效果。并且,相比于如细胞一样大的药品,外泌体不存在转移等的风险,且由于不需要在注入细胞时发生的内质网形态的分解,因此具有与细胞不同的时空效应。最近,正在开发将从具有改善及治愈多种症状的效果的干细胞中得到的外泌体作为治疗组合物来使用的技术。韩国公开专利10-2017-0044999(2015.10.16.)公开了包含成体干细胞或其培养液来源的外泌体作为活性成分的用于治疗伤口的组合物。但是,包括上述公开专利的使用外泌体的治疗组合物的相关技术而言,外泌体的收率较低,并且大部分使用分离及扩增苛刻的干细胞。因此,为了在临床上使用外泌体,需要一种新型技术,该技术可从容易获得、扩增和保持的细胞(非干细胞)中得到外泌体的同时,还能提高外泌体的收率。
技术实现要素:
发明所要解决的问题
本发明为了解决上述问题而提出,本发明的一实施例提供如下的外泌体的制备方法,该制备方法包括:向细胞直接/间接提供超声波刺激的步骤;以规定时间培养上述细胞及培养基的混合物的步骤;以及从上述混合物分离外泌体的步骤,其中,直接提供刺激是指向含有细胞的培养基施加超声波刺激,间接提供刺激是指向未含有细胞的培养基施加超声波刺激之后,混合上述培养基和上述细胞,因此可以在短时间内从可轻易获得的细胞中以高收率得到具有皮肤再生及伤口治愈效果的外泌体。
并且,本发明的一实施例提供通过上述制备方法制备、且能促进皮肤再生及伤口治愈的基因的rna增加的外泌体。
并且,本发明的一实施例提供含有上述外泌体的用于再生皮肤及治愈伤口的含有诱导的外泌体的组合物,其能具有比合成药品高的持续性和安全性。
本发明所要解决的技术问题不限于前述技术问题,本领域技术人员可以根据以下的记载而明确地了解到未提及的其它技术问题。
用于解决问题的方案
作为用于解决上述技术问题的技术方案,根据本发明一实施例的具有皮肤再生及伤口治愈效果的外泌体的制备方法包括:向细胞直接/间接提供超声波刺激的步骤;以规定时间培养上述细胞及培养基的混合物的步骤;以及从上述混合物中分离外泌体的步骤,其中,直接提供刺激是指向含有细胞的培养基施加超声波刺激,间接提供刺激是指向不含有细胞的培养基施加超声波刺激之后,混合上述培养基和上述细胞。
其中,上述向细胞直接/间接提供超声波刺激的步骤通过选自以下方式中的任一种方式来执行:在混合细胞和培养基之后,向上述混合物提供超声波刺激,或者在向培养基提供超声波刺激之后,混合上述培养基和细胞,或者在向细胞提供超声波刺激之后,混合上述细胞和培养基,或者在向细胞提供超声波刺激之后,混合上述细胞和培养基,然后向上述混合物提供超声波刺激,或者在向培养基提供超声波刺激之后,混合上述培养基和细胞,然后向上述混合物提供超声波刺激,或者在分别向细胞和培养基提供超声波刺激之后,混合上述细胞及上述培养基,或者在分别向细胞和培养基提供超声波刺激之后,混合上述细胞及上述培养基,然后向上述混合物提供超声波刺激。
就直接的上述超声波刺激而言,强度为0.1至3w/cm2,频率为20khz至20mhz,持续时间为0.1秒至20分钟,就间接的上述超声波刺激而言,强度为1至20w/cm2,频率为20khz至20mhz,持续时间为0.1秒至20分钟。
上述细胞选自由各种哺乳类来源的干细胞、祖细胞(progenitorcell)、成纤维细胞、角质细胞或者器官内的组织细胞构成的组。
上述培养基可以是上皮干细胞培养基、真皮干细胞培养基,脂肪干细胞培养基、间充质干细胞培养基或者胚胎干细胞培养基中的任一种。
上述混合物的培养进行1小时至10天。
分离外泌体的上述步骤利用超离心、密度梯度、过滤、尺寸排除色谱法,免疫亲和分离、沉淀、基于微流体的分离方法中的一个以上。
分离外泌体的上述步骤可以包括:通过对培养后的上述混合物进行离心分离来获取上清液的步骤;利用过滤器过滤上述上清液,由此获取过滤液的步骤;对上述过滤液进行浓缩的步骤。
分离外泌体的上述步骤还可以包括:利用过滤器过滤上述上清液之前,在4℃以下的条件保管3个月以内的时间的步骤。
所分离的上述外泌体的直径为50至200nm。
根据本发明的另一实施例,提供通过上述制备方法来实现制备的、具有皮肤再生及伤口治愈效果的外泌体。
其中,上述外泌体与未通过权利要求1的制备方法的细胞所分泌的外泌体相比,促进皮肤再生及伤口治愈的基因的rna有所增加,上述促进皮肤再生及伤口治愈的基因是egfr、fn1、mmp9、mmp2、mapk1、fgf2、ctgf、akt1、alb、tgfb1、mapk3、vegfa、fgf7、hgf、il6、egf、mir-210、mir-31、colα1、eln、pcna、n-cadherin及cyclin-d1中的任一种以上。
上述外泌体与未通过权利要求1的制备方法的细胞所分泌的外泌体相比,涂布在皮肤时,进一步增加皮肤中的促进皮肤再生及伤口治愈的基因的rna表达,上述促进皮肤再生及伤口治愈的基因可以是colα1、col3α1、eln、pcna、n-cadherin及cyclin-d1中的任一种以上。
根据本发明的再一实施例,提供含有具有上述皮肤再生及伤口治愈效果的外泌体的组合物。
其中,上述组合物可以含有106个/ml以上浓度的上述外泌体。
发明效果
根据本发明的一实施例的外泌体的制备方法可以通过如超声波处理的简单的过程,不仅能从分离及扩增过程较苛刻的干细胞及祖细胞诱导具有皮肤再生及伤口治愈效果的大量的外泌体,而且还可以从可容易获得的体细胞中诱导具有皮肤再生及伤口治愈效果的大量的外泌体。对于以这种方式诱导的外泌体而言,其收率比现有的方法高,在上述外泌体内所含有的各种因子的含量及数量更多。
根据本发明的一实施例的外泌体及含有其的组合物中可以大量包括可诱导皮肤再生及伤口治愈的多种因子。并且,外泌体具有基于磷脂的膜结构,容易渗透毛孔,故递送物质的效率高,因此根据本发明的一实施例的外泌体可以有效地诱导皮肤再生及伤口治愈,且没有使用合成药品时出现的副作用。并且,根据本发明的一实施例的外泌体将在哺乳类中通常无法完全治愈的伤口诱导实现更完整的伤口愈合,使得疤痕消失或变小,并且还可以再生伤口部位的毛根等皮肤附属结构。
本发明的效果并不限于上述效果,而应当被理解为包括可通过记载的本发明的详细的说明或者记载于权利要求书的发明的结构来推测的所有效果。
附图说明
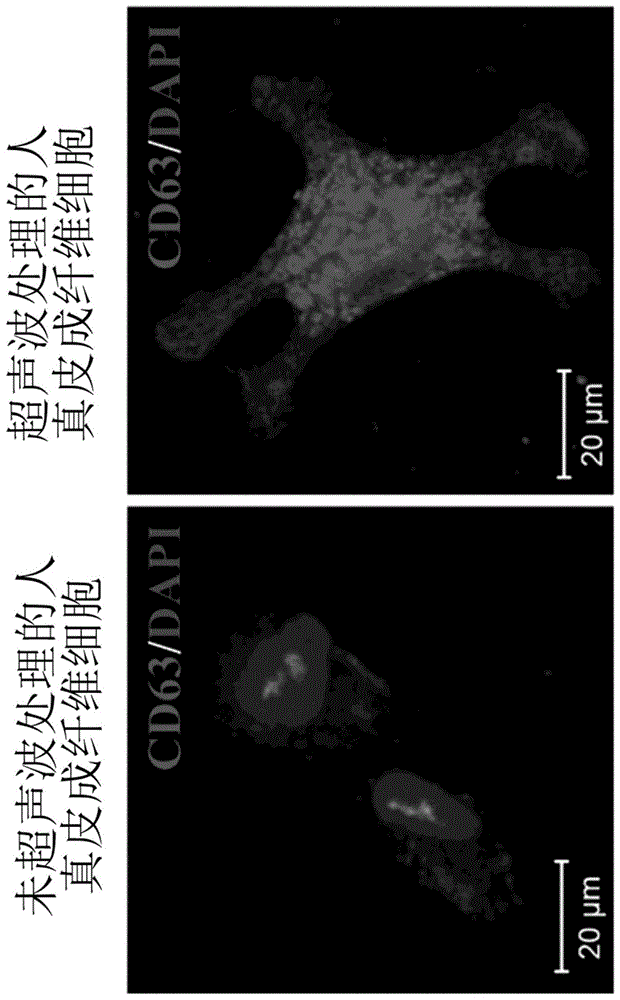
图1为本发明实施例1的具有皮肤再生及伤口治愈效果的外泌体的生成数据,其为示出诱导外泌体标记物cd63的免疫荧光染色图。
图2为本发明实施例1的具有皮肤再生及伤口治愈效果的外泌体的基因表达数据,其是示出通过转录组测序(rna-seq)仅在上述外泌体(iexo)中读取(readcount)数为12以上的基因的基因本体(geneontology)分析结果。
图3为本发明实施例1的具有皮肤再生及伤口治愈效果的外泌体的基因表达数据,其是与伤口治愈相关的rna-seq结果数据。
图4为本发明实施例1的具有皮肤再生及伤口治愈效果的外泌体的基因表达数据,其是与血管新生、细胞生长、细胞移动、细胞增殖、炎症反应、再生、分泌、组织再生及组织重塑相关的rna-seq结果数据。
图5为本发明实施例1的具有皮肤再生及伤口治愈效果的外泌体的基因表达数据,其是分析上述外泌体内的皮肤再生及伤口治愈相关基因的rna的qrt-pcr数据。
图6为基于本发明实施例1的具有皮肤再生及伤口治愈效果的外泌体的体外(invitro)效果数据,其是以不同浓度的上述外泌体进行处理的人真皮成纤维细胞(hdf)中的细胞增殖的数据。
图7为基于本发明实施例1的具有皮肤再生及伤口治愈效果的外泌体的体外效果数据,其是通过划痕实验(scratchassay)测量的以不同浓度外泌体处理的hdf的不同时间的移动率数据。
图8为基于本发明实施例1的具有皮肤再生及伤口治愈效果的外泌体的体外效果数据,其是以不同浓度外泌体处理的人脐静脉内皮细胞(huvec)的管(tube)形成分析数据。
图9为基于本发明实施例1的具有皮肤再生及伤口治愈效果的外泌体的体外效果数据,其是对用上述外泌体进行处理的细胞内的皮肤再生及伤口治愈相关基因的rna进行分析的qrt-pcr数据。
图10为基于本发明实施1的具有皮肤再生及伤口治愈效果的外泌体的体内(invivo)效果数据,其是以不同浓度的上述外泌体进行处理的小鼠的根据时间的伤口治愈过程的图。
图11为基于本发明实施1的具有皮肤再生及伤口治愈效果的外泌体的体内效果数据,其是以不同浓度的上述外泌体进行处理的小鼠的伤口部位的组织剖面的h&e染色的图。
图12为基于本发明实施1的具有皮肤再生及伤口治愈效果的外泌体的体内效果数据,其是以不同浓度的上述外泌体进行处理的小鼠的伤口部位的根据浓度的细胞增殖标记物分析数据。
图13为基于本发明实施1的具有皮肤再生及伤口治愈效果的外泌体体内效果数据,其是上述外泌体的皮肤渗透分析数据。
图14为基于本发明实施1的具有皮肤再生及伤口治愈效果的外泌体的体内效果数据,其是以不同浓度的上述外泌体进行处理的小鼠的根据不同的外泌体浓度的伤口部位中的rt-pcr结果数据。
图15为基于本发明实施1的具有皮肤再生及伤口治愈效果的外泌体的体内效果数据,其是以不同浓度的上述外泌体进行处理的小鼠伤口经过3周后的伤口部位的皮下血管发育比较图。
具体实施方式
以下,更详细地说明本发明。但是本发明能够以各种不同的方式来实现,且不限于在此说明的实施例,只能根据前述的权利要求书定义本发明。
并且,在本申请中使用的术语仅仅是为了说明特定的实施例而使用的,并不是限定本发明的意图。单数的表述方式只要在文脉上没有明确指出不同意思就包括多数的表述含义。在本发明的整个说明书中“含有”某个结构要素是指在没有特别相反的记载的情况下,并不是排除其他构成要素,而是还能够进一步含有其他结构要素。
根据本发明一实施例的具有皮肤再生及伤口治愈效果的外泌体的制备方法包括:向细胞直接/间接提供超声波刺激的步骤;以规定时间培养上述细胞及培养基的混合物的步骤;以及从上述混合物中分离外泌体的步骤,其中,直接提供刺激是指向含有细胞的培养基施加超声波刺激,间接提供刺激是指向不含有细胞的培养基施加超声波刺激之后,混合上述培养基和上述细胞。
其中,向细胞直接/间接提供超声波刺激的上述步骤通过选自以下方式中的任一种方式来执行:在混合细胞和培养基之后,向上述混合物提供超声波刺激,或者在向培养基提供超声波刺激之后,混合上述培养基和细胞,或者在向细胞提供超声波刺激之后,混合上述细胞和培养基,或者在向细胞提供超声波刺激之后,混合上述细胞和培养基,然后向上述混合物提供超声波刺激,或者在向培养基提供超声波刺激之后,混合上述培养基和细胞,然后向上述混合物提供超声波刺激,或者在分别向细胞和培养基提供超声波刺激之后,混合上述细胞及上述培养基,或者在分别向细胞和培养基提供超声波刺激之后,混合上述细胞及上述培养基,然后向上述混合物提供超声波刺激。如上所述的超声波刺激可以是对细胞通过直接/间接的方法执行一次以上,或以上述方式中选择一种以上的组合来进行,随着次数的增加,外泌体的皮肤再生及伤口治愈效果可以成比例的增加。如此,在提供一次以上的超声波刺激时,优选在每次的超声波刺激之间留有时间间隔,以能使细胞能恢复。上述时间间隔为一日以上,更优选为两日以上。
对于直接的上述超声波刺激而言,强度为0.1至3w/cm2,频率为20khz至20mhz,持续时间为0.1秒至20分钟,对于间接的上述超声波刺激而言,强度为1至20w/cm2,频率为20khz至20mhz,持续时间为0.1秒至20分钟。更优选地,对于直接的上述超声波刺激而言,强度为0.5至2w/cm2,频率为20khz至2mhz,持续时间为0.1秒至10分钟,对于间接的上述超声波刺激而言,强度为2至10w/cm2,频率为20khz至2mhz,持续时间为1秒至15分钟。
上述细胞可以选自各种哺乳类来源的除生殖细胞以外的各种细胞,优选地,上述细胞选自由各种哺乳类来源的干细胞、祖细胞、成纤维细胞、角质细胞或者器官内的组织细胞构成的组,更优选地,上述细胞可以是哺乳类来源的成纤维细胞或者器官内的组织细胞中的任一种。这是因为,根据后述的本发明一实施例的具有皮肤再生及伤口治愈效果的外泌体的制备方法,即使使用任何细胞,也能够获取上述外泌体,因此与难以获得且扩增条件苛刻的干细胞或祖细胞相比,更容易获取、保持及扩增的细胞(如成纤维细胞或器官内的组织细胞等)可更加容易、且有效地获取外泌体。根据上述外泌体对于后述的生物体的后续用途,上述细胞可以是自体来源(autologous)的细胞、同种来源(allogeneic)的细胞或者异种来源(heterologous)的细胞中的任一种,就异种来源的细胞而言,可以是从哺乳类中获取的。为了减少免疫排斥的可能性,优选使用同种来源的细胞,最优选使用自体来源的细胞。
向细胞施加超声波刺激的上述步骤中,可直接对细胞进行超声波处理,或者在仅含有最小量(即在细胞能被初始培养基勉强覆盖的程度)的情况下进行超声波处理。此时,初始培养基作为将上述细胞保持为健康状态时使用的普通培养基,可以是适合于上述细胞的普通培养的培养基,例如,上述细胞是成纤维细胞,初始培养基为含有抗生素和血清的dmem培养基。
上述培养基(在无细胞的情况下超声波处理的培养基)可以选自上皮干细胞培养基、真皮干细胞培养基、脂肪干细胞培养基、间充质干细胞培养基或者胚胎干细胞培养基,但是并不限于此。例如,上述培养基可以是皮肤干细胞培养基、骨髓干细胞培养基、血管内皮祖细胞培养基、血管祖细胞培养基、间充质祖细胞培养基、上皮干细胞培养基、真皮干细胞培养基、造血干细胞培养基、脂肪干细胞培养基、间充质干细胞培养基或者胚胎干细胞培养基及各种成体干细胞培养基中的任一种。根据本发明的发明人申请的韩国专利第10-2018-0060317号,通过对超声波处理的第二细胞培养基(可培养第二细胞或可诱导分化为第二细胞的培养基)及超声波处理的第一细胞的混合物进行培养而获得的外泌体来处理其他细胞,则可以将该细胞重编程为第二细胞,干细胞或者其提取物、培养液等均呈现皮肤再生及伤口治愈的效果。
上述混合物的培养进行1至10日,优选地,进行1至6日,最优选地,进行1至2日。这是因为外泌体在超声波处理后的第一天分泌最多,随着时间的流逝,其分泌量减少,从这种分泌量减少的情况来看,成分也有可能发生变化。
分离外泌体的上述步骤中,可利用超离心分离、密度梯度分离、过滤、尺寸排除色谱法、免疫亲和分离、沉淀、基于微流体的分离方法中的一个以上。
分离外泌体的上述步骤可以包括:通过对培养后的上述混合物进行离心分离来获取上清液的步骤;利用过滤器过滤上述上清液,由此获取过滤液的步骤;以及对上述过滤液进行浓缩的步骤。上述离心分离是为去除细胞碎片及死细胞而进行,优选地,以1000至5000g进行10分钟至60分钟。利用过滤器过滤上清液的步骤是为了进一步去除细胞碎片,且仅获取特定尺寸以下的粒子而执行,优选地,在此使用的过滤器可以是注射器式过滤器(syringefilter)。优选地,对上述过滤液进行浓缩的步骤中,可以利用离心式过滤器(centrifugalfilter)来进行浓缩。如果利用离心式过滤器,则可以对上述过滤液进行浓缩的同时,去除特定尺寸的粒子。分离外泌体的上述步骤还可以包括:利用过滤器过滤上述上清液之前,在4℃以下的条件下进行3个月以内时间的保管的步骤。对于上述保管而言,优选地,在4℃以下的条件下保管7天以内的时间,更优选地,可以在-20℃以下的条件下保管1个月以内的时间,最优选地,可以在-80℃以下的条件下保管3个月以内的时间。外泌体的活性成分为mrna和蛋白质等,在温度高或接近能使酶活性高的温度时,这些成分更容易发生变性或分解。
所分离的上述外泌体的直径为50至200nm,优选地,直径为100至150nm。
根据本发明的另一面的具有皮肤再生及伤口治愈效果的外泌体,通过上述制备方法来实现制备。
其中,皮肤再生及伤口治愈可以包括抗老化、防止皱纹、改善皱纹、伤口治愈、疤痕治愈及组织再生中的一个以上。
上述外泌体与从未通过上述制备方法的细胞中分泌的外泌体相比,促进皮肤再生及伤口治愈的基因的rna增加,其中,上述促进皮肤再生及伤口治愈的基因是表皮生长因子受体(epidermalgrowthfactorreceptor,egfr)、纤连蛋白1(fibronectin1,fn1)、基质金属蛋白酶9(matrixmetallopeptidase9,mmp9)、基质金属蛋白酶2(matrixmetallopeptidase2,mmp2)、丝裂原活化蛋白激酶1(mitogen-activatedproteinkinase1,mapk1)、成纤维细胞生长因子2(fibroblastgrowthfactor2,fgf2)、结缔组织生长因子(connectivetissuegrowthfactor,ctgf)、丝氨酸/苏氨酸蛋白激酶1(aktserine/threoninekinase1,akt1)、白蛋白(albumin,alb)、转化生长因子β1(transforminggrowthfactorbeta1,tgfb1)、丝裂原活化蛋白激酶3(mitogen-activatedproteinkinase3,mapk3)、血管内皮生长因子a(vascularendothelialgrowthfactora,vegfa)、成纤维细胞生长因子7(fibroblastgrowthfactor7,fgf7)、肝细胞生长因子(hepatocytegrowthfactor,hgf)、白介素6(interleukin6,il6)、表皮生长因子(epidermalgrowthfactor,egf)、微rna-210(microrna210,mir-210)、微rna-31(microrna31,mir-31)、ⅰ型胶原α1(collagen1alpha1,colα1)、弹性蛋白(elastin,eln)、增殖细胞核抗原(proliferatincellnuclearantigen,pcna)、n-钙粘蛋白(cadherin)及细胞周期蛋白-d1(cyclin-d1)中的任一种以上。
上述外泌体与从未通过上述制备方法的细胞中分泌的外泌相比,涂布在皮肤时,进一步增加在皮肤中能促进皮肤再生及伤口治愈的基因的rna表达,上述促进皮肤再生及伤口治愈的基因可以是colα1、iii型胶原α1(collagen3alpha1,col3α1)、eln、pcna、n-cadherin及cyclin-d1中的任一种以上。
根据本发明的另一实施例,提供含有具有上述皮肤再生及伤口治愈效果的外泌体的组合物。
其中,上述组合物可以最少含有106个/ml以上的上述外泌体,优选地,含有106个/ml至1014个/ml浓度的上述外泌体,更优选地,可以含有1011个/ml至1012个/ml浓度的上述外泌体。这是因为,当含有的外泌体的浓度小于106个/ml或大于1014个/ml时,皮肤再生及伤口治愈效果可能会降低,特别是在浓度过高时,经济性也会降低。
向上述组合物除了添加具有皮肤再生及伤口治愈效果的上述外泌体之外,显而易见地,还能够以多种方式添加药用载体及/或者进一步增强活性成分的吸收或再生及治愈反应的其他添加剂等,因此将省略对其的具体说明。
以下,对本发明的实施例进行详细地说明,以便本领域技术人员能够容易实施。然而本发明能够以各种不同的方式来实现,且不限于在此说明的实施例。
本发明的所有实施例及实验例中的所有细胞培养是在37℃、5%的co2条件下进行的。
实施例1.具有皮肤再生及伤口治愈效果的外泌体的制备
为了获取具有皮肤再生及伤口治愈效果的外泌体,利用ultrarepro1001(stemon公司,首尔,韩国)直接向1×106个人真皮成纤维细胞(hdf)施加20khz,1.0w/cm2的超声波刺激5秒。在35-mm培养皿中,将2×105个uhdf与超声波处理(20khz,5.0w/cm2,10分钟)的胚胎干细胞的培养基((dmem)/f12、15%胎牛血清(fbs)、2mmglutamax、0.1%非必需氨基酸(neaa)、0.1%青霉素/链霉素,0.1mmβ-巯基乙醇、1000unit/ml白血病抑制因子(lif))一起培养一天。从培养经超声波处理的hdf(uhdf)的培养基中,分离外泌体的方式如下:以3000×g方式对培养基进行离心分离20分钟,从而去除细胞碎片及死细胞之后,用0.22-mm过滤器(
实验例1.具有皮肤再生及伤口治愈效果的外泌体分析实验
对根据实施例1的具有皮肤再生及伤口治愈效果的外泌体的制备方法而培养出的细胞(uhdf)通过基于cd63外泌体标记物的免疫荧光染色进行分析的结果(此时,对照染色为核染剂4',6-二脒基-2-苯基吲哚(dapi)),与对照组相比,cd63信号强度非常高,从而可以确认大量的外泌体正在生成(图1)。对于制备的外泌体进行的rna-seq结果,根据实施例1制备的外泌体(iexo)相比于从在没有超声波刺激的情况下培养的细胞中分离的外泌体(nexo),尤其在与伤口治愈、血管新生、细胞成长、细胞移动、细胞增殖、炎症反应、再生、分泌、组织再生及组织重塑等相关的基因表达更高(图2~4),代表性地,含有egfr、fn1、mmp9、mmp2、mapk1、fgf2、ctgf、akt1、alb、tgfb1、mapk3、vegfa、fgf7、hgf、il6、egf等的蛋白质编码基因和mir-210、mir-31等的微rna(图3,其中“重编程因子的外泌体”是指“repsome”)。
并且,从外泌体(iexo)(该外泌体是从上述细胞的培养液分离的外泌体)提取rna并通过qrt-pcr进行分析的结果,可以确认有关组织再生及伤口治愈的细胞外结构物质(细胞外基质(extracellularmatrix))相关基因colα1、col3α1及eln,以及与细胞增殖相关的基因pcna、n-cadherin及cyclin-d1等的表达与从对照组分离的外泌体(nexo)相比更高(图5)。
实验例2.根据具有皮肤再生及伤口治愈效果的外泌体处理的细胞表型分析实验
通过向培养基额外添加根据实施例1的具有皮肤再生及伤口治愈效果的外泌体的制备方法而制备的外泌体来培养hdf,由此,确认了根据外泌体浓度的效果。首先,利用细胞增殖相关标记物ki67的免疫荧光染色来对细胞增殖效果进行分析的结果,实验组与对照组相比,上述标记物的表达更高,尤其,当用5×1011个/ml及10×1011个/ml浓度的外泌体来进行处理时,其效果更为显著,确认了细胞数增加得更多(图6)。其次,进行如下的伤口愈合实验(woundhealingassay),具体地,以填满孔板的方式培养上述hdf之后,利用20μl黄枪头(yellowtip)画线,使细胞间隔开一定距离,然后用外泌体进行处理并进行培养,其结果,在外泌体处理组中,相对较快地填满了空的空间(图7),由此可以确认实验组的细胞移动率更高。
接着,为了分析根据通过实施例1制备的外泌体的浓度的组织再生过程中的血管生成效率,利用不同浓度的外泌体对作为内皮细胞的人脐静脉内皮细胞(huvec)进行处理,10小时之后确认了管(tube)形成的状态。其结果,外泌体处理组与对照组相比,更好地形成了管,这也可以用肉眼来确认(图8的a),并且管的长度及交叉点数(图8的b-c)更高,尤其,以5×1011个/ml及10×1011个/ml的浓度处理的组呈现出更好的效果。
最后,通过qrt-pcr来分析外泌体处理的细胞内的组织再生及伤口治愈相关基因colα1、col3α1、eln、pcna、n-cadherin及cyclin-d1的表达。其结果,实验组与对照组相比,呈现出更高的伤口治愈相关基因的表达(图9)。
实验例3.具有皮肤再生及伤口治愈效果的外泌体处理的体内(invivo)效果分析实验
为了在体内(invivo)确认根据实施例1的具有皮肤再生及伤口治愈效果的外泌体的制备方法而制备的外泌体(iexo)的效果,利用打孔器(punch)在6周大的c57小鼠的皮肤上留下6mm的伤口,将iexo分别以0、5×1011、10×1011、20×1011个/ml浓度稀释在磷酸盐缓冲液(pbs),并每周两次涂抹于伤口部位。
其结果,1周后,可以确认外泌体处理的小鼠与未处理的小鼠相比,露出于外部的伤口(opening)的尺寸明显减小(图10:与此相关地,在第2周时,就外泌体处理的小鼠而言,伤口完全闭合,并在其上长了毛发,由此无法拍摄处理组之间的比较图)。并且,在1周及2周后,采用h&e染色分别确认伤口部位组织剖面的结果,相比于未进行外泌体处理的小鼠,外泌体处理的小鼠的伤口的尺寸较小,由此可确认迅速实现了皮肤再生及伤口治愈,尤其,对于将10×1011及20×1011个/ml浓度的外泌体处理在伤口部位的情况而言,在第二周时,皮肤组织完全恢复及再生,从而可以明确地区分构成皮肤组织的表皮和真皮层、脂肪层、肌肉层,并且作为皮肤附属组织的毛囊以伤口部位与周边部位之间无任何差异的方式生成于真皮层和脂肪层,尤其,对于利用10×1011及20×1011个/ml浓度的外泌体来进行处理的情况而言,在第二周时,疤痕也消失了(图11)。进一步地,通过免疫荧光染色确认在伤口恢复部位的组织剖面的细胞增殖标记物ki67的结果,与未进行外泌体处理的组相比,在处理组中观察到大范围的ki67(图12),由此可知,在损伤部位细胞增殖正在活跃地进行着。利用vybranttmdid细胞标记溶液(cell-labelingsolution)对iexo进行染色,并将其处理在伤口部位,2周后,通过荧光显微镜来分析iexo处理的部位的结果,可以确认iexo渗透在整个伤口部位,由于这种有效的渗透,能呈现出前述的再生及治愈效果(图13)。
其次,通过qrt-pcr来分析在外泌体处理的伤口部位中的组织再生及伤口治愈相关基因colα1、col3α1、eln、n-cadherin及cyclin-d1的表达,其结果,iexo处理的实验组与对照组相比,上述基因中的一个以上的表达大体上实现增加(图14)。此时,根据各个不同的浓度,增加量最多的基因也随之不同,很难确认浓度和表达增减的相关关系。
最后,在完成伤口治愈后的第3周时,确认了伤口部位的皮下血管的发育程度。其结果,iexo处理的组织的血管发育得更多(图15)。
综上所述,根据实施例1而制备的外泌体促进细胞增殖、移动及血管发育等,从而可以提高组织的伤口治愈及再生能力。并且,上述外泌体在体内(invivo)也能实现这些效果,因此,在能够提高皮肤再生及伤口治愈速度的同时,能诱导更加完整的皮肤再生及伤口治愈(使伤口更小或无伤口,且还能使皮肤附属组织也实现再生)。
比较例1.对于外泌体的对照组(nexo)
在含有2mmglutamaxtm-i添加剂(gibco)、6u/ml肝素(heparin)(sigma-aldrich)及200μm抗坏血酸(ascorbicacid)(sigma-aldrich)的成纤维细胞培养基(含有10%胎牛血清(fetalbovineserum)(gibco)及1%青霉素/链霉素(penicillin/streptomycin)(gibco)的dmem(gibco))培养未进行超声波刺激的hdf(nhdf)。当从培养上述nhdf的培养基分离外泌体(nexo)时,采用与实施例1的外泌体分离方法相同的过程。
比较例2.由外泌体诱导的细胞的对照组
将1×105个的hdf接种到35-mm培养皿培养一天之后,将培养基更换为含有根据比较例1而获取的外泌体的培养基,并培养5天。此时,在培养5天的期间内,以将外泌体包含在胚胎干细胞培养基的方式进行了使用,这种包含外泌体的培养基每两天进行更换。
比较例3.由外泌体诱导皮肤再生及伤口治愈的小鼠的对照组
每周两次,将iexo稀释溶剂pbs涂抹于利用打孔器(punch)留下6mm直径的伤口的小鼠。
前述的本发明的说明用于示例,本领域技术人员能够理解在不变更本发明的技术思想或必要特征的前提下,可变形为其他具体形态。因此,应当被理解为以上描述的实施例在所有方面都是示例性的,而不是限定性的。例如,以一体的方式说明的各个结构要素也可以由分散的形态实施,同理,以分散的方式说明的结构要素也可以由结合为一体的形态实施。
本发明的范围由前述的权利要求书而体现,从权利要求书的含义、范围以及等效概念导出的所有变更或者变形的形态应包括在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!