一种具有粘附-抗冻双功能的二嵌段融合蛋白及合成方法和应用与流程
本发明属于生物技术领域,具体涉及一种具有粘附-抗冻双功能的二嵌段融合蛋白及合成方法和应用;包括具有粘附-抗冻双功能的二嵌段融合蛋白的基因设计、含有融合蛋白基因片段的重组表达载体的构建、在大肠杆菌中的发酵表达、融合蛋白的分离纯化方法、及其在抗冻表面方面的应用。
背景技术:
抗冻蛋白(afp)是一类具有提高生物抗冻能力的蛋白质类化合物的总称,它能够结合到小的冰晶上,阻止冰的结晶化和晶体的生长。通常,抗冻蛋白的热滞后值越大,生物体对于低温的适应性越好。(热滞后效应为以非依数性的方式降低溶液的冰点,而不改变其熔点,从而使的溶液的冰点和熔点产生差异,溶液熔点与冰点的差值被称为热滞后值。)
抗冻蛋白分为防冻类蛋白和耐冻类蛋白。防冻类蛋白能够保护他们的体液,防止冻到一起,但是在极冷的环境下afp功能会受损,导致冰晶的迅速增长,以致生物体死亡;耐冻类蛋白被认为是作为低温保护剂,以保护生物体免受冻伤,而不是不结冻,所以含有耐冻类蛋白的物种在体液冻结时仍能生存。
到目前为止,已经发现了许多类已知的afp,包括鱼类afp、植物afp、昆虫afp和海冰微生物物种的afp。其中,鱼类的afp研究的最为清楚,分为抗冻糖蛋白、ⅰ型afp、ⅱ型afp、ⅲ型afp、ⅳ型afp。抗冻糖蛋白(afgp)是由甘氨酸-甘氨酸-苏氨酸三肽重复单元构成的聚合物,其中苏氨酸上连有一个双糖基团。i型afp富含丙氨酸(60%以上),且具有规整的α-螺旋结构。ii型afp含有较高含量的半胱氨酸(8%),其结构中含有α-螺旋结构,β-折叠结构及大量的无规结构。iii型afp是小的球形蛋白(62~66个氨基酸),具有一个平的冰结合面。iv型afp中4个α-螺旋结构反向平行排列。对于植物afp与昆虫afp的研究表明,多数都具有能够很好的与冰的基平面和棱面结合的β片结构,使得这类蛋白具有较高的活性。将这类蛋白称为“高抗冻蛋白”。与普通抗冻蛋白相比,高活性抗冻蛋白不仅可以吸附在冰晶的棱面,也可以吸附在冰晶的基平面上。抗冻蛋白的这些特性使得其在工农业及医学等领域,都有着广阔的应用前景。例如,工业中用作防冻剂,通过转基因技术将抗冻基因接入作物的dna序列中,延长其生产季节,或医学上细胞和器官的低温保存等。
但是,提纯和制备抗冻蛋白非常困难,从而大大限制了其应用。蛋白质的水解产物为多肽。多肽合成技术成熟,如固相合成法,液相合成法,酸解法,碱解法,酶法等。因此,设计及合成具有抗冻活性的多肽,使具有和抗冻蛋白相似的功效,有利于扩大其在各个领域的应用及实现大规模工业化生产。
目前为止,对于防结冰材料的研究主要集中在利用疏水或超疏水表面,但是疏水材料的防结冰效果并不理想,超疏水材料制备方法较繁琐。也有少数科学家将抗冻蛋白与高分子结合修饰到材料表面,均取得了较好的防结冰效果,然而将抗冻蛋白与高分子结合,需要对蛋白质修饰反应基团,易导致蛋白的失活,并且操作繁琐。
技术实现要素:
本发明以基因工程为技术手段,制备一种同时含有抗冻蛋白基因与黏附蛋白基因的基因表达载体,并将其转化入宿主细胞,通过诱导剂使其过量表达此蛋白,分离纯化获得融合蛋白。这种具有黏附-抗冻双功能的二嵌段融合蛋白制备得到的抗冻表面效果显著,并且该制备方法简单易行,无需特殊的反应条件,且适用范围广。
本发明的第一个目的是,通过基因工程技术获得一种同时具有特异性黏附和抗冻的功能的二嵌段融合蛋白。其中,第一嵌段以贻贝足丝蛋白作为锚定功能单元,第二嵌段以抗冻蛋白作为抗冻功能单元。
为实现上述目的,本发明提供的技术方案为:一种具有特异性黏附和抗冻功能的融合蛋白,其氨基酸序列如seqidno.3所示。
所述的融合蛋白的贻贝粘附蛋白氨基酸序列包含seqidno.1所示的序列,抗冻蛋白氨基酸序列包含seqidno.2所示的序列。
本发明的第二个目的是提供了上述融合蛋白的合成方法,其特征在于将融合蛋白的基因克隆到质粒载体得到重组表达质粒,将重组表达质粒与表达酪氨酸激酶的质粒共同转化入宿主细胞后用诱导剂诱导宿主细胞过量表达融合蛋白,分离纯化后得到融合蛋白。
技术方案如下:
一种具有粘附-抗冻双功能的二嵌段融合蛋白,其特征在于所述融合蛋白含有贻贝粘附蛋白和抗冻蛋白。
所述的贻贝粘附蛋白包含seqidno.1所示的序列。
所述的抗冻蛋白包含seqidno.2所示的序列。
本发明所述具有粘附-抗冻双功能的二嵌段融合蛋白的合成方法,其特征在于:将融合蛋白的基因克隆到质粒载体得到重组表达质粒,将重组表达质粒与表达酪氨酸激酶的质粒共同转入宿主细胞后用诱导剂诱导宿主细胞过量表达融合蛋白,分离纯化后得到融合蛋白。
优选所述融合蛋白氨基酸序列为seqidno.3,核苷酸序列为seqidno.4。重组表达载体是将二嵌段融合蛋白基因克隆到大肠杆菌表达载体pet-28a中得到重组表达载体,所述的重组表达载体含有bamhi和notⅰ限制性酶切位点,t7强启动子、lca乳糖操纵子以及卡那霉素、氯霉素的抗性筛选基因。
表达所述融合蛋白的宿主细胞为含有seqidno.4的核苷酸序列的宿主细胞;或者为含有重组表达载体的宿主细胞。优选所述的细胞为大肠杆菌bl21(de3)。
优选本发明的融合蛋白的合成方法,将贻贝粘附蛋白和抗冻蛋白利用基因工程技术进行融合,构建重组表达载体,再将重组表达载体与表达酪氨酸激酶的表达载体共同转化入大肠杆菌bl21(de3)中进行融合蛋白的表达,通过柱层析或乙酸提取的方法纯化贻贝粘附蛋白/抗冻蛋白融合蛋白。包括以下步骤:
(1)人工合成二嵌段融合蛋白基因,所述的基因的核苷酸序列为seqidno.4所示;
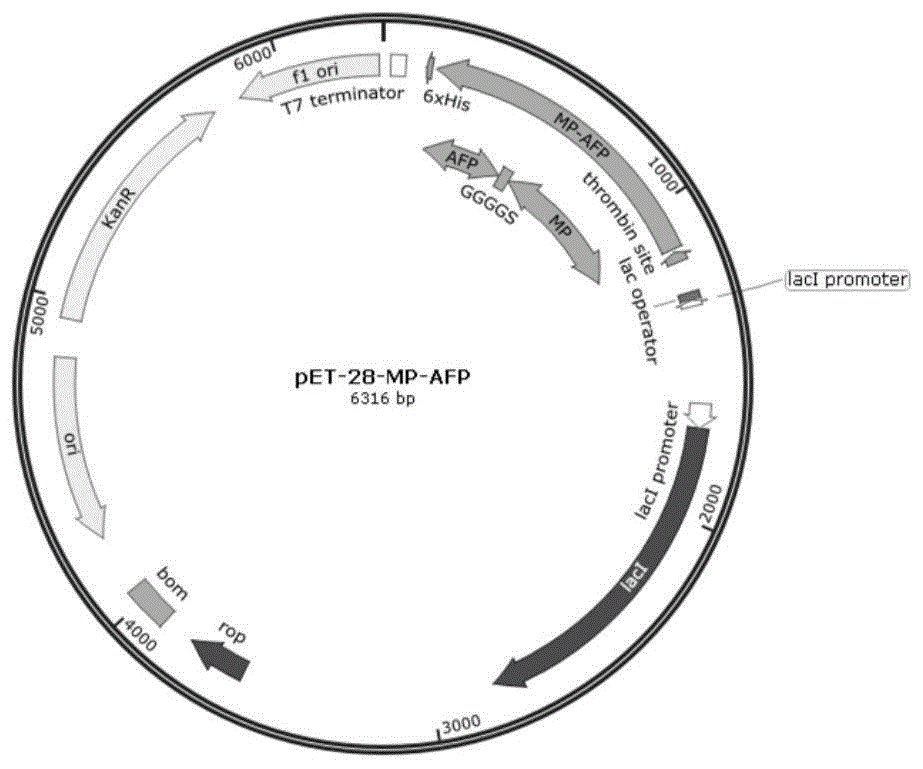
(2)将合成的二嵌段融合蛋白基因克隆到大肠杆菌表达载体pet-28a中,在融合蛋白基因5’端加入bamhi限制性酶切位点,在基因3’端加入notⅰ限制性酶切位点,得到重组表达载体,(如图1);
(3)构建表达酪氨酸激酶的表达载体,(如图2);
(4)将构建成功的重组表达载体与表达酪氨酸激酶的表达载体共同转化入大肠杆菌bl21(de3)中,利用含有卡那霉素和氯霉素双抗性的lb固体培养基(蛋白胨10g/l,酵母提取物5g/l,nacl10g/l,琼脂15g/l);平板筛选转化子;
(5)大肠杆菌bl21(de3)发酵表达出具有粘附-抗冻双功能的二嵌段融合蛋白seqidno.3;核苷酸序列为seqidno.4;
(6)二嵌段融合蛋白的分离纯化。
表达所述融合蛋白的宿主细胞为含有seqidno.4的核苷酸序列的宿主细胞或者为含有重组表达载体的宿主细胞;
所述的宿主细胞为大肠杆菌bl21(de3);重组表达载体是将融合蛋白基因克隆到大肠杆菌表达载体pet-28a中得到重组表达载体,所述的重组表达载体含有bamhⅰ和notⅰ限制性酶切位点,t7强启动子、lca乳糖操纵子、六聚组氨酸标签以及卡那霉素、氯霉素的抗性筛选基因。
相较于现有技术,本发明的有益效果是:本发明中首次将贻贝粘附蛋白和抗冻蛋白在基因水平上进行融合,构建了具有粘附-抗冻双功能的二嵌段融合蛋白。利用大肠杆菌发酵表达融合蛋白,并根据融合蛋白独特的性质,利用亲和层析技术纯化上清蛋白,利用乙酸纯化包涵体,构建了高纯度的分离纯化方法,实现了微生物一步法合成融合蛋白,该过程温和高效,成本低廉,设备要求度低,易于后期扩大生产。利用酪氨酸激酶实现了在大肠杆菌体内融合蛋白中酪氨酸残基到非天然氨基酸dopa的部分转化。羟基化后融合蛋白的贻贝粘附蛋白部分含有dopa,能通过共价键和配位能力将融合蛋白牢固地粘附在基质材料表面,形成表面蛋白修饰层;同时由于抗冻蛋白对正常动物细胞的生长没有任何毒性影响,有望成为医疗器材和生物芯片中抗冻涂层材料。
附图说明
图1:重组表达载体体pet-28a-mp-afp示意图;
所述的重组表达载体含有bamhi和notⅰ限制性酶切位点,t7强启动子、lca乳糖操纵子、六聚组氨酸标签以及卡那霉素、氯霉素的抗性筛选基因。
图2:表达酪氨酸激酶的重组表达载体示意图;
图3:重组菌株双酶切图;
图4:未羟基化的贻贝足丝蛋白与mp-afp对比图;
图5:融合蛋白抗冻性测试。
具体实施方式
本发明以具体实施例提供一种优选的具有黏附-抗冻双功能的二嵌段融合蛋白mp-afp(我们将其命名为mp-afp(mytilusedulisfootprotein-antifreezeprotein)),其氨基酸序列如seqidno.3所示。其核苷酸序列如seqidno.4所示。
本发明中的融合蛋白mp-afp基因根据大肠杆菌表达偏好进行密码子优化,使融合蛋白能够在大肠杆菌中过量稳定表达。
本发明提供含有上述融合蛋白mp-afp基因的重组表达载体,其特征在于将贻贝粘附蛋白/抗冻蛋白融合蛋白mp-afp基因克隆到大肠杆菌表达载体pet-28a中得到重组表达载体pet-28a-mp-afp(我们将其命名为pet-28a-mp-afp),所述的重组表达载体含有bamhⅰ和notⅰ限制性酶切位点,t7强启动子、lca乳糖操纵子、六聚组氨酸标签以及卡那霉素、氯霉素的抗性筛选基因。本发明提供含有上述融合蛋白mp-afp基因的宿主细胞,其特征在于所述的宿主细胞为含有如seqidno.3所示的核苷酸序列的宿主细胞,或者为含有上述的重组表达载体pet-28a-mp-afp的宿主细胞,优选的,所述的宿主细胞为大肠杆菌bl21(de3)。
本发明提供一种产生上述融合蛋白mp-afp的方法,其特征在于将贻贝粘附蛋白mp和ke两性离子多肽利用基因工程技术进行融合,构建重组表达载体pet-28a-mp-afp,再将pet-28a-mp-afp质粒载体转化入大肠杆菌bl21(de3)中进行融合蛋白mp-afp的表达,通过柱层析或乙酸提取的方法纯化贻贝二嵌段融合蛋白mp-afp
实施例1:重组表达载体和菌株的构建
①重组表达载体的构建
以3个ggggs重复序列作为连接多肽连接黏附蛋白和水粉虫抗冻蛋白构成融合蛋白mp-afp,在不改变其氨基酸序列的基础上根据大肠杆菌表达的偏好性对基因进行密码子优化。在基因序列的5’端加入bamhⅰ限制性酶切位点并在基因3’端加入notⅰ限制性酶切位点;人工合成该基因序列并克隆到大肠杆菌表达载体pet-28a中得到重组表达载体pet-28a-mp-afp,所述重组表达载体中含有t7强启动子、lca乳糖操纵子、卡那霉素抗性标记位点和六聚组氨酸标签,如图1所示。
②大肠杆菌的化学转化
将感受态大肠杆菌bl21(de3)在冰上融化。将构建正确的重组表达载体pet-28a-mk-afp、表达酪氨酸激酶的表达载体与感受态大肠杆菌bl21(de3)混合均匀后在冰上孵育30min,42℃热激45s后迅速在冰上静置3min;加入450μllb培养基,并震荡复苏2h,复苏后取100μl菌液均匀涂布在含有卡那霉素和氯霉素的双抗性lb固体培养基平板上进行抗性筛选;无菌操作挑取同一单菌落过夜培养后按照质粒小提试剂盒进行大肠杆菌的质粒提取,提取的质粒用bamhⅰ限制性内切酶和notⅰ限制性内切酶酶切并进行琼脂糖电泳,质粒被酶切出两个条带,分别在700bp和5.5kb左右(如图3所示)。分别与理论结果的融合蛋白基因和pet-28a载体大小相符。同时提取的质粒送往金唯智公司进行测序;将测序结果与如seqidno.4所示的基因序列进行比对,相似性大于99%,认为该基因片段即为融合蛋白mp-afp基因。菌落pcr、质粒双酶切和测序均成功的菌落为目标转化子。转化成功的大肠杆菌菌株用甘油保存于-80℃。
实施例2:融合蛋白mp-afp的表达纯化
①大肠杆菌发酵表达融合蛋白mp-afp
将转化成功的大肠杆菌在含有卡那霉素和氯霉素的双抗性lb固体培养基平板上划线活化。挑取单菌落于5ml含有50μg/ml的卡那霉素和氯霉素的lb液体培养基的试管中,于37℃、200rpm震荡培养过夜。按1:100比例转接大肠杆菌种子液于含有200ml培养基的500ml摇瓶中;用紫外分光光度计测量大肠杆菌的生长曲线,在大肠杆菌转接后当菌液浓度为od600=0.8时,用0.8mm的iptg诱导大肠杆菌表达融合蛋白mp-afp,在37℃,250rpm条件下继续培养12h后收集大肠杆菌菌体。
②融合蛋白mp-afp的分离纯化
大肠杆菌发酵液在4℃,6000rpm条件下离心10min弃去培养基。用pbs溶液重悬大肠杆菌菌体,菌液在冰水浴下超声破碎40min,输出功率200w,破碎2s,停歇3s;破碎得到的澄清菌液4℃离心分别得到上清和包涵体,将大肠杆菌菌体、破碎后上清、破碎后包涵体加入上样缓冲液(loadingbuffer)并煮沸后进行聚丙烯酰胺凝胶(sds-page)电泳,融合蛋白mp-afp,因此后续实验采取用亲和层析方法分离上清中的融合蛋白mp-afp,从包涵体中用乙酸分离纯化融合蛋白mp-afp。
a.融合蛋白mk-afp上清的分离纯化:
大肠杆菌发酵结束后在4℃,6000rpm条件下离心10min离心收集菌体。用bindingbuffer(20mm磷酸钠、0.5m氯化钠、40mm咪唑,ph7.4)将大肠杆菌菌体重悬,菌液在冰水浴下超声破碎40min,输出功率200w,破碎2s,停歇3s。破碎得到的澄清菌液在4℃下离心得到上清。离心后收集的含有融合蛋白mp-afp的上清用0.22μm膜过滤除去固体颗粒。选用ge公司的5mlhistrap柱对融合蛋白mp-afp上清进行亲和层析分离。将histrap柱与akatprimeplus连接好。histrap柱依次用10倍柱体积的高纯水和bindingbuffer洗涤至基线走平。将过膜的融合蛋白mp-afp上清按1ml/min流速上柱,使融合蛋白mp-afp结合在柱上。上样结束后用的washbuffer(20mm磷酸钠、0.5m氯化钠、320mm咪唑,ph7.4)以2ml/min流速洗涤柱中的杂蛋白至基线走平。洗涤结束后用elutionbuffer(20mm磷酸钠、0.5m氯化钠、500mm咪唑,ph7.4)洗脱柱上结合的融合蛋白mp-afp并收集吸收峰出现时的洗脱液。histrap柱依次用8倍柱体积的bindingbuffer和高纯水洗涤,最后将histrap柱保存在20%乙醇中。洗脱液用超滤管超滤同时用高纯水换液。得到的溶液用冷冻干燥机冻干。
b.融合蛋白mp-afp沉淀的分离纯化:
得到的包涵体用含有2m尿素、0.6%triton-x-100、50mmpbs、4mmedta的包涵体洗涤液洗涤包涵体2次,每次30min以除去包涵体以外的杂蛋白。60%乙酸重悬包涵体,在25℃、250rpm条件下震荡处理3h,使大部分包涵体蛋白溶于酸溶液中。处理后的乙酸上清在4℃下过夜透析18h。透析结束后,透析袋中的溶液在4℃离心后用超滤管超滤浓缩,并用冻干机冷冻干燥,得到融合蛋白mp-afp。
纯化得到的融合蛋白mp-afp溶于pbs缓冲液中,加入上样缓冲液(loadingbuffer)煮沸后进行聚丙烯酰胺凝胶电泳并进行纯度分析,纯化后的融合蛋白纯度大于80%,纯化后融合蛋白分子量约为36kd。
实施例3:表面修饰及原子力显微镜分析
①样品对基质材料的表面修饰
以玻璃片和云母片为基质材料,以水及融合蛋白mp-afp作为样品修饰基质材料表面。将清洗干净的基质材料浸润在两种样品中,在25℃下80%湿度孵育12h,每组至少3个重复。孵育结束后用高纯水将基质材料洗涤3次以去除多余的蛋白样品。
②原子力显微镜检测
用原子力显微镜采用轻敲模式检测基质材料的表面形貌,融合蛋白修饰的玻璃片表面呈紧凑致密的蛋白修饰层,而且规整有序。
实施例4:融合蛋白黏附性测试
贻贝足丝蛋白的黏附机理一直是热门研究领域,目前认为其强粘合力与其氨基酸残基密切相关,其中最关键的是酪氨酸经羟基化修饰的dopa残基,dopa能与蛋白质等极性聚合物间形成很强的氢键,并且dopa的苯酚基团具有很强的金属络合力,可以在材料表面形成不可逆的有机金属络合物。研究表明,除去黏附界面dopa残基之后,其粘着力显著下降。所以,dopa的存在很大程度上决定了黏附性。dopa残基是否存在可以nbt来检测,含有dopa的贻贝足丝蛋白遇nbt明显变蓝。我们将本研究的二嵌段融合蛋白与未羟基化的贻贝足丝蛋白进行对比,分别加入nbt,结果表明,本二嵌段融合蛋白含有dopa,具有黏附性。如图4所示,左侧为未羟基化贻贝足丝蛋白,右侧为本二嵌段融合蛋白,可以明显看出,右侧颜色深。
实施例5:融合蛋白抗冻性测试
将重组菌株在lb培养基中,37℃,220r/min培养,培养到od600=0.6,将菌液离心(5000r/rain,4min)。分为三组,分别加入二嵌段融合蛋白mp-afp、bsa和lb重悬沉淀。置于-20℃,分别在0、24、48、72、96、120和144h,取100ul菌液,涂布lb平板,每个处理做5个重复,37℃过夜培养,计算菌落数。以0h菌落数为100%计算抗冻效率。结果如图5所示。可以明显看出,使用此二嵌段融合蛋白(mp-afp)保存细菌的成活率,远远高于使用bsa和lb保存细菌的成活率,表明此融合蛋白具有良好的抗冻性。
实施例6:mtt细胞毒性检测
①动物细胞培养
以nih/3t3成纤维细胞作为实验动物细胞进行mtt细胞毒性检测。用含有1%青霉素和链霉素及10%小牛血清的dmem培养基在37℃、5%co2条件下培养nih/3t3成纤维细胞。
②基质材料的无菌处理
将修饰后的云母片用无菌pbs溶液洗涤3次做无菌处理。
③mtt实验
在48孔板中每孔植入3.5*10^4个细胞,培养12h。经无菌处理的云母片对应加入孔中,nih/3t3细胞继续培养24h。培养结束后每孔加入300μl10%的mtt溶液,继续培养4h。培养结束后,吸去孔板中的上清,每孔加入330μl的dmso溶解液,并在摇床上震荡摇动10min。将上述液体转移至96孔板中,并在490nm下检测吸光度。以未处理的云母片孵育的细胞孔作为空白对照,并设定为100%,发现融合蛋白修饰的云母片对细胞没有任何毒性影响,存活率均高于100%。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明。尽管前述实施方案对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例的技术方案进行修改,或者对其中部分技术特征进行等同替换,来实现融合蛋白最终的制备。特别需要指出的是,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围内。
核苷酸序列表:
seqidno.1:
akpsypptykakpsypptykakpsypptykakpsypptykakpsypptykakpsypptyksseeykggyypgntyhyhsggsyhgsgyhggykgkyygkakkyyykyknsgkykylkkarkyhrkgykkyygggssggggsakpsypptykakpsypptykakpsypptykakpsypptykakpsypptykakpsypptyk
seqidno.2:
mgfktcgfskkwlvtavivmclctecycqctggadctsctaactgcgncpnavtctnsqhcvkattctgstdcntavtctnskdcfeaqtctdstncykatactnstgcpgh*
seqidno.3:
ggatccmakpsypptykakpsypptykakpsypptykakpsypptykakpsypptykakpsypptyksseeykggyypgntyhyhsggsyhgsgyhggykgkyygkakkyyykyknsgkykylkkarkyhrkgykkyygggssakpsypptykakpsypptykakpsypptykakpsypptykakpsypptykakpsypptykggggsggggsggggsmgfktcgfskkwlvtavivmclctecycqctggadctsctaactgcgncpnavtctnsqhcvkattctgstdcntavtctnskdcfeaqtctdstncykatactnstgcpgh*gcggccgc
seqidno.4:
序列表
<110>天津大学
<120>一种具有粘附-抗冻双功能的二嵌段融合蛋白及的合成方法和应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>201
<212>prt
<213>人工序列(artificialsequence)
<400>1
alalysprosertyrproprothrtyrlysalalysprosertyrpro
151015
prothrtyrlysalalysprosertyrproprothrtyrlysalalys
202530
prosertyrproprothrtyrlysalalysprosertyrproprothr
354045
tyrlysalalysprosertyrproprothrtyrlyssersergluglu
505560
tyrlysglyglytyrtyrproglyasnthrtyrhistyrhissergly
65707580
glysertyrhisglyserglytyrhisglyglytyrlysglylystyr
859095
tyrglylysalalyslystyrtyrtyrlystyrlysasnserglylys
100105110
tyrlystyrleulyslysalaarglystyrhisarglysglytyrlys
115120125
lystyrtyrglyglyglyserserglyglyglyglyseralalyspro
130135140
sertyrproprothrtyrlysalalysprosertyrproprothrtyr
145150155160
lysalalysprosertyrproprothrtyrlysalalysprosertyr
165170175
proprothrtyrlysalalysprosertyrproprothrtyrlysala
180185190
lysprosertyrproprothrtyrlys
195200
<210>2
<211>112
<212>prt
<213>人工序列(artificialsequence)
<400>2
metglyphelysthrcysglypheserlyslystrpleuvalthrala
151015
valilevalmetcysleucysthrglucystyrcysglncysthrgly
202530
glyalaaspcysthrsercysthralaalacysthrglycysglyasn
354045
cysproasnalavalthrcysthrasnserglnhiscysvallysala
505560
thrthrcysthrglyserthraspcysasnthralavalthrcysthr
65707580
asnserlysaspcyspheglualaglnthrcysthraspserthrasn
859095
cystyrlysalathralacysthrasnserthrglycysproglyhis
100105110
<210>4
<211>338
<212>prt
<213>人工序列(artificialsequence)
<400>4
glyglyalathrcyscysmetalalysprosertyrproprothrtyr
151015
lysalalysprosertyrproprothrtyrlysalalysprosertyr
202530
proprothrtyrlysalalysprosertyrproprothrtyrlysala
354045
lysprosertyrproprothrtyrlysalalysprosertyrpropro
505560
thrtyrlyssersergluglutyrlysglyglytyrtyrproglyasn
65707580
thrtyrhistyrhisserglyglysertyrhisglyserglytyrhis
859095
glyglytyrlysglylystyrtyrglylysalalyslystyrtyrtyr
100105110
lystyrlysasnserglylystyrlystyrleulyslysalaarglys
115120125
tyrhisarglysglytyrlyslystyrtyrglyglyglyserserala
130135140
lysprosertyrproprothrtyrlysalalysprosertyrpropro
145150155160
thrtyrlysalalysprosertyrproprothrtyrlysalalyspro
165170175
sertyrproprothrtyrlysalalysprosertyrproprothrtyr
180185190
lysalalysprosertyrproprothrtyrlysglyglyglyglyser
195200205
glyglyglyglyserglyglyglyglysermetglyphelysthrcys
210215220
glypheserlyslystrpleuvalthralavalilevalmetcysleu
225230235240
cysthrglucystyrcysglncysthrglyglyalaaspcysthrser
245250255
cysthralaalacysthrglycysglyasncysproasnalavalthr
260265270
cysthrasnserglnhiscysvallysalathrthrcysthrglyser
275280285
thraspcysasnthralavalthrcysthrasnserlysaspcysphe
290295300
glualaglnthrcysthraspserthrasncystyrlysalathrala
305310315320
cysthrasnserthrglycysproglyhisglycysglyglycyscys
325330335
glycys
<210>4
<211>972
<212>dna
<213>人工序列(artificialsequence)
<400>4
gctaaaccgtcttacccgccgacctacaaagctaaaccgtcttacccgccgacctacaaa60
gctaaaccgtcttacccgccgacctacaaagctaaaccgtcttacccgccgacctacaaa120
gctaaaccgtcttacccgccgacctacaaagctaaaccgtcttacccgccgacctacaaa180
tcttctgaagaatacaaaggtggttactacccgggtaacacctaccactaccactctggt240
ggttcttaccacggttctggttaccacggtggttacaaaggtaaatactacggtaaagct300
aaaaaatactactacaaatacaaaaactctggtaaatacaaatacctgaaaaaagctcgt360
aaataccaccgtaaaggttacaaaaaatactacggtggtggttcttctgctaaaccgtct420
tacccgccgacctacaaagctaaaccgtcttacccgccgacctacaaagctaaaccgtct480
tacccgccgacctacaaagctaaaccgtcttacccgccgacctacaaagctaaaccgtct540
tacccgccgacctacaaagctaaaccgtcttacccgccgacctacaaaggtggtggtggt600
tctggtggtggtggttctggtggtggtggttctatgggattcaaaacgtgtggtttttca660
aaaaaatggttagtaacagcagttatagttatgtgtttgtgtaccgagtgttattgccaa720
tgcactggaggtgctgattgtactagttgtacagcagcatgcactggttgtggaaactgt780
ccaaatgcagtaacgtgtaccaattctcaacattgtgtcaaggcaacaacatgtactggg840
tctacagattgtaatacagccgtgacgtgtacaaactcaaaagactgtttcgaagcccaa900
acatgtactgactcaaccaactgttacaaagctacagcctgtaccaattcaacaggatgt960
cccggacattaa972
- 还没有人留言评论。精彩留言会获得点赞!