一种黑鲷抗菌肽AS-hepc3(48-56)及其应用的制作方法
本发明属于海洋分子生物学技术领域,具体涉及一种黑鲷抗菌肽as-hepc3(48-56)及其应用。
背景技术:
1928年英国科学家fleming发现了第一种抗生素——青霉素。从此,抗生素不断被发现、改进并用于现代医疗。随着抗生素的广泛应用,抗生素耐药性也不断被发现,世界卫生组织2014年报告中提出,抗生素耐药性细菌已在全球范围蔓延,我们已经迈入了后抗生素时代。目前,全球范围均有抗生素耐药性的报道,成为全球亟待解决的重要问题之一。who指出每年至少有70万人死于耐药性疾病,如不采取有效措施这一数目在2050年将达到1000万。
在临床分离耐药细菌中,不仅有单一耐药菌株,还发现多重耐药性、极高耐药性和完全耐药性细菌,给临床治疗带来巨大挑战。2017年who提出需要优先研发新药治疗耐碳青霉烯类铜绿假单胞菌、耐碳青霉烯类鲍曼不动杆菌、耐碳青霉烯类和耐三代头孢霉素的肠杆菌科细菌、耐万古霉素肠球菌、耐甲氧西林和万古霉素金黄色葡萄球菌等十二类耐药性细菌。目前认为抗生素因其作用位点单一,细菌可通过固有耐药、适应性耐药和获得性耐药等方式产生耐药性,而抗菌肽作用位点多样,不易产生耐药性,被认为是替代抗生素的选择之一。
抗菌肽(antimicrobialpeptide,amp)又称为宿主防御肽,是一种多为正电荷的两亲性具有抗菌功能的短肽,广泛存在于动物、植物、微生物等生物体中,为先天免疫系统的重要组成部分,具有抗菌活性强,抗菌谱广,不易产生耐药性等特点。抗菌短肽具有结构简单,化学合成方便快捷等特点在生产应用中具有很好的应用前景,目前已有多种多肽类药物用于临床治疗,为降低药物耐药性的发生提供新的思路和策略。
技术实现要素:
本发明的目的在于克服现有技术的不足之处,提供了一种黑鲷抗菌肽as-hepc3(48-56)及其应用,解决了上述背景技术中的问题。
本发明解决其技术问题所采用的技术方案之一是:提供了一种黑鲷抗菌肽as-hepc3(48-56),其分子式为c48h86n24o10s3,其氨基酸序列为seqidno:01:
arg-arg-arg–arg–cys-arg-phe–cys-cys(seqidno:01)。
所述黑鲷抗菌肽的分子量为1255.567道尔顿,包括5个带正电的氨基酸残基和3个半胱氨酸残基。
本发明解决其技术问题所采用的技术方案之二是:提供了一种黑鲷抗菌肽as-hepc3(48-56)在制备抗菌药物中的应用。
本发明解决其技术问题所采用的技术方案之三是:提供了一种抗菌药物,其有效成分包括黑鲷抗菌肽as-hepc3(48-56),所述黑鲷抗菌肽as-hepc3(48-56)的氨基酸序列为seqidno:01。
在本发明一较佳实施例中,所述抗菌药物的有效成分为黑鲷抗菌肽as-hepc3(48-56),所述黑鲷抗菌肽as-hepc3(48-56)的氨基酸序列为seqidno:01。
在本发明一较佳实施例中,所述抗菌药物用于抑制和/或杀灭铜绿假单胞菌、鲍曼不动杆菌、金黄色葡萄球菌、肺炎克雷伯氏菌、大肠埃希氏菌。
本技术方案与背景技术相比,它具有如下优点:
1.本发明的黑鲷抗菌肽as-hepc3(48-56)由9个氨基酸组成,分子式为c48h86n24o10s3,分子量为1255.567道尔顿,其中含有5个带正电的氨基酸残基和3个半胱氨酸残基,根据氨基酸残基电荷预测该抗菌肽等电点为11.40,亲水性平均系数为﹣1.356,具有很好的水溶性,是一种带有正电荷的阳离子多肽,具有长度短、易合成、抗菌谱广、抗菌活性高且稳定等特点,在药物研究方面具有很好应用前景。
2.本发明的黑鲷抗菌多肽as-hepc3(48-56)对铜绿假单胞菌及其临床分离的多重耐药菌均具有良好抗菌效果且不易产生耐药性;此外,as-hepc3(48-56)对正常小鼠肝细胞aml12和人肾上皮细胞293t无细胞毒性。
附图说明
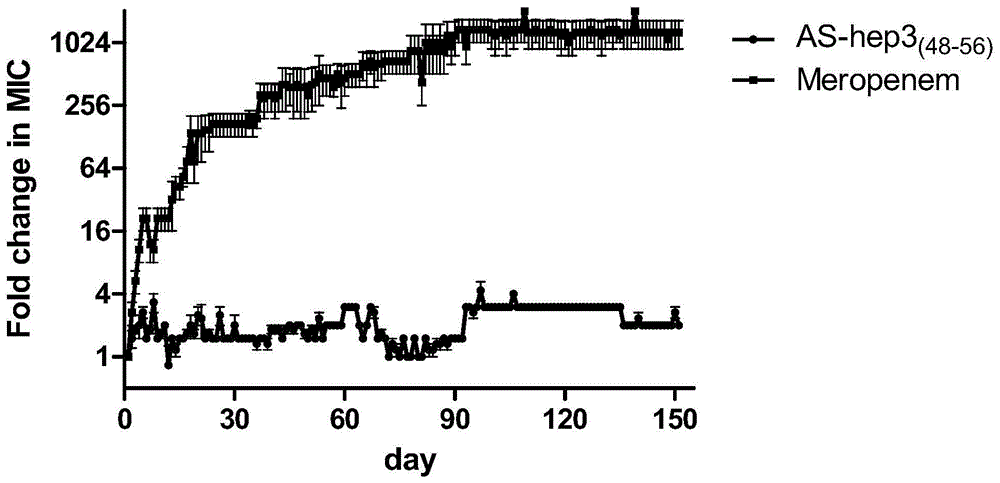
图1为黑鲷抗菌多肽as-hepc3(48-56)与抗生素美罗培南对铜绿假单胞菌pao1抗菌耐药性产生比较;其中,横坐标为时间(day),纵坐标为mic浓度变化与初始抗菌浓度比值。
图2为mts-pms法检测黑鲷抗菌多肽as-hepc3(48-56)细胞毒性实验图;其中,a为aml12细胞,b为293t细胞,横坐标为as-hepc3(48-56)蛋白浓度(μm),纵坐标为细胞增殖率(%)。
具体实施方式
实施例1
本实施例的一种黑鲷抗菌多肽as-hepc3(48-56)的氨基酸序列为:
arg-arg-arg–arg–cys-arg-phe–cys-cys(seqidno:01)
本实施例委托吉尔生化(上海)有限公司以固相合成方法合成获得纯度达95%以上的黑鲷抗菌多肽as-hepc3(48-56),并提供多肽分子量、hplc等检测信息,相关理化参数如表1所示。
表1抗菌多肽as-hepc3(48-56)理化参数
由表1可知本实施例的黑鲷抗菌多肽as-hepc3(48-56)分子量小、稳定性较好,具有很强的水溶性,是一种带有正电荷的阳离子多肽。
一、最小抑菌浓度(mic:minimuminhibitionconcentration)和最小杀菌浓度(mbc:minimumbactericidalconcentration)的测定
1、涉及到的菌株有:铜绿假单胞菌(pseudomonasaeruginosa)pao1,临床分离耐药铜绿假单胞菌qz19121、qz19122、qz19123、qz19124、qz19125,临床分离耐药鲍曼不动杆菌(acinetobacterbaumannii)qz18050,qz18055,临床分离耐药金黄色葡萄球菌(staphylococcusaureus)qz18090、qz18091,临床分离耐药肺炎克雷伯氏菌(klebsiellapneumoniae)qz18106、qz18107,临床分离耐药大肠埃希氏菌(escherichiacoli)qz18109、qz18110。pao1购自中国科学院微生物研究所菌种保藏中心,临床分离菌株来源于福建医科大学附属第二医院检验科。
2、具体方法如下:
(1)将保种菌株划线于mh平板,于37℃条件下倒置培养过夜;
(2)挑取单克隆于mh液体培养基中,37℃,200rpm培养至对数期;
(3)5000g,2min收集细菌,用10mm磷酸钠缓冲液(ph=7.4)将细菌重悬,最后用mh液体培养基稀释细菌,使得菌体的最终浓度为5×105cfu/ml;
(4)将已合成的as-hepc3(48-56)粉末溶于无菌milli-q水,倍比稀释蛋白浓度至2μm、4μm、8μm、16μm、32μm;
(5)在96孔聚丙烯无菌培养板上,每种待测菌设置空白对照组、阴性对照组和待测实验组,每组设置三个平行:
a空白对照组:50μl待测蛋白样品和50μl培养基
b阴性对照组:50μl无菌milli-q水和50μl菌悬液
c待测实验组:50μl待测蛋白样品和50μl菌悬液
将96孔培养板置于37℃培养箱中,培养18-24h,观察待测实验组中mic结果;将待测实验组吹打混匀后,吸取适量的菌液涂布于mh平板上,于37℃倒置培养过夜,观察mbc结果。
3、黑鲷抗菌肽as-hepc3(48-56)mic、mbc观察结果如表2所示。
表2黑鲷抗菌肽as-hepc3(48-56)的抗菌活性
注:mic:最小抑菌浓度(μm),用a-b表示;a:肉眼可见菌体生长的最高蛋白浓度;b:肉眼未见菌体生长的最低蛋白浓度;
mbc:最小杀菌浓度(μm),杀死99.9%细菌浓度。
二、耐药性产生对比实验
1、黑鲷抗菌多肽as-hepc3(48-56)与抗生素美罗培南抗铜绿假单胞菌pao1耐药性产生比较,其中铜绿假单胞菌(pseudomonasaeruginosa)pao1,购自中国科学院微生物研究所菌种保藏中心。
2、具体方法如下:
(1)将保种铜绿假单胞菌划线于mh平板,于37℃条件下倒置培养过夜;
(2)挑取单克隆于mh液体培养基中,37℃,200rpm培养至对数期;
(3)5000g,2min收集细菌,用10mm磷酸钠缓冲液(ph=7.4)将细菌重悬,最后用10mm磷酸钠缓冲液与mh液体培养基混合液稀释细菌,使得菌体的最终浓度为5×105cfu/ml;
(4)将已合成的as-hepc3(48-56)粉末溶于无菌milli-q水,倍比稀释蛋白浓度至8μm、12μm、16μm、24μm、32μm、48μm;
(5)将抗生素美罗培南粉末溶于无菌milli-q水,配置5mg/ml储液,用0.22μm滤膜过滤,倍比稀释至不同工作浓度,0.25μg/ml、0.5μg/ml、1μg/ml、2μg/ml、4μg/ml、8μg/ml、16μg/ml;
(6)在96孔细胞培养板上,每种待测菌设置空白对照组、阴性对照组和待测实验组,每组设置三个平行:
a空白对照组:50μl待测蛋白样品和50μl培养基
b阴性对照组:50μl无菌milli-q水和50μl菌悬液
c待测实验组:50μl待测蛋白样品和50μl菌悬液
将96孔细胞培养板置于37℃培养箱中,培养18-24h,观察待测实验组中mic结果;取细菌可生长最高浓度抗菌物质组细菌稀释1000倍取50μl用于下一代抗菌实验,如此往复150代。
3、结果如图1。
在使用抗生素美罗培南作用铜绿假单胞菌时,3天后其抗铜绿假单胞菌mic值升高至初始mic值的4倍,连续使用10天后,其抗铜绿假单胞菌mic值升高至初始mic值16倍并不断升高,在作用90天后则可达到1024倍,表明铜绿假单胞菌对抗生素美罗培南产生较强的耐药性;而使用抗菌肽as-hepc3(48-56)对铜绿假单胞菌连续作用150天后,其抗铜绿假单胞菌mic值仅为初始mic值的2倍,无明显变化,说明铜绿假单胞菌对抗菌肽as-hepc3(48-56)并没有产生明显耐药性。
三、细胞毒性测定
1、选取小鼠肝细胞(aml12)和人肾上皮细胞(293t),对黑鲷抗菌肽as-hepc3(48-56)细胞毒性进行测定。
2、具体方法如下:
(6)收集生长状态良好的小鼠肝细胞(aml12)和人肾上皮细胞(293t),调整细胞浓度为103-104个/ml,将细胞均匀吹散,在96孔细胞培养板中每孔加入100μl细胞悬液,置于37℃,0.5%co2条件下静置培养,50%以上细胞贴壁。
(7)小心吸出培养基,加入含有不同浓度(0μm、40μm、80μm)as-hepc3(48-56)的相应培养基,置于37℃,0.5%co2条件下静置培养24h。
(8)加入20μlmts-pms溶液后避光孵育3h后,使用酶标仪测得od492值,评价as-hepc3(48-56)的细胞毒性。
3、结果如图2。
在5倍和10倍mic浓度(40μm和80μm)条件下,抗菌肽as-hepc3(48-56)与aml12细胞(图2-a)和293t细胞(图2-b)共孵24h后,与对照组相比实验组细胞存活率均在95%以上,说明抗菌肽as-hepc3(48-56)无细胞毒性。
以上所述,仅为本发明较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
序列表
<110>厦门大学
<120>一种黑鲷抗菌肽as-hepc3<sup>(48-56)</sup>及其应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>9
<212>prt
<213>人工序列(artificialsequence)
<400>1
argargargargcysargphecyscys
15
- 还没有人留言评论。精彩留言会获得点赞!