脐带华通氏胶间充质干细胞成骨定向分化的方法与流程
本发明涉及干细胞与再生医学领域,特别是涉及一种脐带间充质干细胞成骨定向分化的方法。
背景技术:
近年来,研究人员发现,干细胞在移植后具有抑制损伤组织区域免疫反应、改善周围环境、修复损伤等作用,呈现出很好的疗效。间充质干细胞是干细胞家族成员之一,具有干细胞自我复制和多向分化能力。
目前,研究较多的干细胞主要是胎盘干细胞、脐带间充质干细胞、骨髓间充质干细胞等。其中,胎盘干细胞、骨髓间充质干细胞等的获取存在一定伦理限制。脐带间充质干细胞主要来源于母体妊娠后的脐带,分娩之后脐带一般被丢弃,若能有效利用脐带,可以将其变废为宝,而且其来源广泛安全,不存在任何伦理问题,在临床上存在很高的应用价值。
已有研究指出,脐带间充质干细胞在体外可被诱导分化为具有神经功能的细胞,可以表达神经元特异性标记物和神经胶质细胞标记物,表明脐带间充质干细胞在疾病治疗过程中具有较大的潜力。
现有的脐带间充质干细胞分化为成骨细胞的方法效率较低,本发明通过特定的分化方法将脐带间充质干细胞分化为成骨细胞,以期能够得到应用于临床的成骨细胞,为骨相关的临床疾病治疗做出贡献。
技术实现要素:
基于此,有必要针对上述问题,提供一种脐带间充质干细胞成骨定向分化的方法,能显著提高脐带间充质干细胞成骨细胞诱导分化效率。
一种脐带华通氏胶间充质干细胞成骨定向分化的方法,包括以下步骤:
组织消化:向脐带华通氏胶组织碎块中加入组织消化液进行消化,消化后离心,获得脐带间充质干细胞悬液;所述组织消化液中包括胶原酶i、dna酶和tryple;
初代培养:向脐带间充质干细胞悬液中加入含有双抗的完全培养基,混匀后分装,标记为p0代,培养;
传代培养:初代培养后,去除培养液,清洗细胞,加入包括胰蛋白酶和edta的消化液进行消化,加入完全培养液终止消化,进行传代培养;
诱导培养:取传代细胞,消化,终止消化,离心,去掉上清液,保留沉淀,向沉淀中加入完全培养基重悬,接种细胞悬液,培养至预定时间,更换为成骨细胞分化诱导培养基;所述成骨细胞分化诱导培养基包括α-mem基底液、血清替代物、地塞米松、β-磷酸甘油、抗生素、细胞因子il-β、抗坏血酸和异黄酮。
上述方法,使用了本发明的组织消化液和成骨细胞诱导分化培养基,组织消化液可以分离得到更多的数量的脐带间充质干细胞,成骨细胞诱导分化培养基可以将脐带间充质干细胞定向分化为成骨细胞,两者结合使得骨细胞诱导分化效率得到显著的提高;采用本发明得到的细胞用于临床治疗不会产生副作用。
在其中一个实施例中,所述消化步骤具体为:将脐带华通氏胶组织剪至1mm3以下的碎块,加入组织消化液消化28~32min,消化后在温度4±1℃、转速900~1100rpm下离心4~6min,去除上清液,保留沉淀,重悬,获得脐带间充质干细胞悬液。
在其中一个实施例中,所述组织消化液以tryple为基底液,胶原酶i的浓度为0.1~0.3g/ml,dna酶的浓度为0.02~0.03mg/ml。
在其中一个实施例中,所述脐带华通氏胶组织在剪碎前需进行预处理,所述预处理步骤具体为:将获取的脐带剪成2~3cm,用酒精浸泡1~3min,用组织保护液进行清洗,剥离脐带的静脉和动脉,分离出脐带华通氏胶组织。
在其中一个实施例中,所述组织保护液由生理盐水、硫酸庆大霉素、两性霉素b和红细胞裂解液配制而成,其中硫酸庆大霉素的浓度为23~27μg/ml,两性霉素b的浓度为3~7μg/ml,红细胞裂解液的体积百分数为3%~7%。
在其中一个实施例中,将所述脐带华通氏胶组织进行储存时,先在脐带华通氏胶组织中加入冻存液,然后通过程序降温仪降温至-80~-90℃,放置液氮中长期存储;所述冻存液包括dmem、甘油、细胞因子和/或趋化因子,其中,甘油的体积百分数为33%~37%,细胞因子的体积百分数为8%~12%。
在其中一个实施例中,所述初代培养步骤中,培养p0代细胞时,温度为37±0.5℃,饱和湿度,co2浓度为5±1%,培养时间为14~16天,培养期间每隔4~5天更换一次培养基。
在其中一个实施例中,所述传代培养步骤中,所述消化液中胰蛋白酶的质量百分数为0.04%~0.06%,edta的质量百分数为0.003%~0.005%;传代培养过程中,当细胞融合度达到60%~70%时传代一次,传至p3代。
在其中一个实施例中,所述诱导培养步骤中,细胞悬液的浓度为1~3×104个/ml,每隔2~4天更换一次成骨细胞分化诱导培养基。
在其中一个实施例中,述骨细胞分化诱导培养基中,血清替代物的质量百分数为8%~12%,地塞米松的浓度为8~12nm,β-磷酸甘油的浓度8~12m/ml,抗生素的质量百分数为0.8%~1.2%,细胞因子il-β的浓度为20~30ng/ml,抗坏血酸的浓度为105mm/ml,异黄酮的浓度为8~12μg/ml。其中,血清替代物为knockouttmsr或ultrosertmg/ksr。
与现有技术相比,本发明具有以下有益效果:
本发明的方法,使用了本发明的组织消化液和成骨细胞诱导分化培养基,组织消化液可以分离得到更多的数量的脐带间充质干细胞,成骨细胞诱导分化培养基可以将脐带间充质干细胞定向分化为成骨细胞,两者结合使得骨细胞诱导分化效率得到显著的提高;采用本发明得到的细胞用于临床治疗不会产生副作用。
附图说明
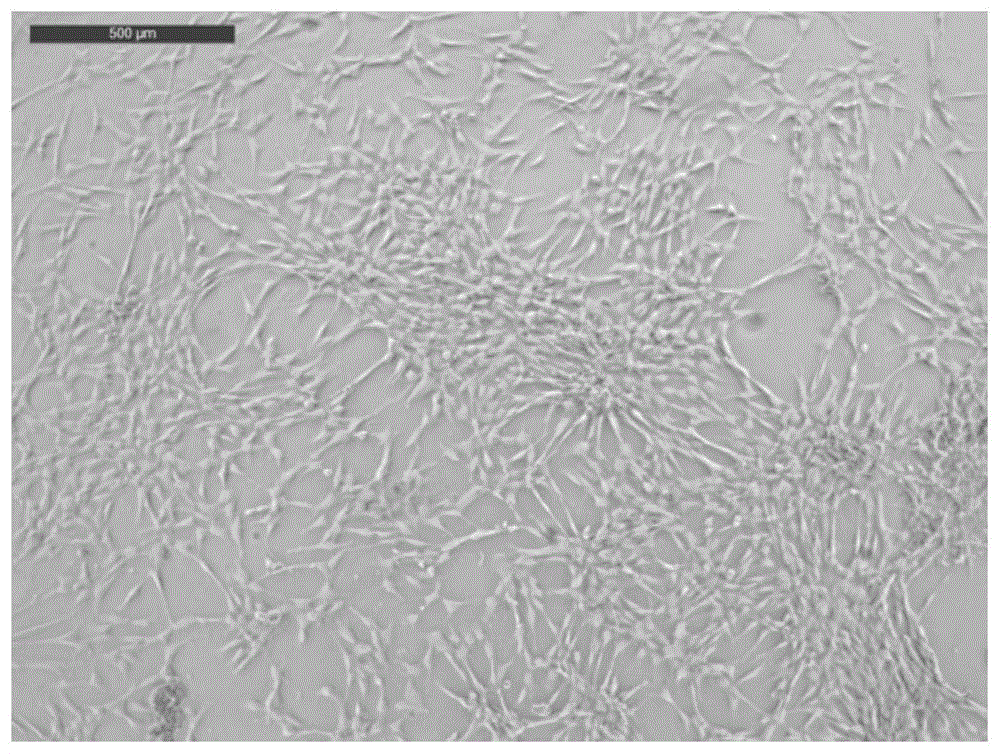
图1为实施例p0代脐带华通氏胶间充质干细胞图;
图2为实施例p3代脐带华通氏胶间充质干细胞图;
图3为实施例p3代脐带华通氏胶间充质干细胞流式检测结果;
图4为实施例钙结节的形成情况;
图5为对比例1钙结节的形成情况;
图6为对比例2钙结节的形成情况。
具体实施方式
为了便于理解本发明,下面将对本发明进行更全面的描述。以下给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
实施例1
一种脐带华通氏胶间充质干细胞成骨定向分化的方法,包括以下步骤:
1)预处理:将脐带两端剪掉,取中间15~18cm的脐带剪成2~3cm的小段,用75%的酒精浸泡2min,然后用组织保护液进行清洗,清洗掉脐带里面的血液,剥离去除动脉和静脉,分离出透明胶状物,即为脐带华通氏胶组织,将脐带华通氏胶组织放于水平离心机中,800rpm转速下离心1min;
其中,组织保护液由生理盐水、硫酸庆大霉素、两性霉素b和红细胞裂解液配制而成,硫酸庆大霉素的浓度为25μg/ml,两性霉素b的浓度5μg/ml,红细胞裂解液的体积百分数为5%;组织保护液可以确保脐带组织在运输过程中无细菌和真菌污染,红细胞裂解液可以减少红细胞对脐带间充质干细胞纯度的影响;
2)储存:取2ml的冻存管,加入1ml细胞冻存液和0.5g华通氏胶组织,通过程序降温仪降温至-80~-90℃,再将冻存管放置于-196℃的液氮中,可长期存储;
其中,冻存液由甘油、细胞因子、dmem配制而成,dmem为基底液,甘油的体积百分数为35%,细胞因子和/或趋化因子的体积百分数为10%;
3)组织消化:取2g脐带华通氏胶组织放入50ml无菌离心管中,用灭菌直剪剪成1mm3以下的碎块,加入等体积的组织消化液,消化30min,在4℃下离心5min,离心转速为1000rpm,去除上清液,保留沉淀,向沉淀中加入培养基重悬,得到脐带间充质干细胞悬液;
其中,组织消化液由胶原酶i、dna酶和tryple配制而成,tryple为基底液,胶原酶i的浓度为0.2g/ml,dna酶的浓度为0.025mg/ml;
4)初代培养:向脐带间充质干细胞悬液中加入20ml含有双抗的完全培养基,混匀后分装至t75培养基中,标记为p0代(细胞状态如图1所示),放入培养箱中进行培养,每4.5天更换一次培养基,培养基为含双抗的完全培养液,培养箱温度为37℃,饱和湿度,co2浓度为5%;
5)传代培养:初步培养15天,弃掉培养液,用pbs清洗细胞两次,加入2~3ml包括胰蛋白酶和edta的消化液消化1min,加入完全培养液终止消化,分装至t75培养瓶中培养,当细胞融合度达到60%~70%时传代一次(约3天一次),传至p3代(细胞状态如图2所示),通过流式检测p3代脐带华通氏胶间充质干细胞表面的标记物,结果如图3所示;
6)诱导培养:取p3代细胞,加入消化液消化1min,加入终止消化液终止消化,4℃离心5min,离心转速为1200rpm,去掉上清液,保留沉淀,向沉淀中加入完全培养基重悬,按照2×104个/ml的浓度接种在24孔板中,每孔1ml,每隔3天更换一次培养基,更换使用的培养基为成骨细胞分化诱导培养基,培养14天;
其中,成骨细胞诱导培养基由α-mem基底液、血清替代物(knockouttmsr)、地塞米松、β-磷酸甘油、抗生素、细胞因子il-β、抗坏血酸和异黄酮配制而成,血清替代物的质量百分数为10%,地塞米松的浓度为10nm,β-磷酸甘油的浓度为10m/ml,抗生素的质量百分数为1%,细胞因子il-β的浓度为25ng/ml,抗坏血酸的浓度为105mm/ml,异黄酮的浓度为10ug/ml。
对比例1
一种脐带华通氏胶间充质干细胞成骨定向分化的方法,与实施例1的区别在于,步骤3)为取2g脐带华通氏胶组织放入50ml无菌离心管中,用灭菌直剪剪成1mm3以下的碎块,加入培养基,在4℃下离心5min,离心转速为1000rpm,去除上清液,保留沉淀,向沉淀中加入培养基重悬,得到脐带间充质干细胞悬液。
对比例2
一种脐带华通氏胶间充质干细胞成骨定向分化的方法,与实施例1的区别在于,步骤6)中,成骨细胞诱导培养基由fbs、β甘油磷酸钠、维生素c、地塞米松和dmem配制而成,其中fbs的质量百分数为10%,β甘油磷酸钠的浓度为10mmol/l,维生素c的浓度为0.05mmol/l,地塞米松的浓度为100mmol/l。
实验例1
分别取实施例1和对比例1~2诱导培养得到的细胞,弃掉培养基,用pbs清洗两次,加入4%的多聚甲醛固定20min,加入茜素红染色20min,用生理盐水清洗两次,观察钙结节的形成情况,结果如图4~6所示。
从图中可以看出,图4中的成骨结节更丰富,说明本发明组织消化液和成骨细胞培养液结合使用所诱导分化的细胞,成骨钙结节更丰富,成骨诱导分化效果更好。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!