一种通过解除酸崩溃现象提高玉米丁醇发酵性能的方法与流程
本发明属于微生物发酵领域,具体涉及一种稳定玉米丁醇发酵过程、强化丁醇合成的方法,尤其是一种解除玉米丁醇发酵过程中“酸崩溃”现象提高玉米丁醇发酵性能的方法。
背景技术:
丁醇是一种高效的液态燃料和新型的燃料添加剂,相比于乙醇,丁醇具有能值高、吸水性低、挥发性低和能与汽油任意比混合等优点,近年来对生物丁醇的研究受到了研究者的广泛关注。目前,利用产溶剂梭菌(如丙酮丁醇梭菌clostridiumacetobutylicum、拜氏梭菌clostridiumbeijerinckii、糖乙酸多丁醇梭菌clostridiumsaccharoperbutylacetonicum等)的厌氧发酵过程是生物丁醇生产的主要方式,其中丙酮丁醇梭菌clostridiumacetobutylicum是研究丁醇发酵应用最广泛的产溶剂梭菌,玉米是使用最多的发酵底物。
丁醇的微生物合成过程也称为丙酮-丁醇-乙醇发酵、abe发酵或丁醇发酵,包括产酸期和产溶剂期两个阶段。在产酸期阶段,产溶剂梭菌将葡萄糖代谢后主要转化为有机酸(乙酸和丁酸),并伴随着细胞的快速增殖、发酵液的ph值逐渐降低,该阶段合成的溶剂(丁醇、丙酮和乙醇)较少;当低ph环境刺激微生物细胞强化其对有机酸的吸收时,发酵过程即进入第二个阶段(产溶剂期),该阶段的发酵液ph值逐渐回升,细胞增殖基本停止,溶剂(丁醇、丙酮和乙醇)大量合成,直至发酵结束。然而,由于丁醇的分子结构特征,使得~10g/l的丁醇就对细胞的生长和生理代谢活动产生强烈的抑制作用,因此利用野生型发酵菌株合成丁醇的浓度普遍低于13g/l。如何提高玉米丁醇发酵性能(丁醇产量)是目前玉米丁醇发酵领域亟待解决的关键科学问题。
丁醇发酵过程的经济性主要由发酵原料成本、操作成本和精制成本组成。当使用玉米作为发酵底物时,原料成本占到生产总成本的60-70%,操作成本占约10-15%,精制成本占约20-25%。其中,精制成本占生产总成本的比例主要受到溶剂浓度的影响,当丁醇浓度从12g/l提高至19g/l时,精制成本降低大约50%。由于产酸期产生的丁酸是合成丁醇的重要前体物质,因此添加丁酸是提高玉米丁醇发酵性能的有效途径之一。然而,由于丁酸溶液ph较低,当一次性添加丁酸大于4g/l时,产溶剂梭菌无法及时代谢添加的过量丁酸,丁醇发酵液的ph值下降,而低ph环境也会使得细胞内的分子态丁酸浓度大幅提高,最终导致发酵失败,该现象即为“酸崩溃”。尽管反复多次添加丁酸可以在一定程度上解除玉米丁醇发酵过程的“酸崩溃”现象,但是发酵液中较低的丁酸浓度不利于丁醇的高效合成,也增加了发酵过程的操作复杂性,最终降低了丁醇发酵的整体经济性。因此,如何解除玉米丁醇发酵过程的“酸崩溃”现象,是实现外添丁酸策略改善丁醇合成效率和产量的有效解决方案。
技术实现要素:
发明目的:为了解决外添丁酸导致的“酸崩溃”现象、玉米丁醇发酵性能无法提升的问题,本发明提供了一种通过解除酸崩溃现象提高玉米丁醇发酵性能的方法,本发明是一种添加外源氨基酸策略解除“酸崩溃”现象的方法。本发明通过简单地添加外源氨基酸提高了产溶剂梭菌对高丁酸和低ph值环境的耐受能力、强化了细胞对丁酸的高效吸收并提高了丁醇合成效率和产量,进而改善玉米丁醇发酵性能。
技术方案:为了实现上述目的,如本发明所述一种通过解除酸崩溃现象提高玉米丁醇发酵性能的方法,其特征在于,包括如下步骤:
(1)将保藏于孢子管中的丙酮丁醇梭菌活化至活化培养基中,以得到高活力的丙酮丁醇梭菌种子液;
(2)将丙酮丁醇梭菌种子液转接至发酵培养基中,进行丁醇发酵,合成丁醇、丙酮和乙醇;发酵的第一阶段为产酸期,产酸期过程的发酵液ph不控制;
(3)当丁醇发酵进行至产溶剂期的初始阶段,向发酵液中添加丁酸溶液和氨基酸溶液;继续进行发酵,即可解除外添丁酸所出现的“酸崩溃”现象,从而提高了玉米丁醇发酵性能。
本发明中单独添加高浓度丁酸溶液时,微生物细胞无法及时代谢添加的过量丁酸,使得发酵液ph值下降,发酵过程出现“酸崩溃”现象,最终导致发酵失败;通过同时添加丁酸溶液和氨基酸溶液,避免了添加丁酸之后发酵过程出现的ph值降低现象,添加的丁酸被产溶剂梭菌逐渐代谢用来合成丁醇,发酵液ph值逐步回升,即解除了外添丁酸所出现的“酸崩溃”现象。同时,外添的氨基酸作为细胞耐受外部环境的保护因子,使得产溶剂梭菌可以适应高浓度的丁酸和丁醇环境,从而提高了玉米丁醇发酵性能。
其中,步骤(1)中所述活化培养基为玉米醪培养基具体制作方法如下:称取市售玉米粉加入至去离子水中,缓慢煮沸,维持煮沸状态1.5-2h,将多余水份逐渐挥发,得到玉米醪培养基。
作为优选,称取50g市售玉米粉加入至5l去离子水中,用电磁炉缓慢煮沸,维持煮沸状态1.5-2h,将多余水份逐渐挥发,体积直至1000ml结束,此即为5%玉米醪培养基。该过程得到的玉米醪培养基可以促进产溶剂梭菌的萌发,强化细胞对淀粉质原料的利用效率,提高产溶剂梭菌分泌淀粉酶的能力,最终获得高活力的丙酮丁醇梭菌种子液。
其中,步骤(2)中所述发酵培养基为玉米双酶水解液培养基具体制作方法如下:称取市售玉米粉加入至去离子水中,搅拌均匀后放置于95-100℃水浴锅中,搅拌直至溶液出现黏糊状后再加入耐高温淀粉酶,维持95-100℃条件搅拌50-60min,此即为玉米粉液化液;然后,将玉米粉液化液冷却至60-65℃,加入糖化酶,60-65℃中糖化50-60min,得到玉米粉发酵培养基,即为玉米双酶水解液培养基。
进一步地,步骤(2)中所述淀粉酶添加量为6-10u/g玉米粉,糖化酶添加量100-120u/g玉米粉。
作为优选,称取150g市售玉米粉加入至600ml去离子水中,搅拌均匀后放置于95-100℃水浴锅中,搅拌直至溶液出现黏糊状后再加入耐高温淀粉酶,淀粉酶添加量为6-10u/g玉米粉,维持95-100℃条件搅拌50-60min,用磁力方式进行搅拌直至黏度明显降低,此时玉米粉中的淀粉主要转化为单糖和寡糖,此即为玉米粉液化液。然后,将玉米粉液化液冷却至60-65℃,加入高活力糖化酶,糖化酶添加量100-120u/g玉米粉,放置于60-65℃水浴锅中50-60min,最后定容至1000ml,此即为15%玉米粉发酵培养基。
其中,步骤(2)中所述糖化酶水解时间的确定方法为利用生物传感仪测定玉米水解液中的葡萄糖浓度,测定之前首先稀释玉米粉双酶水解液,将其中的葡萄糖浓度控制在0.2-1.0g/l范围内,测定后计算水解液的葡萄糖总浓度;当玉米粉双酶水解液中的葡萄糖浓度达到60g/l时,即可进行后续的灭菌和发酵。
作为优选,步骤(2)中所述发酵开始之前通入无菌氮气移除发酵培养基中溶解的氧气,创造适宜于丁醇发酵的厌氧环境。
其中,步骤(3)中所述丁酸溶液将其ph调至4.5-5.5,再添加到发酵液中,添加时间为发酵过程从产酸期转型至产溶剂期的初始阶段(大约在发酵24h)。通常发酵ph从最低值(约3.8)回升时,表明发酵过程已进入产溶剂期的初始阶段,在此时加入丁酸;优选地,丁酸溶液ph调至5.0再添加。在本发明中发酵的第一阶段是产酸期,该过程会使得ph下降,下降到一定程度后(约3.8),就开始回升,则进入产溶剂期了,回升的时候为产溶剂期的初始阶段。
其中,步骤(3)发酵液中的丁酸终浓度在4-8g/l。
作为优选,首先利用3mol/l的naoh溶液将步骤(3)中的丁酸溶液ph调至5.0。当需要添加丁酸溶液时,利用蠕动泵将丁酸溶液加到丁醇发酵液中,添加时间为发酵24h,即发酵过程从产酸期转型至产溶剂期的初始阶段。本发明涉及的高浓度丁酸溶液指的是丁酸浓度为400-600g/l,加入到发酵液中的丁酸终浓度在4-8g/l。
其中,步骤(3)中所述氨基酸溶液指的是赖氨酸、甲硫氨酸、苯丙氨酸和酪氨酸的混合液,添加至丁醇发酵液中的四种氨基酸终浓度为0.7-1.0g/l、0.15-0.25g/l、0.3-0.5g/l和0.15-0.25g/l。优选地,添加至丁醇发酵液中的四种氨基酸终浓度为0.8g/l、0.2g/l、0.4g/l和0.2g/l。
作为优选,氨基酸溶液添加方式为利用蠕动泵将氨基酸母液一次性加入到发酵液中,添加时间为发酵大约24h,即发酵过程从产酸期转型至产溶剂期的初始阶段。本发明具体实施过程中,也可以将氨基酸溶液与丁酸配制在一起,然后添加至丁醇发酵液中。
进一步地,发酵总时间为48h(即种子液接入到发酵罐开始),发酵过程无需搅拌,发酵温度为36-38℃。通常发酵温度为37℃。
本发明中玉米丁醇发酵性能提高的一个重要途径是添加合成前体(丁酸),其中一次性添加丁酸是最直接的方式,然而高浓度丁酸和低ph环境会强烈抑制产溶剂梭菌生理代谢,并降低丙酮丁醇梭菌胞内的ph值,进而出现“酸崩溃”现象,最终导致发酵失败。由于氨基酸是维持微生物细胞耐受外部环境胁迫因子的重要屏障,而且胁迫环境也会刺激氨基酸在微生物细胞内的积累,然而胞内氨基酸的自身合成量难以适应外部环境胁迫的剧烈变化。具体到丁醇发酵过程,尚无通过外添氨基酸解除外部胁迫的研究及专利报道。基于此,我们研究了外添多种氨基酸组合对“酸崩溃”现象的解除效果,着重考察了糖酵解途径中相关氨基酸的影响,以期建立解除“酸崩溃”现象、提高玉米丁醇发酵性能的有效方法。
同时本发明发现了天冬氨酸族(赖氨酸和甲硫氨酸)和芳香族氨基酸(苯丙氨酸和酪氨酸)添加可以解除“酸崩溃”现象、并大幅度提升玉米丁醇发酵性能;同时,本发明为丁醇发酵胁迫环境因子的解除、提高微生物细胞对胁迫环境的耐受能力提供了有效的过程工程策略。
有益效果:与现有技术相比,本发明具有如下优点:
(1)为了提高丁醇发酵性能,本发明向丁醇发酵液中加入合成丁醇的前体物质—丁酸。在这种情况下,由于添加丁酸浓度较高,导致出现“酸崩溃”现象,进而使得丁醇发酵终止。因此,本发明提出了一种简单有效解决“酸崩溃”问题的有效方法:通过向发酵液中添加丁酸的同时添加一定浓度的氨基酸溶液,添加的氨基酸混合液可以增强丙酮丁醇梭菌对高丁酸、低ph和高丁醇环境的耐受能力,使得细胞可以代谢添加的过量丁酸,发酵液ph值逐渐回升,细胞的丁醇合成能力得到强化,最终丁醇发酵性能大幅提高。
(2)本发明中发酵过程的操作成本会对溶剂产品的生产总成本产生影响,本发明一次性添加丁酸和氨基酸溶液,使得整个操作过程极为简单;避免了反复添加丁酸造成的操作成本,提高了丁醇发酵的经济性。
(3)本发明中添加氨基酸混合液提高了发酵过程有机酸的吸收速率,提高了丁醇和总溶剂的生产效率和产量。由于精制成本在丁醇生产总成本中大约占20-25%,因此本发明提出的发酵工艺有望降低了后续分离纯化的成本。
(4)本发明提供了一种改善模式菌株丁醇发酵性能的有效策略,扩展了过程工程手段提高丁醇发酵性能的研究范畴。不同于利用代谢工程手段改造获得的高性能工程菌株,本发明提出的工艺使用的是野生型菌株、遗传性能稳定,因此可以稳定地进行丁醇发酵,从而避免了工程菌存在的遗传稳定性差的问题。
附图说明
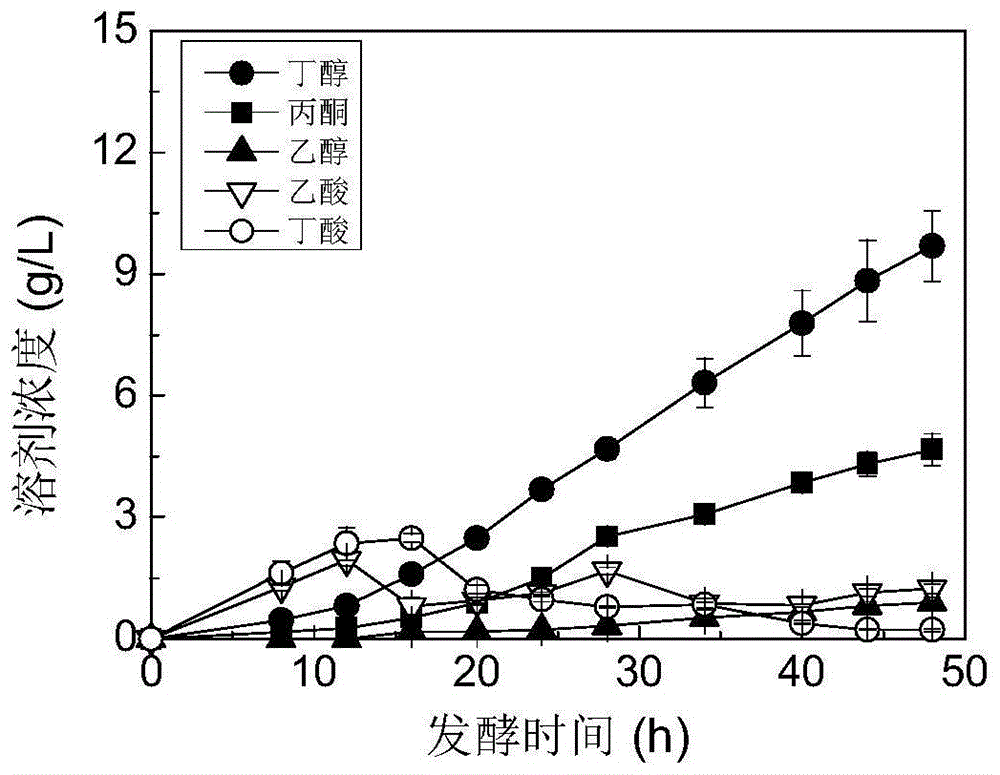
图1为玉米丁醇分批发酵动力学;
图2为在24h一次性添加4g/l丁酸后的丁醇发酵动力学;
图3为在24h同时添加丁酸和氨基酸后的丁醇发酵动力学。
具体实施方式
下面结合实施例对本发明作更进一步的说明。
实施例1:玉米丁醇分批发酵过程
将保藏于4℃的丁醇发酵模式菌株丙酮丁醇梭菌atcc824孢子管转接至活化培养基玉米醪培养基中,接种瓶为100ml厌氧瓶,内装50ml活化培养基,接种量为10%(v/v)。然后,分别在100℃沸水和0℃冰水混合物中进行热激和冰浴处理各2min。利用真空泵进行抽真空操作2min。将其放置于37℃水浴锅中培养24h,使得厌氧瓶中的顶空为正压,即为种子液。将活化好的种子液转接至7l厌氧发酵罐中,厌氧发酵罐装有3.5l发酵培养基即玉米双酶水解培养基,接种量为10%(v/v),发酵温度为37℃,发酵过程中的ph不控制。接种前,向发酵液中通入无菌氮气20min以除去发酵液中游离的氧气。发酵时间为48h,每小时记录发酵过程的产气量,每隔6h取样离心后,测定发酵液中的溶剂浓度和葡萄糖浓度。
活化培养基:5%玉米醪培养基。称取50g市售玉米粉加入至5l去离子水中,用电磁炉缓慢煮沸,维持煮沸状态2h,将多余水份逐渐挥发,体积直至1000ml结束,此即为5%玉米醪培养基。
发酵培养基:15%玉米双酶水解液培养基。
称取150g市售玉米粉加入至600ml去离子水中,搅拌均匀后放置于100℃水浴锅中,搅拌直至溶液出现黏糊状后再加入耐高温淀粉酶,淀粉酶添加量为10u/g玉米粉,维持100℃条件50min,用磁力方式进行搅拌直至黏度明显降低,此时玉米粉中的淀粉主要转化为单糖和寡糖,此即为玉米粉液化液。然后,将玉米粉液化液冷却至60℃,加入高活力糖化酶,糖化酶添加量100u/g玉米粉,放置于60℃水浴锅中60min,最后定容至1000ml,此即为15%玉米粉发酵培养基,此时培养基中的葡萄糖浓度为60g/l。
发酵ph和氧化还原电位的测定:分别利用梅特勒ph电极和orp测定。
产物测定方法:测定的产物包括溶剂(丙酮、丁醇和乙醇)和有机酸(乙酸和丁酸)。利用内标法测定溶剂和有机酸浓度,以异丁醇为内标物,色谱柱为毛细管柱,色谱条件为升温程序法(60℃,3min;60→140℃,10℃/min;140→200℃,20℃/min),进样量为0.5μl。
葡萄糖浓度的测定:利用生物传感仪sba-40e测定玉米双酶水解液和发酵液中的葡萄糖浓度。具体方法如下:首先,稀释待测溶液至其中的游离葡萄糖浓度为0.2-1.0g/l,然后取样25μl,通过sba-40e生物传感仪测定葡萄糖浓度,最终计算待测溶液中的葡萄糖浓度为稀释倍数乘以生物传感仪显示的葡萄糖浓度值。
发酵结果如图1所示,发酵至48h结束,葡萄糖消耗量为39.0g/l。发酵过程的ph先降低后上升,ph最终达到4.28,在产酸末期ph低至3.8。发酵结束的溶剂浓度分别为丁醇(9.69g/l)、丙酮(4.67g/l)和乙醇(0.90g/l),总溶剂浓度为15.26g/l。丁醇和总溶剂的生产效率分别为0.20g/l/h和0.32g/l/h。发酵过程中的总酸浓度最大值出现在16h,为2.5g/l。当将发酵时间延长至58h时,丁醇产量也仅为11.1g/l;该批次的丁醇浓度低于13g/l,表明10g/l左右的丁醇浓度即对丙酮丁醇梭菌的生理代谢活动产生强烈抑制。
实施例2:添加4g/l丁酸的玉米丁醇发酵过程
将保藏于4℃的丁醇发酵模式菌株丙酮丁醇梭菌atcc824孢子管转接至活化培养基中,接种瓶为100ml厌氧瓶,内装50ml活化培养基,接种量为10%(v/v)。然后,分别在100℃沸水和0℃冰水混合物中进行热激和冰浴处理各2min。利用真空泵进行抽真空操作2min。将其放置于37℃水浴锅中培养24h,使得厌氧瓶中的顶空为正压,即为种子液。将活化好的种子液转接至7l厌氧发酵罐中,厌氧发酵罐装有3.5l发酵培养基即玉米双酶水解培养基,接种量为10%(v/v),发酵温度为37℃,发酵过程中的ph不控制。接种前,向发酵液中通入无菌氮气20min以除去发酵液中游离的氧气。发酵ph从最低值(约3.8)回升0.1左右时,表明发酵过程已进入产溶剂期,在此时加入终浓度为4g/l的丁酸。发酵时间为48h(即种子液接入到发酵罐开始),每小时记录发酵过程的产气量,每隔6h取样离心后,测定发酵液中的溶剂浓度和葡萄糖浓度。
活化培养基:5%玉米醪培养基。具体制备方法见实施例1。
发酵培养基:15%玉米双酶水解液培养基。具体制备方法见实施例1。
丁酸溶液的配制:根据发酵液体积准确称取终浓度为4g/l的丁酸,利用3mol/l的naoh溶液将丁酸溶液ph调至5.0。
发酵ph和氧化还原电位的测定:分别利用梅特勒ph电极和orp测定。
产物测定方法:利用内标法测定溶剂和有机酸浓度,以异丁醇为内标物,色谱柱为毛细管柱,色谱条件为升温程序法(60℃,3min;60→140℃,10℃/min;140→200℃,20℃/min),进样量为0.5μl。
葡萄糖浓度的测定:利用生物传感仪sba-40e测定葡萄糖浓度。
发酵结果如图2所示,发酵至48h结束,葡萄糖消耗量为41.3g/l。发酵过程的ph先降低后上升,当添加4g/l丁酸时,ph先回升,这主要是由于丁酸溶液ph为5.0的缘故,然而发酵至35h时,ph持续下降,此时发酵液中的有机酸浓度较高,丁醇合成速率降低,即出现“酸崩溃”现象。发酵结束的溶剂浓度分别为丁醇(9.8g/l)、丙酮(4.1g/l)和乙醇(0.9g/l),总溶剂浓度为14.8g/l。丁醇和总溶剂的生产效率分别为0.20g/l/h和0.31g/l/h。发酵过程中的总酸浓度最大值出现在28h,为4.5g/l。这一结果表明,一次性添加4g/l丁酸会导致发酵过程出现“酸崩溃”现象,丁醇发酵性能甚至低于对照批次,最终发酵失败。因此,解决“酸崩溃”问题对丁醇发酵性能的提高至关重要。
实施例3:本发明同时添加丁酸和氨基酸的玉米丁醇发酵过程
将保藏于4℃的丁醇发酵模式菌株丙酮丁醇梭菌atcc824孢子管转接至活化培养基中,接种瓶为100ml厌氧瓶,内装50ml活化培养基,接种量为10%(v/v)。然后,分别在100℃沸水和0℃冰水混合物中进行热激和冰浴处理各2min。利用真空泵进行抽真空操作2min。将其放置于37℃水浴锅中培养24h,使得厌氧瓶中的顶空为正压,即为种子液。将活化好的种子液转接至7l厌氧发酵罐中,厌氧发酵罐装有3.5l玉米双酶水解培养基,接种量为10%(v/v),发酵温度为37℃,发酵过程中的ph不控制。接种前,向发酵液中通入无菌氮气20min以除去发酵液中游离的氧气。发酵ph从最低值(约3.8)回升0.1左右时,表明发酵过程已进入产溶剂期,在此时分三组分别加入终浓度为4、6、8g/l的三种不同浓度丁酸,同时添加终浓度为0.8g/l(赖氨酸)、0.2g/l(甲硫氨酸)、0.4g/l(苯丙氨酸)和0.2g/l(酪氨酸)的氨基酸混合液。发酵时间为48h,每小时记录发酵过程的产气量,每隔6h取样离心后,测定发酵液中的溶剂浓度和葡萄糖浓度。
活化培养基:5%玉米醪培养基。具体制备方法见实施例1。
发酵培养基:15%玉米双酶水解液培养基。具体制备方法见实施例1。
丁酸溶液的配制:根据发酵液体积分别准确称取终浓度为4、6、8g/l的丁酸,利用3mol/l的naoh溶液将丁酸ph调至5.0。
氨基酸溶液的配制:根据发酵液体积准确称取终浓度为0.8g/l(赖氨酸)、0.2g/l(甲硫氨酸)、0.4g/l(苯丙氨酸)和0.2g/l(酪氨酸)的氨基酸,溶解于丁酸溶液中。
发酵ph和氧化还原电位的测定:分别利用梅特勒ph电极和orp测定。
产物测定方法:利用内标法测定溶剂和有机酸浓度,以异丁醇为内标物,色谱柱为毛细管柱,色谱条件为升温程序法(60℃,3min;60→140℃,10℃/min;140→200℃,20℃/min),进样量为0.5μl。
葡萄糖浓度的测定:利用生物传感仪sba-40e测定葡萄糖浓度。
如图3表示的是同时添加氨基酸和4g/l丁酸后的发酵性能,发酵至48h结束,葡萄糖消耗量为51.5g/l,表明添加氨基酸可以快速消耗葡萄糖。发酵过程的ph先降低后上升,当添加4g/l丁酸和氨基酸混合液时,ph持续回升,最终ph达到5.77。发酵结束的溶剂浓度分别为丁醇(14.75g/l)、丙酮(4.77g/l)和乙醇(1.29g/l),总溶剂浓度为20.81g/l。丁醇和总溶剂的生产效率分别为0.30g/l/h和0.43g/l/h。发酵过程中的总酸浓度最大值出现在25h,为3.5g/l。
当添加6g/l丁酸和氨基酸混合液时,最终的丁醇浓度达到16.5g/l,丙酮浓度达到6.4g/l,乙醇浓度为1.9g/l,总溶剂浓度为24.8g/l。丁醇和总溶剂的生产效率分别为0.33g/l/h和0.50g/l/h。该批次丁醇浓度比出现“酸崩溃”批次提高了68%,比玉米丁醇对照批次提高了49%,发酵性能显著提升。
当添加8g/l丁酸和氨基酸混合液时,丁醇发酵性能和添加6g/l丁酸和氨基酸混合液批次基本相当。
以上结果表明,添加4-8g/l丁酸和氨基酸混合液可以解除发酵过程出现的“酸崩溃”现象,玉米丁醇发酵性能显著改善,提高了整个丁醇发酵过程的经济性。
实施例4
将保藏于4℃的丁醇发酵模式菌株丙酮丁醇梭菌atcc824孢子管转接至活化培养基中,接种瓶为100ml厌氧瓶,内装50ml活化培养基,接种量为10%(v/v)。然后,分别在100℃沸水和0℃冰水混合物中进行热激和冰浴处理各2min。利用真空泵进行抽真空操作1.5min。将其放置于37℃水浴锅中培养20h,使得厌氧瓶中的顶空为正压,即为种子液。将活化好的种子液转接至7l厌氧发酵罐中,厌氧发酵罐装有3.5l玉米双酶水解培养基,接种量为10%(v/v),发酵温度为37℃,发酵过程中的ph不控制。接种前,向发酵液中通入无菌氮气15min以除去发酵液中游离的氧气。发酵ph从最低值回升时,表明发酵过程已进入产溶剂期,在此时分三组分别加入终浓度为4、6、8g/l的三种不同浓度丁酸(ph4.5),同时添加终浓度为0.7g/l(赖氨酸)、0.15g/l(甲硫氨酸)、0.3g/l(苯丙氨酸)和0.15g/l(酪氨酸)的氨基酸混合液。发酵时间为48h,每小时记录发酵过程的产气量,每隔4h取样离心后,测定发酵液中的溶剂浓度和葡萄糖浓度。淀粉酶添加量为6u/g玉米粉,糖化酶添加量100u/g玉米粉。
其余步骤同实施例3。
实施例5
将保藏于4℃的丁醇发酵模式菌株丙酮丁醇梭菌atcc824孢子管转接至活化培养基中,接种瓶为100ml厌氧瓶,内装50ml活化培养基,接种量为10%(v/v)。然后,分别在100℃沸水和0℃冰水混合物中进行热激和冰浴处理各2min。利用真空泵进行抽真空操作2.5min。将其放置于37℃水浴锅中培养25h,使得厌氧瓶中的顶空为正压,即为种子液。将活化好的种子液转接至7l厌氧发酵罐中,厌氧发酵罐装有3.5l玉米双酶水解培养基,接种量为10%(v/v),发酵温度为37℃,发酵过程中的ph不控制。接种前,向发酵液中通入无菌氮气20min以除去发酵液中游离的氧气。发酵ph从最低值回升时,表明发酵过程已进入产溶剂期,在此时分三组分别加入终浓度为4、6、8g/l的三种不同浓度丁酸(ph5.5),同时添加终浓度为1.0g/l(赖氨酸)、0.25g/l(甲硫氨酸)、0.5g/l(苯丙氨酸)和0.25g/l(酪氨酸)的氨基酸混合液。发酵时间为48h,每小时记录发酵过程的产气量,每隔6h取样离心后,测定发酵液中的溶剂浓度和葡萄糖浓度。
其余步骤同实施例3。
上述实施方式只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所做的等效变换或修饰,都应涵盖在本发明的保护范围之内。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:罗洪镇;刘正;谢方;郑盼丽;杨荣玲;王朝宇
- 技术所有人:淮阴工学院
- 我是此专利的发明人
- 上一篇:自动清洁机器人的制作方法
- 上一篇:一种填埋生活垃圾转化沼气方法与流程
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
- 还没有人留言评论。精彩留言会获得点赞!