高表达TrkB作为新型靶点在抑制胰腺癌转移方面的医药用途的制作方法
本申请涉及一种胰腺癌转移的标志物和治疗靶点。
背景技术:
人们已经在几乎所有已知的肿瘤中发现并鉴定了能够自我更新的具备干细胞特性的肿瘤干细胞的存在,且于2010年底首次从临床实践角度证实了肿瘤干细胞的存在,但对于其来源仍然众说纷纭莫衷一是而处于困惑中。
胰腺癌是一种发病隐匿、极为凶险、高度恶性的消化系统肿瘤,其进展快,早期即发生转移,手术切除率低,术后易复发、转移,并且对常规化疗、放疗均不敏感,预后极差,其发病率和死亡率几乎相等。多年来对其治疗并无突破性进展,5年生存率仍然<5%,总生存率在近30年并无显著改善,这已经成为世界性的难题。鉴于此,对胰腺癌恶性表型的基本生物要素和演化过程,恶性增殖表型与其转移潜能的内在联系有待深入探索,需要从肿瘤侵袭、转移多元调节机制入手,注重研究胰腺癌的独特的分子生物学特征,分析影响其转移的关键要素,并设计有针对性的阻断方法加以遏制,这已成为当前研究的重中之重。
trkb(tyrosinekinasereceptorb)是神经营养因子受体家族(nervenutritioneceptorfactors)成员,其与相应的配体bdnf(brain-derivedneurotrophicfactor)特异性结合在生物进化发育以及细胞存活方面具有重要意义,而且新近发现其可以不依赖相应配体而发挥作用,是一种独立的致死因子而被定义为新的原癌基因。
技术实现要素:
申请人既往研究发现,胰腺癌的远处转移依赖于trkb所介导的癌细胞大聚集体的形成,聚集体中的肿瘤细胞可以通过自体吞噬(autophagy)对抗来自环境的选择性压力以及失巢凋亡(anoikis)的发生。更为有趣的是,处于核心的肿瘤细胞似具有干细胞样特征,我们发现这种特征可能与高表达trkb的肿瘤细胞与骨髓迁徙来的干细胞或本身组织存在的干细胞诱导融合有关。并且聚集体周围的肿瘤细胞似通过相互协作成为保护核心干细胞样瘤细胞转移到靶器官的特洛伊木马(trojanhorse)(如可能通过互噬interophagy增强聚集体完整性,释放表达trkb的微囊泡microvesicles干扰免疫等)。本研究将在我们既往研究基础上进一步验证trkb介导的细胞融合是胰腺癌转移聚集体中肿瘤细胞获得干细胞特性的途径,对trkb信号途径的抑制可能通过干扰细胞融合,破坏大聚集体结构以及微囊泡的释放而达到抑制肿瘤转移的发生。
进而,申请人首次提出:
(1)trkb有促进胰腺癌细胞与骨髓迁徙干细胞抑或胰腺组织干细胞进行细胞融合形成肿瘤干细胞的能力,为trkb这一癌基因的功能机制又增添了全新的证据。
(2)trkb所介导的大聚集体外细胞互噬现象参与了转移的肿瘤细胞大聚集体结构完整性的维持,为失巢状态下的肿瘤细胞生存提供了解释。
(3)胰腺癌转移大聚集体可能通过释放高表达trkb的微囊泡抑制机体的细胞免疫而达到免疫逃逸的目的。
(4)大聚集体的形成是肿瘤转移的必须的形态结构,对大聚集体的抑制可能是抗癌的一条新途径。
(5)对肿瘤细胞在失巢及悬浮的流体动力学状态下大聚集体细胞间黏附现象及其机制研究的重要性。
因此,基于以上研究成果,本申请提出以下医药领域方面的方案:
第一方面,trkb的抑制剂在制备用于抑制胰腺癌细胞转移的药物方面的用途,所述抑制剂能够抑制高表达trkb(降低出现trkb高表达的可能,以及避免已经高表达trkb发生更高表达)。具体是通过抑制肿瘤转移大聚集体的形成或破坏已形成的大聚集体,来达到抗肿瘤的治疗效果。
上述抑制剂可选自针对trkb编码序列的rna干扰分子或反义寡核苷酸。
进一步地,所述rna干扰分子为shrna、sirna、mirna或dsrna。
上述抑制剂作用于trkb或其编码序列的核糖体定位序列。
第二方面,一种用于抑制胰腺癌细胞转移的药物,其中含有能够抑制高表达trkb的成分。
第三方面,一种筛选抗胰腺肿瘤治疗药物的方法,包括:
(a)提供表达trkb的肿瘤细胞系或肿瘤培养物;
(b)将候选药物与步骤(a)中提供的肿瘤细胞系或肿瘤培养物接触,作为给药组;
(c)检测给药组中trkb的表达水平,并与未给予候选药物的对照组的trkb的表达水平进行比较;
如果检测结果显示,给药组的trkb的表达水平显著低于对照组,则表明该候选药物能够有效抑制胰腺癌细胞转移。
第四方面,适于检测trkb表达水平的生物标志物或其识别单元,在构建涉及胰腺癌的医疗设备/试剂方面的用途,所述涉及胰腺癌的医疗设备/试剂用于早期胰腺癌筛查、早期诊断、风险评估、药物筛选和/或疗效评估。其具体应用方法,可参考上述筛选抗胰腺肿瘤治疗药物的方法,其中检测trkb表达水平的技术原理属于常规技术手段。
附图说明
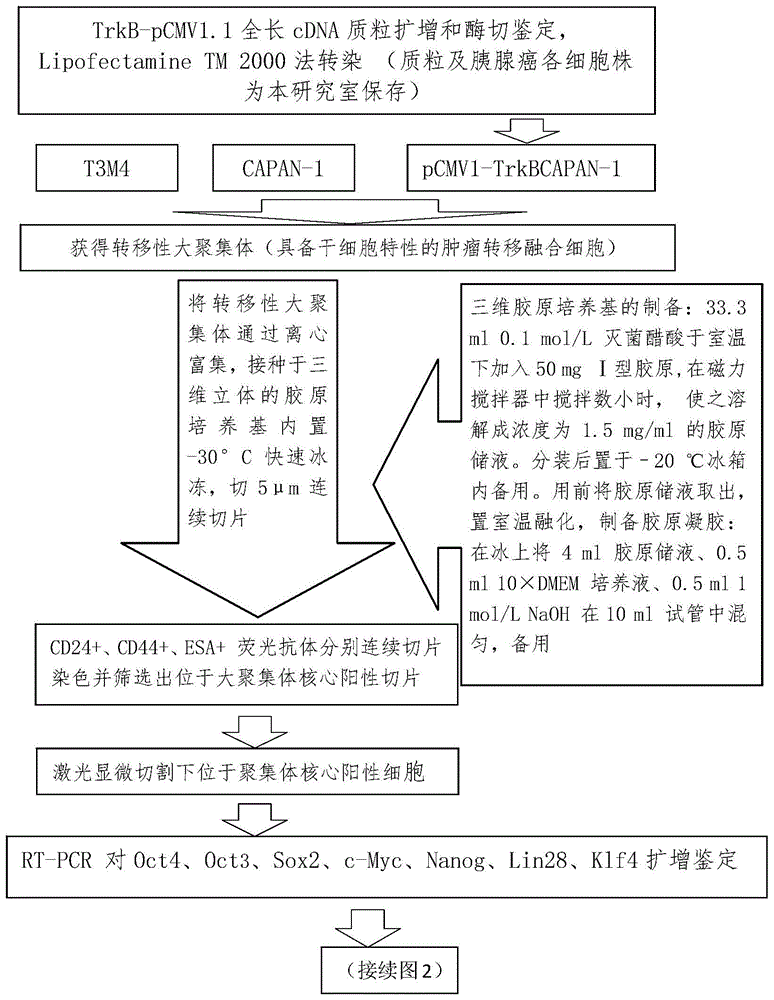
图1以及图2为验证高表达trkb的胰腺癌细胞转移时所形成的大聚集体内部肿瘤细胞具有干细胞特性的实验操作流程示意图。
图3为研究大聚集体结构维稳机制的操作流程示意图。
图4为验证trkb微囊泡诱导骨髓源性抑制细胞(mdscs)的释放以及介导t细胞功能异常的操作流程示意图。
图5为常规研究trkb介导相关通路与胰腺癌转移情况的操作流程示意图。
图6为高表达trkb的胰腺癌细胞株t3m4转移肿瘤细胞电镜图;b为a的局部放大,图中三角所示为细胞间紧密连接,av为自体吞噬小体,箭头所示为自体吞噬囊泡。
图7为免疫荧光图,体现高表达trkb的胃癌细胞向鼠肝脏汇管区转移情况;c,d为a,b融合后图像,其中绿色荧光蛋白标记高标达trkb的胃癌细胞。
图8为免疫荧光图,体现增强型蓝色荧光蛋白标记的lc3ii在t3m4胰腺癌转移大聚集体中的表达,a、c对应于不同的位置,b为a的放大图,d为c的放大图,可以看到大聚集体细胞中lc3荧光斑点(lc3是自体吞噬的标志性分子);e为胰腺癌细胞株trkb表达情况,其中t3m4最高。
图9为光镜图,a-f随时间推移的连续动态照相,呈现胰腺癌转移性大聚集体外围细胞的互噬融合(interphagy)现象。
图10为光镜图,a-o动态连续摄影照片,从图中可以看出,sirna抑制trkb的胰腺癌细胞株t3m4在失巢状态下无法形成肿瘤细胞聚集体。
图11示意了高表达trkb的微囊泡释放并围绕在大聚集体周围,其中a为免疫荧光图,b为电镜图,c为免疫组化图,d为选取一个微囊泡图c进行trkb细胞免疫组织化学染色。
图12为免疫荧光与免疫组化图,体现高表达trkb的胰腺癌细胞向胰腺腺管管腔陷窝处浸润,而该处恰是胰腺组织本身增值分裂最活跃的干细胞区域,b是a的放大图,d是c的放大图。
具体实施方式
以下详细阐述申请人的研究分析和实验等。
肿瘤的转移是一个多步骤,低效率的过程。血管,淋巴管内流体力学的冲击,低氧,营养的缺乏,免疫系统的攻击以及不适的组织微环境等均会对转移的肿瘤细胞造成致命的威胁。所以,申请人认识到,肿瘤细胞的远处转移并不是单个细胞独自完成的,只有聚集形成大的聚集体(cellaggregate,通常>50细胞),形成一个移动着的肿瘤微环境(movingmicroenvironment)才能保证转移的有效性。我们的前期研究发现神经生长因子受体家族的trkb是维系这种大聚集体形成的必要条件。如我们发现trkb可通过对其下游蛋白激酶c(proteinkinasec;pkc)信号途径的激活使得细胞骨架蛋白β-catenin磷酸化,并与细胞膜上的e-cadherin蛋白结合达到影响于肌动蛋白活性参与细胞的黏附作用。
肿瘤细胞大聚集体在转移过程中会面对来自外周环境的各种选择性压力(如流体动力学,免疫系统,失巢凋亡等等),我们新近研究发现,高表达trkb的胰腺癌细胞可以通过pi3k/akt/pkb/mtor细胞通路的激活而实现对失巢凋亡的抑制(失巢凋亡anoikis是凋亡的一种特殊形式,正常细胞在离开与其接触的细胞外基质和其周围的邻居细胞后,由于失去了既往的生存环境而自发死亡,这种现象被称之为失巢凋亡。而癌细胞之所以在离开其原始生存环境后仍然能够向远处浸润转移就是由于癌细胞不会发生失巢凋亡现象,因此,克服失巢凋亡是癌细胞在浸润转移过程中生存的先决条件)。而且,大聚集体外周的肿瘤细胞似也能通过细胞间的相互吞噬(interophagy)来保证其聚集体结构的完整性,通过自体吞噬现象(autophagy)来保证获取必要的能量支持。我们认为,细胞的融合是自然界进化出的新基因以及新性状产生的一种方式,而细胞间的相互吞噬,则应该是细胞遭遇选择性压力时的一种自卫性表现。我们还观察到,在肿瘤细胞大聚集体的转移过程中,始终有从聚集体外周肿瘤细胞膜上释放出的高表达trkb的微囊泡(microvesicles),这种微囊泡似乎也是为肿瘤大聚集体转移保驾护航的必要部分,可能与抑制机体对肿瘤细胞的免疫监视和免疫逃逸有关。该现象与最近liciarivoltini所首次报道的有关黑色素瘤细胞和人结肠癌细胞相关微囊泡促进人单核细胞向骨髓源性抑制性细胞分化(myeloid-derivedsuppressorcells,mdscs)进而造成肿瘤免疫逃逸的结论具有异曲同工之处。上述报道指出,mdscs可以通过多种途径抑制机体的获得性和天然抗肿瘤免疫,使肿瘤细胞逃避机体的免疫监视和攻击,促进肿瘤发展。所以,这就提示我们,这些伴随在大聚集体周围的高表达trkb的微囊泡也应该是保护大聚集体转移过程中不遭受外界打击的一种机制。
既往研究及我们的新近研究在乳腺癌、前列腺癌、基底细胞癌、肺癌、胆管癌、胃癌、食管癌、肝细胞癌和胰腺癌中均证实,高表达trkb的肿瘤具有更强的侵袭性及更差的预后。但肿瘤细胞的侵袭性并不意味着其具有更强的远处转移克隆的能力。有趣的是,我们发现,处于胰腺癌转移大聚集体核心的肿瘤细胞似乎具有干细胞样的特征,其表达有干细胞特有的分子标记。这种干细胞特性应该正是胰腺癌转移大聚集体转移到达远处靶器官如肝脏等能够得以克隆种植生长的原因。我们认为,无论是从生物进化还是基因经济学的角度看,肿瘤细胞获取干细胞特性最佳以及最捷径的方式就是与已经具备干细胞特性的各种前体干细胞融合而直接获取其干细胞特性,即具有较强侵袭能力的肿瘤细胞获得干细胞特性进而具备远处靶器官种植克隆的能力。而新近的研究证实,骨髓作为人体最大的干细胞库持续不断的往外周释放各种前体干细胞并已经在部分肿瘤中发现其踪迹,以及我们新近发现,高表达trkb的胰腺癌细胞向胰腺腺管管腔陷窝处浸润,而该处恰是胰腺组织本身增值分裂最活跃的干细胞区域。2008年,yamanaka等利用病毒将oct4、sox2、c-myc、klf4四个基因成功导入实验鼠的肝和胃细胞,而将这些已经分化的成体细胞诱导成多能干细胞inducedpluripotentstemcells,ips),这与我们认为的肿瘤可以通过与干细胞融合获得干细胞特性的假设不谋而合,为我们的假设提供了又一有利支持。肿瘤细胞似乎也很可能通过合成分泌各种趋化因子招募利用循环干细胞进行细胞融合而获取干细胞特征。
由此,我们结合我们既往研究及前人研究得到这样一个可能的启示:在胰腺癌中,高表达trkb的胰腺癌细胞与骨髓迁移来的干细胞融合或高表达trkb的胰腺癌细胞侵袭到胰腺组织内与胰腺本身干细胞融合而获得干细胞特性,进而形成大聚集体将融合后的肿瘤干细胞保护起来向远处转移,这时的肿瘤转移大聚集体就像特洛伊木马一样,保护了核心肿瘤干细胞免受转移过程中各种选择性压力以及免疫系统的攻击,而安全到达远处靶器官种植克隆形成转移灶。
通过上述研究,我们可以基本明确trkb所介导的有关肿瘤转移干细胞,转移大聚集体的形成以及维持稳定方面的重要作用,我们预期通过已知的与trkb相关的3条信号转导通路上的每个信号节点入手,分析每个节点在上述trkb所介导的有关细胞融合,大聚集体形成以及微囊泡形成释放中的作用,力争寻找到一个或者数个最佳靶点作为抑制肿瘤转移大聚集体的形成阻断肿瘤远处转移的治疗的方向(数个最佳靶点与鸡尾酒疗法异曲同工)。
相关实验(验证)过程简述:
一,为探索胰腺癌转移性肿瘤干细胞的来源,验证是否是高侵袭性的胰腺癌细胞与腺管内部干细胞融合抑或招募骨髓循环干细胞融合抑或二者兼而有之。如图1、图2所示。
我们前期试验中已经成功构建了稳定、高表达绿色荧光蛋白的(greenfluorescentprotein,gfp)的人胰腺癌细胞株t3m4-gfp以及trkb-sirna转染的t3m4-gfp细胞。通过将上述含有trkb以及将其抑制的t3m4细胞与胰腺组织原位或循环骨髓细胞的融合观察来探讨trkb基因的高侵袭性可能促进细胞融合的机制。
对于验证高表达trkb的胰腺癌细胞转移时所形成的大聚集体内部肿瘤细胞是否具有干细胞特性,我们利用i型胶原蛋白制备成三维立体的胶原培养基质,将大聚集体置入其中并迅速冰冻切片,从纵向切片就可以利用免疫荧光抗体来鉴别干细胞性质的肿瘤细胞的位置分布。对于处于聚集体核心的阳性表达干细胞特征分子标记(cd24+、cd44+、esa+)的细胞利用激光显微切割技术切割下来再利用rt-pcr对细胞中的oct4、oct3、sox2、c-myc、nanog、lin28、klf4干细胞特征性活性基因进行检测筛选达到目的。我们暂且定义2个或以上的表面分子阳性合并1个转录因子阳性的细胞为具有干细胞特征的肿瘤细胞,并将获得的这些细胞在裸鼠肝脏移植模型中对其克隆增值转移的干细胞活性进行在体验证。
对于鉴别该干细胞特征的获得是否是高侵袭性的胰腺癌细胞与腺管内部干细胞融合抑或招募骨髓循环干细胞融合抑或二者兼而有之,我们采用雄balb/c-nu裸鼠骨髓,移植给最佳骨髓毁损剂量放射后的雌balb/c-nu裸鼠,然后将高表达trkb的t3m4-gfp胰腺原位移植到该接受骨髓毁损的雌性裸鼠中,继而可以通过y染色体荧光原位杂交和sry基因(雄性的性别决定基因,指y染色体上具体决定生物雄性性别的基因片段)pcr检测肿瘤干细胞中y染色体存在情况来判断胰腺癌细胞是否与循环的骨髓细胞融合。
二,对肿瘤细胞转移大聚集体结构稳定性的调控可能发生在多种水平,包括粘附调控、聚集以及和细胞骨架结构的协调作用,我们前期研究已经证实了高表达trkb的胰腺癌细胞可以通过pi3k/akt/pkb/mtor细胞通路的激活而实现对失巢凋亡的抑制,进而促使转移肿瘤细胞的存活。如图3所示。后续的研究,我们在模拟血流动力学条件下将在高表达trkb的胰腺癌细胞株t3m4,低表达trkb的胰腺癌细胞capan-1中分别考察各细胞粘附分子信号通路以及细胞骨架分子通道的活性,并利用sirna干扰的t3m4以及转染了trkb的capan-1细胞上考察上述信号通路的动态变化。
三,肿瘤细胞逃避宿主免疫系的监视和攻击进化出了很多手段,包括对自身免疫标志物的掩盖,修饰,突变,缺失来逃逸宿主的免疫监控和识别,另一方面就是通过对免疫效应细胞结构和功能的破坏来达到抑制机体抗肿瘤免疫,使肿瘤获得免疫逃逸而促进其发展。本部分研究首先利用图1实验获得的高表达trkb的融合肿瘤干细胞继续在rwv中模拟失巢流体学业动力学环境下诱导大聚集体的形成,然后利用免疫磁珠(magneticactivatedcellsorting,macs)将围绕在移动的大聚集体周围循环的trkb微囊泡富集分离出来,来验证trkb微囊泡是否能够诱导骨髓源性抑制细胞(mdscs)的释放,并进一步通过干扰素释放试验验证trkb微囊泡是否能介导t细胞功能的异常,trkb微囊泡是否能介导抗原呈递细胞(dc细胞)功能的异常这些角度进行研究,最后将trkb微囊泡富集后注射于我们已经建立的原位胰腺癌仓鼠模型,观察仓鼠免疫功能变化以及肿瘤转移情况。如图4。
研究结果:
我们对神经营养因子(ngf,bdnf)及其受体(trka,trkb及p75ntr)在胰腺癌浸润和转移中的作用进行了系统且深入的研究,发现ngf及其受体trka/p75ntr不仅参与中枢和周围神经的发育、存活和功能维持,而且在胰腺癌中也具有诱导细胞凋亡、促进癌细胞分裂和存活的作用,ngf对胰腺癌的促生长作用与其表达水平和trka/p75ntr的比率相关,ngf及其受体的不同表达与胰腺癌神经侵润及转移相关,高频率的侵润和转移常伴有ngf和trka高水平的表达,反之p75ntr的高表达与良好的预后相关。我们还发现高表达p75ntr的胰腺癌细胞系中pi3k/akt通路蛋白激酶活性相比较低表达p75ntr的细胞系活性降低,而该通道的激活是肿瘤细胞抵抗失巢凋亡发生的重要途经。有趣的是,我们的新近研究还发现自体吞噬现象参与了转移肿瘤细胞的能量供给,见图6。图6中,三角所示为细胞间紧密连接,av为自体吞噬小体,箭头所示为自体吞噬囊泡;b为a的局部放大。
我们采用不同方法分别从不同水平角度证实了胃癌中trkb的表达与组织的分化程度相关,trkb在高分化肿瘤中的表达明显高于低分化肿瘤。胃癌中trkb的表达与胃癌的远处转移,特别是肝转移显著相关,提示高分化胃癌患者中trkb的表达可以作为远处转移特别是肝转移的一个预测因子,见图7。从图7可以看到,高表达trkb的胃癌细胞向鼠肝脏汇管区转移情况,c,d为a,b融合后图像,其中绿色荧光蛋白标记高标达trkb的胃癌细胞。
我们利用高表达trkb的胰腺癌细胞株t3m4在失巢状态下诱导转移大聚集体的形成,我们观察到大聚集体细胞可以通过自体吞噬现象供给自我能量达到对抗转移过程中各种选择性压力的作用,如图8;并观察到转移聚集体外周肿瘤细胞之间的互噬融合现象,如图9。sirna抑制trkb的胰腺癌细胞株t3m4在失巢状态下无法形成肿瘤细胞聚集体,如图10。我们发现高表达trkb的胰腺癌细胞株t3m4在失巢状态下形成的转移大聚集体在模拟血管流体动力学转移状态下有许多高表达trkb的微囊泡释放并围绕在大聚集体周围,如图11。我们观察到,高表达trkb的胰腺癌细胞向胰腺腺管管腔陷窝处浸润,而该处恰是胰腺组织本身增值分裂最活跃的干细胞区域,如图12。
从图8可以看出增强型蓝色荧光蛋白标记的lc3ii在t3m4胰腺癌转移大聚集体中的表达情况,可以看到大聚集体细胞中lc3荧光斑点(lc3是自体吞噬的标志性分子)。e为胰腺癌细胞株trkb表达情况,其中t3m4最高。
从图9可以看出胰腺癌转移性大聚集体外围细胞的互噬融合(interphagy)现象;a-f随时间推移的连续动态照相。
从图10可以看出,sirna抑制trkb的胰腺癌细胞株t3m4在失巢状态下无法形成肿瘤细胞聚集体,a-o动态连续摄影照片。
从图11可以看出,高表达trkb的微囊泡释放并围绕在大聚集体周围(a,b)图d为选取一个微囊泡图c进行trkb细胞免疫组织化学染色。
从图12可以看出,高表达trkb的胰腺癌细胞向胰腺腺管管腔陷窝处浸润,而该处恰是胰腺组织本身增值分裂最活跃的干细胞区域。
- 还没有人留言评论。精彩留言会获得点赞!