具有IRAK4抑制剂活性的异喹啉类化合物的制作方法
具有irak4抑制剂活性的异喹啉类化合物
技术领域
1.本发明涉及可用于治疗与白介素-1受体相关的激酶irak有关的自身免疫和炎性疾病的化合物,更尤其是调节irak4的功能的化合物,属于医药领域。
背景技术:
2.慢性炎症性疾病与自身免疫性疾病威胁全球数百万人的生命,这些疾病与炎症介导的信号异常相关。另外,一些疾病,如2型糖尿病和心血管疾病等,也与介导炎症的信号异常有关。白细胞介素-1受体相关激酶4(irak-4)是细胞内丝氨酸/苏氨酸激酶irak家族的成员之一。激酶家族的其他成员还包括irak-2、irak-m和irak-3。当白介素-1受体(il-1r)或者toll样受体(tlr)与配体结合后,irak-4能够介导信号传导,激活下游炎症因子的表达
1.。tlr可以接受来自机体与微生物作用或者内源性物质刺激产生的配体信号,以及这些刺激引发的第一波炎症信号和先天免疫反应信号
2.。tlr在许多疾病中,包括感染和自身炎症性疾病以及人类的许多其他疾病,起着非常重要的作用。像癌症坏死因子-α(tnf-α)和其他主要的细胞因子一样,白细胞介素-1(il-1)是炎症介导通路中的关键因子,能够传播和放大信号。由于tlr、il-1r和其他细胞因子受体介导的信号通路有着相互交联的作用,所以tlr和il-1r炎症通路下游的关键信号因子irak-4,在全身炎症反应中作用重大,能够作为治疗各种炎症相关性疾病的一个有效潜在靶点。
3.先天应答机制的中心是模式识别受体(prr)。prr能够识别病原微生物自身携带或者释放的病原体相关模式(pamp)分子,激活先天免疫系统,诱发组织局部炎性细胞浸润、炎性因子释放,导致组织持续处于炎性损伤状态。与pamp分子相对应,具有免疫活性调节作用的内源性物质被称为损伤相关模式(damp)分子。在慢性炎症疾病如风湿性关节炎和红斑狼疮的疾病过程中,prr能够识别damp分子,进而引发炎症和疾病。tlr是一种非常重要的分子模式受体,而il-1r在炎症的级联放大过程中,同样起到非常重要的作用。il-1r和tlr(tlr3除外)介导的信号通路十分相似,都是通过一种髓系分化因子88(myd88)作为调节分子,激活下游炎症通路。髓系分化因子88(myd88)对于人类的tlr信号是必需的(tlr3除外),人类所有的toll样受体都是通过此蛋白传递信号(tlr4有着独立的和依赖myd88两种信号传导通路)。tlr和il-1r与配体结合以后,myd88分子富集,之后myd88通过其n端的死亡结构域对irak-4进行富集。irak-4磷酸化后产生激酶活性,对其底物irak-1进行激活,使其磷酸化,进而irak-1构型发生改变。变构后的irak-1与受体复合物亲和力下降而分离,与tnf受体相关因子6(traf-6)结合,使traf-6发生低聚的作用。进而通过转接蛋白tab激活转化生长因子β活化激酶和nf-κb诱导激酶(nik)。nik激活iκb激酶(ikk)复合物,ikk磷酸化iκb。iκb磷酸化后被降解,从而解除对nf-κb的抑制作用,使nf-κb活化。活化的nf-κb进入细胞核,促使促炎细胞因子的转录和表达
3.。traf-6还可以通过另外一条途径激活丝裂原活化蛋白激酶引起转录因子的活化。所以,myd88和traf-6是共同信号通路中的关键蛋白,而irak-4作为两者之间信号传导的介质,在tlr/il-1r信号通路中起核心作用,使其成为阻止炎症信号传导的强有力靶点。临床上irak-4缺乏的特征之一就是个体对细菌感染的敏感性增加。myd88
缺少的患者有着相似的临床表现。缺乏irak-4的患者,外周血单核细胞(pbmc)对tlr激动剂不能响应(tlr3除外)。而且缺乏irak-4患者的淋巴细胞(b细胞、t细胞和nk细胞)对tlr激动剂也不能响应。另外,患者身上的成纤维细胞对il-1β的刺激也没有响应[10]。用tlr2、tlr4或tlr9配体刺激irak-4缺陷或者激酶敲除(kdki)的小鼠模型,其体内的细胞因子表达水平明显降低
[4]
,证明了包括动脉粥样硬化、类风湿性关节炎、牛皮癣、系统性红斑狼疮和炎症性肠疾病在内的一系列的疾病都与myd88依赖性的tlr有关。因此,有理由相信irak-4抑制剂在这些疾病的治疗当中能够取得较好效果。在多种类型白血病中都发现有myd88基因的突变图2irak-4的结构,包括活化b细胞样弥漫性大b细胞淋巴瘤(abc-dlbcl)、慢性淋巴细胞白血病等[16-17]。irak-4抑制剂和b细胞信号封锁的协同效应,能使从abc-blbcl患者体内分离出细胞的生长能力减弱,并且在小鼠异种移植模型中能够抑制肿瘤的生长。irak-4在黑色素瘤细胞系中也高水平表达,长春碱和irak-4抑制剂的联合使用(瘤内注射给药),比两者单独使用能够产生更好的效果。这些报道都显示出irak-4抑制剂在对抗癌症方面的潜力
[5]
。
[0004]
参考文献:[1]p nati acad sci usa,2002,99(8):5567-5572.[2]immunol rev,2008,226(1):10-18.[3]trends immunol,2002,23(10):503-506.[4]eur j immunol,2008,38(3):870-876.[5]central south pharmacy.october 2015,vol.13 no.10
技术实现要素:
[0005]
本发明涉及式(i)的化合物。
[0006][0007]
其中:
[0008]
a为s、so、so2或者se;
[0009]
x、y和z各自独立的是c或者n,且x、y和z中至少有一个不是n。
[0010]
r1是c1-c6烷基;c2-c6烯基;c2-c6炔基;3至6元环烷基;具有一个至三个杂原子的3至7元杂环烷基;具有一个至三个杂原子的5至10元杂芳基;6至10元芳基;其中,所述烷基、烯基、炔基、环烷基、杂环烷基、杂芳基或者芳基任选被一至五个卤素、氘、-or6、-sr6、-nr
7a
r
7b
、氰基、c1-c6烷基,c3-c6环烷基或者c1-c6烷氧基取代;
[0011]
r2是氢、氰基、酰胺基、烷基酮基、醛基、羧酸基及羧酸酯基;
[0012]
r
3a
和r
3b
各自独立的是氢或者c1-c6烷基;
[0013]
r
4a
和r
5a
各自独立的是氢、氘、氟、oh、-or6、甲基、乙基、乙烯基、环丙基或者丙基,任选被一只五个氘、氟、甲基、甲氧基或者oh取代;或者r
4a
和r
5a
与它们所连接的碳一起形成4至7元环烷基或者杂环烷基,其中环烷基或杂环烷基任选被一个至三个氟、羟基、c1-c3烷基
取代;
[0014]
r
4b
和r
5b
各自独立和任选的是氢、卤素、羟基、氘、c1-c6烷基、c2-c6烯基、-or6、3至6元环烷基或4至6元杂环烷基,其中所述基团各自任选和独立地被一至五个氘、卤素、氰基、羟基或c1-c6烷氧基取代;氨基;或者r
4b
和r
5b
与它们所连接的碳一起形成4至7元环烷基或者杂环烷基,其中环烷基或杂环烷基任选被一个至三个氟、羟基、c1-c3烷基取代;
[0015]
r6是氢或者c1-c6烷基,其中,所述烷基任选被卤素取代;
[0016]
r
7a
和r
7b
各自独立的是氢或者c1-c6烷基,其中,所述烷基任选被氘、c1-c6烷氧基或氰基取代;如果是c2-c6烷基,则所述烷基任选被氘、c1-c6烷氧基、氰基、卤素或oh取代;或所述化合物的可药用盐,或所述化合物或所述盐的互变异构体。
[0017]
1.权利要求1的化合物,a为s、so或者so2;或所述化合物的可药用盐,或说书化合物或所述盐的互变异构体。
[0018]
2.权利要求1的化合物,r2为氰基(-cn)、酰胺基(-conh2、-conr
3a
r
3b
)或者羧基(-co2r
3a
);r
3a
和r
3b
为氢或者c1-c6烷基;或所述化合物的可药用盐,或说书化合物或所述盐的互变异构体。
[0019]
3.权利要求1、2和3的化合物,其中x是n,y和z是c;x和y是n,z是c;x和z是n,y是c;x和z是c,y是n;x是c,y和z是n;x和y是c,z是n;x、y和z是c;或所述化合物的可药用盐,或所述化合物或所述盐的互变异构体。
[0020]
4.权利要求1、2、3或者4的化合物,其互变异构体为式(ia)的化合物。
[0021][0022]
其中:
[0023]
a为s、so、so2或者se;
[0024]
x、y和z各自独立的是c或者n,且x、y和z中至少有一个不是n。
[0025]
r1是c1-c6烷基;c2-c6烯基;c2-c6炔基;3至6元环烷基;具有一个至三个杂原子的3至7元杂环烷基;具有一个至三个杂原子的5至10元杂芳基;6至10元芳基;其中,所述烷基、烯基、炔基、环烷基、杂环烷基、杂芳基或者芳基任选被一至五个卤素、氘、-or6、-sr6、-nr
7a
r
7b
、氰基、c1-c6烷基,c3-c6环烷基或者c1-c6烷氧基取代;
[0026]
r2是氢、氰基、酰胺基、烷基酮基、醛基、羧酸基及羧酸酯基;
[0027]
r
3a
和r
3b
各自独立的是氢或者c1-c6烷基;
[0028]
r
4a
和r
5a
各自独立的是氢、氘、氟、oh、-or6、甲基、乙基、乙烯基、环丙基或者丙基,任选被一只五个氘、氟、甲基、甲氧基或者oh取代;或者r
4a
和r
5a
与它们所连接的碳一起形成4至7元环烷基或者杂环烷基,其中环烷基或杂环烷基任选被一个至三个氟、羟基、c1-c3烷基取代;
[0029]
r
4b
和r
5b
各自独立和任选的是氢、卤素、羟基、氘、c1-c6烷基、c2-c6烯基、-or6、3至6元环烷基或4至6元杂环烷基,其中所述基团各自任选和独立地被一至五个氘、卤素、氰基、羟基或c1-c6烷氧基取代;氨基;或者r
4b
和r
5b
与它们所连接的碳一起形成4至7元环烷基或者杂环烷基,其中环烷基或杂环烷基任选被一个至三个氟、羟基、c1-c3烷基取代;
[0030]
r6是氢或者c1-c6烷基,其中,所述烷基任选被卤素取代;
[0031]
r
7a
和r
7b
各自独立的是氢或者c1-c6烷基,其中,所述烷基任选被氘、c1-c6烷氧基或氰基取代;如果是c2-c6烷基,则所述烷基任选被氘、c1-c6烷氧基、氰基、卤素或oh取代;
[0032]
或所述化合物的药用盐。
[0033]
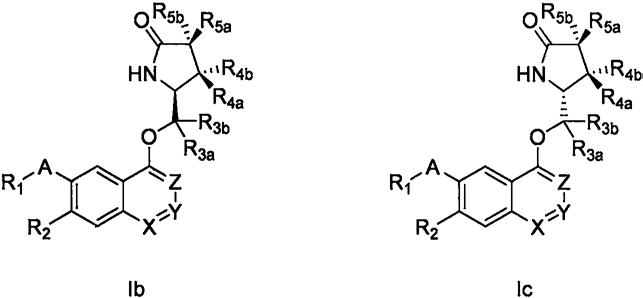
5.权利要求1、2、3、4和5的化合物,为单一非对应异构体式(ib)的化合物或者式(ic)的化合物或者式(ib)和式(ic)的化合物的任意比例混合物。
[0034][0035]
6.式(ii)的化合物:
[0036][0037]
其中:
[0038]
a为s、so或者so2;
[0039]
x、y和z各自独立的是c或者n,且x、y和z中至少有一个不是n。
[0040]
r1是c1-c6烷基;其中,所述烷基任选被卤素、氘、-oh、c1-c6烷基,c3-c6环烷基或者c1-c6烷氧基取代;
[0041]
r
3a
和r
3b
各自独立的是氢或者c1-c6烷基;
[0042]
r
4a
和r
5a
各自独立的是氢、氘、氟、oh、-or6、甲基、乙基、乙烯基、环丙基或者丙基,任选被一至五个氘、氟、甲基、甲氧基或者oh取代;或者r
4a
和r
5a
与它们所连接的碳一起形成4至7元环烷基或者杂环烷基,其中环烷基或杂环烷基任选被一个至三个氟、羟基、c1-c3烷基取代;
[0043]
r
4b
和r
5b
各自独立和任选的是氢、卤素、羟基、氘、c1-c6烷基、c2-c6烯基、-or6、3至6
元环烷基或4至6元杂环烷基,其中所述基团各自任选和独立地被一至五个氘、卤素、氰基、羟基或c1-c6烷氧基取代;氨基;或者r
4b
和r
5b
与它们所连接的碳一起形成4至7元环烷基或者杂环烷基,其中环烷基或杂环烷基任选被一个至三个氟、羟基、c1-c3烷基取代;
[0044]
或所述化合物的可药用盐,或所述化合物或所述盐的互变异构体。
[0045]
具体实施方法
[0046]
本发明具体实施方案中使用的原料、设备均为已知产品,通过购买市售产品获得。
[0047]
实施例1:制备1-氯-7-(甲基)异喹啉-6-甲腈(10)
[0048][0049]
步骤一:合成化合物4-碘-3-巯基苯甲酸(2)
[0050]
将化合物1(17g,0.1mol)加入6n盐酸溶液(185ml),于-5℃搅拌下滴加亚硝酸钠(7.6g,0.11mol)溶于水(20ml)制成的溶液。混合物于0℃搅拌30分钟,然后加入碘化钾(50g,0.3mol)溶于水(40ml)制成的溶液。反应液于0-15℃搅拌2小时,倒入水(1l)中,用乙酸乙酯(800ml)萃取三次。合并有机相,用饱和食盐水(800ml)洗两次。有机相用无水硫酸钠干燥,然后过滤,浓缩得到化合物(2)粗品(25.2g,90%)。
[0051]
步骤二:合成化合物4-碘-3-(甲硫基)苯甲酸甲酯(3)
[0052]
将化合物(2)(20g,0.089mol)溶于dmf(100ml),然后加入碳酸钾(30.7g,0.222mol),氮气保护。于室温,搅拌下加入碘甲烷(31.6g,0.222mol)。反应液于50℃搅拌4小时,然后降温至室温。反应液倒入水(500ml)中,用乙酸乙酯(500ml)萃取三次。合并有机相,用饱和食盐水(500ml)洗涤两次,然后用无水硫酸钠干燥。经过滤,减压蒸走有机溶剂得到化合物(3)(20.24g,92%)。
[0053]
步骤三:合成化合物(4-碘-3-(甲硫基)苯基)甲醇(4)
[0054]
向化合物(3)(20g,0.065mol)的thf(100ml)溶液中,加入硼氢化钠(12.3g,0.325mol),氮气保护,并加热回流4小时。反应液冷却至室温,倒入冷1n盐酸溶液(500ml)中,并用乙酸乙酯(500ml)萃取三次。合并有机相,用饱和食盐水(500ml)洗涤两次,然后用无水硫酸钠干燥。经过滤,减压蒸走有机溶剂得到化合物(4)(16.18g,89%)。
[0055]
步骤四:合成化合物4-碘-3-(甲硫基)苯甲醛(5)
[0056]
向化合物(4)(15g,0.054mol)的氯仿(150ml)溶液中加入二氧化锰(40.8g,0.324mol),氮气保护,反应液加热回流12小时。反应液冷却至室温,用硅藻土过滤,并用氯仿充分洗涤。合并有机溶剂,经减压蒸干得到化合物(5)粗品(13.4g,90%)。
[0057]
步骤五:合成化合物(e)-3-(4-碘-3-(甲硫基)苯基)丙烯酸(6)
[0058]
将化合物(5)(13g,0.047mol)溶于吡啶(50ml)中,加入丙二酸(6.35g,0.061mol),氮气保护。反应液加热回流4小时。然后减压蒸去溶剂,残留物加入水(80ml),用稀盐酸进行酸化,将ph调节到2.0。过滤产生的固体,用水(20ml)洗涤三次。真空干燥后得到产品(6)(13.5g,90%)。
[0059]
步骤六:合成(e)-3-(4-碘-3-(甲硫基)苯基)丙烯酰叠氮(7)
[0060]
将化合物(6)(13g,0.04mol)溶于dmf(50ml)中,于搅拌下加入三乙胺(4.04g,0.04mol),氮气保护,混合物冷却至0℃。滴加氯甲酸乙酯(5.64g,0.052mol),并保持温度为0℃。滴加完毕后在0℃搅拌2小时。于0℃下,缓慢加入叠氮化钠(5.2g,0.08mol)溶于水(20ml)制成的溶液。加完后,反应液升温至室温搅拌1小时。将反应液加入水(300ml)中,搅拌30分钟后。固体过滤,并用水(10ml)洗涤两次,真空干燥得到产品(7)(12g,85%)。
[0061]
步骤七:合成6-碘-7-(甲硫基)异喹啉-1-(2h)-酮(8)
[0062]
向化合物(7)(10g,0.02mol)的二苯醚(100ml)溶液中加入三正丁胺(3.64g,0.02mol)氮气保护。反应液加热至200℃,反应3小时。反应液冷却至室温,加入正己烷(300ml),搅拌下生成固体。固体过滤,用冷正己烷(100ml)洗涤。固体经真空干燥后得到产品(8)(2.47g,39%)。
[0063]
步骤八:合成7-(甲硫基)-1-氧代-1,2-二氢异喹啉-6-甲腈(9)
[0064]
向化合物(8)(1g,3.2mmol)的dmso(20ml)溶液中加入氰化亚铜(0.63g,7.04mmol),氮气保护下,将该混合物加热至150℃,保持1小时。然后将反应液倒入冰水(100ml)中。过滤后,水溶液用乙酸乙酯(200ml)萃取三次。合并有机溶剂,用饱和食盐水(200ml)洗涤两次,然后用无水硫酸钠干燥。经过滤,减压蒸干溶剂得到产品(9)(0.51g,75%)。
[0065]
步骤九:合成1-氯-7-(甲基)异喹啉-6-甲腈(10)
[0066]
将化合物(9)(5g,0.023mol)加入三氯氧磷(40ml)中,反应液加热至100℃,反应2小时。反应液冷却至室温,减压浓缩至近干。残留物用冰水(200ml)淬灭,搅拌下,水溶液用饱和碳酸钠溶液调节ph至7.0-8.0。水溶液用乙酸乙酯(300ml)萃取三次。合并有机相,用10%碳酸氢钠水溶液(100ml)洗涤两次,饱和食盐水(100ml)洗涤两次。有机相用无水硫酸钠干燥。经过滤,减压蒸干得到粗品。粗品经硅胶柱纯化(乙酸乙酯)得到产品(10)(4.24g,78%)。ms(m/z):234,236。1h nmr(400mhz,dmso):8.41(d,h),8.20(s,1h),7.87(s,1h),7.23(d,1h),2.4(s,3h)。
[0067]
实施列2:制备1-(((2s,4s)-4-甲基-5-氧代吡咯烷-2-基)甲氧基)-7-(甲硫基)异喹啉-6-甲酰胺(13)
[0068][0069]
步骤一:合成化合物(12)
[0070]
将化合物(10)(5g,0.021mol)和化合物(11)(3g,0.023mol)溶于dmf(50ml)中,反应液冷却至0℃。加入lihmds(46ml,1m,0.046mol),反应液于℃搅拌2小时。加入冰水
(100ml),混合物用乙酸乙酯(200ml)萃取三次。合并有机相,用饱和食盐水(200ml)洗涤两次。有机溶液经无水硫酸钠干燥,过滤,减压蒸干后得到产品(12)粗品,直接用于下一步。
[0071]
步骤二:合成化合物化合物1-(((2s,4s)-4-甲基-5-氧代吡咯烷-2-基)甲氧基)-7-(甲硫基)异喹啉-6-甲酰胺(13)
[0072]
将化合物(12)粗品加入6n盐酸溶液(20ml),氮气保护,于60℃搅拌3小时。将反应液倒入冰水(100ml)中,用饱和氢氧化铵溶液调节ph至8.0。水溶液用乙酸乙酯(300ml)萃取三次。合并有机相,用饱和食盐水(300ml)洗涤两次。有机相用无水硫酸钠干燥,过滤,减压蒸干溶剂得到产品粗品。粗品经硅胶柱纯化(乙酸乙酯∶石油醚=1∶2)得到产品(13)(5.15g,两步收率70%)。1h nmr(400mhz,dmso):8.61(s,1h),8.42(d,1h),8.03(br,1h),7.89(br,1h),7.81(s,1h),7.02(d,1h),3.90(m,1h),3.50-3.73(m,2h),2.56(s,3h)2.34(m,1h),2.04(m,2h),1.09(d,3h)。
[0073]
实施例3:制备1-(((2s,4s)-4-乙基-4-氟-5-氧代吡咯烷-2-基)甲氧基)-7-(甲硫基)异喹啉-6-甲酰胺(16)
[0074][0075]
步骤一:合成化合物(15)
[0076]
将化合物(14)(5.07g,0.032mol)溶于dmf(100ml)中,氮气保护下,于0℃分批加入nah(60%,3.2g,0.08mol)。反应液搅拌30分钟,然后于0℃加入化合物(10)(5g,0.021mol)溶于dmf(10ml)制成的溶液。反应液升温至50℃搅拌3小时。反应也加入冰水(200ml)淬灭反应,混合物用乙酸乙酯(300ml)萃取三次。合并有机相,用饱和食盐水(300ml)洗涤两次,然后有机相用无水硫酸钠干燥。经过滤,减压蒸干溶剂得到粗品,直接用于下一步。
[0077]
步骤二:合成1-(((2s,4s)-4-乙基-4-氟-5-氧代吡咯烷-2-基)甲氧基)-7-(甲硫基)异喹啉-6-甲酰胺(16)
[0078]
将化合物(15)粗品加入6n盐酸溶液(20ml),氮气保护,于60℃搅拌3小时。将反应液倒入冰水(100ml)中,用饱和氢氧化铵溶液调节ph至8.0。水溶液用乙酸乙酯(300ml)萃取三次。合并有机相,用饱和食盐水(300ml)洗涤两次。有机相用无水硫酸钠干燥,过滤,减压蒸干溶剂得到产品粗品。粗品经硅胶柱纯化(乙酸乙酯∶石油醚=1∶3)得到产品(16)(5.87g,两步收率73%)。1h nmr(400mhz,dmso):8.59(s,1h),8.47(d,1h),8.23(br,1h),7.87(br,1h),7.67(s,1h),6.99(d,1h),3.90(m,1h),3.55-3.75(m,2h),2.51(s,3h)2.22(m,2h),1.83(m,2h),0.98(d,3h)。
[0079]
实施例4:制备1-(((2s,3s,4s)-3-乙基-4-氟-5-氧代吡咯烷-2-基)甲氧基)-7-(甲硫基)异喹啉-6-甲酰胺(19)
[0080][0081]
步骤一:合成化合物(18)
[0082]
将化合物(17)(5.07g,0.032mol)溶于dmf(100ml)中,氮气保护下,于0℃分批加入nah(60%,3g,0.075mol)。反应液搅拌30分钟,然后于0℃加入化合物(10)(7g,0.03mol)溶于dmf(20ml)制成的溶液。反应液升温至50℃搅拌4小时。反应也加入冰水(300ml)淬灭反应,混合物用乙酸乙酯(500ml)萃取三次。合并有机相,用饱和食盐水(500ml)洗涤两次,然后有机相用无水硫酸钠干燥。经过滤,减压蒸干溶剂得到粗品,直接用于下一步。
[0083]
步骤二:合成1-(((2s,3s,4s)-3-乙基-4-氟-5-氧代吡咯烷-2-基)甲氧基)-7-(甲硫基)异喹啉-6-甲酰胺(19)
[0084]
将化合物(18)粗品加入6n盐酸溶液(80ml),氮气保护,于60℃搅拌3.5小时。将反应液倒入冰水(300ml)中,用饱和氢氧化铵溶液调节ph至8.0。水溶液用乙酸乙酯(500ml)萃取三次。合并有机相,用饱和食盐水(500ml)洗涤两次。有机相用无水硫酸钠干燥,过滤,减压蒸干溶剂得到产品粗品。粗品经硅胶柱纯化(乙酸乙酯∶石油醚=1∶3)得到产品(19)(7.36g,两步收率65%)。1h nmr(400mhz,dmso):8.56(s,1h),8.48(d,1h),8.23(br,1h),7.79(br,1h),7.61(s,1h),7.04(d,1h),4.09(m,1h),3.87(m,1h),3.59-3.73(m,2h),2.64(m,1h),2.47(s,3h),1.79(m,2h),0.96(d,3h)。
[0085]
实施例5:制备1-(((2s,3s,4s)-3-乙基-4-氟-5-氧代吡咯烷-2-基)甲氧基)-7-(甲基亚磺酰基)异喹啉-6-甲酰胺(20)
[0086][0087]
步骤:将化合物(17)(1.0g,2.65mmol)溶于二氯甲烷(50ml)中。溶液冷却至-40℃。在搅拌下滴加mcppba(0.43g,2.52mmol)溶于二氯甲烷(10ml)制成的溶液。反应液于-40℃搅拌3小时,然后加入二氯甲烷(100ml)稀释。当溶液升温至室温,有机溶液分别用10%硫代硫酸钠(50ml)、饱和食盐水(50ml)和水(50ml)洗涤。有机相用无水硫酸钠干燥,经过滤,加压干燥后得到粗品。粗品经硅胶柱纯化(乙酸乙酯∶石油醚=1∶4)得到产品(20)(0.55g,53%)。1h nmr(400mhz,dmso):9.21(s,1h),8.45(d,1h),8.23(s,1h),8.11(br,1h),7.79(br,1h),7.09(d,1h),4.05(m,1h),3.94(m,1h),3.69(m,2h),2.76(s,3h),2.57(m,1h),1.58(m,2h),0.99(d,3h)。
[0088]
实施例6:制备1-(((2s,3s,4s)-3-乙基-4-氟-5-氧代吡咯烷-2-基)甲氧基)-7-(甲磺酰基)异喹啉-6-甲酰胺(21)
[0089][0090]
步骤:将化合物(19)(1.0g,2.65mmol)溶于二氯甲烷(50ml)中。在室温搅拌下加入mcppba(0.43g,2.52mmol)溶于二氯甲烷(10ml)制成的溶液。反应液于-40℃搅拌3小时,然后加入二氯甲烷(100ml)稀释。当溶液升温至室温,有机溶液分别用10%硫代硫酸钠(50ml)、饱和食盐水(50ml)和水(50ml)洗涤。有机相用无水硫酸钠干燥,经过滤,加压干燥后得到粗品。粗品经硅胶柱纯化(乙酸乙酯∶石油醚=1∶4)得到产品(20)(0.55g,53%)。1h nmr(400mhz,dmso):9.21(s,1h),8.45(d,1h),8.23(s,1h),8.11(br,1h),7.79(br,1h),7.09(d,1h),4.05(m,1h),3.94(m,1h),3.69(m,2h),2.76(s,3h),2.57(m,1h),1.58(m,2h),0.99(d,3h)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- SPNP‑I在制备Nav1.7通道工具试剂中的应用的制造方法与工艺
- SPNP‑I在制备Nav1.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- SGLT‑2糖尿病抑制剂及其中间体的制备方法与流程