肌球蛋白来源活性肽及其应用的制作方法
本发明属于蛋白活性肽领域,具体涉及肌球蛋白来源的生物活性肽及其应用。
背景技术:
目前,生物活性肽的制备及其应用开发已经成为世界范围内研究的热点。鲜味肽因其可增强食物鲜味和醇厚味,且易于吸收,具有良好的加工特性及营养价值,而受到了越来越多的关注。并且,鲜味肽在食品中的应用也符合“天然、营养、安全”的食品发展趋势。鲜味肽不仅可以增强食物的鲜美口感,还可作为挥发性风味物质的前体物质与美拉德反应,进一步增强食品的特征香味;还能使糖更甜,使盐更咸,降低苦味和酸味,协同五种基本口味,使鲜味更具有质感。鲜味是继酸、甜、苦、咸之后的第五种基本味觉,可以给人带来欢愉感,是人体必不可少的味觉需求。在1908年,日本科学家首次在海带中分离出谷氨酸,并提出鲜味的概念,以umami命名。随后肌苷酸,鸟苷酸等核苷酸也被发现具有鲜味。1978年日本学者从牛肉的蛋白酶解液中分离、提取、纯化出一条美味肽-牛肉八肽(bmp)。随后,逐渐从肉类酶解物、水产品、火腿等食品中也提取出一些具有鲜味的多肽,并将其统一命名为鲜味肽。而鲜味肽是继msg、imp、gmp之后的一种理想的天然鲜味物质。
鲜味肽的制备方法主要有提取法和蛋白降解法,结合凝胶色谱、高效液相色谱等技术对其进行分离纯化得到更高纯度的鲜味肽。但是目前为止,已知食品中的鲜味肽种类有限,其对鲜味的贡献程度也有不同,同时鲜味肽作为一种新型天然鲜味剂也备受人们关注和研究,因此新型鲜味肽亟待开发。
技术实现要素:
本发明目的在于提供:
一种生物活性肽dk,其包括由asp-lys组成的活性肽;
一种生物活性肽eek,其包括由glu-glu-lys组成的活性肽;
一种生物活性肽edqk,其包括由glu-asp-gln-lys组成的活性肽;
一种生物活性肽seggr,其包括由ser-glu-gly-gly-arg组成的活性肽;
一种生物活性肽qdsigs,其包括由gln-asp-ser-ile-gly-ser组成的活性肽。
较优的,所述的活性肽均具有鲜味和浓厚感。可作为基料或辅料来制作调味品,广泛应用于食品加工中。选用味精作为阳性对照,将肽dk、eek、edqk、seggr、qdsigs及味精(msg)配制成0.1mg/ml的溶液。选用aae、ct0、ca0、c00、ae15个测试传感器和2个参比传感器对样品进行检测。结果表明,肽dk、eek、edqk、seggr、qdsigs的鲜味效果均要优于味精(msg)。其中,肽edqk的鲜味强度最高。
较优的,所述的活性肽dk、eek、edqk、seggr、qdsigs均来自虾夷扇贝肌球蛋白,并且分别为肌球蛋白(genbank:bab40711.1)第595~597位、第342~345位、第1383~1387位、第1513~1518位、第1488~1494位的氨基酸残基。
本发明通过toxinpred和peptidepropertycalculator对活性肽dk、eek、edqk、seggr、qdsigs进行毒性、水溶性性质的分析,利用鲜味肽的氨基酸组成、氨基酸的空间排列、分子量等进行多轮筛选,结合分子对接实验,活性肽dk、eek、edqk、seggr、qdsigs与鲜味受体t1r1/t1r3结合紧密。
本发明的生物活性肽dk、eek、edqk、seggr、qdsigs均可以通过基因工程的方法和化学方法人工合成,也可以从肌球蛋白中通过分离纯化、酶降解的方法获得。利用电子舌检测,结果表明肽段dk、eek、edqk、seggr、qdsigs具有鲜味和浓厚感。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明的鲜味肽是小分子量肽,易于被人体吸收。
(2)本发明开发的鲜味肽鲜味强度高,可以代替味精的使用,在食品中的应用意义较大。
(3)本发明获得的鲜味肽纯度高。
附图说明
本发明附图8幅,其中:
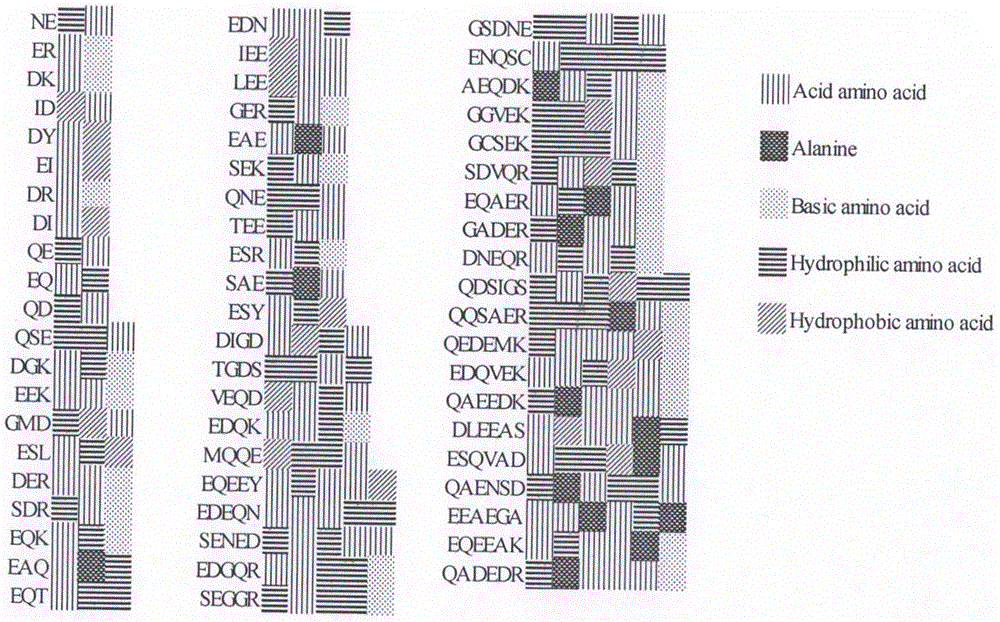
图1.62种多肽氨基酸组成图;
图2.鲜味受体t1r1/t1r3模型的ramachandranplot(拉曼图谱);
图3.鲜味受体t1r1/t1r3的胞外结构模型图;
图4.dk质谱图;
图5.eek质谱图;
图6.edqk质谱图;
图7.seggr质谱图;
图8.qdsigs质谱图。
具体实施方式
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
下面以具体实施例的方式对本发明作进一步阐述。
实施例1虾夷扇贝肌球蛋白的酶解筛选
选用胃蛋白酶(ec3.4.23.1),胰蛋白酶(ec3.4.21.4)和胰凝乳蛋白酶(ec3.4.21.1)通过expasypeptidecutter(http://web.expasy.org/peptide_cutter/)用对肌球蛋白序列(genbank:bab40711.1)进行酶切,获得747条肽序列。
利用toxinpred(http://crdd.osdd.net/raghava//toxinpred/)对肽的毒性进行分析。通过peptidepropertycalculator(http://www.innovagen.com/)对肽的水溶性进行分析,筛选获得322条无毒、水溶性良好的活性肽。鲜味肽的呈味与与氨基酸组成、氨基酸的空间排列及肽的分子量有关,含有谷氨酸和天冬氨酸,以及含有一定的亲水性氨基酸,且肽链骨架长度为2-6时,具有较好的呈味效果,且二肽c端为带负电荷的酸性氨基酸,n端为带正电荷的碱性氨基酸,具有呈味特性。基于此,对322条肽进行筛选获得70条符合条件的肽序列。利用活性肽数据库biopep(http://www.uwm.edu.pl/biochemia/index.php/en/biopep)进行检索和比对,剔除已被报道过的鲜味肽。最终筛选得到62条未被报道的肽序列,结果见图1。
采用modeller9.18构建鲜味受体t1r1/t1r3异源二聚体蛋白模型。选取metabotropicglutamatereceptor(pdbid:1ewk)作为建模模板。在gromacs2018.1软件包中对构建模型进行分子动力学优化。对优化后的鲜味受体模型进行拉氏图计算,结果如图2所示,数据分析表明该模型中有99.3%的氨基酸残基处于允许区内,根据90%的临界评价原则,表明鲜味受体t1r1/t1r3模型构型合理。鲜味受体t1r1/t1r3胞外结构模型如图3所示。
通过discoverystudio(ds)2017客户端软件的cdocker程序进行分子对接。对接能量结果如表1所示,结果表示二肽dk、三肽eek、四肽edqk、五肽seggr和六肽qdsigs具有最低的dockingenergy和dockinginteractionenergy得分,得分越低表示结合越紧密。因此对dk、eek、edqk、seggr和qdsigs进行制备。
表1多肽与鲜味受体t1r1/t1r3的对接能量
实施例2电子舌检测
本实施例选用味精(msg)作为阳性对照。将肽dk、eek、edqk、seggr、qdsigs及msg配制成0.1mg/ml的溶液。选用aae、ct0、ca0、c00、ae15个测试传感器和2个参比传感器对样品进行检测。采用插值法来分析样品的味道,数据处理结果见表2。
表2基于电子舌的不同肽的umami和richness值
结果表明,活性肽dk、eek、edqk、seggr、qdsigs的呈鲜效果均要优于味精(msg)。其中,肽edqk的鲜味强度最高。最终本发明提供了五条鲜味肽。
实施例3活性肽dk、eek、edqk、seggr、qdsigs的化学合成
本实施例采用fmoc法固相合成肽dk、eek、edqk、seggr、qdsigs。在温度为22℃~28℃和常压下,将fmoc-tyr(tbu)-wangresin加入到多肽固相合成反应器中,加入10ml25%哌啶/dmf溶液脱除氨基保护基fmoc,依次同2倍过量的下一个氨基酸的活化羟基反应延长肽链,缩合过程中采用茚三酮定性显色监测反应进程,直至得到合成所需的目标肽段。选择适当的切割条件将目标多肽从树脂裂解下来并除去侧链保护基,溶液经旋蒸后,加入无水乙醚使多肽沉淀析出,经离心、洗涤和真空干燥,即得到目标肽粗品。
采用高效液相色谱对目标肽的纯度进行分析,色谱条件:色谱柱为gemini-nxc18(4.6×250mm,5μm)色谱柱,进样量20μl;流动相a液为0.1%的三氟乙酸乙腈溶液,流动相b液为0.1%的三氟乙酸水溶液;梯度洗脱方式为2%a+98%b在30min内降为100%a+0%b;流速为1.0ml/min;检测波长为220nm。自动收集洗脱峰。目标肽纯度分别为88%、95%、96%、91%、94%。
采用质谱法对样品进行鉴定。质谱条件为电喷雾电离源(esi),曲型脱溶剂装置(cdl)温度为250℃,加热块(block)温度为200℃,雾化气流速为1.5l/min,探针(probe)电压为+4.5kv。肽dk、eek、edqk、seggr、qdsigs理论分子量分别为216.27da、404.42da、518.51da、504.49da、605.59da。五个样品的质谱分析报告见图4、图5、图6、图7、图8,得到的分子离子峰分别为261.7、405.2、519.3、505.3、606.3,与肽dk、eek、edqk、seggr、qdsigs理论分子量一致,确定样品为目标肽。
最后,还需注意的是,上述实施例是示例性的,不能理解为对本发明的限制,对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围的前提下,还可以做出各种变化、修改、替换和变型,其也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种酶解牦牛骨皮制备小分子量胶原蛋白活性肽的方法
- 一种含有花生短肽的营养饮料的制作方法
- 天然植物复合营养粉的制作方法
- 烟曲霉Asp f 3的线性抗原表位最小基序肽Asp f 3<sup>12-17</sup>及其扩展短肽的制作方法
- 烟曲霉Asp f 3的线性抗原表位最小基序肽Asp f 3<sup>67-72</sup>及其扩展短肽的制作方法
- 一种花生功能性混合短肽及其制备方法
- 一种含短肽的复合型特殊营养食品配方的制作方法
- 烟曲霉Asp f 3的线性抗原表位最小基序肽Asp f 3<sup>35-41</sup>及其扩展短肽的制作方法
- 烟曲霉Asp f 4的线性抗原表位最小基序肽Asp f 4<sup>136-141</sup>及其扩展短肽的制作方法
- 烟曲霉Asp f 4的线性抗原表位最小基序肽Asp f 4<sup>219-226</sup>及其扩展短肽的制作方法