一种海洋真菌-细菌共生体及其代谢产物和在制备抗菌药物中的应用
1.本发明属于生物技术领域,具体涉及一株大亚湾来源的真菌-细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001及其代谢产物spiromarmycin和在制备抗菌药物或生物农药中的应用。
背景技术:
2.近年来,各大类耐药致病菌迅速产生和蔓延,如耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,mrsa),耐药性高,致病力强,引起全身感染病死率可高达50%以上。目前,mrsa对所有β-内酰胺类抗菌药物、氨基糖苷类、喹诺酮以及大环内脂类抗菌药物形成了耐药性,临床上唯一有效治疗的药物主要是糖肽类抗菌药物,例如被称为“人类最后一道防线”的万古霉素。然而,耐万古霉素肠球菌(vancomycin-resistant enterococcus,vre)、多耐药结核分枝杆菌(multidrug-resistant tuberculosis,mdrmt),以及近年来新出现的被称为“超级细菌”的产ndm-1耐药细菌(新德里-金属-内酰胺酶,new delhi metallo-lactamase)的出现,让我们面临一旦感染,却无药可医的尴尬局面。令人沮丧的是,自20世纪80年代以后,由于通过对潜在药物靶点进行高通量筛选以获得新型抗菌药物越来越困难,新型抗生素的研发速度远远不能满足人们的需求,开发新型抗生素显得尤为紧迫。
3.此外,随着有机化学农药的过度使用,不仅带来了严重的环境污染以及农药残留等问题,同时,也使得一些常见的植物致病真菌耐药性的出现。据报道,全世界农业生产上,病原真菌引起的植物病害造成的损失占总产量的10%~20%,一些由卵菌引起的疫霉病害,甚至可以导致农作物的绝产绝收。令人担忧的是,这些问题呈现慢慢增长的趋势,开发新型杀菌剂变得尤为迫切。已有研究表明微生物代谢产物是新型杀菌剂的潜在重要来源,如从担子菌中分离得到的strobilurins杀菌剂几乎覆盖了全球主要杀菌剂市场。因此,从微生物代谢产物寻找新型杀菌剂,具有一定的可行性。
技术实现要素:
4.本发明的目的在于提供一种从我国南海北部大亚湾海底沉积物中筛选出的,能够产生具有良好生物活性代谢产物的真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001,以及从其液体发酵液中提取得到的化合物spiromarmycin及其制备方法与在制备抗菌药物或生物农药中的用途。
5.本发明的第一个目的是提供一种真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001,该真菌/细菌共生体是从我国南海北部大亚湾海底沉积物中筛选出的,于2019年9月19日保藏于广东省微生物菌种保藏中心(gdmcc),地址:广州市先烈中路100号大院59号楼5楼;邮编:510075,其保藏编号是:gdmcc 60747。
6.本发明的化合物spiromarmycin为一对可以在质子型溶剂中发生互变的一对差向
异构体,分别为spiromarmycin1a与spiromarmycin1b,其结构式如下式所示:
[0007][0008]
因此,本发明的第二个目的是提供对化合物spiromarmycin,即对化合物spiromarmycin 1a或spiromarmycin1b的保护。
[0009]
本发明的第三个目的是提供上述的真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001在制备化合物spiromarmycin1a和/或spiromarmycin1b中的应用。
[0010]
本发明的第四个目的是提供一种化合物spiromarmycin(spiromarmycin1a与spiromarmycin1b)的制备方法,其是从真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001的发酵产物中分离获得的。
[0011]
具体步骤如下:
[0012]
1)将真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b00接种到马铃薯葡萄糖水培养基(pdb)中,于摇床上,在180~200rpm(较佳为200rpm)、27~30℃(较佳为28℃)条件下培养2~3天作为种子液;
[0013]
2)将步骤1)所得种子液接种于装有200~400ml pdb培养基(200ml较佳)的1l摇瓶中,接种量为30~100ml(较佳为50ml),于摇床上,在180~200rpm(较佳为200rpm)、27~30℃(较佳为28℃)条件下发酵5~8天(较佳为7天),得到发酵产物;
[0014]
3)将步骤2)所得发酵产物于3900rpm离心取上清液或用两层纱布过滤取滤液,将上清液或滤液用丁酮萃取,真空浓缩(负压为100mpa,温度为40℃,干燥50~60min)干燥得到深棕色粗浸膏;
[0015]
4)对步骤3)所得的浸膏进行硅胶柱层析分段,采用氯仿/甲醇按体积比100:0,98:2,96:4,94:6,92:8,90:10,85:15,80:20,50:50,0:100进行梯度洗脱,得到10个洗脱部分f1-f10;
[0016]
5)将氯仿/甲醇按体积比96:4洗脱得到的f3部分浓缩(负压为100mpa,温度为40℃,干燥50~60min),然后进行凝胶柱层析分离、过滤、于甲醇中重结晶纯化后得到化合物spiromarmycin。
[0017]
本发明的第五个目的是提供上述的化合物spiromarmycin在制备抗菌药物(含生物农药)中的应用,如抗细菌或真菌的药物。
[0018]
本发明的第六个目的是提供一种细菌或真菌的药物,其含有上述化合物spiromarmycin作为活性成分。
[0019]
优选,所述的细菌包括多耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus),对多耐铜绿假单胞菌(pseudomonas aeruginosa),藤黄微球菌
(micrococcus luteus),草芽孢杆菌(bacillus subtilis),鲍曼不动杆菌(acinetobacter baumannii),金黄色葡萄球菌(staphylococcus aureus),耐氧西林表皮葡萄球菌(methicillin-resistant staphycoccus epidermidis)或粪链球菌(enterococcus faecalis)。
[0020]
优选,所述的真菌包括白色念珠菌(candida albicans)、立枯丝核病菌(rhizoctonia solani)、苹果腐烂病菌(valsa mali)、小麦赤霉病菌(gibberella sanbinetti)、茄子辣椒根腐病菌(fusarium spp)、杨树溃疡病菌(dothiorella gregaria)、番茄早疫病菌(altemaria solani)、黄瓜枯萎病菌(fusarium oxysporumf.sp.cucumerinu)、苦瓜枯萎病菌(fusarium oxysporumf.sp.momordicae)、棉花枯萎病菌(fusarium oxysporumf.sp.vasinfectum)、玉米赤霉病菌(gibberella zeae)、玉米小斑病菌(helminthosporium maydis)、番茄灰霉病菌(botrytis cinerea pers)、苹果轮纹病菌(physalospora piricpla nose)、柑橘炭疽病菌(colletot tichum gloeosporioides penz)、苹果炭疽病菌(colletot tichum gloeosporioides)、小麦纹枯病菌(ceratobasidium cornigerum)、小麦根腐病菌(bipolaris sorokiniana)、柑橘绿霉(penicillium digitatum)、辣椒疫霉菌(phytophthora capsici lt1534)、辣椒疫霉菌(phytophthora capsici p35)或辣椒疫霉菌(phytophthora capsici lt263)。
[0021]
与现有技术相比,本发明具有如下有益效果:
[0022]
本发明提供了一株从我国南海北部大亚湾海底沉积物中筛选出的真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001,该共生体能够产生具有较好生物活性的代谢产物,其中在其发酵液丁酮萃取物中分离得到化合物spiromarmycin,该化合物为一对可以互变的差向异构体,对该化合物进行生物活性测试结果表明:化合物spiromarmycin具有很好的抗细菌活性及抗真菌活性,可用于开发新型抗细菌剂以及抗真菌剂。而且该化合物spiromarmycin可以利用微生物进行液体发酵而得,周期短、成本低、工艺简便而且来源可靠。
[0023]
本发明的真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001,于2019年9月19日保藏在广东省微生物菌种保藏中心(gdmcc),保藏编号为gdmcc 60747,保藏单位的地址为:广州市先烈中路100号大院59号楼5楼。
附图说明
[0024]
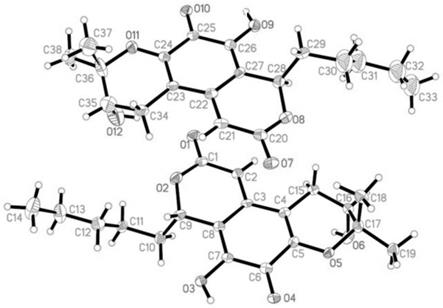
图1是化合物spiromarmycin单晶结构。
[0025]
图2是真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001的菌落形态观察。(a-d):为菌株在isp2平板上形态;(e-h):为菌株在isp4平板上形态;(i-l):为菌株在mea平板上形态。
[0026]
图3是真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001的菌落形态电子扫描显微镜观察。(a-c):为菌株孢子上形态;(d-n):为菌株孢子及孢子形成结构形态;(o):为菌株孢子形态(标尺为0.2μm)。
[0027]
图4是基于5.8s rdna内转录间隔区(its)构建的无根系统发育树。
[0028]
图5是物种间的进化关系图。
[0029]
图6是基于16s rrna构建的无根系统发育树。
具体实施方式
[0030]
下面结合具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
[0031]
实施例1:菌株的分离纯化
[0032]
将取自于我国南海北部大亚湾海底淤泥取适量置于干净的培养皿中,进行风干处理备用(约一周左右)。将风干的海泥和新鲜的海泥取适量置于装有30ml人工海水的250ml三角瓶中(里面可以加入少量玻璃珠),200rpm,28℃摇床摇30min,然后于55℃水浴锅内热激5min备用。用移液枪吸取350μl制备好的海泥样品,均匀涂布于事先准备好的海藻糖培养基(fucose-proline agar)的平板中,该培养基的配方组成为:脯氨酸1g,海藻糖5g,k2hpo
4 1g,mgso4.7h2o 1g,(nh4)2so
4 1g,复合维生素(对氨基苯甲酸,核黄素,叶酸,肌醇,泛酸,vc,vb1,vb6,vb12各50mg,生物素25mg),海盐30g,caco32g,琼脂粉20g,加水至1l,ph 7.0-7.4,其中复合维生素是到平板的时候添加(培养基加入制霉菌素(nys)与甲氧苄氨嘧啶(tmp)抗生素,终浓度均为100μg/ml)。待涂布的平板表面干燥后,放入28℃培养箱进行培养,3~4天观察即可。3~4天观察平板,用牙签或者竹签将长好的菌落在新的isp2培养基平板内(isp2培养基:葡萄糖4g、麦芽粉10g、酵母粉4g,琼脂粉15-20g,海盐30g,加水至1l,ph 7.2-7.4,115℃灭菌30min备用;加入tmp抗生素,终浓度为100μg/ml)划线,纯化三代即可。获得菌落宿主真菌f190(真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001)保存于isp2培养基试管斜面,4℃保存备用。
[0033]
实施例2:菌株的鉴定
[0034]
1、形态学鉴定
[0035]
将获得的培养物宿主真菌f190(真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001)菌饼接种到倒好的isp2、isp4以及mea平板上,28℃黑暗培养,每天定时观察菌落生长形态。利用光学显微镜以及电子扫描显微镜观察产孢结构以及孢子的形态,并测量孢子大小。其生态学特征如图2所示,在isp2培养基上菌落生长较快,28℃黑暗条件下3d菌落直径1.0-3.5mm,菌落初期为白色,后逐渐变成橘黄色,菌落不向外侧扩散生长,形似放线菌(如图2a-d);在isp4培养基上菌落生长较慢,28℃黑暗条件下3d菌落直径较小形同放线菌,菌落初期为白色,后期也会呈现白色,菌落不向外侧扩散生长(如图2e-h);在mea培养基上菌落生长较快,28℃黑暗条件下3d菌落直径1.5-3.5mm,菌落初期为白色,后期也会呈现黄白色,菌落不向外侧扩散生长(如图2i-l)。节孢子呈圆柱形,白色,壁光滑,表面有一层膜包裹。孢子形态为分离的,之间存在有隔膜,圆柱状中间会有轻微凹陷,其大小及直径为2.9-3.0
×
1.4-1.5μm(如图3所示)。经文献比对发现,上述部分形态特征与spiromastix.属的真菌非常类似,因此初步将该菌株归为spiromastix.属内的一个真菌新种。
[0036]
2、菌株分子生物学鉴定
[0037]
将培养4d的新鲜菌体作为dna提取材料,采用新型快速真菌基因组dna提取试剂盒提取菌株基因组dna,1%浓度的琼脂糖凝胶电泳检测纯度。以上述提取的基因组dna为模板,用引物its1(forward):its1(5'-tccgtaggtgaacctgcgg-3'),its4(reverse),its4(5'-tcctccgcttattgatatgc-3')对供试菌株5.8s rdna的its区域进行pcr扩增。反应液体积50μ
l,包括:32.5μl ddh2o,10.0μl 5
×
pcrbuffer,4.0μl dntps,its1、its4各1.0μl,菌株基因组模板1.0μl,0.5μl fastpfu dna聚合酶。pcr反应程序:95℃预变性2min;95℃变性1min,55℃复性1min,72℃延伸0.5min,进行35个循环,最后72℃延伸5min,16℃保存;利用引物1492r(5'-ggttaccttgttacgactt-3')和27f(5'-agagtttgatcctggc-tcag-3')对菌株16s rrna进行pcr扩增,pcr延伸时间改为2min,其他pcr扩增条件如上;利用引物ns1(forward)(5'-gtagtcatatgcttgtctc-3')和ns8(reverse)(5'-tccgcagcttcacctacgga-3')对菌株18s rdna进行pcr扩增,pcr延伸时间改为2min,其他pcr扩增条件如上。pcr产物用1%琼脂糖凝胶测其纯度。pcr扩增产物经检测后送至上海生工生物工程有限公司进行测序。测序引物为its1,测序结果为:真菌/细菌共生体中宿主真菌f190(spiromastix sp.scsio f190)的5.8s rdna的its区域序列见seq id no.1所示,18s rdna的its区域序列见seq id no.3所示;内生细菌b001(alcaligenes faecalis scsio b001)的16s rrna序列见seq id no.2所示。
[0038]
将测序得到的序列通过ncbi数据库(http://blast.cbi.nlm.nih gov/blast)中的核酸序列进行比对以及ezbiocloud数据库中的进行比对。
[0039]
结果发现真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001与已知的真菌(spiromastix princeps以及spiromastix warcupli)具有较大的差异性。其5.8s rdna内转录间隔区(its)序列达到595bp,其blast序列比对覆盖率只有93%与96%,与其亲缘关系较近的spiromastix princeps(nr111109.1)以及spiromastix warcupli(ln867609.1)序列相似性只有97%与90%。真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001的18s rdna序列长度为1873bp,其blast序列比对并未发现与spiromastix princeps、spiromastix warcupli以及同属相关菌株相似的18s rrna序列,反而与已知真菌arachnomyces minimus cbs 32470(fj358342.1)的18s rrna序列具有80%的覆盖率以及94%的相似性,与其他 的菌株相似性则更低。利用ezbiocloud数据库进行比对发现与真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001序列最相似菌株(top-hit strain)为cordyceps cylindrica(nbrc 31180),其最高相似性(top-hit similarity)仅为69.32%,而其completeness值仅为45.70%。以27f,1492r为引物进行pcr,同样获得1.5kb大小的16s rrna片段,对所得dna片段进行测序,发现该细菌的16s rrna与a.faecalis的16s rrna序列达到99%的相似性。
[0040]
在genbank数据库中选取了部分与测定序列相似性较高的代表性基因序列,通过clustal-x软件和mega软件以neibor-joining方法构建系统进化树(见图4),进行系统发育分析。从系统发育树可以看出真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001的18s rdna与spiromastix属的菌株处于同一分支上。此外,分析了菌株的基因组信息,并构建了基因组的系统发育树结果。分支上的数字表示分支可信度,值越接近100表示可信度越高;分支长度表示进化距离的大小,进化距离以平均每个核苷酸的替换次数来计算。从图5中,可以看出spiromastix sp.scsio f190在进化树上位于coccidioides immitis rs与emmonsia crescens uamh4076之间,但不在同一分支,说明了真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001拥有较为独特基因组,属于一个未曾报道过的新菌种。以16s rrna序列进行系统发育树发现,扩
增的16s rrna序列与粪产碱杆菌a.faecalis在树上处于同一分支(图6),证明该培养物极具有真菌生物学特征同时也具有细菌生物学特征。
[0041]
综上并结合其形态学特征,鉴定宿主真菌f190为散囊菌亚纲里的一个潜在新种,将该真菌/细菌共生体命名为spiromastix sp.scsio f190/alcaligenes faecalis scsio b001。该菌株于2019年9月19日保藏于广东省微生物菌种保藏中心,地址:广州市先烈中路100号大院59号楼5楼;邮编:510075,其保藏编号是:gdmcc 60747。
[0042]
实施例3:真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001发酵液的制备
[0043]
于划好的isp2培养基平板中挑取适量的真菌/细菌共生体spiromastix sp.scsio f190/alcaligenes faecalis scsio b001加入装有50ml的pdb培养基中,28℃,200r/min摇床培养2-3天得到种子液。然后进行扩大发酵,50ml种子液全部加到含有200ml pdb培养基的1l锥形瓶中,28℃,200r/min摇床培养7天收集发酵液,将发酵液于3900r/min离心取上清液,即为菌株发酵液备用。
[0044]
备注说明:上述所用pdb培养基为购买于环凯生物技术有限公司的马铃薯葡萄糖水培养基。
[0045]
实施例4:化合物spiromarmycin的提取分离
[0046]
代谢产物的分离:取上述实施例3中所得菌株发酵液(上清液)50l,用等体积丁酮萃取3次,将所得萃取液在旋转蒸发仪中进行浓缩干燥(负压为100mpa,温度为40℃,干燥50~60min),得到黄色油状粗提取物(22.6g)。将粗提取物以硅胶(100-200目)柱层析分离,采用氯仿/甲醇按体积比100:0,98:2,96:4,94:6,92:8,90:10,85:15,80:20,50:50,0:100进行梯度洗脱,每次洗脱的体积为1500ml,得到10个馏分f1-f10。将氯仿/甲醇按体积比96:4洗脱得到的馏分f3(3.3g)进行浓缩(负压为100mpa,温度为40℃,干燥50~60min),然后进行lh-20葡聚糖凝胶柱层析(洗脱剂为甲醇),收集滤液进行浓缩(负压为100mpa,温度为40℃,干燥50~60min),所得馏分于甲醇中重结晶纯化得到化合物spiromarmycin(2.6g)。
[0047]
实施例5:化合物spiromarmycin的结构鉴定
[0048]
化合物spiromarmycin的结构鉴定是基于化合物的质谱、相关核磁共振谱以及x-ray单晶衍射数据(见图1)分析而确定的。
[0049]
光谱学数据如下:
[0050]
表1.化合物spiromarmycin(chloroform-d)1h和
13
c-nmr信号谱
[0051]
[0052][0053]
根据上述数据结果,确认化合物spiromarmycin为一对可以在质子型溶剂中发生互变的一对差向异构体,分别为spiromarmycin1a与spiromarmycin1b,其结构式如下式所示:
[0054][0055]
实施例6:化合物spiromarmycin的抗细菌活性
[0056]
1、滤纸片扩散法:用丙酮溶解所测试的化合物spiromarmycin,配成6mg/ml样液,使用移液枪移取5μl样液于无菌的滤纸片(6mm),夹取滤纸片置于固体lb(lb培养基:蛋白胨10g,酵母粉5g,nacl 10g,琼脂粉15~20g,去离子水1l,121℃灭菌30min备用)培养基中(事先已均匀喷洒供试病菌悬浮液),28℃恒温培养箱培养,16-18h后观察供试病菌生长情况,采用十字交叉法测量供试菌抑菌圈直径。阳性对照为氨苄霉素、环丙沙星、两性霉素b、氟康唑。
[0057]
2、肉汤稀释法:将化合物spiromarmycin以dmso为溶剂配成终浓度为2.56mg/ml的母液,-20℃保藏备用。
[0058]
1)选用mueller-hinton(mh)肉汤培养基培养实验菌。并在实验菌长好之前准备好样品溶液。
[0059]
2)配置样品、阳性对照浓度,阳性对照选用氨苄西林、卡那霉素两种(水溶)。与样品均配置成3200μg/ml,均以dmso溶解。
[0060]
3)用排枪往96孔板中,第1列加92μl无菌mh肉汤,其余各列加入50μl无菌mh肉汤,第11列和第12列(加50μl无菌mh肉汤),分别作为阳性对照和阴性对照,标记后盖上盖子备用。
[0061]
4)吸取8μl(起始浓度为128μg/ml;若起始浓度为64μg/ml需取4μl;起始浓度为32μg/ml需取2μl)事先配好的样品或阳性对照药物,加入第1列。
[0062]
5)将排枪体积设置为50μl,将第1列的测试药物小心上下吸取4-5次,以混合均匀,期间要防止用力过猛溅出。
[0063]
6)从第一列中吸取50μl,加入到对应的第二列中,上下吸取小心4-5次,混匀后再吸取50μl加入第三排。依次类推,直到稀释至第10列。
[0064]
7)从第10列中取出50μl弃掉。
[0065]
8)将一定体积无菌的mh肉汤倒入一个带盖的灭菌平皿中。将过夜培养的菌体用mh肉汤进行1000稀释后,向1-11列每孔加入50μl稀释的实验菌液。此时,第1列至第10列药物浓度分别为128,64、32、16、8、4、2、1、0.5、0.25μg/ml。
[0066]
9)盖上盖子,轻微震荡,置于37℃培养箱进行培养。
[0067]
10)培养16-18小时,第11列做阳性对照,第12列做空白对照,根据对照的结果进行实验结果的观察,确定出每个样品的mic值。
[0068]
11)每个样品做3个平行。
[0069]
表2.化合物spiromarmycin对病原菌的抑制活性
[0070][0071]
[0072]
注:-:无活性;+:有活性;++:活性好;+++:活性非常好(滤纸片法测试活性);
a
以氨苄霉素为阳性对照;
b
以卡那霉素为阳性对照。
[0073]
由于化合物spiromarmycin 1a与spiromarmycin 1b之间存在着互变而且在短时间内就可以互变完全,因此我们测试了混合化合物spiromarmycin的抗菌活性(见表2)。首先我们利用滤纸片扩散法(10μg/disc)对化合物spiromarmycin的抗菌活性进行了初步的筛选,然后测试了其mic,实验结果表明:化合物spiromarmycin对14株s.aureus(包括11株临床分离的耐药菌株以及3株家禽耐药菌株),具有较好的抗菌活性,mic在4.0~64.0μg/ml;对一株家禽耐药菌株s.cohnii dkg4具有活性,mic为64.0μg/ml,对家禽耐药菌株s.simulans aka1在进行滤纸片活性测试时具有较为微弱的活性,测试其mic>128μg/ml;对v.alginolyticus xsbz14具有较好的活性,其mic为32.0μg/ml;对临床来源的耐药菌株e.faecalis(atcc29212)具有较好的活性,其mic为16.0μg/ml,以及一株家禽致病耐药菌株e.faecalis 5f137c,mic在64.0μg/ml,对一株家禽致病耐药菌株e.gallinarum 5f52c具有活性,mic在32.0μg/ml;对四株临床来源的e.faecium具有一定的活性,其mic在16~32μg/ml;对临床耐药菌株m.luteus有较好的活性,mic为8.0μg/ml;对b.thuringiensis有较好的活性,mic为16.0μg/ml。
[0074]
表3.化合物spiromarmycin对candida albicans的抑菌活性
[0075][0076][0077]
注:-:无活性;+:有活性;++:活性好;+++:活性非常好(滤纸片法测试活性);
a
以两性霉素b为阳性对照;
b
以氟康唑为阳性对照。
[0078]
活性测试结果表明:化合物spiromarmycin对不同来源的白色念珠菌具有较好的
活性,具体活性结果见表3。化合物spiromarmycin对耐药标准菌株c.albicans atcc96901(mic=16.0μg/ml);以及对3株临床来源耐药菌c.albicans(173202375:mic=2.0μg/ml;174105146:mic=1.0μg/ml;173202416:mic=2.0μg/ml)与阳性对照活性相当。
[0079]
实施例7:化合物spiromarmycin的抗真菌活性
[0080]
将化合物spiromarmycin溶于丙酮,配成浓度为500μg/ml,250μg/ml,100μg/ml,50μg/ml,10μg/ml,1μg/ml稀释液母液。分别吸取1ml母液与9ml mea培养基(配方:麦芽20g,蔗糖20g,琼脂20g,蛋白胨1g,蒸馏水1l,ph 7.0)于无菌试管中,充分振摇后倒入无菌培养皿中,使培养基中化合物spiromarmycin的最终质量浓度为母液的十分之一,以等量丙酮作为空白对照,以放线菌酮、甲霜灵、烯酰吗啉为阳性对照。将活化的植物致病真菌用无菌打孔器打成直径为5mm的菌块,置于上述培养基,每处理重复3次,培养4~5天后,采用十字交叉法测量供试菌菌落直径。按如下公式计算抑制率:抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-5mm)
×
100%。
[0081]
表4.化合物spiromarmycin对植物病原的ic
50
值(μg/ml)
[0082][0083]
a
值表示三次重复的平均值
±
标准差;
b
以放线菌酮为阳性对照;
c
nt未进行测试。
[0084]
化合物spiromarmycin对辣椒疫霉菌(p.capsici)具有较好的活性,化合物spiromarmycin对辣椒疫霉菌p.capsici(lt1534、p35以及lt263)的ic
50
分别为8.1,4.5,1.5μg/ml。另外实验结果表明,两株辣椒疫霉菌(lt1534、lt263)对阳性对照甲霜灵具有一定的耐药性,然而化合物spiromarmycin对这个两个菌活性要远远好于阳性对照甲霜灵。烯酰吗啉活性要好于化合物spiromarmycin和甲霜灵的活性。其中甲霜灵对辣椒疫霉菌p.capsici(lt1534、p35以及lt263)的ic
50
分别为38.7,1.4,11.1μg/ml;烯酰吗啉对辣椒疫霉菌p.capsici(lt1534、p35以及lt263)的ic
50
分别为0.09,0.6,0.5μg/ml。化合物spiromarmycin对r.solani(ic
50
=3.2μg/ml),v.mali(ic
50
=4.3μg/ml),g.sanbinetti(ic
50
=5.7μg/ml),fusarium spp(ic
50
=8.1μg/ml),a.solani(ic
50
=1.2μg/ml),b.cinerea pers(ic
50
=17.1μg/ml),c.tichum gloeosporioides penz(ic
50
=3.5μg/ml),c.tichum gloeosporioides(ic
50
=1.8μg/ml),以及c.cornigerum(ic
50
=1.7μg/ml),菌具有较好的活性而且与阳性对照放线菌酮活性相当ic
50
分别为0.3,0.3,3.3,2.6,4.4,28.8,1.9,0.8以及0.02μg/ml。具体结果见表4。
[0085]
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1