基于浮萍研究细菌功能的方法与流程
本发明涉及水生环境细菌功能研究领域,具体而言,涉及一种基于浮萍研究细菌功能的方法。
背景技术:
浮萍是一种小型的浮水植物,喜生于富含微量元素以及有机质的静水水域,如稻田、湖泊、池沼等。浮萍的广布范围较广,从温带到热带区域均有分布,极少数也能在极端气候条件下生存。浮萍的繁殖速率几乎接近指数增长,在最佳生长条件下其生物量约2~4天可翻一倍。浮萍自身具有体积小、生长速率快、氮磷吸收能力强等较多的优点。浮萍基因组已完成测序,与模式植物拟南芥(arabidopsisthaliana)基因组(130mb)大小相似。因浮萍基因组较小、结构简单、重复序列少、营养繁殖、遗传周期短(营养条件良好的情况下约30h繁殖一代)、易于采集与培养等优点,是植物模式系统的理想材料,便于植物生长发育、生理病理、基因组学与分子遗传进化等研究工作。
近年来,浮萍与微生物的互作研究发现,浮萍微生物能够促进浮萍生长速率、增加生物量、提高叶绿素含量、加快富营养化水体氮磷的吸收、降解重金属、促进淀粉和蛋白质含量等。但多数研究对浮萍接种细菌时,接种的浮萍因自身含有微生物,接种菌可能与宿主微生物相互作用,或竞争或互利,因而获得的促生结果不能完全总结为接种菌的作用效果。目前,多数研究植物与微生物互作是以模式植物拟南芥来开展,将拟南芥种子灭菌,获得无菌拟南芥来研究单一菌株或构建的菌群对其作用影响。尚缺乏以“水生模式植物”浮萍,来开展水生环境细菌功能的研究。
技术实现要素:
本专利旨在提供一种基于无菌浮萍植物体系,通过分离自水生植物的细菌及构建的菌群,研究其促生长功能的方法。
为了实现本发明的上述目的,特采用以下技术方案:
本发明涉及一种基于浮萍研究细菌功能的方法,包括如下步骤:
1)提供无菌浮萍:将浮萍经过清洗及灭菌处理,将浮萍转移至含有抗生素和蔗糖的1/2sh培养基中培养4~10天后,带核实确认浮萍充分灭菌后再于2×sh培养液中扩大培养;
2)将待检测的细菌与所述无菌浮萍于1/2sh培养基共培养;
3)检测感兴趣的浮萍-微生物互作生理指标。
本发明建立一种基于“水生模式植物”浮萍的细节功能研究体系,能够帮助研究细菌的防病促生机理,对宿主植物是否致病以及微生物与植物建立的共生关系、它们之间的相互作用如何等问题,能够帮助开展水生环境细菌功能的研究,使农业生产系统向具更高水平的生物多样性和更稳定的自我调节机制方向发展。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
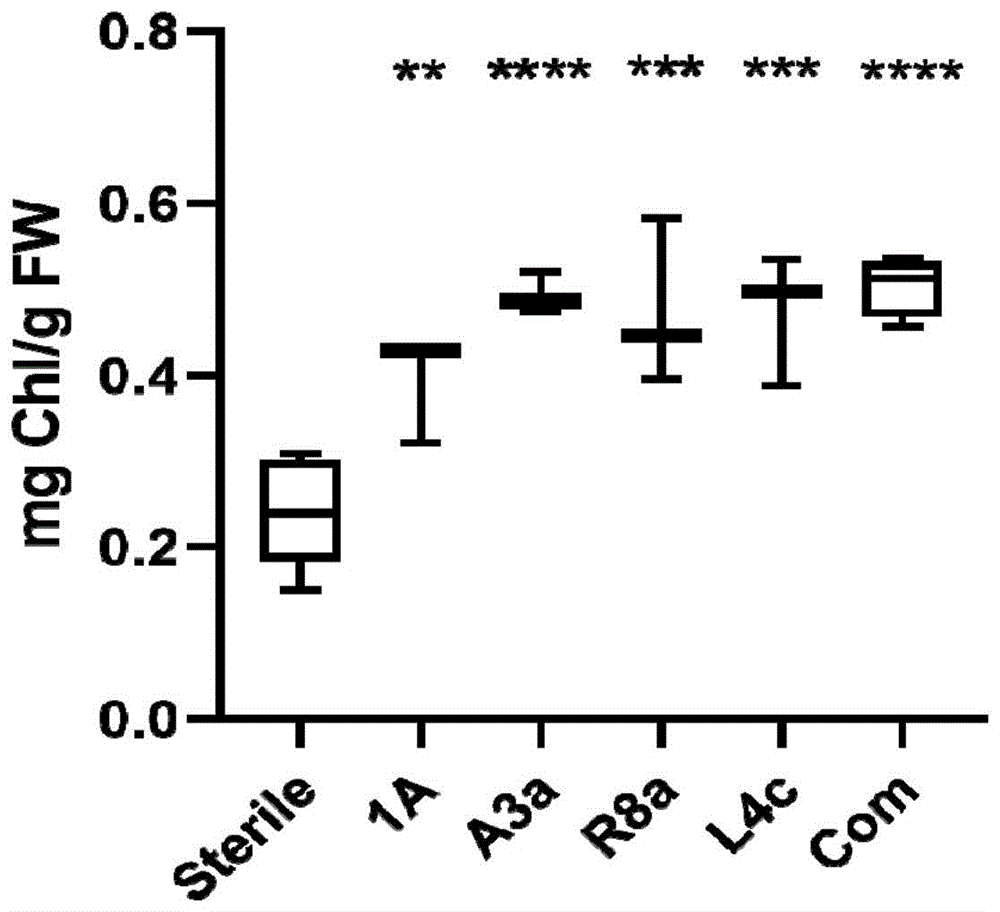
图1为本发明一个实施例中细菌对浮萍的生长促进影响结果图;sterile:无菌浮萍;1a:阳性对照;a3a、r8a和l4c:从浮萍分离的细菌菌株;com:三种细菌构成的菌群;p-value≤0.01=**,p-value≤0.001=***,p-value≤0.0001=****。
具体实施方式
现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
因此,旨在本发明覆盖落入所附权利要求的范围及其等同范围中的此类修改和变化。本发明的其它对象、特征和方面公开于以下详细描述中或从中是显而易见的。本领域普通技术人员应理解本讨论仅是示例性实施方式的描述,而非意在限制本发明更广阔的方面。
本发明涉及一种基于浮萍研究细菌功能的方法,包括如下步骤:
1)提供无菌浮萍:将浮萍经过清洗及灭菌处理,将浮萍转移至含有抗生素和蔗糖的1/2sh培养基中培养4~10天后,带核实确认浮萍充分灭菌后再于2×sh培养液中扩大培养;
2)将待检测的细菌与所述无菌浮萍于1/2sh培养基共培养;
3)检测感兴趣的浮萍-微生物互作生理指标。
植物与微生物的相互作用是近年来微生物学研究的新热点,通过了解植物与根际微生物、叶围微生物和内生菌的相互作用,以及菌体所产生的多种生物学效应,使微生物更好的适应生存环境,有效的利用微生物的促生机制以及对植物病害的生物防治作用,对于提高农作物的产量和品质具有重要的实践意义。同时,植物与微生物的互作在提高植物对营养物质的吸收和防病方面的积极作用,使人们对微生物发展低投入高产出的生态农业充满希望。本发明以浮萍为模式生物建立了水生环境细菌的研究体系,能够促进水生环境细菌与水生植物互作的相关研究。
在一些实施方式中,所述清洗包括无菌水和/或盐溶液清洗;
所述盐溶液包括以下组分:
127mm~147mmnacl,1.7mm~3.7mmkcl,5mm~15mmna2hpo4,1.3mm~2.3mmkh2po4,0.3mm~0.7mmmgso4,0.7mm~1.3mmcacl2,0.07%~0.13%(v/v)triton-x100,且所述盐溶液ph=7.0~7.8。
在一些实施方式中,所述盐溶液包括以下组分:
132mm~142mmnacl,1.9mm~3.5mmkcl,8mm~12mmna2hpo4,1.5mm~2.1mmkh2po4,0.4mm~0.6mmmgso4,0.9mm~1.1mmcacl2,0.08%~0.12%(v/v)triton-x100,且所述盐溶液ph=7.2~7.6。
在一些实施方式中,所述灭菌处理的条件包括使用3%~7%(g/100ml)次氯酸盐洗涤1.5min~2.5min。
在一些实施方式中,所述灭菌处理的条件包括使用4%~6%(g/100ml)次氯酸盐洗涤1.7min~2.3min。
在一些实施方式中,所述次氯酸盐为次氯酸钠。
次氯酸钠溶液有强氧化性,同时是强碱性,虽可用来杀菌消毒,但对植物有破坏作用,因而消毒浓度和时间应当适宜。
在一些实施方式中,所述核实确认浮萍充分灭菌的方法为:
将浮萍置于细菌培养基上,24℃~32℃培养12h~24h后,若浮萍周围无菌落产生,则代表浮萍充分灭菌。
在一些实施方式中,所述抗生素为头孢噻亏。
在一些实施方式中,所述抗生素的浓度为0.08%~0.12%(g/100ml),所述蔗糖的浓度为0.3%~0.7%(g/100ml)。
在一些实施方式中,步骤2)中,所述待检测的细菌在共培养时的菌液od600=(0.1~0.3)。
在一些实施方式中,在步骤2)中,同时设置空白对照和/或阳性对照;
所述空白对照未加入菌液;
所述阳性对照加入有已知功能的菌液。
空白对照和阴性对照可根据本领域技术人员的常规技能进行选择与设置。
在一些实施方式中,所述待检测的细菌为分离自水生植物的细菌。
在一些实施方式中,所述互作生理指标选自浮萍的下列指标中的一种或多种:
生长速率、生物量、叶绿素含量、水体氮磷的吸收速率、降解重金属速率、淀粉含量以及蛋白质含量。
下面将结合实施例对本发明的实施方案进行详细描述。
实施例1
1.构建无菌浮萍体系
将采集的浮萍lm370置于无菌水中洗涤3-4次,取10片左右浮萍于5ml灭菌的盐溶液(137mmnacl,2.7mmkcl,10mmna2hpo4,1.8mmkh2po4,0.5mmmgso4,1mmcacl2,0.1%triton-x100,ph7.4)洗涤20min,弃上清。加入5ml5%次氯酸钠洗涤2min,再用无菌水冲洗2-3次。将浮萍转移至植物培养基(1/2sh+0.5%蔗糖+0.1%头孢噻亏),其中sh是schenk&hildebrandtbasalsaltmixture植物培养基的缩写。待浮萍在培养基上生长7天后,将浮萍置于lb(牛肉膏蛋白胨)细菌培养基上,28℃培养箱过夜观察,若浮萍周围无菌落产生,则代表浮萍充分灭菌。此时,将一些无菌浮萍lm370转移至1l灭菌的2×sh培养液中,再放置于恒温培养室中扩大培养2-3周左右,扩大浮萍生物量,构建稳定的无菌浮萍体系。
2.基于无菌浮萍研究细菌功能
首先,准备接种细菌。
day1,将菌株接种在5mllb培养液中,28℃恒温培养箱,250rpm摇床过夜培养。
day2,从day1的细菌培养液中,取出500μl至50mllb培养液扩大培养,培养条件同day1。
day3,从day2的细菌培养液中,取出25ml于灭菌的离心管中,4℃低温8,000rpm离心5min。弃上清后,加25ml无菌水混匀沉淀物,4℃低温8,000rpm离心5min,弃上清,重复此步骤。加入25ml0.5×sh灭菌溶液混匀,用分光光度计读取细菌溶液在600nm处的吸光值,然后稀释菌液至od600=0.2/50ml。将50ml溶于0.5×sh的菌液倒入无菌瓶中,再将提前培养好的无菌浮萍植物lm370转移至菌液瓶内,覆盖菌液表面即可。
另外,设置50ml1/2sh灭菌溶液倒入无菌瓶中,加入同样数量的浮萍,做空白对照;同时,用1/2sh稀释菌液至od600=0.2/50ml的细菌菌株a3a(pantoeaspp.)、r8a(bacillusspp.)、l4c(acinetobacterspp.)以及三种菌株的等量混合液com(细菌菌株a3a、r8a、l4c为从浮萍分离的细菌菌株),也分别加入无菌浮萍,做阳性对照。然后,将实验组和对照组浮萍转移到恒温培养室中培养。
培养两周后,将各瓶中的0.5×sh溶液吸出,倒入适量无菌水,冲洗浮萍表面残留的菌液并倒出,于吸水纸上干燥,称量浮萍鲜重记为fw。并检测叶绿素含量:将浮萍样品放入装有玻璃珠的离心管中,加入1ml80%丙酮,于组织研磨仪1,200rpm速度下研磨10min。将研磨液转移至新的离心管中,16,000rpm离心10min。取上清液,用紫外分光光度计分别测其在od645nm和od663nm的吸收值。通过公式chl(mg/g)=0.0202od645+0.00802od663测得浮萍叶绿素浓度记为chl,进而通过chl/fw得到单位重量上浮萍样品的叶绿素含量。实验重复三次,数值记录见表1。分析结果见图1。
表1接种细菌后的单位重量浮萍的叶绿素含量
从上表可知,从浮萍分离的细菌菌株a3a、r8a、l4c也同样具有增强单位重量浮萍的叶绿素含量的能力。
实施例2
实施例2与实施例1大致相同,区别在于步骤1中的参数发生一些变动:
1.构建无菌浮萍体系
将采集的浮萍lm370置于无菌水中洗涤3-4次,取10片左右浮萍于5ml灭菌的盐溶液(147mmnacl,1.7mmkcl,15mmna2hpo4,1.3mmkh2po4,0.7mmmgso4,1.3mmcacl2,0.07%(v/v)triton-x100,且所述盐溶液ph=7.0)洗涤15min,弃上清。加入5ml3%次氯酸钠洗涤2.5min,再用无菌水冲洗2-3次。将浮萍转移至植物培养基(1/2sh+0.7%蔗糖+0.09%头孢噻亏)。待浮萍在培养基上生长10天后,将浮萍置于lb(牛肉膏蛋白胨)细菌培养基上,28℃培养箱过夜观察,若浮萍周围无菌落产生,则代表浮萍充分灭菌。此时,将一些无菌浮萍lm370转移至1l灭菌的2×sh培养液中,再放置于恒温培养室中扩大培养2-3周左右,扩大浮萍生物量,构建稳定的无菌浮萍体系。
实施例3
实施例3与实施例1大致相同,区别在于步骤1中的参数发生一些变动:
1.构建无菌浮萍体系
将采集的浮萍lm370置于无菌水中洗涤3-4次,取10片左右浮萍于5ml灭菌的盐溶液(127mmnacl,3.7mmkcl,5mmna2hpo4,2.3mmkh2po4,0.3mmmgso4,0.7mmcacl2,0.13%(v/v)triton-x100,且所述盐溶液ph=7.8)洗涤12min,弃上清。加入5ml7%次氯酸钠洗涤1.5min,再用无菌水冲洗2-3次。将浮萍转移至植物培养基(1/2sh+0.3%蔗糖+0.12%头孢噻亏)。待浮萍在培养基上生长4天后,将浮萍置于lb(牛肉膏蛋白胨)细菌培养基上,28℃培养箱过夜观察,若浮萍周围无菌落产生,则代表浮萍充分灭菌。此时,将一些无菌浮萍lm370转移至1l灭菌的2×sh培养液中,再放置于恒温培养室中扩大培养2-3周左右,扩大浮萍生物量,构建稳定的无菌浮萍体系。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!