一种利用超声辅助-复合酶提取海藻酸钠的工艺的制作方法
本发明涉及海藻酸钠提取领域,具体涉及一种利用超声与复合酶结合的方法从海带中提取海藻酸钠的方法。
背景技术:
海带(saccharinajaponica)别名昆布,属于褐藻门(phaeophyta)褐藻纲(phaeophyceae)海带目(laminariales)海带科(laminariaceae)海带属(laminaria),是一种生长在低温海水中的大型褐藻植物,参照文献1:钱树本,刘东燕,孙军.海藻学[m].青岛:中国海洋大学出版社:2005,2-6.。海带具有丰富的食用和药物价值,在我国海水养殖产业中占有重要地位。目前我国海带的人工养殖规模与产量均居世界首位,参照文献2:金振辉,刘岩,张静,宫庆礼,崔竞进,刘涛.中国海带养殖现状与发展趋势[j].海洋湖沼通报,2009(01):141-150。海带中的主要活性物质是海带多糖,参照文献3:赵瑞希.海藻多糖提取、纯化及其补体结合活性的研究[d].哈尔滨工业大学,2015,研究表明,海带多糖具有良好的凝胶型、稳定性、成膜性,并且在抗病毒、抗氧化、抗肿瘤、免疫调节、降血糖等方面也有着独特的药用价值,参照文献4:xuezhao,chang-huxue,ba-fangli.studyofantioxidantactivitiesofsulfatedpolysaccharidesfromlaminariajaponica[j].journalofappliedphycology,2008,20(4),即赵雪,薛长湖,李八方.海带硫酸盐多糖抗氧化活性的研究[j].应用植物学报,2008,20(4);文献5:beibeiren,chunchen,chaoli,xiongfu,lijunyou,ruihailiu.optimizationofmicrowave-assistedextractionofsargassumthunbergiipolysaccharidesanditsantioxidantandhypoglycemicactivities[j].carbohydratepolymers,2017,173,即任蓓蓓,陈春,李超,扶雄,游丽君,刘瑞海.微波辅助提取马尾藻多糖及其抗氧化和降血糖活性[j].碳水化合物聚合物,2017,173。目前,研究海带多糖的提取工艺已成为开发利用海洋生物质资源的重要课题之一。
海藻酸钠(sodiumalginate,ags),又称褐藻胶或褐藻酸钠,是一类从海带或马尾藻等褐藻类中提取出来的天然多糖,参照文献6:马和庆,田栋.海藻酸钠及其提取方法的研究现状[j].山东食品发酵,2014(02):39-40,其分子式为(c6h7o6na)n。海藻酸钠是由α-l-古罗糖醛酸(α-l-guluronicacid,g)与其同分异构体β-d-甘露糖醛酸(β-d-mannuronicacid,m)通过1-4糖苷键连接而成的,其连接方式有mm、gg、mg三种形式,参照文献7:;sherryxci,tanyahhuynh,lesliewlouie,andrewyang,bridgetjbeals,nileshron,wen-ghihtsang,patricksoon-shiong,neilpdesai.molecularmassdistributionofsodiumalginatebyhigh-performancesize-exclusionchromatography[j].journalofchromatographya,1999,864(2),即sherryxci,tanyahhuynh,lesliewlouie,andrewyang,bridgetjbeals,nileshron,wen-ghihtsang,patricksoon-shiong,neilpdesai.高效排阻色谱法分析海藻酸钠的分子量分布[j].色谱学报,1999,864(2).文献8:gomezcésarg,pérezlambrechtmaríav,lozanojorgee,rinaudomarguerite,villarmarceloa.influenceoftheextraction-purificationconditionsonfinalpropertiesofalginatesobtainedfrombrownalgae(macrocystispyrifera).[j].internationaljournalofbiologicalmacromolecules,2009,44(4),即gomezcésarg,pérezlambrechtmaríav,lozanojorgee,rinaudomarguerite,villarmarceloa.提取纯化条件对褐藻藻类藻酸盐最终性质的影响[j].国际生物大分子杂志,2009,44(4).纯品海藻酸钠为白色或淡黄色粉末,无毒、无味,易溶于水,不溶于乙醇、乙醚、氯仿等有机溶剂。溶于水成粘稠胶体溶液,且易与蛋白质、淀粉、果胶、阿拉伯胶、丙三醇及山梨醇等共混,不溶于ph小于3的稀酸,参照文献9:寇伟姣,刘军海.海藻酸钠提取工艺的研究进展[j].化工科技市场,2009,32(03):14-16;文献10:王孝华.海藻酸钠的提取及应用[j].重庆工学院学报(自然科学版),2007(05):124-128。随季节和生长条件的变化,海藻酸钠在海带中的含量可达海带干重的25%~30%,参照文献11:詹冬梅,王翔宇,辛美丽,吕芳,吴海一.三种马尾藻的营养组成分析[j].广西科学院学报,2016,32(03):221-225,因而以海带为原料提取海藻酸钠具有良好的发展前景。
目前,钙凝-离子交换法已成为提取海带中海藻酸钠的一种新型工艺方法,参照文献12:黄攀丽,沈晓骏,陈京环,吴玉英,孙润仓.海藻酸钠的提取与功能化改性研究进展[j].林产化学与工业,2017,37(04):13-22;文献13:孝华.海藻酸钠的提取及应用研究[d].重庆大学,2004.,但由于在前处理过程中仍采用传统工艺中的酸提法与醛提法,不仅容易导致海藻酸钠降解严重,使产品粘度降低,还会对环境造成严重的污染,参照文献14:权维燕,杨子明,李思东,夏延致,王兵兵,李普旺.海藻酸钠的提取研究进展[j].山东化工,2018,47(19):56-59。因而近年来,在钙凝-离子交换法的基础上,又逐渐发展了以酶解或超声处理代替有机体系浸泡的酶解法和超声法,参照文献15:雷雨.基于生物酶提取海藻酸钠及其纤维制备[d].大连工业大学,2013;文献16:杨晓雪.海带多糖综合提取纯化工艺的研究[d].山东农业大学,2017。
以往的酶解法多采用单一酶,参照文献17:宋彦显,闵玉涛,张秦,马庆一.海带中海藻酸钠的提取及纯化工艺优化[j].食品科技,2015(06):289-293;文献18:杨红霞,李博,窦明.酶解法提取海藻酸钠研究[j].安徽农业科学,2007(12):3661-3662;文献19:马成浩,刘陆游,于丽娟,彭奇均.纤维素酶提取海藻酸钠的研究[j].广州食品工业科技,2004(04):12-14,因其生产成本高、工艺周期长且纯度不高而未能大量用于生产;而超声法则因鲜少专门用于海藻酸钠的提取,工艺方法尚未成熟,参照文献20:王瑞芳,谢远红.超声波辅助提取海带多糖及其脱色研究[j].江苏农业科学,2013,41(06):248-249;文献21:林国荣,姚剑瑞.海带多糖的超声波辅助提取及果冻的研制[j].食品工业,2015,36(02):54-57。且这两种方法目前多为单独使用,并未将其有效结合。
技术实现要素:
为了克服传统海带中提取海藻酸钠方法中存在的缺点,本发明提供一种在钙凝-离子交换法的工艺基础上,采用超声波辅助-复合酶法进行前处理,不仅优化了工艺流程、提高了海藻酸钠的纯度与产率、缩短了生产周期,还大大降低了对环境的污染,通过减少工艺流程中酸和碱的用量,也有助于生产成本的降低。
本发明解决其技术问题所采用的技术方案是:
一种利用超声辅助-复合酶提取海藻酸钠的工艺,包括以下步骤:
第一步,海带超声预处理
清洗晾干的海带用药物粉碎机粉碎成50-150目的粉末备用;
取干海带加入蒸馏水室温下浸泡1-2h,超声作用20-50mim,超声功率为100-200w,再静置;
第二步,海带酶解
将预处理的海带溶液中加入一定比例的纤维素酶、果胶酶酶、蛋白酶,然后加入磷酸盐缓冲溶液控制体系ph至4-6,40℃-60℃下酶解保温,然后90℃,保持5min使酶失活;
第三步,消化处理
加入溶液质量2%-4%的碳酸钠,调节ph至9-11,40℃-60℃进行碱消化,得到糊状粘稠液体。离心过滤,取上层清液;
第四步,脱色处理
滤液调节ph至4-6,加入10%-30%双氧水5-20ml,40℃-60℃脱色,离心过滤取上层清液;
第五步,钙凝处理
加入质量5%-20%氯化钙,立刻产生大量的海藻酸钙凝胶,呈白色,带有淡淡的黄绿色,静置后过滤,滤渣用蒸馏水洗涤过滤2遍至无氯化钙残留;
第六步,离子置换
滤渣中加质量10%-20%氯化钠100ml-200ml,大块的团状凝胶沉淀在溶液中渐渐地变成小块分散絮状凝胶,40℃-60℃静置,至块状沉淀凝胶全部转化为分散的絮状凝胶,可以判断海藻酸钙在氯化钠溶液中发生了离子交换作用,且全部转换成了海藻酸钠,离心过滤取滤渣;
第七步,提纯海藻酸钠
滤渣加入无水乙醇脱水,静置;溶液中出现大量絮状固形物;抽滤取滤渣再次加入无水乙醇超声清洗,抽滤去滤渣,重复超声清洗步骤,抽滤后可以得大量白色硬胶质状物体,40℃-60℃真空干燥,粉碎得白色粉末状的海藻酸钠成品。
进一步,所述步骤一中,利用超声对海带粉末进行预处理,超声处理有利于破坏海带中细胞的表观结构,提高了海藻酸钠的提取率。
再进一步,所述步骤二中,加入纤维素酶、果胶酶酶和蛋白酶,利用复合酶提取的方法解决了传统生产工艺通过有机体系浸泡后再消化,耗能耗水量大,溶剂排放还会造成环境危害等问题,更加环保绿色。其中三种酶总重量为海带重量的百万分之十~百万分之一百,其中各酶占总酶用量的重量百分比为
纤维素酶43wt%
果胶酶酶43wt%
蛋白酶14wt%。
本发明通过超声与复合酶结合的方法对海带进行处理,然后通过钙凝法提取海藻酸钠的方法,提取出海藻酸钠粘度高。
本发明以海带为原料,在钙凝-离子交换法的工艺基础上,采用超声波辅助-复合酶法进行前处理,代替传统工艺中用酸和醛来浸泡海带,不仅优化了工艺流程、提高了海藻酸钠的纯度与产率、缩短了生产周期。通过减少工艺流程中酸和碱的用量,大大降低了对环境的污染,也有助于生产成本的降低。致力于优化从海带中提取海藻酸钠的工艺流程,有助于进一步提高海藻酸钠的纯度及产率,有望为海藻酸钠的工业生产和后续的产品附加值提升提供更好的思路与帮助。
本发明的有益效果主要表现在:1、缩短了生产周期。2、解决了有机溶剂排放导致的环境污染问题,更加环保绿色。3、通过减少工艺流程中酸和碱的用量,大大降低了对环境的污染,也有助于生产成本的降低。
附图说明
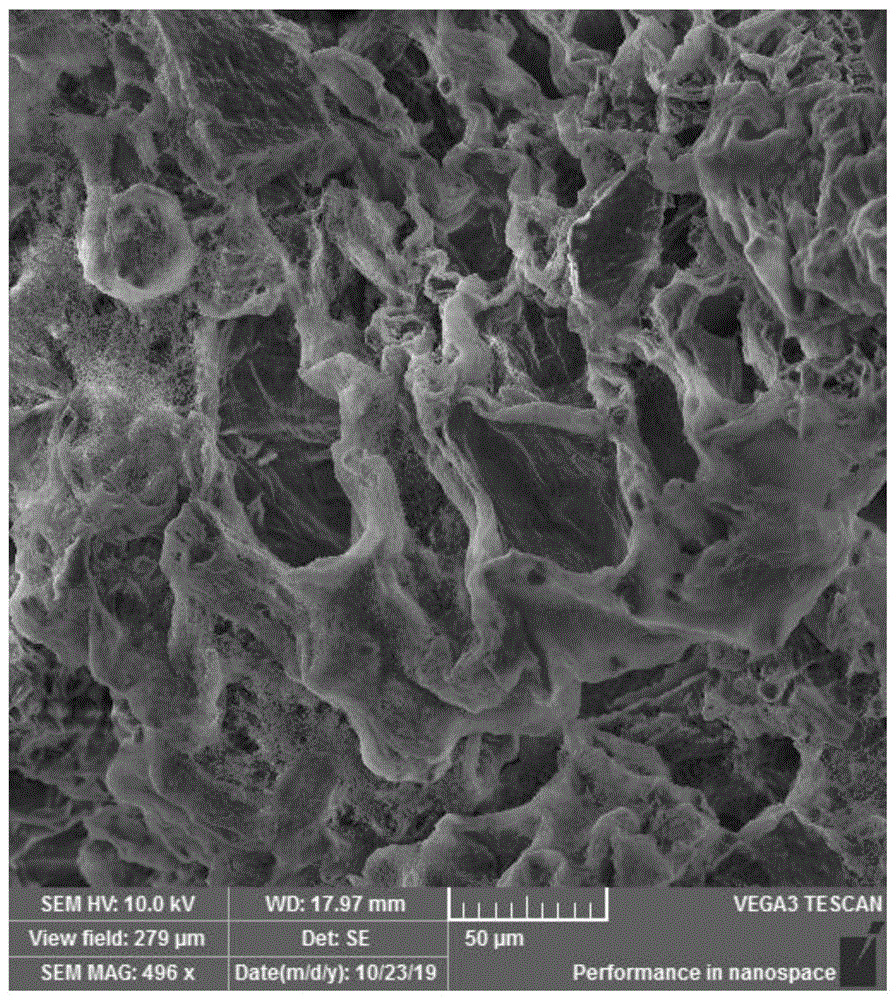
图1是60目海带粉末经超声后残渣微观结构;
图2是120目海带粉末经超声后残渣微观结构;
图3是未经超声的海带粉末残渣微观结构。
具体实施方式
下面结合附图对本发明作进一步描述。
实施例1
一种利用超声辅助-复合酶提取海藻酸钠的工艺,包括以下步骤:
第一步,海带超声预处理
清洗晾干的海带用药物粉碎机粉碎成60目的粉末备用。
取10g干海带加入200ml蒸馏水室温下浸泡1h,超声作用30mim,超声功率为150w,再静置1h。
第二步,海带酶解
将预处理的海带溶液中加入0.3g纤维素酶、0.3g果胶酶酶、0.1g蛋白酶,然后加入磷酸盐缓冲溶液控制体系ph=5,50℃下酶解保温18小时。然后90℃,保持5min使酶失活。
第三步,消化处理
加入溶液质量2%的碳酸钠,调节ph=11,50℃保持4h进行碱消化,得到糊状粘稠液体。离心过滤20min(4000n/min),取上层清液。
第四步,脱色处理
滤液调节ph至6,加入30%双氧水15ml,50℃脱色12h,离心过滤取上层清液。
第五步,钙凝处理
加入质量10%氯化钙,立刻产生大量的海藻酸钙凝胶,呈白色,带有淡淡的黄绿色,静置2h后过滤,滤渣用蒸馏水洗涤过滤2遍至无氯化钙残留。
第六步,离子置换
滤渣中加质量15%氯化钠150ml,大块的团状凝胶沉淀在溶液中渐渐地变成小块分散絮状凝胶,50℃静置3h,至块状沉淀凝胶全部转化为分散的絮状凝胶,可以判断海藻酸钙在氯化钠溶液中发生了离子交换作用,且全部转换成了海藻酸钠。离心过滤取滤渣。
第七步,提纯海藻酸钠
滤渣加入无水乙醇脱水。静置3h,溶液中出现大量絮状固形物。抽滤取滤渣再次加入无水乙醇超声清洗30分钟,抽滤去滤渣,重复超声清洗步骤,抽滤后可以得大量白色硬胶质状物体,55℃真空干燥,粉碎得白色粉末状的海藻酸钠成品。
实施例2
一种利用超声辅助-复合酶提取海藻酸钠的工艺,包括以下步骤:
第一步,海带超声预处理
清洗晾干的海带用药物粉碎机粉碎成120目的粉末备用。
取10g干海带加入200ml蒸馏水室温下浸泡1h,超声作用30mim,超声功率为150w,再静置1h。
第二步,海带酶解
将预处理的海带溶液中加入0.3g纤维素酶、0.3g果胶酶酶、0.1g蛋白酶,然后加入磷酸盐缓冲溶液控制体系ph=5,50℃下酶解保温18小时。然后90℃,保持5min使酶失活。
第三步,消化处理
加入溶液质量2%的碳酸钠,调节ph=11,50℃保持4h进行碱消化,得到糊状粘稠液体。离心过滤20min(4000n/min),取上层清液。
第四步,脱色处理
滤液调节ph=6,加入30%双氧水15ml,50℃脱色12h,离心过滤取上层清液。
第五步,钙凝处理
加入质量10%氯化钙,立刻产生大量的海藻酸钙凝胶,呈白色,带有淡淡的黄绿色,静置2h后过滤,滤渣用蒸馏水洗涤过滤2遍至无氯化钙残留。
第六步,离子置换
滤渣中加质量15%氯化钠150ml,大块的团状凝胶沉淀在溶液中渐渐地变成小块分散絮状凝胶,50℃静置3h,至块状沉淀凝胶全部转化为分散的絮状凝胶,可以判断海藻酸钙在氯化钠溶液中发生了离子交换作用,且全部转换成了海藻酸钠。离心过滤取滤渣。
第七步,提纯海藻酸钠
滤渣加入无水乙醇脱水。静置3h,溶液中出现大量絮状固形物。抽滤取滤渣再次加入无水乙醇超声清洗30分钟,抽滤去滤渣,重复超声清洗步骤,抽滤后可以得大量白色硬胶质状物体,55℃真空干燥,粉碎得白色粉末状的海藻酸钠成品。
实施例3
一种利用超声辅助-复合酶提取海藻酸钠的工艺,包括以下步骤:
第一步,海带超声预处理
清洗晾干的海带用药物粉碎机粉碎成60目的粉末备用。
取10g干海带加入200ml蒸馏水室温下浸泡1h,超声作用20mim,超声功率为100w,再静置1h。
第二步,海带酶解
将预处理的海带溶液中加入0.3g纤维素酶、0.3g果胶酶酶、0.1g蛋白酶,然后加入磷酸盐缓冲溶液控制体系ph=5,50℃下酶解保温18小时。然后90℃,保持5min使酶失活。
第三步,消化处理
加入溶液质量2%的碳酸钠,调节ph=9,40℃保持4h进行碱消化,得到糊状粘稠液体。离心过滤20min(4000n/min),取上层清液。
第四步,脱色处理
滤液调节ph至4,加入30%双氧水5ml,50℃脱色12h,离心过滤取上层清液。
第五步,钙凝处理
加入质量10%氯化钙100ml,立刻产生大量的海藻酸钙凝胶,呈白色,带有淡淡的黄绿色,静置2h后过滤,滤渣用蒸馏水洗涤过滤2遍至无氯化钙残留。
第六步,离子置换
滤渣中加质量5%氯化钠100ml,大块的团状凝胶沉淀在溶液中渐渐地变成小块分散絮状凝胶,50℃静置3h,至块状沉淀凝胶全部转化为分散的絮状凝胶,可以判断海藻酸钙在氯化钠溶液中发生了离子交换作用,且全部转换成了海藻酸钠。离心过滤取滤渣。
第七步,提纯海藻酸钠
滤渣加入无水乙醇脱水。静置3h,溶液中出现大量絮状固形物。抽滤取滤渣再次加入无水乙醇超声清洗30分钟,抽滤去滤渣,重复超声清洗步骤,抽滤后可以得大量白色硬胶质状物体,45℃真空干燥,粉碎得白色粉末状的海藻酸钠成品。
实施例4
一种利用超声辅助-复合酶提取海藻酸钠的工艺,包括以下步骤:
第一步,海带超声预处理
清洗晾干的海带用药物粉碎机粉碎成120目的粉末备用。
取10g干海带加入200ml蒸馏水室温下浸泡5h,超声作用50mim,超声功率为180w,再静置1h。
第二步,海带酶解
将预处理的海带溶液中加入0.3g纤维素酶、0.3g果胶酶酶、0.1g蛋白酶,然后加入磷酸盐缓冲溶液控制体系ph=6,60℃下酶解保温18小时。然后90℃,保持5min使酶失活。
第三步,消化处理
加入溶液质量2%的碳酸钠,调节ph=11,60℃保持4h进行碱消化,得到糊状粘稠液体。离心过滤20min(4000n/min),取上层清液。
第四步,脱色处理
滤液调节ph至6,加入30%双氧水20ml,60℃脱色12h,离心过滤取上层清液。
第五步,钙凝处理
加入质量20%氯化钙100ml,立刻产生大量的海藻酸钙凝胶,呈白色,带有淡淡的黄绿色,静置2h后过滤,滤渣用蒸馏水洗涤过滤2遍至无氯化钙残留。
第六步,离子置换
滤渣中加质量15%氯化钠100ml,大块的团状凝胶沉淀在溶液中渐渐地变成小块分散絮状凝胶,50℃静置3h,至块状沉淀凝胶全部转化为分散的絮状凝胶,可以判断海藻酸钙在氯化钠溶液中发生了离子交换作用,且全部转换成了海藻酸钠。离心过滤取滤渣。
第七步,提纯海藻酸钠
滤渣加入无水乙醇脱水。静置3h,溶液中出现大量絮状固形物。抽滤取滤渣再次加入无水乙醇超声清洗30分钟,抽滤去滤渣,重复超声清洗步骤,抽滤后可以得大量白色硬胶质状物体,45℃真空干燥,粉碎得白色粉末状的海藻酸钠成品。
对比实施例
参考实施例中1的制备步骤,区别在于第一步海带预处理中不利用超声的方法。其余操作步骤和处理步骤相同。
实施例4
一种利用超声辅助-复合酶提取海藻酸钠的工艺,通过扫描电镜对实施例1,实施例2和对比实施例中的海带预处理后的残渣进行观察,实施例1见附图1,实施例2附图2,对比实施例附图3.
由图可知当选用的海带粉末为120目时,其细胞结构破坏最严重,且可以看出未超声处理的海带渣仍有部分区域细胞壁结构较为完整,经超声处理后的海带渣细胞结构破坏更为严重。通过细胞表观结构的比较,验证了超声有利于破坏海带中细胞的表观结构,有利于多糖的溶出,提高了海藻酸钠的提取率。
需要说明的是,以上优选实施例仅为本发明的实施方式更易于理解,而非用以限定本发明。尽管通过上述优选实施例已经对本发明进行了详细的描述,但任何本发明所属技术领域内的技术人员应当理解,可以在实施的形式上及细节上作一定限度的修改与变化,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!