一种促进玉米赤霉烯酮降解酶ZHD518蛋白分泌表达的方法及应用与流程
本发明属于分子生物学技术领域,具体而言,涉及一种促进zhd518蛋白分泌表达的方法及应用。
技术背景
玉米赤霉烯酮(zearalenone,zen)是由一类真菌产生的次级代谢产物。zen是在1962年从有赤霉病的玉米中分离纯化后获得的,具有雌性激素的作用(stobetal.1962)。作为世界上污染范围最为广泛的真菌毒素之一,zen主要的污染谷物包括小麦、玉米、燕麦、水稻等。zen可以直接通过污染谷物进入人和动物体内,造成急慢性中毒,引起动物的生殖异常甚至死亡,给畜牧场带来巨大损失。到目前为止,对于zen降解酶的报道很少,而对于大肠杆菌胞外分泌的降解酶报道就更是少见,虽然毕赤酵母可以胞外分泌但发酵周期长且需要甲醇诱导,这样严重约束了工业生产,所以寻找促胞外分泌表达的方法成为现在急需解决的问题。
zhd518是一种高效率降解zen的酶,该酶可以水解酯键使zen开环而失去毒性。然而,zhd518在大肠杆菌中的表达都为胞内而不分泌到细胞外部,要进行破菌纯化才能得到目的蛋白,严重制约了工业生产的需要,因此迫切需要找到可以促胞外分泌的方法。
技术实现要素:
鉴于zhd518在大肠杆菌中胞外分泌报道很少的情况,以及zhd518表达量较低的问题,本发明提供了一种可以促进zhd518蛋白胞外分泌表达的方法,该方法极大的节约了生产时间和工业成本,同时具有较好的酶活。
为了实现本发明的目的,发明人利用已经报道的信号肽phoa、ompa、pelb,在商品化载体pet-28a的基础上构建一个可以将zhd518分泌表达的载体,并将该分泌表达载体转化到大肠杆菌中,从而得到一种可以分泌表达zhd518的基因工程菌。在深入研究过程中,本发明还发现phoa信号肽相比于pelb、ompa胞外分泌的效果要好很多。之后重点研究了phoa信号肽,发现phoa在28℃、乳糖终浓度10g/l且加入终浓度为0.5%tritonx-100的条件下诱导18-40h的胞外表达量显著提高,其中最高酶活达到86u/ml。
基于上述研究成果,本发明人最终提供了一种信号肽与目标蛋白融合促进表达及初步的诱导优化条件,具体的技术方案概括如下:
一种大肠杆菌高效分泌表达zhd518蛋白的重组表达载体,所述重组表达载体的结构为pet-28a-phoa-zhd518,其中的zhd518的核苷酸序列如seqidno.1所示,phoa的核苷酸序列如seqidno.2所示。
一种分泌表达zhd518蛋白的基因工程菌的构建方法,该方法包含如下步骤:
(1)通过三轮pcr扩增得到phoa-zhd518片段,其中第一轮pcr扩增得到zhd518片段,扩增引物为:
zhd518-f:ctaaggccatggctgcatggctgctactagaaccagaggttac
zhd518-r:ccgctcgagttacttcaggtactttctggaagtc
第二轮pcr扩增得到信号肽phoa片段,扩增引物为:
phoa-f:cgcggatccatgaaacaatcaaccattgcactg
phoa-r:gcagccatggccttagtcaccggagtgaaaa
第三轮pcr扩增得到融合了phoa的zhd518片段,扩增引物为:
phoa-f:cgcggatccatgaaacaatcaaccattgcactg
zhd518-r:ccgctcgagttacttcaggtactttctggaagtc
第三轮通过连接pcr的方式将phoa片段连接于zhd518片段的n端,形成大片段phoa-zhd518;
(2)将步骤(1)中连接好的phoa-zhd518片段经bamhⅰ和xhoⅰ双酶切后,与同样经bamhⅰ和xhoⅰ双酶切后的pet-28a质粒连接,转入克隆菌株,抽质粒送生工测序;
(3)将测序正确的重组质粒转化于表达菌株中,通过抗生素平板筛选后,获得分泌表达zhd518蛋白的基因工程菌。
进一步优选地,如上所述分泌表达zhd518蛋白的基因工程菌的构建方法,其中步骤(1)的pcr反应体系为:
加ddh2o至反应体系为50μl。
进一步优选地,如上所述分泌表达zhd518蛋白的基因工程菌的构建方法,其中步骤(1)的pcr扩增的反应程序为:94℃,3min;94℃,30s,58℃,20s,72℃,30s,25个循环;72℃,5min;4℃,∞。
进一步优选地,如上所述分泌表达zhd518蛋白的基因工程菌的构建方法,其中步骤(2)中所述的克隆菌株为大肠杆菌dh5α。
进一步优选地,如上所述分泌表达zhd518蛋白的基因工程菌的构建方法,其中步骤(3)中所述的表达菌株为bl21(de3)。
另外,本发明还提供了上述方法构建的分泌表达zhd518蛋白的基因工程菌在制备zhd518蛋白中的应用。具体应用的步骤和技术参数优选如下:将分泌表达zhd518蛋白的基因工程菌在培养基中扩大培养至生长对数期,向培养基中加入乳糖至终浓度10g/l,以及加入tritonx-100至终浓度0.5%,28℃诱导18-40h(优选28℃诱导32-36h),离心,取上清液,得到zhd518粗蛋白。
与现有技术相比,本发明具有如下优点和显著的进步:
(1)本发明将融合表达策略与zhd518蛋白自身特性相结合,获得了一种融合信号肽促进zhd518蛋白在大肠杆菌中表达并且分泌到胞外的方法,该方法不仅能够使蛋白可溶性表达,而且简化了后续蛋白分离纯化的步骤,实现快速获得目的蛋白的目的。
(2)与现有的破菌获得目的蛋白方式相比,本发明提供的利用信号肽促进蛋白胞外分泌表达的方法,可以从发酵上清中直接得到目的蛋白,无需对细胞破碎处理,降低了由于破菌不彻底造成目的蛋白的浪费,同时此方法还具有简便、低成本的优点,更适用于大规模的工业应用。
(3)本发明对诱导表达的条件进行了优化,利用乳糖为诱导剂更加安全而且可以节约成本。
附图说明
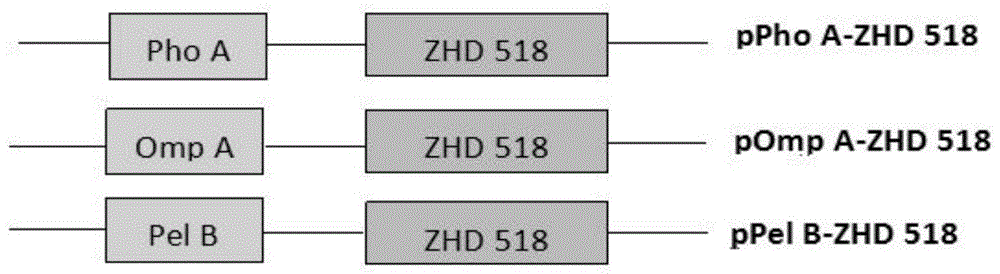
图1:融合表达质粒结构示意图,包括含有phoa信号肽的表达载体pphoa-zhd518;含有ompa信号肽的表达载体pompa-zhd518;含有pelb信号肽的表达载体ppelb-zhd518。
图2:不同融合信号肽对zhd518表达量影响的sds-page检测图;其中,1、2、3分别表示融合了phoa、ompa、pelb信号肽的蛋白表达情况(a)以及相对酶活力测定(b),箭头所示为目的蛋白的大小,m代表marker,所加iptg终浓度为0.5mm,诱导温度为28℃,诱导时间为28h。。
图3:最优信号肽phoa对zhd518蛋白分泌的条件优化。在诱导温度为28℃诱导时间为28h时所加不同iptg浓度对目的蛋白的表达量影响的sds-page检测图(a)以及相对酶活力测定(b)。其中(a)中的1-3分别表示加入终浓度为0.1,0.25,0.5mm的iptg蛋白表达情况。
图4:最优信号肽phoa对zhd518蛋白分泌的条件优化。所用iptg终浓度为0.25mm时不同诱导温度及时间对目的蛋白的表达量影响的sds-page检测图(a)及相对酶活力测定(b)。
图5:最优信号肽phoa对zhd518蛋白分泌的条件优化。所用iptg浓度为0.25mm,诱导温度为28℃时,不同种类的渗透剂对目的蛋白的表达量影响的sds-page检测图(a),以及相对酶活力测定(b)。其中(a)中的1-6分别为:1.不加渗透剂的对照,2-6加入不同种类的渗透剂及浓度,分别为tritonx-100(0.5%),sds(0.02%),glycine(0.5%),sucrose(0.5%),sorbitol(0.5%)。
图6:不同浓度的最优渗透剂tritonx-100对zhd518蛋白分泌的影响的sds-page检测图(a),以及36小时相对酶活力测定(b)。其中(a)中的1-5分别为:1.不加tritonx-100的对照,2-5为加入不同浓度的tritonx-100,浓度分别为0.1%,0.25%,0.5%,0.75%。
图7:不同浓度的乳糖为诱导物对zhd518蛋白分泌的影响的sds-page检测图(a),其中加入了0.5%的tritonx-100作为渗透剂,以及相对酶活力测定(b)。m为marker。1.加0.25mmiptg为对照,2-6为加入不同浓度的乳糖,浓度分别为2.5,5,7.5,10,12.5g/l。
具体实施方式
以下结合附图对本发明的原理和特征进行描述,所举实施例只用于解释本发明,并非用于限定本发明的保护范围。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明的总体思路是利用前期报道过的具有引导蛋白分泌的信号肽phoa、ompa、pelb,促进zhd518蛋白在大肠杆菌中可溶性表达,包括如下步骤:
(1)生工合成3种信号肽phoa、ompa、pelb;
(2)将合成的3种信号肽分别与zhd518进行连接pcr,使信号肽基因与目的基因进行连接(如图1所示);
(3)将连接好的片段通过酶切酶连方法与载体连接(如图1所示);
(4)将构建好的载体转克隆菌株,抽质粒送生工测序;
(5)将测序正确的质粒转表达菌株,过夜培养,挑取单菌落进行诱导表达;
(6)收集上清,取适量的上清液进行蛋白胶检测,确定蛋白分泌较好的信号肽;
(7)将验证较好的信号肽菌株进行条件优化,确定最优诱导条件。
实施例1:构建3种融合信号肽(phoa、ompa、pelb)与zhd518基因串联在大肠杆菌bl21(de3)中的表达载体(以phoa为例)
(1)通过三轮聚合酶链式反应(pcr)扩增得到phoa-zhd518片段。其中第一轮pcr扩增得到zhd518基因片段,第二轮pcr扩增得到phoa信号肽基因片段,第三轮通过连接pcr的方式将zhd518基因片段与phoa信号肽基因片段连接成大片段(phoa-zhd518)。其中三轮pcr体系相同,扩增程序随片段的长短延伸时间有些许差别。
pcr反应体系:10×pfubuffer,5μl;dntp(2.5mm),5μl;引物f(10μm),2μl;引物r(10μm),2μl;pfu聚合酶,0.5μl;模板(phoa;zhd518基因由公司合成),1μl;加ddh2o至反应体系为50μl。
pcr扩增程序:94℃,3min;94℃,30s,58℃,20s,72℃,30s(延伸时间随片段长短变化),25个循环;72℃,5min;4℃,∞。
第一轮pcr扩增引物:
zhd518-f:ctaaggccatggctgcatggctgctactagaaccagaggttac
zhd518-r:ccgctcgagttacttcaggtactttctggaagtc
第二轮pcr扩增引物:
phoa-f:cgcggatccatgaaacaatcaaccattgcactg
phoa-r:gcagccatggccttagtcaccggagtgaaaa
第三轮pcr扩增引物:
phoa-f:cgcggatccatgaaacaatcaaccattgcactg
zhd518-r:ccgctcgagttacttcaggtactttctggaagtc
(2)将步骤(1)获得的pcr产物回收后,用限制性内切酶bamhⅰ和xhoⅰ双酶切,再把经过限制性核酸内切酶bamhⅰ和xhoⅰ双酶切后回收的载体pet28a和片段(phoa-zhd518)以t4dnaligase酶连;含酶连产物的质粒pphoa-zhd518结构示意图如图1所示,转化到大肠杆菌感受态细胞中,挑选转化子进行测序验证。
其他标签表达载体pompa-zhd518,ppelb-zhd518的构建方式除所用引物和模板之外其它与上述表达载体pphoa-zhd518一样。
实施例2:含有融合信号肽的zhd518蛋白在大肠杆菌中的诱导表达
将实施例1构建的融合表达载体pompa-zhd518,ppelb-zhd518,pphoa-zhd518分别转化于大肠杆菌bl21(de3)感受态细胞。转化体系:重组质粒1μl;感受态细胞10μl;混合好体系后,冰上放置10min,然后42℃水浴35s,加入150μllb培养基,37℃摇床孵育1h,然后涂布于加了卡那霉素的lb平板上,37℃培养12-16h。
接种单菌落于20ml液体lb培养基中,加入50μg/ml的卡那霉素,37℃培养12-16h,按1%的接种量转接至50ml液体lb培养基,加入50μg/ml的卡那霉素,37℃培养,待od600达到1.2-1.5时,加入终浓度为0.5mm的iptg,然后转移至28℃低温诱导28h。
诱导完成后,4℃、5000rpm离心10min收集上清,取上清液,上清体积为20μl与5×的蛋白loading混合,100℃加热10min,取10μl样品用12%的sds-peag胶检测。经sds-page检测后,各种信号肽促进表达结果如图2a所示,1、2、3泳道分别为连接了信号肽phoa,ompa和pelb分泌表达的zhd518蛋白。结果表明,这三种信号肽都可以促进目的蛋白的胞外分泌,但分泌最好的为phoa-zhd518,其次为ompa-zhd518和pelb-zhd518。为了进一步确定不同信号肽对蛋白分泌的影响,取上述诱导发酵28h后的适量发酵液通过与底物反应计算相对酶活力,结果如图2b所示。
实施例3:含有融合信号肽的zhd518蛋白在大肠杆菌中的诱导表达条件的优化
将实施例2中表达最好的融合表达载体ompa-zhd518做分泌条件的优化,取实施例2中涂布的lb平板挑取单菌落接种于20ml液体tb培养基中,加入50μg/ml的卡那霉素,37℃培养12-16h,按1%的接种量转接至50ml液体tb培养基,加入50μg/ml的卡那霉素,37℃培养,待od600达到1.2-1.5时,加入不同终浓度的iptg后将摇瓶置于温度为28℃的摇床中诱导表达并取28h的发酵液与底物反应测定相对酶活力,具体方法与实施例2一致,结果如图3a和3b。
将实施例2中表达最好的融合表达载体ompa-zhd518做分泌条件的优化,取实施例2中涂布的lb平板挑取单菌落接种于20ml液体tb培养基中,加入50μg/ml的卡那霉素,37℃培养12-16h,按1%的接种量转接至50ml液体tb培养基,加入50μg/ml的卡那霉素,37℃培养,待od600达到1.2-1.5时,加入终浓度为0.25mm的iptg后将摇瓶置于不同温度的摇床中诱导表达并取在不同时间的发酵液测定相对酶活力,具体方法与实施例2一致,结果如图4a和4b。
取实施例2中涂布的lb平板挑取单菌落接种于20ml液体tb培养基中,加入50μg/ml的卡那霉素,37℃培养12-16h,按1%的接种量转接至50ml液体tb培养基,加入50μg/ml的卡那霉素,37℃培养,待od600达到1.2-1.5时,加入终浓度为0.25mm的iptg以及sucrose(0.5%),glycine(0.5%),tritonx-100(0.5%),sds(0.02%)andsorbitol(0.5%)的渗透剂,在28℃诱导表达36h后取样,进行蛋白浓度以及相对酶活力测定,具体方法与实施例2一致,结果如图5a和5b。
取实施例2中涂布的lb平板挑取单菌落接种于20ml液体tb培养基中,加入50μg/ml的卡那霉素,37℃培养12-16h,按1%的接种量转接至50ml液体tb培养基,加入50μg/ml的卡那霉素,37℃培养,待od600达到1.2-1.5时,加入终浓度为0.25mm的iptg以及不同浓度的trionx-100,在28℃诱导表达36h后取样,进行蛋白浓度以及相对酶活力测定,具体方法与实施例2一致,结果如图6a和6b。
取实施例2中涂布的lb平板挑取单菌落接种于20ml液体tb培养基中,加入50μg/ml的卡那霉素,37℃培养12-16h,按1%的接种量转接至50ml液体tb培养基,加入50μg/ml的卡那霉素,37℃培养,待od600达到1.2-1.5时,加入不同终浓度的乳糖,以终浓度为0.25mm的iptg为对照,并且加入0.5%的trionx-100在28℃诱导表达36h后取样,进行蛋白浓度以及相对酶活力测定,具体方法与实施例2一致,结果如图7a和7b。
综上所述,发明人通过优选几种常用的信号肽,最终发现3种信号肽都促进了zhd518在大肠杆菌中的表达并分泌到胞外,但分泌最好的为phoa-zhd518,其次为ompa-zhd518,最后为pelb-zhd518。并通过对phoa-zhd518诱导条件的优化找到了最优的诱导条件。
需要说明的是,虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
序列表
<110>湖北大学
<120>一种促进玉米赤霉烯酮降解酶zhd518蛋白分泌表达的方法及应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>801
<212>dna
<213>人工序列(artificialsequence)
<400>1
atggctgctactagaaccagaggttacgttactaccaaggacggtatcaagtggtactac60
gaacaagaaggttccggtccagacgttgttttgattccagatggtttgggtgagtgccag120
atgttcgataagccaatgtccttgatcgcctccaacggtttcagagttactaccttcgat180
atgccaggtatgtccagatcttctgacgctccaccagaaacttaccaggacatcactggt240
agaaagctggccggttacatcatcactttgttggacaccctggacatcaagatcgcttcc300
gtttggggttgttcttctggtgcttctactgttttggccctgtgttctgactacccagag360
cgtgttagaaacggtatgccacacgaagttccaactggtaacccagacatcttgttgcac420
attcacgaagttgacccagccactatctctcaagaaatggctgcacactccagagcctac480
tctggtaacgttgaagcttgggatgctttgggtcctgaagttcatgctagactgcacgac540
aactacccaagatgggcttacggttacccaagaactattccaccatccgctccagttaag600
actgaggacttgcacaaggttccaatcgactggactgttggagcttccactccaactaag660
ctgttcttcgagaacatcgttatcgctgccagagagggtatcaacatcggtactttgcca720
ggtaaccactttccatacgtttctcacccagaagagttcgccaagtacgttgttgagact780
tccagaaagtacctgaagtaa801
<210>2
<211>63
<212>dna
<213>人工序列(artificialsequence)
<400>2
atgaaacaatcaaccattgcactggcacttttacccctgcttttcactccggtgactaag60
gcc63
- 还没有人留言评论。精彩留言会获得点赞!