一种水稻原生质体分离与转化方法与流程
本发明涉及原生质体分离转化
技术领域:
,更具体的说是涉及一种水稻原生质体分离与转化方法。
背景技术:
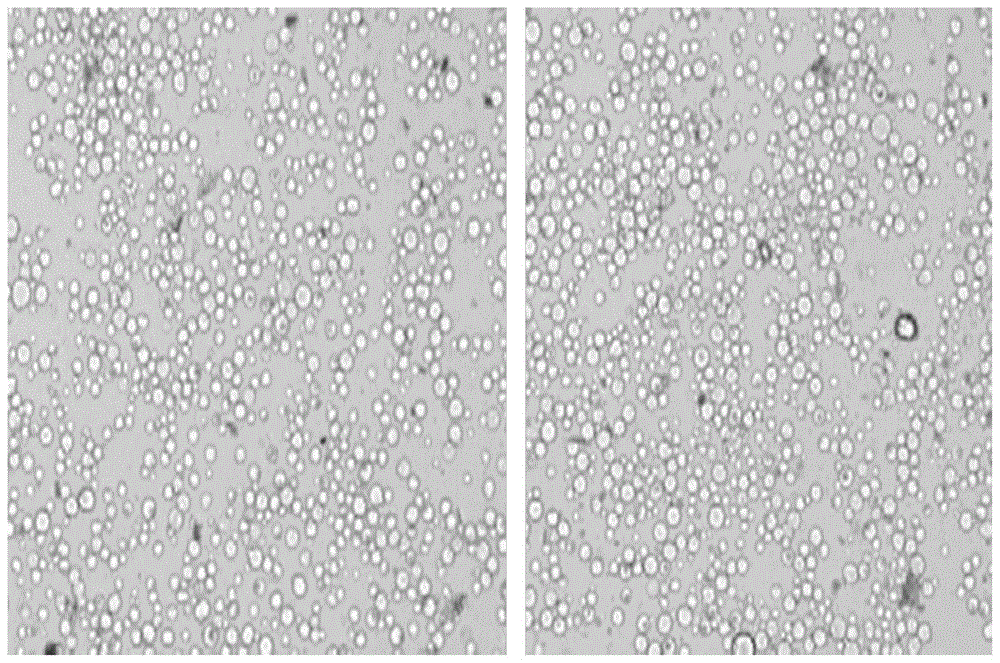
:原生质体指在人为条件下,去除原有细胞壁或抑制新生细胞壁后所得到的仅有一层细胞膜包裹着的圆球状对渗透敏感的细胞。目前,水稻原生质体是一种非常好的瞬时表达系统,已被广泛应用于植物生理生化和分子机制的研究,包括细胞信号转导过程,离子转运,细胞壁合成,蛋白质分泌以及细胞程序化死亡等生物学过程。基于原生质体的实验技术主要包括亚细胞定位,基因瞬时表达分析,启动子活性分析,离子吸收实验以及蛋白质相互作用验证。但是水稻原生质体在制备过程中通常表现为分离率低、破裂率高、杂质多等缺点,影响水稻的进一步研究。如何制备高质量水稻原生质体相关报道少见。因此,提供一种水稻原生质体分离与转化方法,提高效率与质量是本领域技术人员亟需解决的问题。技术实现要素:有鉴于此,本发明提供了一种水稻原生质体分离与转化方法为了实现上述目的,本发明采用如下技术方案:一种水稻原生质体分离方法,其特征在于,包括以下步骤:(1)取水稻苗茎部和叶片制备成0.4-0.6mm薄片,将所述薄片和酶液按质量体积比1g:10-15ml混合,避光,25-30℃摇床,转速50rpm,酶解2.5-3.5h后,过300-400目筛,弃初滤液,留残存的薄片;选择茎部或叶片制备薄片(其细胞较小、质量佳),置于250ml三角瓶中,铺满三角瓶底部;加入25-50ml酶液,三角瓶需用锡箔纸包住,避免见光;优选28℃摇床;优选360目筛;(2)将步骤(1)残存的薄片用40-60mlw5溶液洗脱回收,再用力震荡8-12s、过300-400目筛收集滤液,并重复收集4-6次;w5溶液用量为40-60ml,优选50ml;将残存的薄片洗脱回收至新的三角瓶中,用力震荡10s左右,此时便可将质量佳的原生质体裂解出来,并重复;(3)将步骤(2)收集的滤液各自通过水平转子200-300g离心3-4min,弃上清,留沉淀混匀,得原生质体a;优选水平转子250g离心3min,离心升降速设为1;(4)将步骤(3)所述原生质体a和10-20mlw5溶液混合,重悬所述原生质体a,水平转子400-500g离心3-4min,弃上清,得原生质体b,原生质体b和1mlmmg溶液混合,得原生质体悬浊液。w5溶液优选10-20ml,进一步优选为15ml;优选水平转子450g,离心3min;得到的原生质体悬浊液用显微镜观察原生质体的裂解效果,其中,质量佳的批次可直接用于单细胞测序。优选的:水稻苗来源:取水稻种子于35-40℃浸泡20-30h,再将浸泡后的种子置于25-30℃,暗培养催芽12-20d,每天用清水换液。优选的:于37℃浸泡24h,再将浸泡后的种子置于30℃培养箱中,暗培养催芽。优选的:酶液每100ml包括0.6md-mannitol2.74g、10mmmes0.05g、1.5%cellulaser-100.38g和0.75%macerozyme0.19g,0.1%bsa0.03g、3.4mmcacl20.01g和200mg/mlcarbenicillin6.25μl。优选的:酶液制备方法:先将0.6md-mannitol、10mmmes、1.5%cellulaser-10和0.75%macerozyme混合,在55℃水浴至全部溶解;再用1mkoh调ph至5.7,过0.22μm滤膜除菌;最后冷却至室温加入0.1%bsa、3.4mmcacl2和200mg/mlcarbenicillin6.25μl,得酶液。进一步的:一种水稻原生质体转化方法,包括以下步骤:(1)将目标载体和原生质体悬浊液按照质量体积比为1-2μg:20μl混匀,使细胞终浓度为1-5×106cell/ml,得悬浊液a;(2)将悬浊液a和peg溶液按照体积比10:11迅速混匀,得悬浊液b;(3)将悬浊液b经25-30℃水浴10-20min,再和w5溶液按体积比7:60混匀,待终止反应得悬浊液c;(4)将悬浊液c水平转子250-350g离心3-4min,得悬浊液d;(5)将所述悬浊液d弃上清,得悬浊液e,再和750μlw5溶液混匀,转入细胞培养板,于25-30℃避光培养6-12h,最终获得成功表达目的基因的原生质体细胞。步骤(3)水浴优选28℃水浴15min;步骤(4)优选水平转子300g,离心3min;步骤(5)细胞培养板优选12孔细胞培养板,用封口膜包好,优选28℃避光培养6-12h。优选的:目标载体为:使用qiagen中量提取试剂盒获得100-150μg的高纯度无内毒素的质粒,定量稀释到2μg/μl。一次原生质体转化一般需要5-10μg。优选的:peg溶液体积浓度为40%,每100mlpeg溶液成分包括0.6md-mannitol10.93g;100mmcacl21.11g;40%(v/v)peg400040g。经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种水稻原生质体分离与转化方法,取得的技术效果为本发明制备的原生质体混合液,用台盼蓝染色法染色,进一步通过光学显微镜观察,评估原生质体裂解效果时,在10倍显微镜下可以观察到90%以上有活力的细胞且细胞数量多(参见附图1)。用激光共聚焦显微镜进一步观察裂解的原生细胞,可以看到数量多且边界清晰,圆润饱满,有活力的原生质细胞(参见附图2)。本发明能够较好地获得高质量水稻原生质体,并将其应用于后续研究。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。图1附图为10倍电子显微镜下观察台盼蓝染色后的原生质细胞。图2附图为激光共聚焦显微镜下观察的原生质细胞。具体实施方式下面本发明将结合附图对实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明实施例公开了一种水稻原生质体分离与转化方法涉及的单一药品均为市售产品,其中,每100ml40%peg溶液成分如下:0.6md-mannitol10.93g;100mmcacl21.11g;40%(v/v)peg400040g;每100mlw5溶液成分如下:154mmnacl(m=58.44)0.9g;125mmcacl2(m=110.99)1.39g;5mmkcl(m=74.55)0.037g;2mmmes(m=195.24,ph=5.7)0.039g;每100mlmmg溶液成分如下:0.6md-mannitol(m=182.17)10.93g;15mmmgcl2(m=95.22)0.143g;4mmmes(m=195.24,ph=5.7)0.078g实验的前期准备:水稻来源取200粒水稻种子,于35-40℃浸泡20-30h,再将浸泡后的种子置于25-30℃,暗培养催芽12-20d,每天用清水换液。目标载体即质粒制备:转化原生质体对质粒的质量要求比较高,使用qiagen中量提取试剂盒获得100-150μg的高纯度无内毒素的质粒。质粒提取完毕后需要定量,通常将质粒稀释到2μg/μl,一次原生质体转化需要5-10μg质粒。酶液制备方法为先将0.6md-mannitol、10mmmes、1.5%cellulaser-10和0.75%macerozyme混合,在55℃水浴至全部溶解;再用1mkoh调ph至5.7,过0.22μm滤膜除菌;最后冷却至室温加入0.1%bsa、3.4mmcacl2和200mg/mlcarbenicillin6.25μl,得酶液。实施例1一种水稻原生质体分离方法,包括以下步骤:(1)选择水稻苗从茎基部截断,取茎部和叶片制备成0.4mm薄片3g,迅速转入含有酶液30ml的250ml三角瓶中,三角瓶用锡箔纸包住,避光,25℃摇床,转速50rpm,酶解2.5h后,过300目筛,弃初滤液,留300目筛上残存的薄片;(2)将步骤(1)300目筛上残存的薄片用40mlw5溶液洗脱回收至新的三角瓶中,再用力震荡8s、过300目筛收集滤液,并重复收集4次;(3)将步骤(2)收集的滤液各自导入50ml离心管,通过水平转子250g离心3min,升降速设为1,弃上清,沉淀即原生质体;(4)将步骤(3)原生质体中和10mlw5溶液混合,重悬原生质体,水平转子450g离心3min,弃上清,留沉淀和1mlmmg溶液混合,得原生质体悬浊液。实施例2一种水稻原生质体分离方法,包括以下步骤:(1)选择水稻苗从茎基部截断,取茎部和叶片制备成0.5mm薄片3g,迅速转入含有酶液36ml的250ml三角瓶中,三角瓶用锡箔纸包住,避光,28℃摇床,转速50rpm,酶解3h后,过360目筛,弃初滤液,留360目筛上残存的薄片;(2)将步骤(1)360目筛上残存的薄片用50mlw5溶液洗脱回收至新的三角瓶中,再用力震荡10s、过360目筛收集滤液,并重复收集5次;(3)将步骤(2)收集的滤液各自导入50ml离心管,通过水平转子250g离心3min,升降速设为1,弃上清,沉淀即原生质体;(4)将步骤(3)原生质体中和15mlw5溶液混合,重悬原生质体,水平转子450g离心3min,弃上清,留沉淀和1mlmmg溶液混合,得原生质体悬浊液。实施例3一种水稻原生质体分离方法,包括以下步骤:(1)选择水稻苗从茎基部截断,取茎部和叶片制备成0.6mm薄片3g,迅速转入含有酶液45ml的250ml三角瓶中,三角瓶用锡箔纸包住,避光,30℃摇床,转速50rpm,酶解3.5h后,过400目筛,弃初滤液,留400目筛上残存的薄片;(2)将步骤(1)400目筛上残存的薄片用60mlw5溶液洗脱回收至新的三角瓶中,再用力震荡12s、过400目筛收集滤液,并重复收集6次;(3)将步骤(2)收集的滤液各自导入50ml离心管,通过水平转子250g离心3min,升降速设为1,弃上清,沉淀即原生质体;(4)将步骤(3)原生质体中和20mlw5溶液混合,重悬原生质体,水平转子450g离心3min,弃上清,留沉淀和1mlmmg溶液混合,得原生质体悬浊液。将实施例2制备的原生质体混合液,用台盼蓝染色法染色,进一步通过光学显微镜观察,评估原生质体裂解效果。在10倍显微镜下可以观察到90%以上有活力的细胞且细胞数量多(参见附图1)。用激光共聚焦显微镜进一步观察裂解的原生细胞,可以看到数量多且边界清晰,圆润饱满,有活力的原生质细胞(参见附图2)。统计3个不同视野下细胞的质量,数据参见表1。表1sample细胞浓度(/ul)细胞成活率(%)碎片及杂质占比(%)120609312218409215319009517本发明能够较好地获得高质量水稻原生质体,分离率高、单细胞完整性好、杂质少等,符合单细胞测序的相关要求,克服水稻原生质体易破裂、成团率高、杂质富集等缺点,利于后续转化研究。实施例4原生质体转化:(1)在2ml离心管中加入5-10μg制备的质粒,再加入100μl实施例1-3任一制备的原生质体悬浊液,并轻柔地吸打混匀,原生质体悬浊液,细胞终浓度为1-5×106cell/ml;(2)加入110μl40%peg,并迅速轻柔混匀,勿使原生质体成团。(3)置于25-30℃水浴10-20min,再和1.8mlw5溶液混合,重选原生质体,并终止反应,转移液体置2ml离心管中;(4)将2ml离心管套在10ml离心管中,水平转子300g离心3min,升降速为1;(5)用移液器小心吸除上清后,重悬原生质体于750μlw5溶液中;(6)转移原生质体到12孔细胞培养板里,用封口膜包好后,于25-30℃避光培养6-12h。经实验检测成功获得表达目的基因的原生质体细胞。本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1