一种甲醛荧光探针及其制备和应用的制作方法
本申请涉及荧光探针领域,具体地,涉及一种相乘型检测模式的甲醛荧光探针及其制备方法与应用。
背景技术:
甲醛是分子结构最简单的醛,也是众所周知作为致癌和诱变污染物。环境中的甲醛主要由人为工业生产和生物燃料燃烧,同时,甲醛也是动植物中内源性活性羰基物质。正常浓度的甲醛在空间记忆和认知能力的形成中起着重要作用,而过量的甲醛会导致学习和记忆障碍、过敏性肺部炎症、哮喘症状和癌症的产生。因此,准确检测人体的甲醛浓度是非常重要且值得的。
近年来,荧光探针技术由于其准确性高、操作简单等优点被广泛应用于细胞甲醛的检测。目前,主要的检测模式有增强型、减弱型以及比率型检测模式。
技术实现要素:
本发明提供一种甲醛荧光探针,应用于相乘型检测模式检测待测溶液的甲醛浓度,在特定浓度配比下,两个不同通道的荧光强度值相乘值与甲醛浓度之间呈现线性关系,提高检测灵敏度的同时降低检测下限,还可用于细胞内甲醛成像分析。
一种甲醛荧光探针,结构式如式i所示:
本发明还提供一种如所述甲醛荧光探针在定量检测甲醛浓度中的应用。
本发明还提供一种甲醛浓度的定量检测方法,包括:
取待测溶液,加入所述的甲醛荧光探针,反应结束后分别在激发波长为440nm、发射波长为540nm和激发波长为535nm、发射波长为585nm条件下检测反应液的荧光强度值,然后两个检测条件下的荧光强度值相乘,再将相乘值带入线性标准曲线中,计算得到待测溶液中的甲醛浓度;荧光探针在待测溶液中的加入量以荧光探针的摩尔浓度与溶液中甲醛浓度计为:0.005mm荧光探针:0-5mmol/l甲醛浓度。
本发明研究发现,本发明制备得到的甲醛荧光探针在特定浓度比下与特定检测模式下与甲醛浓度之间呈线性关系。
相乘型检测模式的甲醛荧光探针的荧光检测原理为:在水溶液中探针本身几乎没有荧光,与甲醛反应后,探针的萘酰亚胺及罗丹明通道的荧光强度均增加,将两个荧光强度值进行相乘作为甲醛浓度的检测信号。
依据相乘型检测模式,探针只对甲醛具有响应能力,对其他活性碳簇、活性氧簇、生物硫醇没有响应。因此,探针可对溶液和细胞中的甲醛浓度进行检测,为研究细胞中甲醛的生理作用提供了新的检测手段。
以下还提供了若干可选方式,但并不作为对上述总体方案的额外限定,仅仅是进一步的增补或优选,在没有技术或逻辑矛盾的前提下,各可选方式可单独针对上述总体方案进行组合,还可以是多个可选方式之间进行组合。
可选的,甲醛荧光探针与待测溶液的反应条件为:温度36℃~38℃;反应时间2~3小时;反应体系ph值为7.0~7.5。
可选的,甲醛荧光探针与待测溶液的反应条件为:温度37℃;反应3小时;反应体系ph值为7.4左右(例如7.3~7.5之间)。
可选的,所述线性标准曲线中,纵坐标为激发波长440nm、发射波长为540nm和激发波长为535nm、发射波长为585nm条件下检测反应液的荧光强度值的乘积,横坐标为甲醛浓度。
可选的,所述线性标准曲线的线性方程为:y=62.8x+0.95;r2=0.988;y为激发波长440nm、发射波长为540nm和激发波长为535nm、发射波长为585nm条件下检测反应液的荧光强度值的乘积;x为甲醛浓度。
可选的,所述标准曲线的制备方法如下:
将0.005mm如权利要求1所述的荧光探针分别与甲醛浓度在0~5mmol/l内的溶液反应,利用酶标仪进行荧光强度检测;通道一:在激发波长为440nm、发射波长为540nm下采集反应液的荧光强度;通道二:在激发波长为535nm、发射波长为585nm下采集反应液的荧光强度;以两个通道的荧光强度进行相乘的数值为纵坐标,甲醛浓度为横坐标,绘制即得线性标准曲线。
本发明还提供一种如所述甲醛荧光探针在细胞内甲醛成像分析中的应用。
可选的,所述细胞为人乳腺癌细胞mcf-7细胞。该细胞为商品化的细胞系,可购自于上海碧云天生物技术有限公司。
本发明还提供一种甲醛荧光探针的制备方法,包括:
在缩合剂的存在下,化合物ii与化合物iii发生酰胺缩合反应生成化合物iv;在一价铜离子的存在下,化合物iv和化合物v发生点击化学反应生成化合物i;
甲醛应该探针的合成路线如下:
可选的,
化合物ii和化合物iii的物质的量之比为1:1-1.2,在hobt(1-羟基苯并三唑)、edc.hcl(1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐)及三乙胺的存在下进行反应,反应时间为8-12小时,溶剂为二氯甲烷,反应温度为室温;反应结束后,蒸干反应溶剂,粗产物利用薄层层析技术进行分析纯化,展开剂为体积比为20:1的二氯甲烷:甲醇,获得目标产iv;
制备过程中,hobt和edc.hcl一般按照化合物ii摩尔质量的1.5倍配比。
化合物iv和化合物v的物质的量之比为1:1-1.2,在一价铜离子的存在下进行反应,反应时间为6-8小时,溶剂为四氢呋喃和水,反应温度为室温;反应结束后,蒸干反应溶剂,粗产物利用薄层层析技术进行分析纯化,展开剂体积比为20:1的二氯甲烷:甲醇,获得目标产物i。
相比于现有技术,本发明的有益效果体现在:本发明提供了新型检测模式——相乘型检测模式,可用于检测缓冲液和细胞内甲醛的浓度。
附图说明
图1为实施例1制备的探针(i)的核磁氢谱。
图2为实施例1制备的探针(i)在dmso/pbs缓冲液(ph=7.4,v/v=1/99)条件下加入不同当量甲醛下的荧光发射光谱图。
图中(a)为荧光发射光谱图,激发波长440mm;图中(b)为荧光发射光谱图,激发波长535mm;图中(c)为540nm和585nm处的荧光强度相乘值与不同甲醛浓度的线性图。
图3为实施例1制备的探针(i)对甲醛和其它生物相关活性物质的选择性图。
图4为实施例1制备的探针(i)在不同ph条件下与甲醛作用过程中的荧光图。
图5为实施例1制备的探针(i)的细胞甲醛成像图。
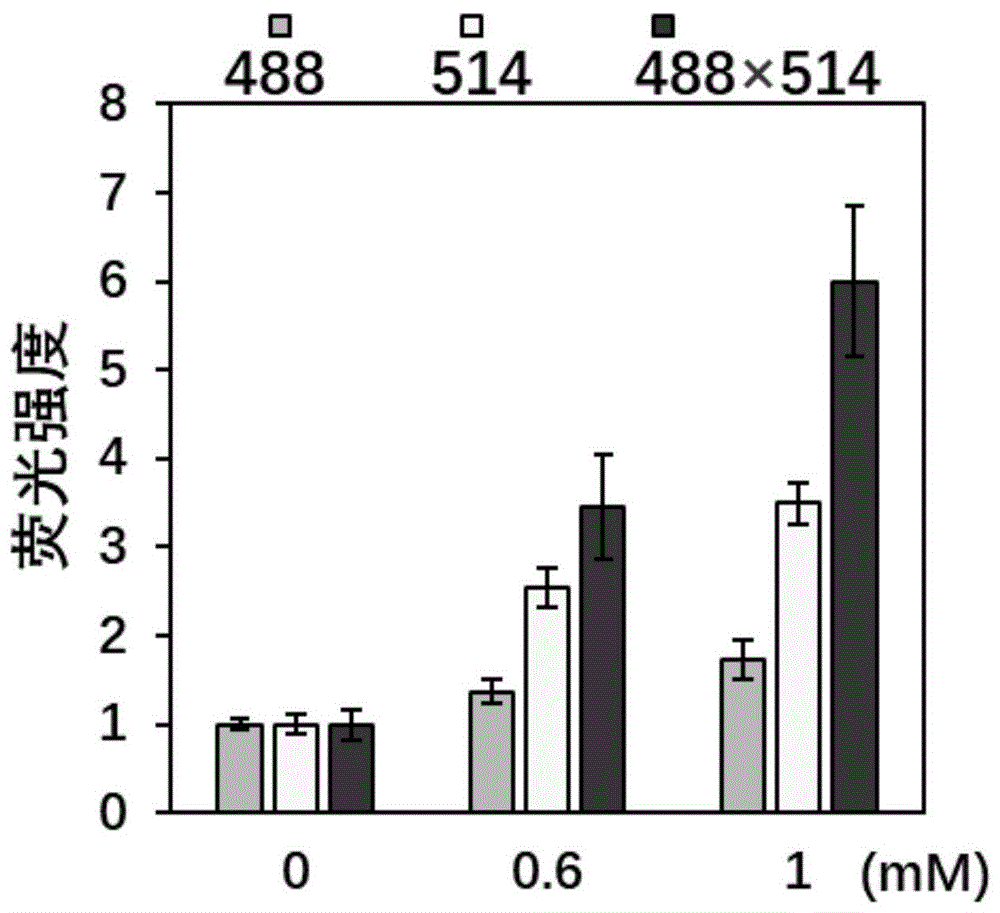
图6是实施例1制备的探针在细胞甲醛成像应用中荧光强度与甲醛浓度之间的关系图。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:化合物(i)的制备
将化合物(ii)(0.06g,0.01mmol)溶于5ml二氯甲烷中,随后依次加入1-羟基苯并三氮唑(0.02g,0.15mmol)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(0.03g,0.15mmol)、三乙胺(0.02g,0.2mmol)和化合物(iii)(0.02g,0.15mmol),室温下反应10小时。反应结束后,蒸干反应溶剂,粗产物利用薄层层析技术进行分离纯化,展开剂为二氯甲烷:甲醇为20:1(体积比),得到暗红色固体化合物(iv)(0.045g,62%产率)。
1hnmr(500mhz,meod)δ7.84–7.76(m,2h),7.75–7.68(m,1h),7.55(s,1h),7.30(d,j=9.5hz,2h),7.09(dd,j=9.5,2.1hz,2h),6.99(d,j=2.4hz,2h),3.71(q,j=7.1hz,8h),3.66(t,j=4.9hz,2h),3.55(t,j=5.6hz,2h),3.54–3.33(m,12h),2.62(t,j=6.7hz,2h),2.49(t,j=6.6hz,2h),1.32(dd,j=12.6,5.5hz,12h).esicalcd.forc40h51n8o5[m]+723.40,found723.59.
将化合物(iv)(0.03g,0.04mmol)和化合物(v)(0.02g,0.04mmol)溶于3ml四氢呋喃中,将溶解在3ml水溶液中的vc(0.004g,0.02mmol)和五水硫酸铜(0.003g,0.02mmol)加入到上述的混合液中,常温反应6小时。反应结束后,蒸干反应溶剂,粗产物利用薄层层析技术进行分离纯化,展开剂为二氯甲烷:甲醇为20:1(体积比),得到暗红色固体化合物(i)(0.045g,62%产率)。其核磁氢谱参见图1。
1hnmr(500mhz,meod)δ8.43(d,j=6.4hz,1h),8.27(d,j=6.7hz,1h),8.18(s,1h),7.90(s,1h),7.79–7.70(m,2h),7.62(d,j=7.5hz,1h),7.52(d,j=6.6hz,1h),7.45(d,j=8.1hz,2h),7.38(t,j=7.1hz,1h),7.17(d,j=9.4hz,2h),7.12(d,j=8.2hz,2h),6.99(d,j=8.8hz,2h),6.85–6.79(m,2h),5.69(dd,j=16.9,9.9hz,1h),5.23–5.12(m,4h),4.64–4.59(m,2h),4.26(dd,j=12.0,6.1hz,1h),4.00(dd,j=16.9,9.6hz,4h),3.87(d,j=4.5hz,2h),3.71–3.58(m,10h),3.50(s,2h),3.34–3.29(m,8h),2.93–2.87(m,1h),2.83–2.76(m,1h),2.55(d,j=6.0hz,2h),2.44(s,2h),1.61(dd,j=14.4,7.3hz,2h),1.39(dd,j=14.9,7.4hz,2h),1.28(t,j=6.6hz,12h),0.96(t,j=7.4hz,3h).hrms(esi)calcd.forc70h81n10o9[m]+1205.615,found1205.6183.
实施例2:探针(i)在dmso/pbs缓冲液(v/v=1/99),ph=7.4的条件下,探针的荧光强度随甲醛浓度的变化的荧光性能测试。
准确称取一定量的探针(i)(实施例1制备),用二甲基亚砜配制成浓度为0.5mm的探针母液,移液枪吸取4μl加入到392μl磷酸缓冲液(10mmph=7.4),分别加入4μl不同浓度的甲醛水溶液(最终甲醛在水中的浓度分别为0、0.0025、0.0075、0.01、0.025、0.04、0.05、0.06、0.075、0.1、0.15、0.25、0.4、0.5、0.6、0.75、1、2、5mm),在37℃下反应3小时后,测试其荧光值。激发波长分别为440nm或535nm,荧光谱图见图2a/b。随后,我们将激发/发射波长为440/540nm处的荧光强度值和激发/发射波长为535/585nm处的荧光强度值进行相乘值为纵坐标,甲醛浓度为横坐标,做相关线性曲线,线性关系图见图2(c)。
实验数据表明,随着甲醛浓度的提升,激发波长分别为440nm或535nm下的荧光通道的强度均增加。我们将激发/发射波长为440/540nm处的荧光强度值和激发/发射波长为535/585nm处的荧光强度值进行相乘值为纵坐标,甲醛浓度为横坐标,做线性关系图可以发现,在甲醛浓度为0-0.25mmol/l的范围内,两者具有很好的线性关系,线性方程:y=62.8x+0.95(r2=0.988),证明了探针可通过相乘型检测模式对甲醛溶液进行定量检测。同时,本申请将荧光强度相乘后对甲醛的检测下限与各自通道对甲醛的检测下限进行对比发现,荧光强度相乘型检测下限(0.5μmol/l)低于各自通道检测下限(3.3μmmol/l、6.4μmmol/l),证明了相乘型检测模式对甲醛检测具有更高的灵敏度,具有良好的应用前景。
实施例3:本发明中的探针(i)(5μm)在dmso/pbs缓冲液(ph=7.4,v/v=1/99)条件下对甲醛的专一性荧光测试。
准确称取一定量的探针(i)(实施例1制备),用二甲基亚砜配制成浓度为0.5mm的探针母液,移液枪吸取4μl加入到392μl磷酸缓冲液(10mmph=7.4),分别加入4μl甲醛水溶液(最终甲醛在水中的浓度均为1mmol/l)和生物相关活性小分子水溶液((1)pbs;(2)fa;(3)acetaldehyde;(4)methylglyoxal;(5)benzaldehyde;(6)p-nitro-benzaldehyde;(7)p-hydroxy-benzaldehyde;(8)acetone;(9)
formicacid;(10)sodiumpyruvate;(11)glucose;(12)gsh;(13)hcy;(14)cys;(15)
nahs;(16)h2o2;(17)tbhp,最终浓度均为1mmol/l),37℃下反应3小时,测定其荧光值。纵坐标为激发/发射波长为440/540nm处的荧光强度值和激发/发射波长为535/585nm的相乘值,专一性荧光谱图见图3。
实验结果表明,除了甲醛,其它相关生物活性分子存在下对化合物(i)的荧光强度基本干扰,表明其对甲醛的选择性好。
实施例4:本发明中探针(i)(5μm),在dmso/pbs缓冲液(v/v=1/99)条件下,不同ph条件下与甲醛(1mm)反应前后的荧光光谱图。
准确称取一定量的探针(i)(实施例1制备),用二甲基亚砜配制成浓度为0.5mm的探针母液,移液枪吸取4μl加入到392μl磷酸缓冲液(10mmph分别为3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5),加入4μl甲醛水溶液(最终甲醛在水中的浓度均为1mmol/l),37℃下反应3小时,测定其荧光值。纵坐标为激发/发射波长为440/540nm处的荧光强度值和激发/发射波长为535/585nm的相乘值,横坐标为不同的ph值。荧光变化图见图4。
实验数据表明,在化合物(i)能够满足生理条件下的甲醛检测。
实施例5:本发明中探针(i)(5μm),对细胞破碎上清液中未知甲醛浓度的测试。
将细胞培养瓶中的细胞进行分离,破碎,离心,得到细胞上清液,随机加入几滴37%的甲醛水溶液。将该未知甲醛浓度的溶液分别用pbs缓冲液稀释10、100及1000倍,分别命名为a、b、c组,称取一定量的探针(i)(实施例1制备),用二甲基亚砜配制成浓度为0.5mm的探针母液,移液枪吸取4μl加入到392μl磷酸缓冲液(10mmph=7.4),加入4μl上述未知浓度的甲醛溶液,37℃下反应3小时,测定其荧光值。计算激发/发射波长为440/540nm处的荧光强度值和激发/发射波长为535/585nm的相乘值。
实验数据表明,a、b、c组的荧光强度相乘值分别为415.39、124.69和8.54,鉴于荧光强度相乘值为8.54的时候是处于线性标准曲线中,利用标准方程y=62.8x+0.95得出甲醛浓度为0.12mmol/l,随之可推算出最初的甲醛溶液浓度为0.12mol/l。将c组的溶液的甲醛浓度稀释至原先浓度的十分之一(d组),利用酚试剂分光光度法甲醛测定d组甲醛浓度,得到d组甲醛浓度为0.01mmol/l,可获得未知甲醛浓度溶液的浓度为0.10mol/l,与利用本申请中探针(i)测得的最终甲醛浓度一致,证明本申请中探针(i)可用于未知甲醛浓度溶液的检测。
当未知甲醛浓度溶液高于0.25mmol/l时,荧光强度相乘值则会大于16.65,可以通过稀释再进行荧光检测,使得荧光强度相乘值介于0.95至16.65,通过线性曲线方程进行甲醛浓度的计算。
实施例6:本发明中的探针(i)在癌细胞中的甲醛成像分析。
准确称取一定量的探针(i)(实施例1制备),用二甲基亚砜配制成浓度为10mm的母液,移液枪吸取2μl加入到1.998mldmem培养基中。取1ml含有探针(i)的培养液加入到mcf-7细胞中,37℃下孵化0.75小时,用新鲜培养液,洗涤两次,然后用不同的甲醛浓度(最终甲醛浓度分别为0、0.6、1mmol/l),孵化3h,用pbs洗涤两次后,用zeisslaserscanningmicroscope780共聚焦显微镜进行细胞成像。荧光通道一:激发波长为488nm,发射接收波长范围为500~550nm。荧光通道二:激发波长为514nm,发射接收波长范围为470~630nm。基准尺,20μm。细胞成像图见图5和图6。
图5中a1、b1和c1是荧光通道一的成像结果,a2、b2和c2是荧光通道二的成像结果,a3、b3和c3的重合是由通道一、通道二以及明场叠加而得到。
实验结果表明,随着细胞内甲醛浓度的提高,两个荧光通道的荧光强度也同时增强(参见图5),随后,本申请用imagej软件进行荧光强度分析,将两个荧光通道的荧光强度进行量化并相乘,发现细胞的荧光强度相乘值伴随着甲醛浓度的提高而增加(参见图6),证明化合物(i)的相乘型检测模式也能应用在细胞成像上。
以上所述实施例仅表达了本申请的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干变形和改进,这些都属于本申请的保护范围。因此,本申请专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!