一种基于胶原的天然高分子水凝胶及其制备方法与流程
本发明涉及一种基于胶原的天然高分子水凝胶及其制备方法,属于水凝胶领域。
背景技术:
现代社会的人们生活节奏快,习惯于快速行走,从而易导致骨骼以及软骨损伤的发生。因为骨组织中缺乏淋巴、血管以及神经分布,在修复过程中缺乏营养供给,仅靠基质、关节腔滑液的有限营养以及成骨与软骨细胞微弱的自身分裂能力,使得骨组织无法进行有效的自我修复。软骨损伤后会引起膝关节疼痛、关节失稳、关节僵硬等临床症状,严重时会发生继发骨性关节炎,这也是是引起肢体功能障碍及残疾的重要原因,会严重影响患者生活质量。故软骨损伤的修复问题是现代医疗的一个重点关注问题。
现有的骨损伤治疗方法主要分成两种,即手术法和组织工程法。手术方法虽具有一定疗效,但对患者的膝关节功能改善作用有限,且手术过程复杂,操作难度大,患者还需忍受手术带来的疼痛。组织工程法可以通过模仿细胞外环境的关键部分来改变干细胞的分化情况,其中,间充质干细胞(mesenchymalstemcells,mscs)是多能细胞,其可在体外和体内产生间充质和非间充质组织,并且拥有出色的分化能力,可分化为成骨细胞、软骨细胞和脂肪细胞。此外,还可以通过调节生物材料的物理性质来调节干细胞的分化,生物材料的物理性质包括成分、机械性能、2d形貌和3d空间等因素,尤其是2d表面上的化学功能的特定性质诸如刚度、表面的电荷和亲水性等因素已被证明对干细胞的分化有重要影响。细胞外基质(extracellularmatrix,ecm)衍生的蛋白质和/或肽,例如i型胶原蛋白,被引入到基质上,用于选择性指导神经发生、肌生成和成骨。除有机分子外,无机元素也可用于指导细胞分化,例如,现有技术发现将羟基磷灰石相添加到材料中有更好的细胞和蛋白质粘附性,增强了细胞增殖以及更高的成骨基因的表达。
在软骨及成骨修复方面,国内及国际上已有一些生物支架、海绵的相关研究。生物支架与海绵可以用作填充物,同时引导干细胞在其上黏附生长。相比支架和海绵这类固体支架,水凝胶材料拥有更易亲水的三维网络结构,在水中可以快速溶胀并保持大量体积的水而不溶解。水凝胶的此特性使其在组织工程的应用方面具有很高的价值,水凝胶在植入生物体后,其自身与生物流体和组织之间的接触面趋于模糊,能够降低表面张力、减少细胞和蛋白在表面的吸附、降低其与周围的摩擦并减小对周围组织的破坏,从而避免炎症发生。
目前,现有技术公开过将胶原和羟基磷灰石相结合制备得到软骨材料的报道,但是现有技术主要将二者进行简单的物理混合,这种技术无法将羟基磷灰石与胶原进行交联,在后续使用过程中,由于密度以及在体内的存在形式不同,会导致二者极易分离,在体内应用时会存在一定的风险,因此需要寻找一种克服二者无法长期共存的水凝胶体系。
技术实现要素:
【技术问题】
现有技术的水凝胶存在无机组分在其中分布不均匀、无法长期稳定存在的问题。
【技术方案】
为了解决上述问题,本发明首先合成了一种糖原衍生物用作交联剂,该糖原衍生物表面有多种基团,能够通过化学键与静电作用将无机成分羟基磷灰石和有机成分胶原连接起来,可以将天然高分子材料与无机材料进行更合的结合和联用,从而形成能够有效定向诱导mscs分化的水凝胶。
首先,本发明提供了一种氧化胍基糖原,所述氧化胍基糖原的结构式为:
其中,m≥1,n≥1,i≥1,平均分子量为8000~1000kda。
其次,本发明提供了上述氧化胍基糖原的制备方法,包括以下步骤:
(1)糖原的正电化:将糖原溶于二甲基亚砜中形成质量体积比为0.5-2%(单位为g/ml,下同)的溶液,之后加入1-20倍于糖原的物质的量的n,n-羰基二咪唑,惰性气氛保护下搅拌1一小时,之后将5-50倍于糖原的物质的量的乙二胺溶于5ml二甲基亚砜得到乙二胺溶液,并将乙二胺溶液滴加至上述活化后的反应溶液中,惰性气氛保护下反应12-24小时,纯化、干燥后得到氨基化糖原;
(2)在氨基化糖原上接枝胍基:将胍基乙酸溶于水中得到质量体积比为0.5-2%的胍基乙酸溶液并调节ph为5-6,向胍基乙酸溶液中加入1-5倍于胍基乙酸的物质的量的1-乙基-(3-二甲氨基丙基)碳酰二亚胺盐酸盐和1-5倍于胍基乙酸的物质的量的n-羟基琥珀酰亚胺,活化0.5-4小时后加入0.1-1倍于胍基乙酸的物质的量的步骤(1)制备得到的氨基化糖原并调节溶液ph为7-8,反应12-16小时,纯化、干燥后得到胍基糖原;
(3)胍基糖原的氧化:将适量的步骤(2)制备得到的胍基糖原溶于水中得到质量体积比为0.5-2%的胍基糖原溶液,再加入1-5倍于胍基糖原的物质的量的高碘酸钠,遮光反应1-3小时,纯化、干燥后得到氧化胍基糖原。
在本发明的一种实施方式中,所述纯化为将产物在3500da、7000da或14000da透析袋中透析24-72h。
在本发明的一种实施方式中,所述干燥优选为冷冻干燥。
在本发明的一种实施方式中,步骤(2)中所述调节ph的方法是用盐酸或氢氧化钠调节,所述盐酸或氢氧化钠的浓度优选为1mol/l。
在本发明的一种实施方式中,步骤(3)中,反应结束时,加入2-10倍于胍基糖原的物质的量的乙二醇终止反应。
在本发明的一种实施方式中,所述惰性气氛为氮气、氦气、氩气等气氛。
第三,本发明提供了一种基于胶原的天然高分子水凝胶的制备方法,所述方法包括:分别配制得到浓度为11.25-22.5mg/ml的胶原水溶液以及浓度为37.5-75mg/ml的氧化胍基糖原溶液,再在氧化胍基糖原溶液中按照每1ml溶液中添加0-25mg纳米羟基磷灰石,得到掺杂纳米羟基磷灰石的氧化胍基糖原溶液;将胶原水溶液和掺杂纳米羟基磷灰石的氧化胍基糖原溶液按照体积比2:1混合,之后15-60分钟之后将碳酸盐缓冲液滴加在混合溶液上,静置2-24h,从模具中取出后用质量体积分数为0.05%的硼氢化钠溶液还原0.5-2h,水洗后灭菌(如紫外灭菌)即可得到基于胶原的天然高分子水凝胶。
在本发明的一种实施方式中,所述水洗的次数为1-6次;所述杀菌为紫外灯下照射0.5-4h。
在本发明的一种实施方式中,所述碳酸盐缓冲液为碳酸钠-碳酸氢钠溶液,浓度为0.5-2mol/l。
在本发明的一种实施方式中,所述水优选为超纯水。
第四,本发明提供了上述制备方法制备得到的基于胶原的天然高分子水凝胶。
第五,本发明提供了包含上述基于胶原的天然高分子水凝胶的保健品或药物。
第六,本发明提供了上述基于胶原的天然高分子水凝胶在mscs分化中的应用。
本发明取得的有益技术效果为:
(1)本发明制备得到的基于胶原的天然高分子水凝胶中,胶原之间通过氧化胍基糖原进行交联,同时氧化胍基糖原将纳米羟基磷灰石均匀分散在其中,最终形成了淡黄色的固态凝胶,具有一定的拉伸性、弹性以及可弯折能力,压缩模量与弹性模量处于能够使骨髓间充质干细胞分化成软骨、成骨的区间范围内(软骨分化压缩模量~80kpa,成骨分化压缩模量~190kpa;骨分化弹性模量:40~80kpa)。对成纤维细胞的生长有促进增殖的作用。
(2)本发明的基于胶原的天然高分子水凝胶中,由于胶原蛋白具有优良的生物相容性、柔韧性和可降解性,糖原具有优良的生物相容性、吸水能力和保水能力,从而使得形成的水凝胶能够为细胞提供一个易于粘附、增殖和分化的环境,利于干细胞的生长分化;羟基磷灰石的加入,更好地模拟了骨骼环境,同时也显著地改善了水凝胶的机械强度,最终合成的基于胶原的天然高分子水凝胶料在面对较大的骨损伤时,不易被破坏,大大提升其使用寿命。
附图说明
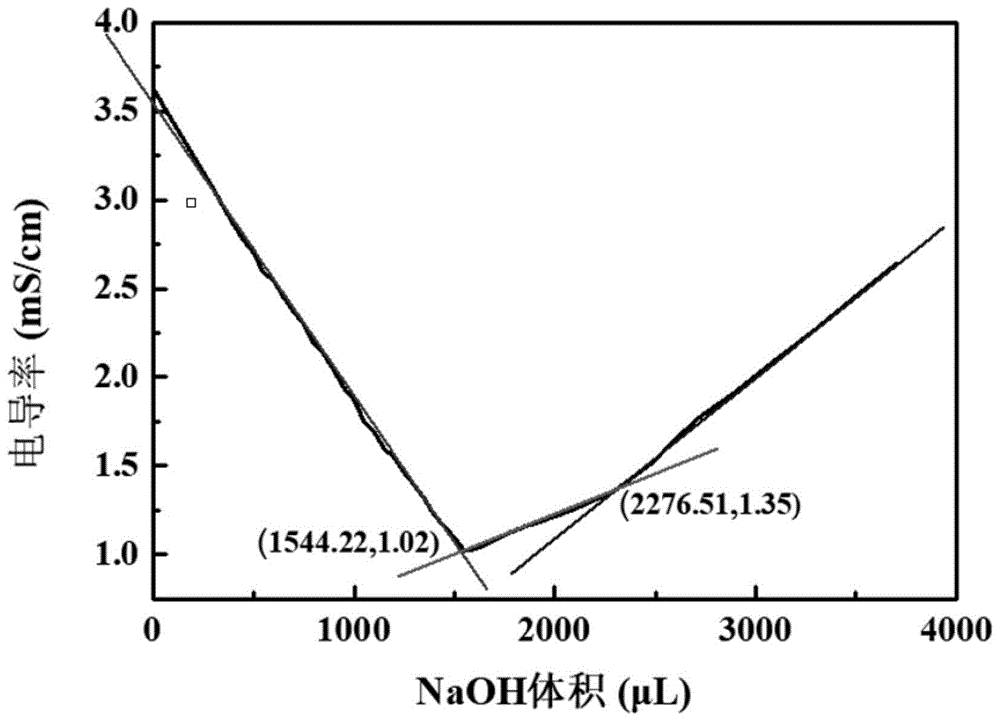
图1电导滴定法测定氨基化糖原中氨基的含量时获得氢氧化钠溶液加入体积与电导率之间的关系图以及v1和v2的确定方法示意图。
图2氧化胍基糖原的合成路线示意图,其中,cdi表示n,n-羰基二咪唑;edc表示1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐;nhs表示n-羟基琥珀酰亚胺。
图3糖原、氨基化糖原、胍基糖原和氧化胍基糖原样品的1h-nmr谱图。
图4糖原、氨基化糖原、胍基糖原和氧化胍基糖原粒子的电位测定结果。
图5不同比例的氧化胍基糖原和纳米羟基磷灰石混合后得到的掺杂纳米羟基磷灰石的氧化胍基糖原的粒径分布结果。
图6氧化胍基糖原和纳米羟基磷灰石质量比为10:1混合后到的掺杂纳米羟基磷灰石的氧化胍基糖原的透射电子显微镜照片。
图7实施例2-11制备得到的基于胶原的天然高分子水凝胶的压缩模量数据。
图8实施例9的制备得到的水凝胶的循环压缩实验数据。
图9实施例2~11中制备得到的基于胶原的天然高分子水凝胶的对3t3成纤维细胞的细胞毒性数据。
图10实施例3、4、5、7、8、9、10、11中制备得到的基于胶原的天然高分子水凝胶上生长的间充质干细胞中碱性磷酸酶(alp)含量测定的实验数据。
具体实施方式
胶原可购自于无锡贝迪生物工程股份有限公司(可溶性胶原蛋白粉)。
电导滴定法测定氨基化糖原中氨基的含量:称取适量氨基化糖原溶于去离子水,加入2mol/l的盐酸调节ph至2.0,用经标定的0.1mol/l氢氧化钠溶液进行滴定,并用电导仪测量电导率,获得氢氧化钠溶液加入体积与电导率之间的关系图(如图1所示),依据趋势分别做电导率随着加入的naoh体积的变化的三条斜率线,三条斜率线相交得到两个交点,两个交点对应的naoh体积从小到大分别为v1、v2,氨基含量可经下式计算得:
其中,cnaoh表示naoh的浓度,单位是mol/l;mnh2表示氨基的摩尔质量,单位是g/mol;w试样干重表示称取的氨基化糖原的质量,单位是g;v1、v2表示交点处的横坐标,即体积,单位是l。
利用坂口反应测定胍基糖原中胍基的含量:配制不同浓度的胍基乙酸标准溶液、14%氢氧化钠溶液以及显色液(40mg/mlα-萘酚,0.2mg/ml双乙酰,正丙醇作为溶剂)。取一定量的胍基糖原溶于去离子水。各取3ml不同浓度梯度的胍基乙酸溶液以及胍基糖原溶液加入0.5ml上述氢氧化钠溶液,1.5ml显色液以及1ml正丙醇,混合均匀后置于40℃水浴锅中水浴10min,自来水冷却后置于室温并避光。用紫外分光光度计在530nm波长处分别测各溶液的吸光度,绘制胍基乙酸浓度-吸光度的标准曲线(r2>0.999),然后测定胍基糖原溶液的吸光度,将胍基糖原的吸光度代入标准曲线得出其胍基含量。
滴定法测定氧化胍基糖原中醛基的含量:配制ph为4的盐酸羟胺溶液,用25ml盐酸羟胺溶液溶解适量氧化胍基糖原,在磁力搅拌器上室温反应2h。反应结束后,用经标定的0.1mnaoh溶液进行滴定,并用ph计实时监测溶液ph变化情况。至其ph恢复至4,记录所用的naoh溶液体积。醛基含量可经下式计算得:
其中,cnaoh表示naoh的浓度,单位是mol/l;mcho表示醛基的摩尔质量,单位是g/mol;w试样干重表示称取的氨基化糖原的质量,单位是g;v表示消耗的naoh的体积,单位是l。
粒子的带电情况通过电位仪测定,具体方法为:使用zen3600型马尔文粒径电位仪测定糖原,氨基化糖原,胍基糖原,氧化胍基糖原四种粒子的溶液带电情况。分别用去离子水溶解四种粒子配成1mg/ml,将溶液装于粒径杯中进行测定。
实施例1
氧化胍基糖原及其制备方法(氧化胍基糖原的合成路线示意图见图2):
(1)糖原的正电化:称取1g糖原于三颈烧瓶中用70ml无水二甲基亚砜溶解,待完全溶解后加入1gn,n-羰基二咪唑,在氮气保护下活化1小时,之后将1.54ml乙二胺溶于10ml二甲基亚砜,用注射器向反应中缓慢滴加,氮气保护下反应24小时,产物在3500da透析袋中透析48h,冻干后得氨基化糖原;
(2)在氨基化糖原上接枝胍基:称取537.5mg胍基乙酸,溶于50ml去离子水中,用1mol/l的盐酸或氢氧化钠调节ph为5.5,向溶液中加入1.32g碳二亚胺盐酸盐和792.5mgn-羟基琥珀酰亚胺,活化2小时后加入1g步骤(1)得到的氨基化糖原,并用1mol/l的盐酸或氢氧化钠调节溶液ph为7.5,反应16小时,产物在3500透析袋中透析48h,冻干后得胍基糖原;
(3)胍基糖原的氧化:称取1g胍基糖原,溶于50ml去离子水中,完全溶解后加入297.2mg高碘酸钠,避光反应1小时,反应结束时,加入790μl乙二醇终止反应,产物在3500透析袋中透析48h,冻干后得氧化胍基糖原。
对制备得到的氧化胍基糖原进行表征,分别将糖原、氨基化糖原、胍基糖原和氧化胍基糖原样品,溶于重水(d2o)中,利用核磁共振波谱仪检测其1h-nmr谱图,结果如图3所示,可见,在接枝了乙二胺之后,新的氨基化糖原的核磁图中出现了乙二胺亚甲基上的两处氢(2.9ppm和3.2ppm);在缀合了胍基乙酸之后,由于亚甲基周围化学环境变化,产物中原先的两个亚甲基峰变为一个为3.22ppm,另一个为3.46ppm。因为引入胍基,谱图中也增加了一个亚甲基峰3.54ppm;在最后的开环氧化形成了醛基,在8.5-8.8ppm处有特征峰。
采用电导滴定法对氨基化糖原中氨基的含量进行测定并计算,计算得到氨基化糖原的氨基含量为2.65%
采用坂口反应对胍基糖原中胍基的含量进行测定并计算,计算可得胍基糖原中胍基含量为7.20μg/mg。
采用滴定法对氧化胍基糖原中醛基的含量进行测定并计算,计算可得氧化胍基糖原中醛基含量为7.47%。
使用电位仪测定各粒子(1mg/ml)的带电情况,糖原、氨基化糖原、胍基糖原和氧化胍基糖原粒子的电位测定结果见图4,可见,原本糖原带负电,经过修饰后氨基化糖原、胍基糖原和氧化胍基糖原带有正电荷,可以和带有负电荷的羟基磷灰石产生静电作用。
使用透射电子显微镜观察氧化胍基糖原粒子的表观形态特征及粒径大小,并使用粒径仪测定氧化胍基糖原粒子的粒径大小及分布情况,其中值粒径约为120nm,且分布较为集中。
实施例2
一种基于胶原的天然高分子水凝胶的制备,包括以下步骤:
1)氧化胍基糖原的制备:同实施例1;
2)胶原溶液的制备:每1ml水中加入11.25mg胶原,37℃下搅拌均匀,得到胶原溶液;
3)掺杂纳米羟基磷灰石的氧化胍基糖原溶液的制备:每1ml水中加入37.5mg氧化胍基糖原,搅拌均匀,得到氧化胍基糖原溶液,再向其中加入0mg纳米羟基磷灰石,得到掺杂纳米羟基磷灰石(0mg)的氧化胍基糖原溶液;
4)水凝胶的制备:按体积计,取胶原溶液2份,掺杂纳米羟基磷灰石的氧化胍基糖原溶液1份,将掺杂纳米羟基磷灰石的氧化胍基糖原溶液在电动搅拌下(300rpm,下同)倒入胶原溶液,37℃下混合均匀,倒入模具。加入碳酸盐缓冲液滴加在混合溶液的表面,静置12h,从模具中取出后用4ml的0.05wt%的硼氢化钠溶液还原2h,水洗3次,紫外灯下照射2h杀菌,得到基于胶原的天然高分子水凝胶。
实施例3
一种基于胶原的天然高分子水凝胶的制备及其诱导mscs分化,包括以下步骤:
1)氧化胍基糖原的制备:同实施例1;
2)胶原溶液的制备:每1ml水中加入15mg胶原,37℃下搅拌均匀,得到胶原溶液;
3)掺杂纳米羟基磷灰石的氧化胍基糖原溶液的制备:每1ml水中加入50mg氧化胍基糖原,搅拌均匀,得到氧化胍基糖原溶液,再向其中加入0mg纳米羟基磷灰石,得到掺杂纳米羟基磷灰石(0mg)的氧化胍基糖原溶液;
4)水凝胶的制备按体积计,取胶原溶液2份,掺杂纳米羟基磷灰石的氧化胍基糖原溶液1份,将掺杂纳米羟基磷灰石的氧化胍基糖原溶液在电动搅拌下倒入胶原溶液,37℃下混合均匀,倒入模具。加入碳酸盐缓冲液滴加在混合溶液的表面,静置12h,从模具中取出后用4ml的0.05wt%的硼氢化钠溶液还原2h,水洗3次,紫外灯下照射2h杀菌,得到基于胶原的天然高分子水凝胶。
实施例4
一种基于胶原的天然高分子水凝胶的制备,包括以下步骤:
1)氧化胍基糖原的制备:同实施例1;
2)胶原溶液的制备:每1ml水中加入18.75mg胶原,37℃下搅拌均匀,得到胶原溶液;
3)掺杂纳米羟基磷灰石的氧化胍基糖原溶液的制备:每1ml水中加入62.5mg氧化胍基糖原,搅拌均匀,得到氧化胍基糖原溶液,再向其中加入0mg纳米羟基磷灰石,得到掺杂纳米羟基磷灰石(0mg)的氧化胍基糖原溶液;
4)水凝胶的制备按体积计,取胶原溶液2份,掺杂纳米羟基磷灰石的氧化胍基糖原溶液1份,将掺杂纳米羟基磷灰石的氧化胍基糖原溶液在电动搅拌下倒入胶原溶液,37℃下混合均匀,倒入模具。加入碳酸盐缓冲液滴加在混合溶液的表面,静置12h,取出后用4ml的0.05wt%的硼氢化钠溶液还原2h,水洗3次,紫外灯下照射2h杀菌,得到基于胶原的天然高分子水凝胶。
实施例5
一种基于胶原的天然高分子水凝胶的制备,包括以下步骤:
1)氧化胍基糖原的制备:同实施例1;
2)胶原溶液的制备:每1ml水中加入22.5mg胶原,37℃下搅拌均匀,得到胶原溶液;
3)掺杂纳米羟基磷灰石的氧化胍基糖原溶液的制备:每1ml水中加入75mg氧化胍基糖原,搅拌均匀,得到氧化胍基糖原溶液,再向其中加入0mg纳米羟基磷灰石,得到掺杂纳米羟基磷灰石(0mg)的氧化胍基糖原溶液;
4)水凝胶的制备:按体积计,取胶原溶液2份,掺杂纳米羟基磷灰石的氧化胍基糖原溶液1份,将掺杂纳米羟基磷灰石的氧化胍基糖原溶液在电动搅拌下倒入胶原溶液,37℃下混合均匀,倒入模具。加入碳酸盐缓冲液滴加在混合溶液的表面,静置12h,从模具中取出后用4ml的0.05wt%的硼氢化钠溶液还原2h,水洗3次,紫外灯下照射2h杀菌,得到基于胶原的天然高分子水凝胶。
实施例6
一种基于胶原的天然高分子水凝胶的制备及其诱导mscs分化,包括以下步骤:
1)氧化胍基糖原的制备:同实施例1;
2)胶原溶液的制备:每1ml水中加入11.25mg胶原,37℃下搅拌均匀,得到胶原溶液;
3)掺杂纳米羟基磷灰石的氧化胍基糖原溶液的制备:每1ml水中加入50mg氧化胍基糖原,搅拌均匀,得到氧化胍基糖原溶液,再向其中加入0mg纳米羟基磷灰石,得到掺杂纳米羟基磷灰石的氧化胍基糖原溶液;
4)水凝胶的制备:按体积计,取胶原溶液2份,掺杂纳米羟基磷灰石的氧化胍基糖原溶液1份,将掺杂纳米羟基磷灰石的氧化胍基糖原溶液在电动搅拌下倒入胶原溶液,37℃下混合均匀,倒入模具。加入碳酸盐缓冲液滴加在混合溶液的表面,静置12h,从模具中取出后用4ml的0.05wt%的硼氢化钠溶液还原2h,水洗3次,紫外灯下照射2h杀菌,得到基于胶原的天然高分子水凝胶。
实施例7
一种基于胶原的天然高分子水凝胶的制备及其诱导mscs分化,包括以下步骤:
1)氧化胍基糖原的制备:同实施例1;
2)胶原溶液的制备:每1ml水中加入18.75mg胶原,37℃下搅拌均匀,得到胶原溶液;
3)掺杂纳米羟基磷灰石的氧化胍基糖原溶液的制备:每1ml水中加入50mg氧化胍基糖原,搅拌均匀,得到氧化胍基糖原溶液,再向其中加入0mg纳米羟基磷灰石,得到掺杂纳米羟基磷灰石的氧化胍基糖原溶液;
4)水凝胶的制备:按体积计,取胶原溶液2份,掺杂纳米羟基磷灰石的氧化胍基糖原溶液1份,将掺杂纳米羟基磷灰石的氧化胍基糖原溶液在电动搅拌下倒入胶原溶液,37℃下混合均匀,倒入模具。加入碳酸盐缓冲液覆盖12h,取出后用4ml的0.05wt%的硼氢化钠溶液还原2h,水洗3次,紫外灯下照射2h杀菌,得到基于胶原的天然高分子水凝胶。
实施例8
一种基于胶原的天然高分子水凝胶的制备及其诱导mscs分化,包括以下步骤:
1)氧化胍基糖原的制备:同实施例1;
2)胶原溶液的制备:每1ml水中加入22.5mg胶原,37℃下搅拌均匀,得到胶原溶液;
3)掺杂纳米羟基磷灰石的氧化胍基糖原溶液的制备:每1ml水中加入50mg氧化胍基糖原,搅拌均匀,得到氧化胍基糖原溶液,再向其中加入0mg纳米羟基磷灰石,得到掺杂纳米羟基磷灰石的氧化胍基糖原溶液;
4)水凝胶的制备:按体积计,取胶原溶液2份,掺杂纳米羟基磷灰石的氧化胍基糖原溶液1份,将掺杂纳米羟基磷灰石的氧化胍基糖原溶液在电动搅拌下倒入胶原溶液,37℃下混合均匀,倒入模具。加入碳酸盐缓冲液滴加在混合溶液的表面,静置12h,从模具中取出后用4ml的0.05wt%的硼氢化钠溶液还原2h,水洗3次,紫外灯下照射2h杀菌,得到基于胶原的天然高分子水凝胶。
实施例9
一种基于胶原的天然高分子水凝胶的制备及其诱导mscs分化,包括以下步骤:
1)氧化胍基糖原的制备:同实施例1;
2)胶原溶液的制备:每1ml水中加入15mg胶原,37℃下搅拌均匀,得到胶原溶液;
3)掺杂纳米羟基磷灰石的氧化胍基糖原溶液的制备:每1ml水中加入50mg氧化胍基糖原,搅拌均匀,得到氧化胍基糖原溶液,再向其中加入5mg纳米羟基磷灰石,得到掺杂纳米羟基磷灰石的氧化胍基糖原溶液;
4)水凝胶的制备:按体积计,取胶原溶液2份,掺杂纳米羟基磷灰石的氧化胍基糖原溶液1份,将掺杂纳米羟基磷灰石的氧化胍基糖原溶液在电动搅拌下倒入胶原溶液,37℃下混合均匀,倒入模具。加入碳酸盐缓冲液滴加在混合溶液的表面,静置12h,从模具中取出后用4ml的0.05wt%的硼氢化钠溶液还原2h,水洗3次,紫外灯下照射2h杀菌,得到基于胶原的天然高分子水凝胶。
实施例10
一种基于胶原的天然高分子水凝胶的制备及其诱导mscs分化,包括以下步骤:
1)氧化胍基糖原的制备:同实施例1;
2)胶原溶液的制备:每1ml水中加入15mg胶原,37℃下搅拌均匀,得到胶原溶液;
3)掺杂纳米羟基磷灰石的氧化胍基糖原溶液的制备:每1ml水中加入50mg氧化胍基糖原,搅拌均匀,得到氧化胍基糖原溶液,再向其中加入10mg纳米羟基磷灰石,得到掺杂纳米羟基磷灰石的氧化胍基糖原溶液;
4)水凝胶的制备:按体积计,取胶原溶液2份,掺杂纳米羟基磷灰石的氧化胍基糖原溶液1份,将掺杂纳米羟基磷灰石的氧化胍基糖原溶液在电动搅拌下倒入胶原溶液,37℃下混合均匀,倒入模具。加入碳酸盐缓冲液滴加在混合溶液的表面,静置12h,从模具中取出后用4ml的0.05wt%的硼氢化钠溶液还原2h,水洗3次,紫外灯下照射2h杀菌,得到基于胶原的天然高分子水凝胶。
实施例11
一种基于胶原的天然高分子水凝胶的制备及其诱导mscs分化,包括以下步骤:
1)氧化胍基糖原的制备:同实施例1;
2)胶原溶液的制备:每1ml水中加入15mg胶原,37℃下搅拌均匀,得到胶原溶液;
3)掺杂纳米羟基磷灰石的氧化胍基糖原溶液的制备:每1ml水中加入50mg氧化胍基糖原,搅拌均匀,得到氧化胍基糖原溶液,再向其中加入25mg纳米羟基磷灰石,得到掺杂纳米羟基磷灰石的氧化胍基糖原溶液;
4)水凝胶的制备:按体积计,取胶原溶液2份,掺杂纳米羟基磷灰石的氧化胍基糖原溶液1份,将掺杂纳米羟基磷灰石的氧化胍基糖原溶液在电动搅拌下倒入胶原溶液,37℃下混合均匀,倒入模具。加入碳酸盐缓冲液滴加在混合溶液的表面,静置12h,从模具中取出后用4ml的0.05wt%的硼氢化钠溶液还原2h,水洗3次,紫外灯下照射2h杀菌,得到基于胶原的天然高分子水凝胶。
将氧化胍基糖原和纳米羟基磷灰石以不同比例(10:1、1:10)混合后,对得到的掺杂纳米羟基磷灰石的氧化胍基糖原溶液进行粒径测定,结果如图5所示(比例均为质量比),可见,浓度更高的氧化胍基糖原溶液能够让纳米羟基磷灰石之间更好地聚集。(由于此时浓度较低,周围聚集水化层导致氧化胍基糖原的粒径稍大于其真实尺寸。)
将氧化胍基糖原和纳米羟基磷灰石按照质量比10:1混合后(实施例9中步骤(3)获得的溶液,适当稀释后制备样品),利用透射电子显微镜观察其结构,结果如图6所示,可见氧化胍基糖原周围的确有羟基磷灰石聚集。
压缩实验:为了评估水凝胶的机械强度,制备直径10mm,厚度8mm左右的圆柱形凝胶样品,在万能机械试验机上以50n称重传感器以十字头速率0.2mm/min进行单轴压缩应力-应变试验。应力由σ=load/πr2确定,其中r是压缩前样品的半径。应变ε表示为相对于试样初始高度的高度变化。每次压缩至断裂或形变量达80%(未断裂样品)作为最终的应力值,计算出相应的压缩模量(压缩模量为压缩过程中线性区间的斜率)。
本发明的实施例2-11制备得到的基于胶原的天然高分子水凝胶的压缩模量如图7所示,可见,实施例2、3、6和7制备得到的水凝胶的压缩模量小于80kpa,位于基质硬度促进软骨分化的区间(~80kpa)。而实施例5、10和11制备得到的水凝胶的大于190kpa,位于基质硬度促进成骨分化的区间(~190kpa)。其余实施例制备得到的水凝胶的压缩模量则位于基质硬度促进软骨分化与成骨分化的区间之间。
对实施例9的制备得到的水凝胶进行循环压缩实验,每次压缩过程中的形变量为50%,结构如图8所示。可见,在多次对凝胶进行压缩实验之后,凝胶仍能保持之前的强度。说明该凝胶对外来压力具有一定的抵抗能力,能够维持较长的使用时间。
细胞毒性实验:采用mtt法测定实施例2~11中的基于胶原的天然高分子水凝胶对3t3成纤维细胞的细胞毒性。具体操作为:将各凝胶冷冻干燥,冻干后的凝胶紫外灭菌0.5h后以5mg/ml的浓度浸泡在细胞培养基中,浸提液用于培养细胞;取生长状态良好的3t3细胞,按3000/孔的密度铺于96孔板中,37℃,5%co2培养箱中培养24小时;细胞贴壁后加入100μl各种不同凝胶的浸提液,每种凝胶设置6个平行,且每块孔板设置一组空白对照。细胞继续培养24/72/108小时后,弃培养基,加入100μl0.5mg/ml的mtt,放入细胞培养箱中继续培养4小时终止培养。吸去孔板内上清,每孔加入100μl二甲基亚砜,静置15分钟,用酶标仪检测其在570nm处的吸收值。
细胞毒性(%)=凝胶组细胞吸光度/空白组细胞吸光度*100%。
实验结果:本发明的基于胶原的天然高分子水凝胶对3t3细胞的细胞毒性如图9所示。可见,本发明的基于胶原的天然高分子水凝胶对3t3成纤维细胞的生长有促进增殖的作用,且胶原含量越高的组,增殖效果越好。此外,纳米羟基磷灰石的加入也能够促进增殖。
mscs分化试验:采用碱性磷酸酶(alp)含量定量测定法测定实施例3、4、5、7、8、9、10、11中制备得到的基于胶原的天然高分子水凝胶上生长的间充质干细胞(mscs)中alp的含量,用来表示mscs向成骨细胞分化的情况。具体操作为,将各水凝胶铺在24孔板中,每种凝胶设置3个平行,紫外灭菌0.5小时后用磷酸盐缓冲液浸泡1小时;取生长状态良好的mscs细胞,按50000/孔的密度铺在24孔板中的水凝胶上,37℃,5%co2培养箱中培养7/14天后,弃培养基,用磷酸盐缓冲液冲洗两次后加入1%的曲拉通溶液裂解细胞半小时,然后用alp定量检测试剂盒检测其中alp含量,以酶标仪检测其在405nm处的吸收值作为单位,每孔平行3次。同时,该溶液中的总蛋白含量使用bca试剂盒测定,用酶标仪检测其在562nm处的吸收值,并通过蛋白标准品所做的标准曲线(r2>0.999)来计算出其中的总蛋白含量:
alp含量=od405/总蛋白含量。
实验结果:本发明的基于胶原的天然高分子水凝胶上生长的间充质干细胞中的碱性磷酸酶(alp)含量如图10所示。可见,本发明的基于胶原的天然高分子水凝胶对mscs向成骨细胞分化起到了促进的作用,且压缩模量越大的组,分化效果越明显。此外,纳米羟基磷灰石的增加也更加促进成骨分化。
对比例1
传统方法将胶原和纳米羟基磷灰石直接混合制备得到的人工骨材料,其缺点在于:状态单一,多为固体,生物相容性较差,在对骨缺损处进行填充时较为困难;在体内存在的时间较短,胶原很快就会被降解,而羟基磷灰石会沉降,不利于细胞在其上黏附生长。
对比例2
实施例1中步骤(2)中碳二亚胺盐酸盐和n-羟基琥珀酰亚胺需要大于1倍于胍基乙酸的物质的量的,若此过程中碳二亚胺盐酸盐和n-羟基琥珀酰亚胺小于1倍于胍基乙酸的物质的量,则最终结果中胍基的接枝率几乎为0,而且胍基糖原所带的正电荷也几乎不增加,不利于后续和纳米羟基磷灰石的作用。
对比例3
当采用常用的糖原来替代本发明的氧化胍基糖原时来制备水凝胶材料,制备方法同本发明实施例9;
一种基于胶原的天然高分子水凝胶的制备,包括以下步骤:
1)胶原溶液的制备:每1ml水中加入15mg胶原,37℃下搅拌均匀,得到胶原溶液;
2)3)掺杂纳米羟基磷灰石的糖原溶液的制备:每1ml水中加入50mg糖原,搅拌均匀,得到糖原溶液,再向其中加入5mg纳米羟基磷灰石,得到掺杂纳米羟基磷灰石的糖原溶液;
4)水凝胶的制备:按体积计,取胶原溶液2份,掺杂纳米羟基磷灰石的糖原溶液1份,将掺杂纳米羟基磷灰石的糖原溶液在电动搅拌下倒入胶原溶液,37℃下混合均匀,倒入模具。加入碳酸盐缓冲液滴加在混合溶液的表面,静置12h,从模具中取出后用0.05%的硼氢化钠溶液还原2h,水洗3次,紫外灯下照射2h杀菌,得到基于胶原的天然高分子水凝胶。
该水凝胶由于没有化学交联,虽然在室温下呈现凝胶态,但在37℃情况下无法保持凝胶形态,变为粘稠液体,无法支持后续试验。
制备得到的水凝胶材料,由于未经修饰的糖原带有负电荷,无法对同样带有负电荷的纳米羟基磷灰石产生静电引力,所以内部无法形成有序的交联,有机成分和无机成分仍然是分离开的。在体内无法稳定存在,胶原很快就会被降解,而羟基磷灰石会沉降,不利于细胞在其上黏附生长。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!