利用四角蛤蜊DMRT基因检测海洋中PBDEs的方法与流程
本发明涉及一种检测多溴联苯醚(pbdes)的方法,具体涉及一种利用四角蛤蜊dmrt基因检测海洋中pbdes的方法,属于海洋pbdes生物检测
技术领域:
。
背景技术:
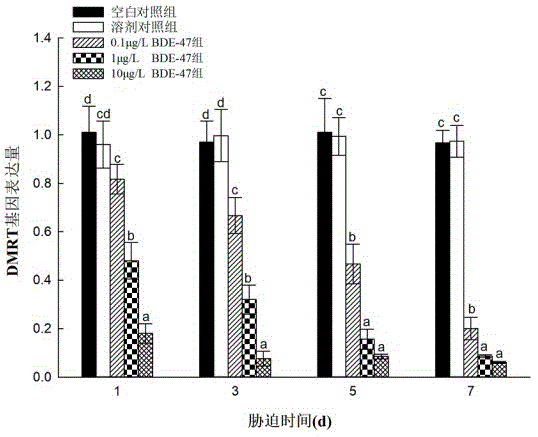
:多溴联苯醚(polybrominateddiphenylethers,pbdes)是一系列含溴原子的芳香族化合物。作为全球使用最广泛的溴代阻燃剂,pbdes在电子电器、纺织、橡胶、塑料、化工等领域得到了大量应用。pbdes能够通过生产、使用和产品的废弃而进入到环境中,通过大气沉降、地表径流等形式汇聚于海洋,累积于海洋沉积物和生物体中。pbdes污染遍布我国沿海,在渤海湾、辽东湾、莱州湾、胶州湾、厦门海域和珠江口海域,均检测到了pbdes污染,在溴代阻燃剂生产工厂分布密集的莱州湾,4-6cm海洋沉积物中pbdes浓度高达1800ng·g-1干重,贝类pbdes富集量为230-720ng/g脂肪,高于日本(6.2-49ng/g脂肪)、韩国(8.5-440ng/g脂肪)和菲律宾(69-140ng/g脂肪),是目前报道的全球海域中贝类富集量的最高水平。毒理学实验表明,pbdes对生物体具有内分泌干扰、免疫、发育、神经等多种毒性。目前,pbdes的检测需借助大型仪器,例如:气相色谱-质谱联用。为了获得较为准确的结果,还需要配备专业的操作人员、选用c同位素内标,检测步骤繁琐、成本高。在前处理过程中会使用大量有机试剂,测定过程中还要使用标准品,造成了环境的二次污染。另外,方法和仪器都具有检测限,低于检测限的浓度检测不出来。关键的是,检测出的数值不能反映pbdes对生物体的影响。众所周知,污染物对生物体的影响是从分子水平开始的,然后逐步在细胞、组织、器官、个体、种群、群落等水平上显现。生物标志物是环境变化的生物学指标,可在生物体受到严重损伤之前提供早期预警,是监测环境生物效应的有效手段。尤其是分子水平的生物标志物,较细胞、组织、器官、个体和群落水平可以提供更为早期的预警,以便进行环境调控,避免大规模损失。生物标志物监测在国际上应用广泛,是发达国家海洋环境管理策略(如欧盟海洋战略框架指令)的强制性指标。我国海洋生态环境的生物监测,主要是利用海洋生物群落多样性评估生态环境质量,而群落多样性对于生态环境的响应较分子水平的生物标志物滞后。贝类由于具有特殊的生活习性,并且分布广泛,是海洋环境污染的良好指示生物,也是毒理学研究的有力工具。贝类监测计划在世界范围内广泛开展。《中国海洋生态环境状况公报》通过检测贝类体内污染物的富集量来反映生态环境状况。目前,暂时还没有从环境导致的生物效应角度评估环境状况。贝类的生物监测多集中于附着型贝类——贻贝和牡蛎。然而在缺乏附着基的滩涂区域,贻贝和牡蛎的分布量非常小,并且贻贝和牡蛎不能对海洋沉积物的污染做出有效指示。滩涂是海洋环境中受人类活动影响最为严重的区域,我国滩涂面积广阔,随着滩涂生态与环境状况恶化,开发滩涂贝类用于环境检测和毒理学研究是十分必要的。四角蛤蜊(mactraveneriformis)是一种典型的滩涂贝类,广泛分布在我国、韩国和日本沿海,是我国主要的经济贝类之一。四角蛤蜊能够大量富集污染物,具有作为污染物指示物种的潜力,其埋栖生活的特性,对海洋沉积物和水质污染有较好的指示作用。dmrt(double-sexandmab-3relatatedtranscriptionfactor)基因是一类转录调控因子,在性别决定、性腺分化、组织和器官的发育形成和功能维持等发面发挥重要作用。技术实现要素:本发明的目的在于提供一种利用四角蛤蜊dmrt基因检测海洋中的pbdes的方法。为了实现上述目标,本发明采用如下的技术方案:利用四角蛤蜊dmrt基因检测海洋中pbdes的方法,其特征在于,包括以下步骤:步骤一:在待测海水或海洋沉积物的取样点取雄性四角蛤蜊成体,提取性腺rna,以该性腺rna为模板反转录合成cdna;步骤二:对于任意一个四角蛤蜊样品,对其dmrt基因和gapdh基因进行扩增,并绘制溶解曲线,dmrt基因和gapdh基因分别扩增时,加入等量的cdna模板;步骤三:通过检测sybrgreen在pcr反应过程中荧光信号的变化,得到每个pcr反应的ct值,然后以gapdh基因为内参,采用2−△△ct法对结果进行分析,计算出dmrt基因的相对表达量,dmrt基因的相对表达量与pbdes的浓度呈现显著负相关,测定dmrt基因的相对表达量就可以反映海水或海洋沉积物被pbdes污染的状况。前述的利用四角蛤蜊dmrt基因检测海洋中pbdes的方法,其特征在于,在步骤二中,按照如下反应体系进行扩增:cdna1μl、实时定量pcr反应混合液10μl、正向引物0.4μl、反向引物0.4μl、水8.2μl;其中,用于检测四角蛤蜊dmrt基因的引物的序列信息如下:正向引物df:gttctgctgcggacaggtat反向引物dr:taagacgcccatctcacg用于检测四角蛤蜊gapdh基因的引物的序列信息如下:正向引物gf:cgtattggtcgtcttgttgttag反向引物gr:ttagcagggtctttctcgttat。前述的利用四角蛤蜊dmrt基因检测海洋中pbdes的方法,其特征在于,在步骤二中,按照如下pcr条件进行扩增:95℃预变性5min,1个循环;95℃变性15s,60℃退火30s,40个循环。前述的利用四角蛤蜊dmrt基因检测海洋中pbdes的方法,其特征在于,在步骤二中,pcr扩增使用的试剂盒是sybrgreenqrt-pcr试剂盒。前述的利用四角蛤蜊dmrt基因检测海洋中pbdes的方法,其特征在于,在步骤二中,扩增结束后,对部分扩增产物进行琼脂糖凝胶电泳、测序以验证扩增的特异性和准确性。本发明的有益之处在于:(1)利用四角蛤蜊dmrt基因检测海洋中的pbdes,相比于目前的仪器化学方法,检出限更低,方法更加灵敏;(2)采用的监测生物——四角蛤蜊在我国沿海分布广泛,采样便利;(3)整个检测过程不使用有机试剂和污染物标准品,减少了对环境的污染,更为环保;(4)检测成本更低,检测时间更短,重复性好,可信度高;(5)对操作人员的专业性要求低,安全保障高;(6)测定的数据不仅能够反映海水和海洋沉积物被pbdes污染的状况,还能体现污染的生物学效应;(7)利用早期的分子水平的生物标志物,能够实现海洋环境pbdes污染的更早期预警,克服了传统的从群落水平进行海洋环境生物监测的滞后性。附图说明图1是实施例1中的四角蛤蜊dmrt基因表达量的计算结果;图2是实施例2中的四角蛤蜊dmrt基因表达量的计算结果;图3是实施例3中的四角蛤蜊dmrt基因表达量的计算结果。具体实施方式以下结合附图和具体实施例对本发明作具体的介绍。实施例11、驯养实验生物采用二龄雄性四角蛤蜊作为实验生物,在实验室玻璃大缸驯养14d,水温16±1℃,溶解氧7.7-8.3,ph7.9-8.1,盐度33。每天换水,换水前投喂新月菱形藻。2、进行胁迫实验将四角蛤蜊转移到15个玻璃小缸里开始试验,每个小缸盛装50l海水,放养100只四角蛤蜊。共设置5个实验组:(1)无污染天然海水对照组;(2)二甲基亚砜对照组;(3)0.1μg/l四溴联苯醚(bde-47)组;(4)1.0μg/l四溴联苯醚(bde-47)组;(5)10μg/l四溴联苯醚(bde-47)组。其中:第(1)组是空白对照组,只有无污染天然海水;第(2)组是溶剂对照组,二甲基亚砜用无污染天然海水稀释,二甲基亚砜终浓度为50μl/l;第(3)组、第(4)组和第(5)组是bde-47胁迫组,先将bde-47粉末溶于助溶剂二甲基亚砜中,然后再一起加入无污染天然海水中,最终将bde-47配制成0.1μg/l、1.0μg/l、10μg/l三个浓度,二甲基亚砜的终浓度均为50μl/l。每组设置3个平行。试验持续7d,每天均全部换水,并补加相应的污染物。在第1d、第3d、第5d和第7d剖取四角蛤蜊性腺。每个取样点每个实验组取3只四角蛤蜊为1个平行,共3个平行。3、测定dmrt基因相对表达量(1)提取各组性腺rna提取性腺rna的方法具体如下:1)剖取雄性四角蛤蜊性腺,放入液氮研磨,取研磨后的性腺40mg加入到1mlrna提取液trizol中;2)加入0.2ml氯仿,用力震荡15s,并于室温放置5min;3)12000g、4℃离心15min,离心后,混合物从上到下依次为无色的水相、中间相和淡红色的酚仿相,rna就存在于水相中;4)将水相移至离心管中,加入等体积异丙醇,-20℃放置15min;5)12000g、4℃离心15min,沉淀rna;6)加1ml75%的乙醇洗涤rna沉淀,12000g、4℃离心10min,弃上清,重复洗涤一次;7)rna沉淀干燥5-10min,加入30μlrnase-free水,4℃放置30min,充分溶解rna;8)将rna样品稀释100倍,在紫外分光光度计下测od260及od280,rna的a260/a280应介于1.8-2.2之间。rna浓度(μg/ml)=od260×稀释倍数×40μg/ml。用琼脂糖电泳检查rna的完整性,真核细胞核糖体rna的28s组分与18s组分的比率应为2:1。(2)反转录合成cdna1)dna酶消化rna5μldna酶1μlrna酶抑制剂0.5μl反转录缓冲液2μl无rna酶水调整总体积至11.5μl37℃温浴20min,然后向上述体系中加入反应终止液1.0μl,65℃灭活dna酶10min,之后再向体系中加入反转录引物2.0μl,70℃热变性5min,迅速冰浴2min。2)反转录在已完成变性反应的以上体系中加入:反转录缓冲液3.0μl无rna酶脱氧核糖核苷三磷酸1.25μl反转录酶1.0μlrna酶抑制剂0.5μl无rna酶水调整总体积至25μl稍离心,然后42℃反转录1h,之后95℃灭活反转录酶10min。(3)进行实时定量pcr实时定量pcr(quantitativerealtimepcr,qrt-pcr)是指在pcr反应体系中加入荧光基团,利用荧光信号积累,实时监测整个pcr进程。对于任意一个样品,加入等量的cdna模板,对其dmrt基因和甘油醛-3-磷酸脱氢酶基因(gapdh,内参基因)进行分别扩增。按照如下反应体系和反应条件,采用sybrgreenqrt-pcr试剂盒,在abiprism7500实时定量pcr仪上进行扩增,并绘制溶解曲线,对部分扩增产物进行琼脂糖凝胶电泳、测序以验证扩增的特异性和准确性。反应体系:cdna1μl实时定量pcr反应混合液10μl正向引物0.4μl反向引物0.4μl水8.2μl其中,我们设计的用于检测四角蛤蜊dmrt基因的实时定量pcr引物的序列信息如下:正向引物df:gttctgctgcggacaggtat反向引物dr:taagacgcccatctcacg我们设计的用于检测四角蛤蜊gapdh基因的实时定量pcr引物的序列信息如下:正向引物gf:cgtattggtcgtcttgttgttag反向引物gr:ttagcagggtctttctcgttatpcr条件:95℃预变性5min,1个循环;95℃变性15s,60℃退火30s,40个循环。(4)计算dmrt基因的相对表达量通过检测sybrgreen在pcr反应过程中荧光信号的变化,得到每个pcr反应的ct值,然后以gapdh基因为内参,采用2−△△ct法对结果进行分析,即可计算出dmrt基因的相对表达量。用单因素方差分析同一取样点不同浓度组之间的差异。在本实施例中,四角蛤蜊dmrt基因的相对表达量的计算结果见图1。由图1可知:bde-47能够降低雄性四角蛤蜊性腺dmrt基因表达量,在胁迫的第1d,与对照组(包括空白对照组和溶剂对照组)相比,各胁迫组dmrt基因表达量均显著下降,随着bde-47浓度的增加,dmrt基因表达量下降幅度增大,呈现剂量效应;随着bde-47胁迫时间延长,dmrt基因表达量逐渐减小,呈现时间效应。这说明:四角蛤蜊dmrt基因表达量可用于监控、检测海水pbdes污染程度。实施例21、驯养实验生物以二龄雄性四角蛤蜊作为实验生物,采用与实施例1完全相同的方法驯养二龄雄性四角蛤蜊。2、制备海洋沉积物在烟台潮间带采集洁净的没有pbdes污染的表层50mm沉积物,采集后30min内转移至实验室。搅拌沉积物,过0.5mm尼龙筛,收集粒径小于0.5mm的沉积物,然后再搅拌均匀实现均一化。3、沉积物加标pbdes用二甲基亚砜配制bde-47母液(100mg/0.1ml),加标沉积物,设置5个实验组:(1)空白对照(只有无污染的天然海水);(2)溶剂对照组(二甲基亚砜和沉积物按照体积重量比1:10000混合);(3)1mg/kg干重四溴联苯醚(bde-47)组;(4)10mg/kg干重四溴联苯醚(bde-47)组;(5)100mg/kg干重四溴联苯醚(bde-47)组。根据加标量计算每个处理组需要的bde-47母液量。按照bde-47溶液和沉积物体积重量比1:1进行混合,放置在玻璃缸内,在每个处理组需要的bde-47母液体积的基础上补加无污染天然海水到所需bde-47溶液体积。第(2)组至第(5)组,二甲基亚砜和沉积物体积重量比为1:10000。搅拌2h以达到均一,在16℃下储存30d,每隔3d搅拌1次,使bde-47在沉积物中分布均匀。4、用沉积物胁迫四角蛤蜊收集处理好的加标沉积物,分别加到测试玻璃缸(4l)内。按照上覆水与沉积物体积重量比1:4的比例,加入干净的海水至满。每个组设置3个重复,静置24h。将10只四角蛤蜊放入1个测试玻璃缸,上覆水以10ml/min的速率连续更新,每天投喂1次新月菱形藻,胁迫7d。在第1d、第3d、第5d、第7d取雄性四角蛤蜊性腺。5、测定dmrt基因的相对表达量采用与实施例1相同的方法测定dmrt基因的相对表达量。在本实施例中,四角蛤蜊dmrt基因的相对表达量的计算结果见图2。由图2可知:用被bde-47污染的沉积物胁迫四角蛤蜊时,bde-47能够抑制dmrt基因表达,dmrt基因表达量对bde-47响应敏感,在胁迫第1d,胁迫组dmrt基因表达量相比对照组即显著下降,随胁迫浓度的增加,dmrt基因表达量逐渐下降,dmrt基因表达量对bde-47表现出剂量效应;随胁迫时间的延长,dmrt基因表达量逐渐减小,dmrt基因表达量对bde-47表现出时间效应。这说明:四角蛤蜊的dmrt基因表达量可用于海洋沉积物pbdes污染的检测。通过上面的两个研究我们发现,四角蛤蜊dmrt基因对pbdes响应敏感,dmrt基因的表达量与pbdes的浓度呈现显著负相关,所以测定dmrt基因的表达量可以反映海水和海洋沉积物被pbdes污染的状况。基于此,我们发明了一种利用四角蛤蜊dmrt基因检测海洋中的pbdes的方法,该方法具体包括以下步骤:一、获取四角蛤蜊的cdna在待测海水或海洋沉积物的取样点取雄性四角蛤蜊成体,提取性腺rna,以该性腺rna为模板反转录合成cdna。1、提取性腺rna提取性腺rna的方法具体如下:1)剖取雄性四角蛤蜊性腺,放入液氮研磨,取研磨后的性腺40mg加入到1mltrizol中;2)加入0.2ml氯仿,用力震荡15s,并于室温放置5min;3)12000g、4℃离心15min,离心后,混合物从上到下依次为无色的水相、中间相和淡红色的酚仿相,rna就存在于水相中;4)将水相移至eppendorf管中,加入等体积异丙醇,-20℃放置15min;5)12000g、4℃离心15min,沉淀rna;6)加1ml75%的乙醇洗涤rna沉淀,12000g、4℃离心10min,弃上清,重复洗涤一次;7)rna沉淀干燥5-10min,加入30μlrnase-free水,4℃放置30min,充分溶解rna;8)将rna样品稀释100倍,在紫外分光光度计下测od260及od280,rna的a260/a280应介于1.8-2.2之间。rna浓度(μg/ml)=od260×稀释倍数×40μg/ml。用琼脂糖电泳检查rna的完整性,真核细胞核糖体rna的28s组分与18s组分的比率应为2:1。2、反转录合成cdna1)dna酶消化rna5μldna酶1μlrna酶抑制剂0.5μl反转录缓冲液2μl无rna酶水调整总体积至11.5μl37℃温浴20min,然后向上述体系中加入反应终止液1.0μl,65℃灭活dna酶10min,之后再向体系中加入反转录引物2.0μl,70℃热变性5min,迅速冰浴2min。2)反转录在已完成变性反应的以上体系中加入:反转录缓冲液3.0μl无rna酶脱氧核糖核苷三磷酸1.25μl反转录酶1.0μlrna酶抑制剂0.5μl无rna酶水调整总体积至25μl稍离心,然后42℃反转录1h,之后95℃灭活反转录酶10min。二、对四角蛤蜊的dmrt基因和gapdh基因进行扩增对于任意一个四角蛤蜊样品,对其dmrt基因和gapdh基因(内参基因)进行扩增,dmrt基因和gapdh基因分别扩增时,加入等量的cdna模板。按照如下反应体系和反应条件,采用sybrgreenqrt-pcr试剂盒,在abiprism7500实时定量pcr仪上进行扩增,并绘制溶解曲线,对部分扩增产物进行琼脂糖凝胶电泳、测序以验证扩增的特异性和准确性。反应体系:cdna1μl实时定量pcr反应混合液10μl正向引物0.4μl反向引物0.4μl水8.2μl其中,用于检测四角蛤蜊dmrt基因的实时定量pcr引物的序列信息如下:正向引物df:gttctgctgcggacaggtat反向引物dr:taagacgcccatctcacg用于检测四角蛤蜊gapdh基因的实时定量pcr引物的序列信息如下:正向引物gf:cgtattggtcgtcttgttgttag反向引物gr:ttagcagggtctttctcgttatpcr条件:95℃预变性5min,1个循环;95℃变性15s,60℃退火30s,40个循环。三、计算四角蛤蜊dmrt基因的相对表达量通过检测sybrgreen在pcr反应过程中荧光信号的变化,得到每个pcr反应的ct值,然后以gapdh基因为内参,采用2−△△ct法对结果进行分析,即可计算出dmrt基因的相对表达量。用单因素方差分析同一取样点不同浓度组之间的差异。实施例3为了验证本发明提供的检测海洋中的pbdes的方法的可行性和准确性,我们从莱州湾西部滩涂采集了四角蛤蜊、海水和海洋沉积物,用本发明提供的方法检测了海水和海洋沉积物中的pbdes,并与气相色谱-质谱联用测得的结果进行了比对。2018年5月,我们在莱州湾西岸滩涂设置了8个调查站位,这8个调查站位的经纬度见表1。表1莱州湾西岸调查站位经纬度站位编号经度纬度1119°17′6″37°40′2119°10′37°39′3119°0′37°38′4118°57′37°32′5118°58′37°22′6119°59′37°16′7119°4′37°15′8119°11′37°8′我们从这8个调查站位采集了雄性四角蛤蜊、海水和海洋沉积物,带回实验室,分析了雄性四角蛤蜊dmrt基因相对表达量,同时采用气相色谱-质谱联用测定了海水和海洋沉积物中pbdes的含量。其中,海水中pbdes的含量采用气相色谱-质谱联用测定的结果见表2,海洋沉积物中pbdes的含量采用气相色谱-质谱联用测定的结果见表3,雄性四角蛤蜊dmrt基因相对表达量的测定结果见图3。表2莱州湾西岸调查站位海水中pbdes的含量(pg/l)站位12345678bde-2838.530.353.232.534.173.49370.1bde-4734.244.263.135.453.94078.141.2bde-7127.924.835.831.145.731.244.528bde-10026.60033.635.336.432.330.4bde-13821.421.528.519.734.520.720.429.3bde-20660.248.753.937.364.345.858.948.8bde-20743.532.825.722.829.539.620.827.1bde-20828.42632.827.140.794.653.833.3总计132.1113.2121.6130.2159190.7134.4127.2表3莱州湾西岸调查站位海洋沉积物中pbdes的含量(ng/gdw)站位12345678bde-282.34.110.75.39.54.92.119.8bde-47106.298.9152.889.4200.3264.1198.9186.3bde-7110.912.73.67.234.127.431.84.6bde-10022.413.411.210.87.714.221.232.5bde-13817.521.945.123.512.610.76.413.2bde-20612.813.14.811.921.122.517.89.1bde-2075.94.21.35.75.38.612.61.7bde-20824.618.69.516.318.525.913.118.4总计963.7730.5801.4566.1967.21050.51011.4931.4随后,我们根据测定的雄性四角蛤蜊dmrt基因相对表达量以及海水和海洋沉积物中pbdes的含量,采用皮尔森相关性分析结果表明海水pbdes含量、海洋沉积物pbdes含量均与dmrt基因表达量呈现显著负相关,相关性系数分别为-0.946、-0.836。所以,测定dmrt基因的表达量可以反映海水和海洋沉积物被pbdes污染的状况,本发明提供的利用四角蛤蜊dmrt基因检测海洋中的pbdes的方法确实可行且有效。另外,本发明提供的利用四角蛤蜊dmrt基因检测海洋中的pbdes的方法,对于判断pbdes对生物体的毒性、构建我国基于生物标物的海洋环境评价体系具有重要意义,能够助力我国实现标准化的生物监测,有良好的推广应用前景。需要说明的是,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。序列表<110>鲁东大学<120>利用四角蛤蜊dmrt基因检测海洋中pbdes的方法<141>2019-10-29<160>4<170>siposequencelisting1.0<210>1<211>20<212>dna<213>artificialsequence<400>1gttctgctgcggacaggtat20<210>2<211>18<212>dna<213>artificialsequence<400>2taagacgcccatctcacg18<210>3<211>23<212>dna<213>artificialsequence<400>3cgtattggtcgtcttgttgttag23<210>4<211>22<212>dna<213>artificialsequence<400>4ttagcagggtctttctcgttat22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1