一种乏氧荧光探针及其应用
本发明属于生物分析检测领域,涉及一种乏氧荧光探针,特别涉及一种靶向线粒体的近红外的循环乏氧荧光探针及其应用。
背景技术:
肿瘤微血管网络中氧气扩散受限或短暂性血流不稳导致的乏氧,是实体肿瘤及肿瘤转移的一个典型特征。实时监测肿瘤乏氧对肿瘤的诊断、预后及治疗评估意义重大。据报道,乏氧对线粒体有双重作用,一方面会导致线粒体自噬,另一方面能促进线粒体生物合成,对维持细胞能量需求和氧化还原平衡有重要作用。人们为识别乏氧状态开发了多种检测方法,包括正电子发射断层成像,免疫染色,核磁共振以及光学成像。其中光学成像具有灵敏度高,时空分辨率高,无创成像的特点,更适合活体乏氧的原位实时成像。以多次乏氧-复氧循环为特点的循环乏氧近年来持续受到关注。循环乏氧上调乏氧诱导因子1(hif-1)促进厌氧代谢的活性,与慢性乏氧状态相比,更能促进肿瘤血管生成,形成耐药性,导致肿瘤转移。因此,急需发展可逆乏氧荧光探针以实时动态监测循环乏氧。
乏氧激活的荧光探针主要依靠探针在乏氧区域内的还原酶作用下被还原,从而产生一系列生物效应。还原酶包括硝基还原酶、醌还原酶和偶氮还原酶等。乏氧靶向基团的选择对实现探针良好的乏氧选择性非常重要。
目前,人们通过还原硝基、喹啉、氮氧化合物、偶氮设计出乏氧发光探针。例如硝基类乏氧靶向基团主要是一些硝基芳环或硝基杂环化合物,其作用机理如下:
硝基首先淬灭芳杂环体系的荧光,在缺氧条件下,经还原型辅酶和硝基还原酶共同作用,被还原转变为羟胺、亚硝基和氨基化合物等细胞毒性物质,致使淬灭失效,化合物恢复荧光,实现乏氧显像。然而目前基于以上特征基团所报道的探针几乎都是不可逆的,无法实时动态检测循环乏氧。(li,y.;sun,y.;li,j.;su,q.;yuan,w.;dai,y.;han,c.;wang,q.;feng,w.;li,f.ultrasensitivenear-infraredfluorescence-enhancedprobeforinvivonitroreductaseimaging.j.am.chem.soc.2015,137,6407-6416;luo,s.;zou,r.;wu,j.;landry,m.p.aprobeforthedetectionofhypoxiccancercells.acssens.2017,2,1139-1145;komatsu,h.;shindo,y.;oka,k.;hill,j.p.;ariga,k.ubiquinone-rhodol(uq-rh)forfluorescenceimagingofnad(p)hthroughintracellularactivation.angew.chem.int.ed.2014,53,3993-3995;knox,h.j.;hedhli,j.;kim,t.w.;khalili,k.;dobrucki,l.w.;chan,j.abioreduciblen-oxide-basedprobeforphotoacousticimagingofhypoxia.nat.commun.2017,8,1794-1802;tian,x.;li,z.;sun,y.;wang,p.;ma,h.near-infraredfluorescentprobesforhypoxiadetectionviajointregulatedenzymes:design,synthesis,andapplicationinlivingcellsandmice.analchem.2018,90,13759-13766;kiyose,k.;hanaoka,k.;oushiki,d.;nakamura,t.;kajimura,m.;suematsu,m.;yamane,t.;terai,t.;hirata,y.;nagano,t.hypoxia-sensitivefluorescentprobesforinvivoreal-timefluorescenceimagingofacuteischemia.j.am.chem.soc.2010,132,15846-15849.)。
人们利用生命体乏氧条件下偶氮还原酶对偶氮化合物的还原作用开发出乏氧探针(piao,w.;tsuda,s.;tanaka,y.;maeda,s.;liu,f.;takahashi,s.;kushida,y.;komatsu,t.;ueno,t.;terai,t.;nakazawa,t.;uchiyama,m.;morokuma,k.;nagano,t.;hanaoka,k.developmentofazo-basedfluorescentprobestodetectdifferentlevelsofhypoxia.angew.chem.int.ed.2013,52,13028-13032;kiyose,k.;hanaoka,k.;oushiki,d.;nakamura,t.;kajimura,m.;suematsu,m.;yamane,t.;terai,t.;hirata,y.;nagano,t.hypoxia-sensitivefluorescentprobesforinvivoreal-timefluorescenceimagingofacuteischemia.j.am.chem.soc.2010,132,15846-15849.)。受光照激发后分子围绕偶氮键进行超快速的构象变化,含偶氮苯的化合物一般没有荧光。偶氮还原酶的还原分多步进行,其作用机理如下:
其中第一步对氧气敏感且可逆,生成偶氮阴离子自由基或苯基肼中间体,它们通常不稳定,被继续还原成苯胺,样品荧光增强。然而这些偶氮类探针都是不可逆的乏氧探针。
技术实现要素:
针对现有技术的不足,本发明提供了一种能响应可逆乏氧的荧光探针及其应用。
本发明具体技术方案如下:
一种乏氧荧光探针,具有荧光团和乏氧识别基团,所述乏氧识别基团为1-5个吸电子基团取代的苯基偶氮。
优选的,所述吸电子基团选自三氟甲基、氟基、硝基、氰基、磺酸基、磺酸酯基、羧基、脂基、酰氨基、烷酰基中的一种或几种。
优选的,所述吸电子基团数量为2个,在苯基上呈间位取代。
本发明所述荧光团可以选择本领域常规使用的荧光团,如罗丹明类、香豆素类、氟硼吡咯类、荧光素类、萘酰亚胺类、吖啶类或菁染料类荧光基团。
本发明一个优选的方案,所述荧光团为菁染料类荧光团,进一步优选为川菁荧光团。川菁染料的脂溶性正电荷具有线粒体靶向性能,可以使乏氧荧光探针靶向线粒体,也可对现有的荧光团修饰上带有脂溶性正电荷的基团,以实现线粒体靶向。
更优选的,所述荧光团为氧杂蒽-川菁荧光团。
本发明一个具体的荧光探针化学结构式如式(ⅰ)所示(简称hdsf):
上述荧光探针,以杂合的氧杂蒽-川菁为荧光团,间二(三氟甲基)偶氮苯为乏氧识别基团,通过共轭连接,构筑靶向线粒体的近红外荧光探针,可以检测细胞及活体内循环乏氧。
本发明所述乏氧荧光探针可以与阴离子结合,所述阴离子选自cl-、br-,i-,no3-或pf4-。
本发明另一目的在于提供本发明所述的乏氧荧光探针在细胞器乏氧循环检测中的应用,进一步的,用于细胞/组织/活体乏氧成像、生物标记或传感领域。本发明所述的靶向线粒体的近红外循环乏氧荧光探针,对含10%氧气的乏氧能有效响应,响应时间为12min。
本发明所述应用包括细胞成像、生物标记和传感领域,进一步包括活体乏氧成像、3d细胞球乏氧成像、活细胞线粒体标记、活细胞线粒体内乏氧检测。
本发明的核心在于通过在偶氮苯基团上连接吸电子基团(一个具体的例子为两个三氟甲基),稳定偶氮还原反应第一步的中间体,使其在乏氧条件下不会被继续还原。由此,苯肼键被打断的不可逆还原过程被阻止,实现对乏氧的可逆响应,同时提高响应灵敏度,能指示氧气含量10%的乏氧,其机理如下:
本发明所述的循环乏氧荧光探针能有效靶向线粒体,pearson共定位系数0.92;能有效成像活细胞的乏氧-复氧循环和斑马鱼体内的乏氧-复氧循环。本发明所述的近红外荧光探针,能有效成像3d细胞球中的乏氧区域,成像深度185μm;能对小鼠肿瘤成像,且能分辨不同体积肿瘤内不同的乏氧程度。
有益效果
(1)本发明所述的循环乏氧荧光探针本身没有荧光,在溶液中呈现蓝色,乏氧条件下,nadph存在下,偶氮被肝微粒体中还原酶还原,705nm附近发出荧光,溶液变成绿色;溶液中氧气含量恢复正常后,荧光消失,溶液由绿色恢复成蓝色。
(2)本发明所述的循环乏氧荧光探针对乏氧识别具有选择性高、灵敏度高、响应速度快、能动态可逆响应的特点,在细胞、斑马鱼中实现循环乏氧成像;荧光发射波长位于近红外区域,能有效成像3d细胞球、小鼠肿瘤中的乏氧区域。该探针在生物学、医学中具有广阔的应用前景。
附图说明
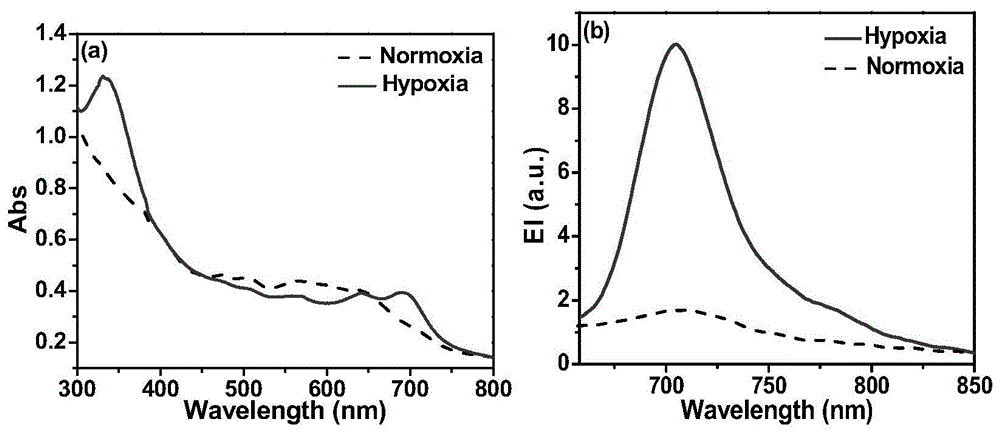
图1.为本发明所述乏氧荧光探针hdsf对乏氧响应的紫外和荧光光谱。
图2.为本发明所述乏氧荧光探针hdsf荧光强度随时间的变化图。
图3.为本发明所述乏氧荧光探针hdsf在常氧-乏氧循环下的荧光发射图(3a)和705nm下的荧光变化曲线(3b)。
图4.为乏氧荧光探针hdma在常氧-乏氧循环下的荧光发射图(4a)和709nm下的荧光变化曲线(4b)。
图5.为本发明所述乏氧荧光探针hdsf乏氧条件下电喷雾质谱图和高分辨质谱图。
图6.为本发明所述乏氧荧光探针hdsf乏氧条件下被还原后的epr图。
图7.为本发明所述乏氧荧光探针hdsf在乏氧或常氧状态下各物种存在时的荧光强度。
图8.为本发明所述乏氧荧光探针hdsf乏氧条件下mcf-7细胞荧光共聚焦成像假色图。(a)探针hdsf通道,633nm激发,640nm-750nm通道收集;(b)线粒体染料mito-trackergreen通道,488nm激发,492nm-630nm通道收集;(c)探针通道与mito-trackergreen通道叠加图;(d)白色箭头穿过区域内探针通道与mito-trackergreen通道荧光强度曲线;bar值:20μm。(e-l):探针hdsf(2μm,0.5%dmso,v/v)孵化的mcf-7细胞在循环乏氧-复氧状态(e-h)及始终常氧状态(i-l)下的共聚焦荧光成像图。633nm激发,640nm-750nm通道收集,bar值:20μm。
图9.不同乏氧程度下本发明所述乏氧荧光探针hdsf(2μm,0.5%dmso,v/v)孵化的mcf-7细胞荧光共聚焦成像假色图。(a)氧气含量0.1%;(b)氧气含量5%;(c)氧气含量10%;(d)氧气含量21%;(e)a-d图中各氧气浓度下细胞内平均荧光强度柱状图,n=3。
图10.本发明所述乏氧荧光探针hdsf对斑马鱼中乏氧-复氧循环的荧光共聚焦成像图。633nm激发,640nm-750nm通道收集。
图11.本发明所述乏氧荧光探针hdsf孵化的mcf-7细胞球荧光共聚焦图(a);沿z轴扫描,每间隔8.1μm成像一次(b);沿z轴扫描图像的叠加图(c)。633nm激发,640nm-750nm通道收集,bar值:200μm。
图12.本发明所述乏氧荧光探针hdsf对小鼠肿瘤的活体成像。(a)在小鼠皮下和肿瘤中分别注射等量探针hdsf溶液,0-35min内每间隔5min成像一次;(b)在不同体积的肿瘤内注射等量探针hdsf溶液,0min和20min时分别成像;(c)a图中各时间点皮下注射和肿瘤部位平均荧光强度变化,n=3;(d)b图中0min和20min时不同体积肿瘤内平均荧光强度,n=3。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实例。
实施例1:化合物2的制备
由文献已知方法合成化合物2(f.kong,z.liang,d.luan,x.liu,k.xu,andb.tang,aglutathione(gsh)-responsivenear-infrared(nir)theranosticprodrugforcancertherapyandimaginganal.chem.2016,88,6450-6456.)。
化合物1的合成:间硝基苯酚(7.61mmol,1.059g)和nah(7.61mmol,0.304g)溶于无水dmf溶液中(80ml),室温在ar氛围中搅拌10min。ir780(3mmol,2g)溶于无水dmf(10ml),用注射器缓慢滴加进上述溶液,室温下避光反应24h,质谱跟踪反应。旋蒸脱溶剂,硅胶色谱柱提纯,展开剂:ch2cl2:ch3oh=50:1(含2‰tea),得到绿色固体1.4g,产率约60%。
化合物2的合成:sncl2·2h2o(36.411mmol,8.218g)置于三颈瓶内,抽真空通ar。化合物1(1.821mmol,1.4g)溶于甲醇(70ml),注射器加入上述溶液,再加入浓盐酸(13.5ml),升温到70℃回流22h,tcl跟踪反应。反应结束后减压旋蒸脱溶剂,粗产物溶于ch2cl2和水中,分液,水相以ch2cl2萃取三次,合并有机相,无水na2so4干燥,硅胶柱分离提纯,洗脱剂:ch2cl2:ch3oh=40:1,得到蓝色固体0.93g,产率约95%。
实施例2:hdma探针的制备(偶氮苯基上为给电子基团的探针)
由文献已知方法合成hdma探针(tian,x.,li,z.,sun,y.,wang,p.,ma,h.near-infraredfluorescentprobesforhypoxiadetectionviajointregulatedenzymes:design,synthesis,andapplicationinlivingcellsandmice.analchem.2018,90,13759-13766.)。化合物2(83.6μmol,45mg)溶于含2%(0.1ml,v/v)三氟乙酸(tfa)的乙腈/二氯甲烷(5ml,1:4,v/v)混合溶剂中,ar氛围中0℃搅拌,加入亚硝酸钠(162.7μmol,15mg),0℃搅拌15min,tcl检测原料点消失,加入氨基磺酸(sulfamicacid,155.24μmol,15mg),继续0℃搅拌5min。n,n-二甲基苯胺(538.9μmol,65.3mg)溶于乙腈溶液(1ml),分批缓慢加进上述溶液中,0℃反应1h,tcl检测。加入水(5ml)稀释,二氯甲烷萃取(10mlx3),收集有机相,无水硫酸钠干燥,旋蒸脱溶剂,硅胶柱提纯,展开剂:ch2cl2:ch3oh=40:1(v/v),得到蓝色固体20mg,产率约36%。
实施例3:hdsf探针的制备
3,5-二(三氟甲基)苯胺(11.15mmol,2.54g)溶于二氯甲烷(75ml)溶液中,快速搅拌。oxone(22.3mmol,13.712g)溶于二次水(112ml)溶液,滴加到上述二氯甲烷溶液中,室温下避光搅拌22h。分液,水相用二氯甲烷萃取(50mlx2),合并有机相,用0.1m的稀盐酸(50mlx2)和二次水(50mlx2)洗涤,无水硫酸钠干燥,减压旋蒸脱溶剂,得到绿色液体(3,5-二(三氟甲基)亚硝基苯),此产物不稳定,直接投入下一步使用。
化合物hd-nh2(0.7mmol,380mg)溶于冰醋酸(260ml),加入上述绿色产物,避光室温搅拌,tcl跟踪反应。过滤,除掉未反应的原料,旋蒸脱溶剂,加入适量二氯甲烷,除去不溶的黄色杂质,脱溶剂,硅胶柱提纯,洗脱剂:乙腈:水=50:1,得到蓝色固体(hdsf)56mg,产率约10%。
1hnmr(400mhz,cd3od,δ,ppm)8.83(d,j=15.2hz,1h),8.51(s,2h),8.19(s,1h),8.02-7.90(m,2h),7.74(d,j=7.1hz,1h),7.68(d,j=7.9hz,2h),7.61-7.50(m,2h),7.33(s,1h),6.73(d,j=15.3hz,1h),4.45(t,j=7.4hz,2h),2.84(t,j=6.1hz,2h),2.76(t,j=6.1hz,2h),1.99(q,j=7.4,7.0hz,4h),1.89(s,6h),1.10(t,j=7.4hz,3h).13cnmr(101mhz,cd3od,δ,ppm)181.04,160.53,154.49,154.38,147.75,144.14,142.73,134.61,134.29,134.29,133.93,133.60,131.43,130.83,130.44,129.60,129.51,127.08,125.88,125.61,124.28,123.99,123.17,122.65,116.90,114.90,110.33,107.93,52.77,48.23,30.57,28.04,25.00,22.63,21.46,11.56.hrms(positivemode,m/z):calcd.636.2444,found636.2478for[m]+.
实施例4:探针hdsf对乏氧响应的紫外和荧光光谱
鼠肝微粒体被广泛应用于药物代谢的评估,在乏氧响应型探针和乏氧控释的前药研究中也得到广泛应用。本发明中所用的鼠肝微粒体均来自bdgentest,来源于雄性sd鼠,货号452501。含探针hdsf(20μm)、鼠肝微粒体(250μg/ml)的pbs缓冲液(0.1m,ph7.4,2%dmso,v/v)中鼓氩气1h,加入nadph(100μm),37℃孵化15min后在乏氧/常氧条件下检测紫外和荧光光谱变化。乏氧条件:往溶液中鼓1h氩气泡;λex=650nm。结果如图1所示,结果显示,在鼠肝微粒体和nadph存在的pbs缓冲液中,常氧下探针hdsf几乎没有荧光,溶液呈蓝色;往溶液中鼓氩气使得溶液乏氧后,探针hdsf荧光显著增强,最大发射出现在705nm处,溶液呈绿色,见图3a。在紫外吸收图中,乏氧状态下探针吸收峰出现大幅度红移,在695nm处出现一个明显的新吸收峰。这是因为乏氧下偶氮基团被还原,与hd荧光团相连的n原子呈供电子的状态,hdsf分子内的ict过程恢复,荧光团吸收峰红移,同时荧光恢复。
实施例5:探针hdsf对乏氧的响应时间
含探针hdsf(20μm)、鼠肝微粒体(250μg/ml)的pbs缓冲液(0.1m,ph7.4,2%dmso,v/v)中鼓氩气1h,加入nadph(100μm),37℃孵化,在各时间点取样检测荧光光谱变化,荧光激发波长650nm。结果见图2。乏氧37℃孵化12min后荧光强度达到平衡,探针hdsf能快速响应乏氧。
实施例6:探针hdsf对溶液乏氧-复氧循环响应
含探针hdsf(20μm)、鼠肝微粒体(250μg/ml)、nadph(100μm)的pbs缓冲液(0.1m,ph7.4,2%dmso,v/v),检测荧光发射光谱;往上述溶液中鼓氩气1h,37℃孵化15min,检测荧光发射光谱变化;上述溶液置于空气中1h,扫描荧光发射光谱变化;加入鼠肝微粒体(250μg/ml)、nadph(100μm),鼓氩气1h,37℃孵化15min,检测荧光发射光谱变化。乏氧条件:往溶液中通氩气;常氧条件:敞开反应体系使之接触空气;λex=650nm。至此完成溶液常氧-乏氧-复氧-乏氧循环,其余类推,结果见图3。结果显示,常氧下探针hdsf几乎没有荧光,溶液呈蓝色;向溶液中鼓氩气使其乏氧后在705nm附近荧光显著增强,溶液变为绿色;溶液恢复常氧后荧光信号消失,溶液变回蓝色。此循环可重复多次。溶液颜色变化见图3a插入图。结果表明探针hdsf是可逆型乏氧荧光探针,能指示溶液循环乏氧。
实施例7:探针hdma对溶液乏氧-复氧循环响应
含探针hdma(20μm)、鼠肝微粒体(250μg/ml)、nadph(100μm)的pbs缓冲液(0.1m,ph7.4,2%dmso,v/v),检测荧光发射光谱;往上述溶液中鼓氩气1h,37℃孵化15min,检测荧光发射光谱变化;上述溶液置于空气中1h,扫描荧光发射光谱变化;加入鼠肝微粒体(250μg/ml)、nadph(100μm),鼓氩气1h,37℃孵化15min,检测荧光发射光谱变化。λex=650nm,结果见图4。结果显示,常氧下探针hdma几乎没有荧光,向溶液中鼓氩气使其乏氧后在709nm附近荧光显著增强;溶液恢复常氧后荧光信号基本不变;再次向溶液中鼓氩气并加入鼠肝微粒体和nadph,荧光信号出现微弱增强;溶液恢复常氧后荧光信号保持不变。结果表明探针hdma是不可逆型乏氧荧光探针,无法指示溶液循环乏氧。
实施例8:探针hdsf响应循环乏氧的机理研究
在手套箱中向含探针hdsf(20μm)、鼠肝微粒体(250μg/ml)、nadph(100μm)的pbs缓冲液(0.1m,ph7.4,2%dmso,v/v)中鼓氩气1h,37℃孵化15min,加入二氯甲烷萃取,有机相过膜。用高分辨质谱检测,结果见图5,仅在核质比为636附近出现信号,此为探针hdsf信号峰,没有新的信号峰出现。在手套箱中向含探针hdsf(1.5mm)、鼠肝微粒体(20mg/ml)、nadph(3mm)的pbs缓冲液(0.1m,ph7.4,10%dmf,v/v)中鼓氩气1h,37℃孵化15min,熔点管封管。电子顺磁共振法(epr)检测,结果见图6。
a图中,(—):hdsf还原后的epr谱;(—):hdsf空白的对照样品epr谱;b图中,(—):自由基捕获剂dmpo的epr谱;(—):37℃孵化1min时加入dmpo的溶液反应后epr谱;(…):37℃孵化15min时加入dmpo的溶液反应后epr谱。
epr测试结果表明,探针hdsf在乏氧条件下的还原产物不是自由基物种,综合以上现象,根据文献推测(hernandez,p.h.;gillette,j.r.;mazel,p.studiesonthemechanismofactionofmammalianhepaticazoreductase-i.biochem.pharmacol.1967,16,1859-1875.),其还原产物可能是苯肼衍生物。
实施例9:探针hdsf对乏氧响应的选择性
hdsf对乏氧响应的选择性测试在含hdsf(20μm)、鼠肝微粒体(250μg/ml)、nadph(100μm)的pbs缓冲液(0.1m,ph7.4,2%dmso,v/v)中进行,,37℃孵化2h后704nm处的荧光强度。金属离子na+,k+,ca2+,mg2+:2mm,其他金属离子50μm;活性氧、活性氮、活性硫物种、草酸、抗坏血酸(asc):100μm,λex=650nm。乏氧条件:往溶液中鼓1h氩气。结果见图7。所有活性氧、活性硫、活性氮物种及fe2+溶液都是现配的milliq水溶液。在常氧条件下探针溶液中加入各种金属离子(2mm的na+,k+,ca2+,mg2+,50μm的mn2+,fe3+,fe2+,co2+,ni2+,cu2+,zn2+)、活性氧物种(100μm的ocl-,h2o2)、活性氮物种(100μm的snp,no2-)以及还原性的含硫物种(100μm的hs-,hcy,gsh,cys)、草酸(oxalicacid,100μm)、抗坏血酸(ascorbicacid/asc,100μm)之后,37℃孵化2h,探针的荧光强度都没有明显变化。在还原性的fe2+、no供体snp、高浓度的hs-存在时,探针荧光强度出现小幅波动,但与乏氧条件下荧光强度大幅增强相比较微不足道,所以探针hdsf对乏氧状态的识别具有高选择性,不受生命体常见物种的干扰。
实施例10:探针hdsf靶向线粒体及对细胞循环乏氧的成像
mcf-7细胞选作研究模型,细胞的乏氧孵化:利用日本三菱株式会社生产的乏氧培养产气袋,把细胞培养小皿(开盖)、氧气含量指示剂放入乏氧产气袋一起密封,置于37℃培养箱孵化。为模拟正常生理条件下的还原环境,选择在乏氧条件下孵化2h左右,以控制还原酶的浓度和细胞内的乏氧程度。
线粒体靶向测试:hdsf(2μm,0.5%dmso,v/v,ph7.4)加入mcf-7细胞培养基中,敞口与纯二氧化碳产气袋一起放入封口袋密封,放入37℃培养箱孵化2小时,取出迅速加入mito-trackergreen(50nm),立即放回封口袋密封,37℃培养箱继续孵化1小时,pbs(20mm,ph7.4)洗三次后荧光共聚焦成像。hdsf的激发波长和发射波长位于近红外区,选用仪器上相近的633nm光源激发,640nm到750nm波段收集荧光信号。线粒体染料选用488nm激发的mito-trackergreen,492nm到630nm波段收集荧光信号,结果见图8a-d。探针hdsf通道和线粒体染料通道的荧光信号高度重合,经程序拟合得到两者的共定位系数(pearson’scorrelationcoefficient)为0.92,说明探针hdsf具有理想的线粒体靶向功能。
对细胞循环乏氧的响应:hdsf(2μm,0.5%dmso,v/v,ph7.4)孵化mcf-7细胞两盘,a盘敞口与纯二氧化碳产气袋一起放入封口袋密封,b盘对照组常氧,一起放入37℃,5%co2培养箱孵化2小时,分别用pbs(20mm,ph7.4)洗三次后荧光共聚焦显微镜成像;上述两盘细胞一起敞口置于常氧状态下2小时,荧光共聚焦显微镜成像;a盘细胞与纯二氧化碳产气袋一起放入封口袋密封,b盘细胞常氧放置,2小时后荧光共聚焦成像;a、b两盘细胞一起敞口置于常氧状态下2小时,荧光共聚焦显微镜成像,结果见图8e-l。a组细胞在乏氧条件下细胞内出现明显荧光信号,恢复常氧后荧光信号消失;荧光信号随乏氧-复氧循环出现增强-减弱的循环变化。b组细胞始终处于常氧条件下,细胞内荧光信号始终很微弱。这一现象与溶液中乏氧-复氧循环下荧光信号的变化相吻合,证实探针hdsf能可逆响应乏氧,是一例可逆型乏氧荧光探针。
实施例11:探针hdsf对不同氧气浓度梯度下的细胞的响应
hdsf(2μm,0.5%dmso,v/v,ph7.4)加入mcf-7细胞培养基中,敞口与不同氧气浓度的产气袋一起放入封口袋密封,放入37℃培养箱孵化2小时,pbs(20mm,ph7.4)洗三次后荧光共聚焦成像,结果见图9。在常氧条件下(21%),细胞内荧光信号微弱,在氧气浓度分别为0.1%,5%,10%的条件下,细胞内都出现明显荧光信号增强,表明探针hdsf能对多种乏氧程度响应,灵敏度高。
实施例12:探针hdsf对斑马鱼心脏的循环乏氧成像
实验用6天的斑马鱼由南京大学模式动物研究所的赵庆顺老师组友情提供,并在显微镜下完成斑马鱼脑部微注射探针hdsf(2μm,2nl)。注射后放于28℃的e3培养液中,18小时后进行荧光共聚焦成像。
斑马鱼循环乏氧模型:按照文献报道(c.j.jouk.w.spitzer,m.tristani-firouzi,blebbistatineffectivelyuncouplestheexcitation-contractionprocessinzebrafishembryonicheartcell.physiol.biochem.2010,25,419-424.),把鱼放到15mmbdm(1%dmso,v/v)心脏收缩解耦剂的灭菌水中,5-10分钟不活动后取出,放于载玻片上成像;成像结束把鱼放于纯灭菌水中,待其体内恢复常氧状态后,放于三卡因麻醉剂溶液中(0.042mg/ml),0.5-1分钟不活动后取出,放于载玻片上成像;上述步骤循环操作两次,以形成斑马鱼体内乏氧-复氧-乏氧-复氧循环。成像激发光波长为633nm,信号收集范围640nm-750nm,结果见图10。常氧条件下斑马鱼体内本身没有荧光信号(a),经过bdm孵化后(15mm,1%dmso,v/v,5-10min),体内出现乏氧,探针hdsf荧光信号迅速增强(b);移除bdm,斑马鱼内氧气含量逐渐恢复正常,探针荧光信号消失(c);再次以bdm孵化,斑马鱼体内重新乏氧,探针的荧光信号再次迅速增强(d);重新移除bdm,斑马鱼体内逐渐恢复氧气供应,荧光信号随之消失(e),当第三次用bdm孵化使斑马鱼体内乏氧后,荧光信号重新增强(f)。在斑马鱼经历三个乏氧-复氧循环时,其体内探针hdsf的荧光信号随之出现了循环性的增强-消失现象。这说明探针hdsf的荧光信号跟随活体中乏氧情况的变化而变化,能够对活体中的循环乏氧实时跟踪式成像,具有极大的应用前景。
实施例13:探针hdsf对3d细胞球内乏氧区域的成像
细胞球的培养采用液体覆盖法(liquidoverlaymethod):称取150mg琼脂糖,并加入20ml的pbs。将此悬浊液进行湿法灭菌1h,降温至90℃时趁热拿出,放入准备好的超净台内,在0.75%的琼脂糖溶液没有凝固前,迅速加入96孔板内,每孔40μl,最终形成一个中间低,四周高的凹面,但同时也不至于太高导致拍摄工作的不便。在上面的工作完成之后,将96孔板置于紫外灯下消毒2h。将处于对数生长期的状态较好的mcf-7细胞,经胰酶消化后以每孔4×103密度的细胞数接种,将其与37℃,5%co2恒温培养3-4天后长到直径700μm左右后可以进行后面的实验。
挑选直径达到700μm左右的细胞球,加入探针hdsf的浓储,使其浓度为2μm,37℃,5%co2培养箱孵化7小时后成像。633nm激发,640nm-750nm范围收集荧光信号,结果见图11。细胞球边缘处没有荧光,距离边缘100μm左右可见到清晰的荧光,说明细胞球内部存在乏氧区域,探针hdsf能够对乏氧部位成像。为了更清晰地了解探针荧光信号在细胞球内的分布情况,我们沿z轴对细胞球进行扫描,并对扫描图进行叠加拟合得到荧光信号的立体分布图(图10b),从图中可看到在细胞球内荧光信号呈球形分布,随着扫描深度的增加,到200μm后细胞球内的荧光已经非常微弱,说明此时达到hdsf探针荧光信号的最大渗透深度。这说明hdsf探针能够渗透进细胞球内,并对其中乏氧区域的细胞进行成像,hdsf探针具有对体内乏氧组织进行有效成像的能力。
实施例14:探针hdsf对活体肿瘤的成像
所有动物实验按照动物保护和使用委员会的指导方针进行。ncg荷mcf-7肿瘤小白鼠由南京大学模式动物研究所提供。实验之前剃除小鼠肿瘤部位的毛发,异氟烷作麻醉剂,perkinelmerivisluminakseriesiii活体成像仪检测,激发光源660nm,收集710nm波段的荧光信号。
小鼠肿瘤成像:探针hdsf溶液(20μm,50μl)经皮下(s.c.)或肿瘤内(i.t.)注射到小鼠测试部位,0-35min内每间隔5min收集一次荧光信号,结果见图12a,c。注射探针hdsf的皮下部位始终没有荧光信号,注射探针hdsf的肿瘤部位出现明显的荧光信号,且0-35min内荧光信号逐渐增强。这表明探针hdsf能成像活体小鼠肿瘤内的乏氧区域。
小鼠不同大小肿瘤成像:选择肿瘤尺寸分别为151mm3和383mm3的小鼠,探针hdsf溶液(20μm,50μl)经肿瘤内注射到小鼠测试部位,注射后分别在0min和20min对小鼠成像,比较荧光强度差异,结果见图12b,d。注射后两小鼠肿瘤部位都出现了明显的荧光信号,大肿瘤内的信号强于小肿瘤。20min后,两肿瘤内的信号都较0min时增强,且大肿瘤内的信号增强幅度大于小肿瘤。表明探针hdsf的荧光信号与肿瘤大小和肿瘤内的乏氧程度正相关。
- 还没有人留言评论。精彩留言会获得点赞!