人CD70抗原结合多肽的制作方法
本发明涉及人cd70抗原结合多肽,属于抗原结合多肽技术领域。
背景技术:
cd70分子,即肿瘤坏死因子受体超家族7因子(tnfsf7)。多肽链长193个a.a.,分子量21.1kd,是一种ⅱ型跨膜糖蛋白(尚未见可溶形式),c端155个氨基酸位于膜外。胞外的第一、三及第二、四个半胱氨酸之间形成二硫键,维持胞外部分的空间结构。通常其以同源三聚体形式存在于膜上。
在正常组织中,cd70的细胞表达谱较窄,主要表达于生发中心的b细胞(诱导分泌抗体)和局部淋巴组织的t细胞,在胸腺髓质上皮细胞中低水平表达。但其表达可被抗原诱导大量增加并随着免疫应答的减弱而减少,比如抗原诱导活化的t、b细胞中高表达cd70。同时其表达受到细胞因子的调控,如il1a、il12、tnfa、gm-csf可上调cd70表达,il4、il10下调cd70表达。另外在成熟的dcs中,在tlr信号通路的介导下cd70表达。这些现象正好表明cd70为初始t细胞完全活化所需的一种协同刺激分子,在调控免疫应答中发挥重要作用。其与配体cd27相互作用,不仅起着t细胞活化第二信号的作用,而且二者之间的互作还可以调节b、nk等免疫细胞的增殖和分化。
短暂表达于活化的t和b淋巴细胞及成熟dc细胞中的cd70,在病理状态下却高表达于多种肿瘤组织中。大量研究表明,cd70在淋巴瘤、肾癌、胶质细胞瘤、乳腺癌、血源性恶性肿瘤(如霍奇金淋巴瘤、多发性骨髓瘤、白血病等)等多种肿瘤组织中高水平表达。同时观察到cd27在这些组织中的表达与cd70同步上升或下降。可能二者作为配体/受体对,形成了反馈环,促进淋巴细胞的增殖与分化,反而起到介导疾病发生的作用。cd70与cd27互作后,cd27活化,traf2/5结合到其胞内段,进一步激活nf-kb和c-jun激酶信号通路,引起细胞增殖、生存和分化等。另外,亦有人认为cd70与cd27结合后也可能使cd27胞内段结合siva从而引起caspase介导的细胞凋亡。
鉴于以上现象,以cd70为靶点制备特异性抗体,开展肿瘤免疫治疗引起人们浓厚兴趣。目前针对cd70靶点,cart治疗、抗体药和抗体偶联药物三种应用方式均在开发中,进展最快的为强生与argen-x合作开发的库萨图珠单抗(cusatuzumab),目前已完成i期临床,结果显示库萨图珠单抗联合维达扎可显著降低aml患者骨髓中的白血病干细胞,证实该靶点的可靠性。
鉴于cd70/cd27分子对重要免疫调节功能,对cd70进行调控必然会引起一系列的t细胞、甚至b细胞及nk细胞等淋巴细胞的信号传递及生理反应,是一个很理想的免疫治疗靶点,合理应用有可能调动多种细胞免疫。同时以此为靶点,药物开发方向较多(cart治疗、抗体药和抗体偶联药物,甚至多特异性抗体等。)。
目前进行临床实验中的抗体类有cusatuzumab、vorsetuzumab及抗体偶联药物中的抗体部分均为进行了人源化的抗体,具有可变区、恒定区等抗体结构,可变区仍可细分为框架区和高变区,可见其仍然为传统的抗体,而非多肽。传统的抗体药,在开发过程中必须有抗体人源化环节,以通过抗体工程降低其在人体内的免疫源性。就目前的技术发展水平,抗体人源化仍然是一项有挑战工作,技术障碍不小,该工程风险高、费时、费力、费钱。
技术实现要素:
发明目的:针对现有技术存在的问题,本发明公开了一种人cd70抗原结合多肽。
技术方案:为了达到上述发明目的,本发明采用以下技术方案:
一种人cd70抗原结合肽,所述多肽为单链结构,并且包括氨基酸序列如seqidno.1所示的抗原结合部位。
作为本发明的一种实施方案,所述人cd70抗原结合肽包括信号肽和抗原结合部位,其氨基酸序列如seqidno.2所示。
或者,所述人cd70抗原结合肽包括信号肽、抗原结合部位和人源fc区域,其氨基酸序列如seqidno.3所示。
或者,所述人cd70抗原结合肽包括信号肽、抗原结合部位、柔性连接肽和人源fc区域,其氨基酸序列如seqidno.4所示。
所述的人cd70抗原结合肽的制备方法,是采用噬菌体展示肽库筛选的方法。具体的方法如下:
以商品化的重组人cd70his标签蛋白和噬菌体展示12肽库为起始材料。将cd70his标签蛋白包被在免疫管上,用12肽库与其孵育,洗去未结合/结合弱的噬菌体,将与cd70his标签蛋白结合的噬菌体洗脱下来。如此反复若干次,每次改变cd70his标签蛋白包被量和洗涤条件,逐次淘汰掉结合弱的噬菌体并尽可能保留更多的结合强的噬菌体。利用空斑形成实验,将获得的结合能力强的噬菌体单克隆化,利用单克隆培养上清进行elisa筛选,并对单克隆进行核酸序列测定。建立编码序列(本发明一种实施方案,将分泌型荧光素酶的信号肽、十二肽即抗原结合部位、人源igg2fc和his标签的编码序列连接),同框阅读,构建哺乳动物表达载体。转染cho-k1细胞,取上清进行流式细胞术检测。大量转染流式测定阳性的表达载体,利用ni-nta亲和层析柱从上清中纯化获得融合蛋白,并对其与cd70结合特性进行鉴定。
一种核酸分子,其含有编码所述的人cd70抗原结合肽的序列。
一种载体,其含有所述的核酸分子。
一种宿主细胞,其含有所述的核酸分子或所述的载体。
一种试剂盒,其包括所述的人cd70抗原结合肽。
所述的人cd70抗原结合多肽在制备试剂盒中的用途,所述试剂盒用于检测cd70在样品中的存在或其水平。
所述的人cd70抗原结合肽在制备抗癌或癌症检测或药物中的应用。
本发明以cd70为靶点,开发抗原结合多肽。抗原结合多肽与抗体一样,均为蛋白类物质,均具有抗原结合功能。因此,抗原结合多肽具有抗体相同的功能及药物开发方向。但其与抗体不同,是一类全新的靶点结合物,目前尚未有靶向cd70的抗原结合多肽研发的报道。本发明中的多肽为12肽,相比于抗体具有免疫原性极小、不存在免疫性的问题,避免了抗体人源化环节,并且易于穿过血管、可能的给药方式多样(口服、肌肉注射、血液注射)、易于保存运输等优点。同时本发明实施过程中采取了噬菌体展示肽库筛选的方法,将噬菌体展示肽库运用于cd70靶向物的开发,亦是本发明的创新。
技术效果:相对于现有技术,本发明成功制备了人源cd70抗原结合多肽(融合蛋白),该多肽特异性好,亲合力较高,并可结合细胞表面表达的人源cd70,该抗人cd70单克隆抗原结合多肽是肿瘤免疫治疗的潜在药物。
附图说明:
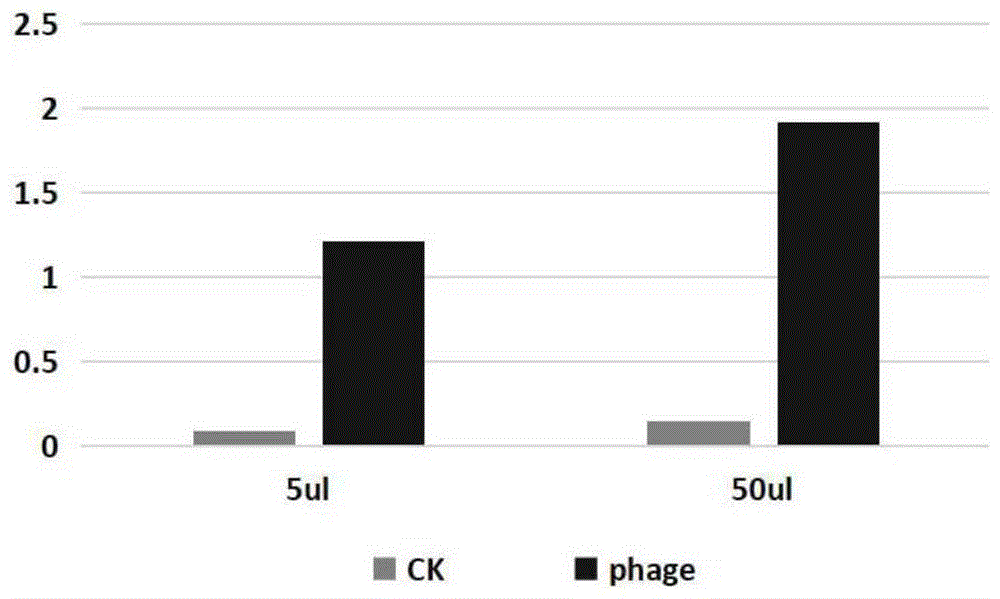
图1:phage粗培液与人源cd70结合elisa检测结果。在噬菌体淘选过程中,用含有phage病毒颗粒的lb培养基50ul和5ul两种加样量做重复验证。
图2:人源cd70抗原结合多肽融合蛋白过表达cho-k1细胞系转染中使用的载体结构示意图,mcs为多克隆位点,靶基因插入此位置。
图3:cho-k1超表达人源cd70抗原结合多肽融合蛋白sds-page检测。图中左、右侧泳道分别为为未转染和转染后的cho-k1细胞,加框处为表达的融合蛋白。
图4:人源cd70与抗原结合多肽融合蛋白结合流式检测结果。图中黑色、红色柱形图分别代表与cho-k1母细胞株、人源cd70过表达cho-k1细胞株结合信号。
图5:纯化的人源cd70抗原结合多肽融合蛋白效价elisa检测。将浓度梯度配置的纯化的融合蛋白与人源cd70结合,与hrp标记抗人fc抗体反应。
具体实施方式
下面结合具体实例,进一步阐明本发明。
实施例
(1)噬菌体展示肽库淘选
1)宿主菌er2738活化(购自neb):制备含20ug/ml四环素的无菌的lb平板(1g/100ml蛋白胨、0.5g/100ml酵母粉、0.5g/100mlnacl),划线法过夜培养er2738于37℃培养箱。
2)包被:按50ug/ml的浓度稀释人源cd70蛋白(购自acrobiosystem)于0.1mnahco3(ph8.6)中,取1.5ml加入到免疫管中,4℃包被过夜。包被液去干净后,用封闭液[0.1mnahco3(ph8.6),5mg/mlbsa]孵育1小时,结束后用tbst[50mmtris-cl(ph7.5),150mmnacl,0.1%tween-20]洗4次。
3)结合:取1011pfu噬菌体病毒颗粒(购自neb),加入到装有1.5mltbst的免疫管中,孵育1小时。包被液去干净后用tbst洗4次。
4)洗脱:用1ml洗脱液[0.2m甘氨酸-盐酸(ph2.2)]反复冲洗免疫管10分钟,加入0.15ml中和液[1mtris-cl(ph9.1)]混匀,暂时保存于4℃
5)测滴度:取2ul、0.2ul(原液用lb稀释10倍后取2ul)、0.02ul(原液用lb稀释100倍后取2ul)洗脱液,与0.2ml对数中期(od600=0.5)的er2738混匀,室温孵育5min,加入到42℃预热的3ml顶层琼脂中,混匀。快速加入到37℃预热的lb/iptg/xgal平板上,铺匀。37℃过夜培养,计数平板上的蓝色空斑数,根据稀释倍数计算滴度。
6)噬菌体扩增:按1:100的比例,接种过夜培养的er2738菌液于20mllb培养液中,同时加入800ul洗脱液,37℃下,250rpm振荡培养4.5小时。6000rpm离心10分钟,去除菌体,上清中加入1/5体积的2.5mnacl/20%peg8000,冰浴2小时。10000rpm离心10min得到噬菌体沉淀,将残液去除干净,加入0.2mltbs液重悬沉淀,如上文测滴度。
7)重复步骤2)-6)两次,第一次重复cd70蛋白的包被浓度调为30ug/ml,第二次重复调为15ug/ml,洗涤次数可增加,其余不变。
(2)单克隆elisa
1)0.5ug/ml人源cd70蛋白4℃过夜包被的酶标板,封闭液处理2h,并用pbs洗涤4次。
2)过夜振荡培养er2738菌,按1:100稀释。取第二次重复淘选后测滴度平板上的空斑,加入到稀释的菌液中,37℃下,250rpm振荡培养4.5小时,离心去除菌体。
3)取50ul或5ul上清,以tbst为介质,补足100ul,加入到酶标板中,孵育1小时,去除液体,pbs洗4次。
4)用含1%脱脂奶粉的pbs稀释hrp标记抗m13噬菌体抗体,取100ul加入到酶标板中,孵育1小时,去除液体,pbs洗4次。
5)加入100ultmb显色液,37℃孵育10min或至黄色充分显现,加入100ul1m硫酸终止反应,在酶标仪上读取od450。结果如图1所示,该单克隆elisa读值明显高于对照,结果为阳性,在elisa水平具有结合人源cd70蛋白的功能。
(3)人源cd70抗原结合多肽融合蛋白制备及流式检测
1)从接种单克隆空斑的er2738培养上清中提取噬菌体基因组dna,测序。
2)化学合成抗原结合多肽融合基因序列,即分泌型荧光素酶的信号肽、结合cd70的十二肽、柔性连接肽、人源igg2fc和his标签的编码序列连接,同框阅读,其核酸序列如seqidno.5所示,编码的融合抗体氨基酸序列如seqidno.6所示。
3)将以上核酸片段按序插入到真核表达载体ploe-puror的mcs区(图2),以合成n端为信号肽、中段为抗原结合十二肽、c端为fc和his标签的融合蛋白。
4)制备无菌无内素的质粒,按转染试剂要求,转染cho-k1细胞,收集上清。
5)sds-page检测抗体表达情况,如图3所示,成功表达出融合抗原结合多肽。
6)流式检测细胞结合能力
①野生型cho-k1细胞和超量表达人源cd70的cho-k1细胞用0.25%的胰酶充分消化,并用pbs轻轻吹打制备单细胞悬液。
②10mlpbs洗涤细胞1次,1000rpm离心5min,再用1mlpbs悬浮细胞,细胞计数。
③取2.5×105个细胞于1.5ml离心管中,离心收集细胞。
④加入200μl超量表达人源cd70抗原结合多肽融合蛋白的cho-k1细胞培养上清,混匀,室温孵育30min。
⑤离心收集细胞,用1mlpbs洗涤细胞1次。
⑥加入50μl20倍稀释的apc标记山羊抗人iggfc片段的二抗(2.5μl/2.5×105,可与人igg结合)混匀,室温下避光反应20min。
⑦用1mlpbs洗涤细胞1次,1000rpm离心8min,去除上清液。
⑧加入200μlpbs重悬成单细胞悬液,用流式细胞仪上机检测。如图4所示,相比不表达cd70的野生型cho-k1细胞株,高表达cd70的cho-k1细胞株信号明显增强,柱形图右移,该抗体可与细胞表面的cd70结合。
(4)cho-k1细胞制备人源cd70抗原结合多肽融合蛋白
1)大量制备流式检测阳性的质粒,转染三个t25瓶的cho-k1细胞。
2)转染后72小时,收集上清(共12ml),同时胰酶消化细胞,离心收集细胞。
3)细胞用5ml冷pbs悬浮。超声波功率设置最大功率的25%,工作2s,暂停6s,总时间3min。于冰浴中超声破碎细胞,结束后与细胞培养上清合并。加入cocktail蛋白酶抑制剂。
4)取ni-nta琼脂糖凝胶4ml,加入到纯化柱的筛选板,填装重力纯化柱。
5)用10ml20mmtris-hclbuffer(ph8.0)/500mmnacl平衡纯化柱。
6)低温下,将合并的溶液加到纯化柱上,控制流速3s/滴。
7)用10ml含30mm咪唑的20mmtris-hclbuffer(ph8.0)/500mmnacl溶液洗柱。
8)用4ml含300mm咪唑的20mmtris-hclbuffer(ph8.0)/500mmnacl溶液洗脱抗原结合肽融合蛋白。
9)加入到去离子水湿润的截留分子量10kd的超滤管中,,加冷pbs至10ml,4℃下3000rpm离心10分钟至液面处于v形超滤膜的上沿。吸去滤过液,内柱中再加入10ml冷pbs,离心至液面处于v形超滤膜的上沿。
10)吸出上内柱中液体,用0.4ml冷pbs冲洗超滤膜,合并液体共约1.5ml。
(5)纯化的人源cd70抗原结合多肽融合蛋白效价检测
1)bradford法融合蛋白浓度
使用bio-rad公司quickstarttmbradford1xdyereagent(货号:5000205)试剂盒进行测定,实验样品做2×、5×、10×、20×四个浓度进行检测。按试剂盒操作,结束后于595nm处读吸光值。
2)用100ul浓度为2ug/ml的人源cd70包被酶标板,包被条件为4℃过夜。
3)0.05%pbst洗板3次,用200ul2%脱脂奶粉室温封闭1小时,0.05%pbst洗板3次。
4)用含1%脱脂奶粉的pbs稀释纯化蛋白至1ng/ul、5ng/ul、25ng/ul、125ng/ul、625ng/ul,加入100ul稀释的纯化蛋白至酶标板,对照孔加含1%脱脂奶粉的pbs。
5)室温孵育2小时,期间晃动几次。去除液体,0.05%pbst洗涤3次。
6)加入hrp标记兔抗人iggfc片段的二抗,室温孵育1小时。去除液体,0.05%pbst洗涤3次。
7)加入100ultmb底物,37℃孵育10分钟左右至黄色充分显现。
8)加入100ul1m硫酸终止反应,在酶标仪上读取od450。结果如图5所示,纯化融合抗原结合多肽与抗原在体外的结合呈现典型的抗原抗体结合浓度依赖型曲线。
序列表
<110>浙江蓝盾药业有限公司
<120>人cd70抗原结合多肽
<160>6
<170>siposequencelisting1.0
<210>1
<211>12
<212>prt
<213>人工序列(artificialsequence)
<400>1
phelysglnaspalatrpglualavalaspilearg
1510
<210>2
<211>29
<212>prt
<213>人工序列(artificialsequence)
<400>2
metglyvallysvalleuphealaleuilecysilealavalalaglu
151015
serphelysglnaspalatrpglualavalaspilearg
2025
<210>3
<211>246
<212>prt
<213>人工序列(artificialsequence)
<400>3
metglyvallysvalleuphealaleuilecysilealavalalaglu
151015
serphelysglnaspalatrpglualavalaspileargproalapro
202530
provalalaglyproservalpheleupheproprolysprolysasp
354045
thrleumetileserargthrprogluvalthrcysvalvalvalasp
505560
valserhisgluaspprogluvalglnpheasntrptyrvalaspgly
65707580
valgluvalhisasnalalysthrlysproargglugluglnpheasn
859095
serthrpheargvalvalservalleuthrvalvalhisglnasptrp
100105110
leuasnglylysglutyrlyscyslysvalserasnlysglyleupro
115120125
alaproileglulysthrileserlysthrlysglyglnproargglu
130135140
proglnvaltyrthrleuproproserarggluglumetthrlysasn
145150155160
glnvalserleuthrcysleuvallysglyphetyrproseraspile
165170175
alavalglutrpgluserasnglyglnprogluasnasntyrlysthr
180185190
thrproprometleuaspseraspglyserphepheleutyrserlys
195200205
leuthrvalasplysserargtrpglnglnglyasnvalphesercys
210215220
servalmethisglualaleuhisasnhistyrthrglnlysserleu
225230235240
serleuserproglylys
245
<210>4
<211>261
<212>prt
<213>人工序列(artificialsequence)
<400>4
metglyvallysvalleuphealaleuilecysilealavalalaglu
151015
serphelysglnaspalatrpglualavalaspileargglyglygly
202530
glyserglyglyglyglyserglyglyglyglyserproalapropro
354045
valalaglyproservalpheleupheproprolysprolysaspthr
505560
leumetileserargthrprogluvalthrcysvalvalvalaspval
65707580
serhisgluaspprogluvalglnpheasntrptyrvalaspglyval
859095
gluvalhisasnalalysthrlysproargglugluglnpheasnser
100105110
thrpheargvalvalservalleuthrvalvalhisglnasptrpleu
115120125
asnglylysglutyrlyscyslysvalserasnlysglyleuproala
130135140
proileglulysthrileserlysthrlysglyglnproargglupro
145150155160
glnvaltyrthrleuproproserarggluglumetthrlysasngln
165170175
valserleuthrcysleuvallysglyphetyrproseraspileala
180185190
valglutrpgluserasnglyglnprogluasnasntyrlysthrthr
195200205
proprometleuaspseraspglyserphepheleutyrserlysleu
210215220
thrvalasplysserargtrpglnglnglyasnvalphesercysser
225230235240
valmethisglualaleuhisasnhistyrthrglnlysserleuser
245250255
leuserproglylys
260
<210>5
<211>804
<212>dna
<213>人工序列(artificialsequence)
<400>5
atgggagtcaaagttctgtttgccctgatctgcatcgctgtggccgagagctttaagcag60
gatgcgtgggaggctgttgatattcgtggtggaggcggttcaggcggaggtggctctggc120
ggtggcggatcgccagcaccacctgtggcaggaccgtcagtcttcctcttccccccaaaa180
cccaaggacaccctcatgatctcccggacccctgaggtcacgtgcgtggtggtggacgtg240
agccacgaagaccccgaggtccagttcaactggtacgtggacggcgtggaggtgcataat300
gccaagacaaagccacgggaggagcagttcaacagcacgttccgtgtggtcagcgtcctc360
accgttgtgcaccaggactggctgaacggcaaggagtacaagtgcaaggtctccaacaaa420
ggcctcccagcccccatcgagaaaaccatctccaaaaccaaagggcagccccgagaacca480
caggtgtacaccctgcccccatcccgggaggagatgaccaagaaccaggtcagcctgacc540
tgcctggtcaaaggcttctaccccagcgacatcgccgtggagtgggagagcaatgggcag600
ccggagaacaactacaagaccacacctcccatgctggactccgacggctccttcttcctc660
tacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctcc720
gtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggt780
aaacaccaccatcaccaccattga804
<210>6
<211>267
<212>prt
<213>人工序列(artificialsequence)
<400>6
metglyvallysvalleuphealaleuilecysilealavalalaglu
151015
serphelysglnaspalatrpglualavalaspileargglyglygly
202530
glyserglyglyglyglyserglyglyglyglyserproalapropro
354045
valalaglyproservalpheleupheproprolysprolysaspthr
505560
leumetileserargthrprogluvalthrcysvalvalvalaspval
65707580
serhisgluaspprogluvalglnpheasntrptyrvalaspglyval
859095
gluvalhisasnalalysthrlysproargglugluglnpheasnser
100105110
thrpheargvalvalservalleuthrvalvalhisglnasptrpleu
115120125
asnglylysglutyrlyscyslysvalserasnlysglyleuproala
130135140
proileglulysthrileserlysthrlysglyglnproargglupro
145150155160
glnvaltyrthrleuproproserarggluglumetthrlysasngln
165170175
valserleuthrcysleuvallysglyphetyrproseraspileala
180185190
valglutrpgluserasnglyglnprogluasnasntyrlysthrthr
195200205
proprometleuaspseraspglyserphepheleutyrserlysleu
210215220
thrvalasplysserargtrpglnglnglyasnvalphesercysser
225230235240
valmethisglualaleuhisasnhistyrthrglnlysserleuser
245250255
leuserproglylyshishishishishishis
260265
- 还没有人留言评论。精彩留言会获得点赞!