一种多杀性巴氏杆菌的检测方法及其引物和探针与流程
本发明属于分子生物学检测领域,具体涉及一种多杀性巴氏杆菌的检测方法及其引物和探针。
背景技术:
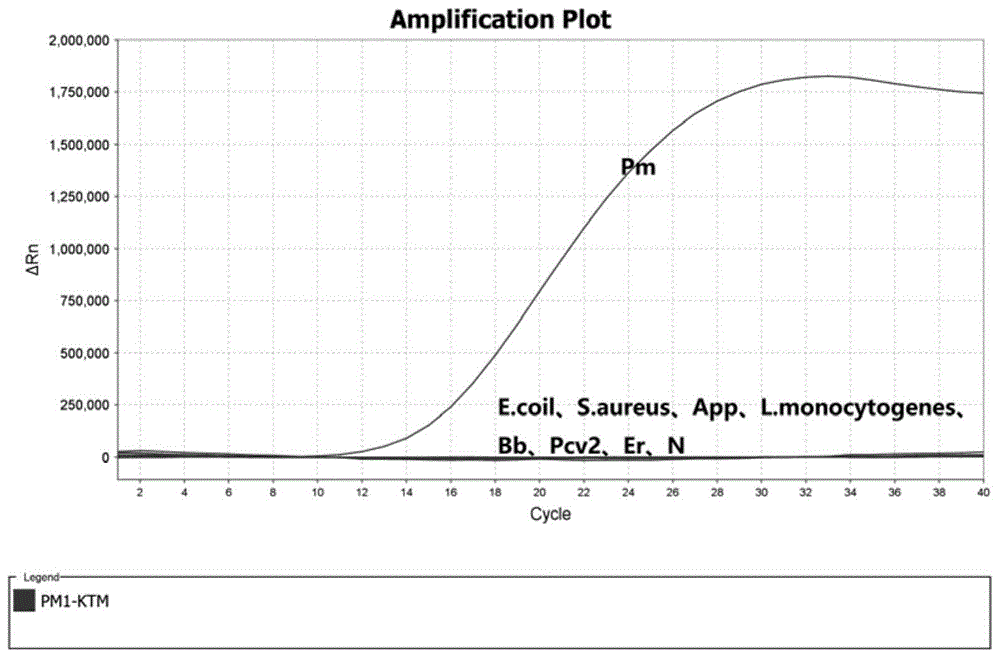
:猪肺疫(swinepasteurellosis)又称猪巴氏杆菌病,是猪感染多杀性巴氏杆菌(pasteurellamultocida)引起的一种急性热性传染病,一年四季均可发病,但多发于春初或秋末等气候骤变时期。猪肺疫在中国爆发具有小范围、高频次爆发的特点。感染多杀性巴氏杆菌的病猪死亡率较高,未死亡的也多转为慢性,是一种造成较大危害的疾病。《供港澳活猪检疫管理办法》中规定,供港澳活猪的检疫项目包括有猪瘟、猪丹毒、猪肺疫、猪水疱病、口蹄疫、狂犬病、日本脑炎和其他动物传染病、寄生虫病,目前对于口蹄疫和猪瘟已有较为完善的分子生物学检测方法,而对于猪肺疫仍沿用传统的检测方法,如细菌分离、免疫学试验等,费时费力,不适用于实际检测的需求,也不适用于大规模流行病学的调查。因此,建立一种简便、快速、准确的多杀性巴氏杆菌快速等温检测方法是十分有必要的。技术实现要素:本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一种检测多杀性巴氏杆菌的引物和探针,以及基于所述引物和探针的raa(重组酶介导核酸扩增)检测方法。本发明所述检测方法的特异性强、灵敏度高、稳定性好,还具有简便、快速的特点。一种检测多杀性巴氏杆菌的引物,所述引物的序列为:f-引物:5’-cgctctaccgttaatggcttcaataatggccataa-3’,r-引物:5’-ggacgttatttattactcagcttattgttatttgc-3’。一种检测多杀性巴氏杆菌的探针,所述探针的序列为:探针:5’-cataagaaacgtaactcaacatggaaatattgataatcagactgacaagga-3’;所述探针上标记有荧光基团、淬灭基团和thf,所述荧光基团与所述淬灭基团均标记在t碱基上,所述荧光基团与所述淬灭基团的间距为1~5nt;所述荧光基团与所述淬灭基团之间设有所述thf,所述thf距所述探针5’端≥30nt,所述thf距所述探针3’端≥15nt。其中所述thf为四氢呋喃,所述thf的数量为一个。本发明根据多杀性巴氏杆菌kmt基因的高度保守区域设计特异性引物和探针,设计了多组不同的引物和探针组合,并经过筛选和分析,从而确定上述引物和探针的检测效果最佳。优选的,所述荧光报告基团包括fam(羧基荧光素)、tet(四氯-6-羧基荧光素)、hex(六氯-6-甲基荧光素)、cy3(3h-吲哚菁)或joe(2,7-二甲基-4,5-二氯-6-羧基荧光素)。优选的,所述淬灭基团包括bhq1、bhq2、tamra、dabcyl、mgb或eclipse。优选的,所述探针的3’末端还标记有修饰基团。更优选的,所述修饰基因包括胺基、磷酸基团、生物素-teg、巯基或c3-spacer。所述修饰基团对探针3’末端起封闭和阻断作用,阻止探针3’末端发生进一步的延伸。一种用于检测多杀性巴氏杆菌的试剂盒,所述试剂盒包括上述的引物和探针。优选的,所述试剂盒还包括阳性标准品和阴性标准品。所述阳性标准品为插入多杀性巴氏杆菌的kmt基因序列的质粒,所述阴性标准品为超纯水或纯净水。其中超纯水由双蒸水经高温杀菌制得。一种非诊断目的的多杀性巴氏杆菌的检测方法,包括以下步骤:(1)提取样品dna;(2)以所述样品dna为模板,利用上述引物和探针进行实时荧光重组酶介导核酸扩增检测;(3)收集荧光信号,得出样品检测结果。本发明采用raa(重组酶介导的等温核酸扩增)技术结合上述的引物和探针进行多杀性巴氏杆菌的检测,样品检测结果可通过荧光分析仪进行读取。raa技术与rpa(重组酶聚合酶等温扩增)技术为类似的体外等温扩增技术,但raa技术是基于rpa技术的改良,其扩增时温度为37~42℃,属于更接近等温的体外等温扩增技术,因此具备一定的优势。优选的,所述样品dna的od260/280为1.8~2.0。由于raa技术对模板的要求较低,样品dna的提取可采用人工提取或试剂盒提取,具体提取方法不作限制。为保证检测的准确性,当所提取样品dna的od260/280不为1.8~2.0时,需重新提取样品dna。优选的,所述raa检测的反应体系中:f-引物的浓度为10μmol/l,r-引物的浓度为10μmol/l,探针的浓度10μmol/l。优选的,所述raa检测的反应体系中:f-引物的用量为2μl,r-引物的用量为2μl,探针的用量为0.6μl。优选的,所述raa检测的反应程序为:39℃40s,1个循环;39℃30s,30~40个循环。相对于现有技术,本发明的有益效果如下:(1)本发明通过采用实时荧光raa检测技术,可在恒温条件下完成实时荧光raa检测,降低了对设备的要求;(2)本发明所述检测方法的特异性强,灵敏度高;(3)本发明所述检测方法操作简便,且检测效率高,通常情况下仅需15~20分钟即可完成,实现了多杀性巴氏杆菌的快速检测,尤其适用于动物卫生监督、海关检疫部门或医院等场所。附图说明图1为实施例3中特异性试验的结果;图2为实施例4中灵敏度试验的结果;图3为实施例5中样品的检测结果;图4为实施例6中第1次稳定性试验的结果;图5为实施例6中第2次稳定性试验的结果。具体实施方式为了让本领域技术人员更加清楚明白本发明所述技术方案,现列举以下实施例进行说明。需要指出的是,以下实施例对本发明要求的保护范围不构成限制作用。实施例1根据genbank中公布的多杀性巴氏杆菌的kmt基因序列,使用分子生物学软件oligo7.0设计特异性引物和探针。其中引物的序列为:f-引物:5’-cgctctaccgttaatggcttcaataatggccataa-3’,r-引物:5’-ggacgttatttattactcagcttattgttatttgc-3’。其中探针的序列为:探针:5’-cataagaaacgtaactcaacatggaaatattga(fam-dt)a(thf)a(bhq1-dt)cagactgacaagga-c3spacer-3’;其中thf位点距探针5’端35个核苷酸,距探针3’端16个核苷酸;其中fam-dt表示标记有荧光基团fam的胸腺嘧啶脱氧核苷酸,bhq1-dt表示标记有淬灭基团bhq1的胸腺嘧啶脱氧核苷酸。其中荧光基团与淬灭基团的间距为3nt。上述引物和探针委托生工生物(上海)股份有限公司合成。实施例2一种非诊断目的的多杀性巴氏杆菌的检测方法,包括以下步骤:(1)提取样品dna;(2)以样品dna为模板,利用实施例1中的引物和探针进行实时荧光raa检测;(3)收集荧光信号,得出样品检测结果。采用dna提取试剂盒进行样品dna的提取,其中dna提取试剂盒为美国omega公司的e.z.n.a.tmtissuednakit产品。采用购自杭州众测生物科技有限公司的raa核酸扩增试剂(荧光型)进行实时荧光raa检测。raa检测的反应体系:上述buffer均来自杭州众测生物科技有限公司的raa核酸扩增试剂(荧光型)。raa检测的反应程序如表1所示:表1步骤温度时间循环数是否收集荧光预热39℃40s1否扩增39℃30s40是采用viia7realtimepcrsystem(厂家:美国appliedbiosystems公司)对荧光信号进行检测,根据扩增曲线直接读取检测结果。实施例3特异性试验采用实施例2中检测方法对以下材料进行检测,验证该检测方法的特异性。生物材料:猪肺疫ca株、猪丹毒gc42株、猪链球菌ii型灭活疫苗、大肠杆菌o157:h7株、金黄色葡萄球菌atcc25923株、猪传染性胸膜肺炎灭活疫苗iii型、单核细胞增生李斯特菌atcc株、猪源支气管败血波氏杆菌833株。其中猪肺疫ca株购买自山东华宏生物工程有限公司,猪丹毒gc42株和猪链球菌ii型灭活疫苗购买自广东永顺生物制药股份有限公司,大肠杆菌o157:h7株和金黄色葡萄球菌atcc25923株购买自广东环凯微生物科技有限公司,猪传染性胸膜肺炎灭活疫苗iii型购买自武汉科前动物生物制品有限责任公司,单核细胞增生李斯特菌atcc株购买自通派(上海)生物科技有限公司,猪源支气管败血波氏杆菌833株购买自西班牙海博莱生物大药厂。阴性对照组:纯净水。如图1所示,只有pm(猪肺疫ca株)随着循环数的增加,荧光信号得到明显增强,出现显著的扩增曲线;而ecoil(大肠埃希氏菌o157:h7株)、s.aureus(金黄色葡萄球菌atcc25923株)、app(传染性胸膜肺炎灭活疫苗iii型)、l.monocytogenes(单核细胞增生李斯特菌atcc株)、bb(猪源支气管败血波氏杆菌833株)、pcv2(猪链球菌ii型灭活疫苗)、er(猪丹毒gc42株)和n(阴性对照组)均未出现扩增曲线。由此可见,本发明所建立的检测方法具备良好的特异性。实施例4灵敏度试验委托上海旭冠生物科技有限公司合成克隆质粒,该克隆质粒中插入多杀性巴氏杆菌的kmt基因序列,得到大小为2962bp的质粒。取2μg该质粒用100μl的纯净水充分溶解,经换算,其初始拷贝数为2.55×1010。以10倍梯度对该质粒样品进行稀释,直至稀释为2.55×101,将不同稀释梯度的质粒样品作为灵敏度试验的阳性标准品。对经梯度稀释后的阳性标准品分别使用实施例2中检测方法进行检测,验证该检测方法的灵敏度。如图2所示,除101(拷贝数为2.55×101)和n(阴性对照组)没有检测到荧光信号的显著变化外,其余阳性标准品均出现明显的扩增曲线,循环数均在6-18之间,能检测到的最小拷贝数约2.55×102(对应图2中的102曲线)。由于当最低拷贝数约2.55×102时,此时的循环数仍不大于18。因此在一些情况下,为追求更高的检测效率,可对raa检测的反应程序进行调整,将扩增的循环数调整至30以下,使得检测时间小于15分钟。实施例5样品检测通过实施例2的检测方法对不同超市采购的猪样品进行检测,其中猪样品共25份:淋巴结、脾脏、肝脏、大小肠和肌肉组织各5份。取实施例4中稀释至拷贝数为2.55×105的阳性标准品为阳性对照组,取纯净水作为阴性对照组。如图3所示,除p(阳性对照组)出现明显的扩增曲线外,25份猪样品和n(阴性对照组)均未检测到荧光型号的变化,得出该25份猪样品均未受到多杀性巴氏杆菌的污染。为了验证此次检测的准确性,将该25份猪样品在实验室中经细菌分离培养、细菌生化鉴定及毒性试验,最终确认该25份样品中不含有多杀性巴氏杆菌。实施例6稳定性试验取实施例4中稀释至2.55×105的多杀性巴氏杆菌质粒的阳性标准品为模板,使用实施例2的检测方法进行两次稳定性试验,试验间隔为15天,单次试验重复数为16个。每次试验开展前使用紫外分光光度计测量阳性标准品的初始dna浓度,其中第1次为2.2ng/μl、第2次为2.1ng/μl,即两次试验的初始dna浓度基本相同。如图3-4所示,多杀性巴氏杆菌质粒在第1次和第2次稳定性试验中的检测结果保持一致,具有高度的相关性和重现性,证实本发明所建立的检测方法具有良好的稳定性。实施例7一种用于检测多杀性巴氏杆菌的试剂盒,包括实施例1中的引物和探针,实施例4中拷贝数为2.55×105的阳性标准品和阴性标准品(纯净水)。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种用于评估皮肤抗过敏情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤防御情况的引物和探针及试剂盒的制作方法
- 一种荧光定量PCR检测猪delta冠状病毒的引物、探针、试剂盒及方法
- 一种快速区分HP-PRRS疫苗GDr180株与野毒株的引物、探针及方法
- 一种用于检测样品中猪凸隆病毒的荧光rt-pcr引物和探针和试剂盒及检测方法
- 一种阿胶中驴、马、牛和猪源性巢式荧光pcr检测引物、探针、试剂盒、检测方法及应用
- 一种用于评估皮肤防晒情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤抗皱情况的引物和探针及试剂盒的制作方法
- 一种用于检测car-t转导效率的引物、探针和方法
- 用于微嵌合检测和个体识别的引物、探针、试剂盒及方法