作为生防菌的伯克氏菌的筛选方法及所用的分离培养基与流程
本发明涉及植物生物防治领域,具体涉及一种生防伯克氏菌的筛选方法。
背景技术:
伯克氏菌是一种被广泛用在农业上作为生物防治和促进植物生长的根际微生物,具有较强竞争力的根围定殖能力。伯克氏菌作为重要的植物杀菌剂和杀虫剂注册了很多商标,如“bluecircle”,“typewisconsin”,“deny”,“capton”。在我国也有注册,如“亚宝”。
生防菌伯克氏菌尚缺乏高效的筛选分离方法,常规的生防菌伯克氏菌的筛选过程繁琐,工作量大、时间长,获得拮抗多种病原真菌的有效伯克氏菌菌株的效率低下。
常规的生防菌伯克氏菌的筛选方法一般采用从土壤中稀释培养,以及从植物叶茎根内生细菌分离方法,都存在获得偶然性、菌株不确定性、拮抗能力未知性。首先,所采用的培养基均为细菌培养基,所采用的培养条件均适合多种细菌的生长,分离获得的大量菌落外形形态极为相似,需要进一步通过分子证据鉴定其确切物种;其次,所分离获得的细菌是否具备拮抗病原菌的能力,也还需要进一步的对峙实验来鉴定,工作量大,成效低。
技术实现要素:
本发明要解决的技术问题是针对生防菌伯克氏菌筛选繁琐且效率低下的难题,提供一种生防菌伯克氏菌简单、快速、高效的筛选方法。
为了解决上述技术问题,本发明提供一种伯克氏菌分离培养基,为以下任一:
一、含抗生素的mea培养基:
向(20±1)g麦芽粉、琼脂(20±1)g中加蒸馏水定容至1l,灭菌(为常规的高温灭菌,121℃下灭菌15min),调节ph至5.6±0.2,再加入硫酸链霉素30~50mg、盐酸四环素30~50mg,得含抗生素的mea培养基;
二、含抗生素的pda培养基:
向马铃薯泥(200±10)克、葡萄糖(20±1)克、琼脂15~20克中加蒸馏水定容至1l,灭菌(为常规的高温灭菌,121℃下灭菌15min),调节ph至5.6±0.2,再加入硫酸链霉素30~50mg、盐酸四环素30~50mg,得含抗生素的pda培养基;
三、含抗生素的martin培养基:
向kh2po41g、mgso4·7h2o0.5g、蛋白胨(5±0.5)g、葡萄糖(10±1)g、琼脂15-20g中加蒸馏水定容至1l,灭菌(为常规的高温灭菌,121℃下灭菌15min),调节ph至5.6±0.2,再加入硫酸链霉素30~50mg、盐酸四环素30~50mg,得含抗生素的martin培养基。
本发明还同时公开了利用上述伯克氏菌分离培养基进行的作为生防菌的伯克氏菌的筛选方法,包括以下步骤:
(1)植物根系材料准备:
取抗枯萎病或感枯萎病的植物根系(健康部分)进行冲洗和消毒,得消毒后根系材料;
说明:如果是感枯萎病植株,需取非腐烂且健康的根系;
判定植物是否为抗枯萎病或感枯萎病,可依据常规的植物感枯萎病症状的方法进行鉴定,当满足茎秆出现病斑、叶片萎蔫、根发生发生腐烂,经鉴定病原菌为尖孢镰刀菌等症状条件时判定成为感枯萎病植株,同样生境下,当不出现上述条件植株生长正常时判定成为感枯萎病植株;
(2)伯克氏菌的筛选培养:
将消毒后根系材料放置于伯克氏菌分离培养基中,(26±0.5)℃黑暗倒置培养3-5天;选择对培养过程中同时长出的真菌具有拮抗能力(明显拮抗能力)的细菌菌落;该细菌为生防伯克氏菌。
一般而言,细菌菌落的直径小于3mm,对靠近的病原真菌生长有显著抑制效果,形成明显的抑菌圈,判定成具有明显拮抗能力。
作为本发明伯克氏菌的筛选方法的改进:
所述步骤(1)中,将植物根系先剪成3-5mm长度的小段,然后再进行冲洗和消毒。
注:不能采取磨碎或其他处理方法。
作为本发明伯克氏菌的筛选方法的进一步改进:
所述步骤(1)为:将自来水反复冲洗后的植物根系小段进行消毒,所述消毒为:先采用75%(体积%)酒精消毒30min,接着用1%(体积%)次氯酸钠消毒3分钟;再90%(体积%)酒精消毒30秒,最后用无菌水漂洗(漂洗次数为5次以上)。
注:上述消毒方式能确保彻底消毒、但不破坏根段形态结构。
在本发明的发明过程中,对培养过程中同时长出的真菌具有拮抗能力(明显拮抗能力)的细菌菌落,进行后续的对多种植物病原真菌的抑制作用的测定,以及采用伯克氏菌16s引物进行pcr扩增,从而鉴定上述具有拮抗作用的细菌菌落,是否为伯克氏菌。
根据本发明方法筛选所得的细菌,经分子鉴定,如采用伯克氏菌16s引物进行pcr扩增,鉴定结果为:筛选所得的具有拮抗作用的细菌菌落,皆为伯克氏菌。
根据本发明方法筛选所得的细菌,对多种植物病原真菌的抑制作用测定,特别对油桐枯萎病,黄瓜枯萎病,禾谷镰刀菌,果生链盘菌等病原真菌有明显的抑制效果。
在本发明中,伯克氏菌分离培养基优先选用利用糖分含量较低的mea培养基制备而得的含抗生素的mea培养基;使用硫酸链霉素、盐酸四环素,能确保尽量减少其它细菌的污染;从而确保筛选所得的细菌为生防伯克氏菌。
本发明所设定的伯克氏菌分离培养基和所设定的培养条件,均不适合其他细菌生长,均只适合生防菌伯克氏菌生长,从而克服了常规技术中生防菌伯克氏菌分离获得的不确定性;本发明采用消毒后的根系材料,配合上述培养基配方和培养条件,可以分离作为细菌的内生伯克氏菌和作为真菌的土传病原菌,从而保证直接分离获得具有拮抗病土传病原菌的伯克氏菌,克服了常规生防菌菌分离方法的拮抗能力未知性。
与现有技术相比,本发明具有如下优点:
(1)本发明的对生防菌伯克氏菌的筛选方法取材容易、方法简单,克服了常规的生防菌伯克氏菌的筛选方法的获得偶然性、菌株不确定性、拮抗能力未知性的缺陷,具有获得伯克氏菌数量多、伯克氏菌菌株分离与拮抗能力同时完成的优势。
(2)经本发明筛选获得的生防菌伯克氏菌对多种植物病原菌有拮抗作用。
综上所述,本发明的方法取材要求低、处理方法简单、筛选效率高、特异性好,分离培养基简单、特异、高效,为拮抗菌伯克氏菌的筛选提供一种快速高效的途径。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细说明。
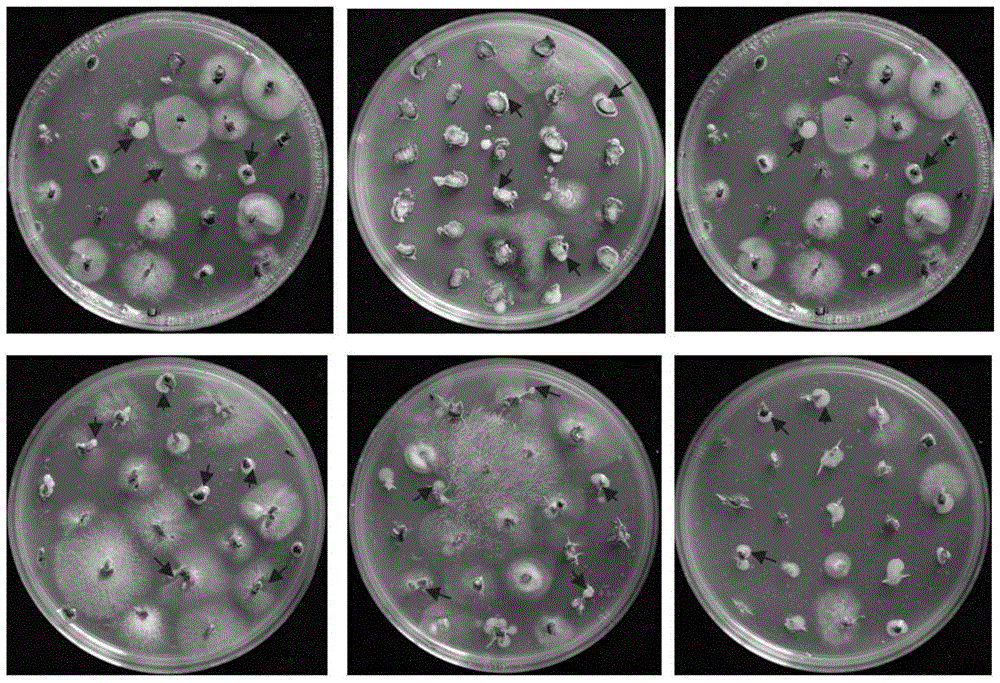
图1为生防菌伯克氏菌在抗、感枯萎病油桐根系的分离;
图1中的6个培养皿中的培养基均为含抗生素的mea培养基;箭头所指为分离获得的伯克氏菌。
图2为筛选所得的拮抗菌伯克氏菌的菌落形态图。
图3为拮抗菌伯克氏分子鉴定的结果;
a为伯克氏菌16s特异性引物扩增结果,1号泳道是marker2000,2-22号泳道是伯克氏菌16s核糖体rnapcr条带;
b为伯克氏菌的系统进化树;
即,利用16s特异性引物pcr扩增鉴定菌落为伯克氏菌burkholderiaarboris。
图4是实施例2中筛选分离的伯克氏菌对多种病原真菌的抑制效果。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
除非另有定义,下文中所使用的所有专业术语与本领域技术人员通常理解的含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
除有特别说明,本发明中用到的各种试剂、原料均为可以从市场上购买的商品或者可以通过公知的方法制得的产品。
实施例1、生防菌伯克氏菌的筛选方法,依次进行以下步骤:
1)、植物材料的准备
从贵州油桐枯萎病病发区采集9株抗枯萎病油桐(简称:抗病油桐)、9株感枯萎病油桐(简称:感病油桐),截取根部,取抗病油桐或感病油桐的健康根系作为材料,即,如果是感病油桐,需取非腐烂且健康的根系。
注:根据常规的植物枯萎病发生症状检测法,可轻易筛选获得抗枯萎病油桐、感枯萎病油桐;均可以从其分离出枯萎病病原真菌。
将每株油桐的根系先剪成3-5mm小段,用自来水反复冲洗后(直至根系上无任何附着物),进行消毒:75%酒精消毒30min,1%次氯酸钠消毒3分钟;90%酒精消毒30秒,无菌水漂洗5次以上;得消毒后根系材料。
每株油桐设置3个重复。
表1、用于根取材的油桐植株信息
2)、拮抗菌伯克氏菌的培养基制备:
拮抗菌伯克氏菌的培养基选用含抗生素的mea培养基:
向20g麦芽粉、20g琼脂中加蒸馏水定容至1l,高温灭菌(121℃下灭菌15min),调节ph至5.6,再加入硫酸链霉素30.0mg、盐酸四环素30.0mg,得含抗生素的mea培养基。
3)、伯克氏菌的筛选培养:
在培养皿中设置培养基,在培养基上放置消毒后根系材料,每个培养皿(直径约为9cm)中培养基的厚度约为5mm,每个培养皿中放置约15个消毒后根系材料(图1),培养条件为:26℃黑暗倒置培养5天。
选择对培养过程中同时长出的真菌(例如为枯萎病病原真菌)具有明显拮抗能力的细菌菌落,即,形成明显抑菌圈的细菌菌落,以此作为拮抗菌株。
4)、利用形态与分子鉴定法:依据伯克氏菌菌落特征(图2)且16s核糖体rnapcr扩增(图3a)测序;满足16s序列与伯克氏菌的同源性达到98%以上(图3b)的菌株判定为属于伯克氏菌。
具体如下:
将步骤3)所得的拮抗菌株,提取基因组dna,经伯克氏菌16s核糖体rnapcr扩增(图3a),引物f:tgtcctgtagtgggggatagc;引物r:ccgtcctccttgcggttaga。
pcr扩增体系为:25ul体系,包括酶:16srdna酶22.0ul(擎科supermix),引物f1.0ul,引物r1.0ul,模板1.0ul;
pcr扩增程序为温度:98℃预变性2min,98℃变性10s,59.5℃退火15s,72℃延伸20s,35循环,72℃延伸5min;
当pcr电泳结果在550bp左右出现特异性条带时,判定为伯克氏菌。
经测序鉴定为伯克氏菌属(图3a);进一步利用16s构建系统进化树(图3b),确定改菌株为burkholderiaarboris。
经上述形态与分子鉴定法,从抗病油桐根截断共分离41株伯克氏菌,感病油桐根分离55株伯克氏菌(表1)。
5)、分离的拮抗菌伯克氏菌的抑菌效果
将上述从油桐根分离获得的伯克氏菌进行对峙实验,对峙实验的设置方式为用打孔器在病原菌(油桐枯萎病病原菌尖孢镰刀菌,黄瓜枯萎病病原菌尖孢镰刀菌,小麦赤霉病病原菌禾谷镰刀菌,桃褐腐病果生链盘菌)培养皿边缘进行打孔,获得6mm直径的病原菌圆形菌块,再将其接种于pda培养基正中,同时将伯克氏菌划线接种于病原菌四周,置于28℃暗,黑暗培养。记录7天对峙条件下病原菌的生长直径和非对峙条件下病原菌的菌落直径。
结果发现:上述从油桐根分离获得的伯克氏菌均具有拮抗多种土传病原真菌的性能,且,菌株ba1对油桐枯萎病病原菌,黄瓜枯萎病病原菌,禾谷镰刀菌,果生链盘菌等多种病原真菌有明显的抑制效果(图4)。
该菌株ba1为burkholderiaarboris,保藏单位:中国微生物菌种保藏管理委员会普通微生物中心,保藏地址:北京市朝阳区北辰西路1号院3号,保藏编号:cgmccno:16905,保藏时间2018年12月07日。
对比例1-1、将实施例1步骤2)中的“含抗生素的mea培养基”改成“含抗生素的tsa细菌培养基”;
tsa细菌培养基的制备方法为:向胰胨15.0g、植物蛋白胨5.0g、氯化钠30.0g、琼脂15.0g中加蒸馏水定容至1.0l,高温灭菌(121℃下灭菌15min),调节ph至5.6,得tsa细菌培养基。
含抗生素添加方式等同于实施例1,其余等同于实施例1。
最终所得结果为:从油桐根(包括抗病油桐根、感病油桐根)分离获得2000株以上细菌菌落,随机挑选50株鉴定,未鉴定到伯克氏菌;因随机挑选,以此类推其余1950以上株存在伯克氏菌的几率小,且鉴定工作量极大,因此分离到伯克氏菌的效率和数量极低。
对比例1-2、将实施例1步骤2)中的“含抗生素的mea培养基”改成“含抗生素的1/10tsa细菌培养基”;
1/10tsa细菌培养基的制备方法为:向胰胨1.5g、植物蛋白胨0.5g、氯化钠3.0g、琼脂1.5g中加蒸馏水定容至1.0l,高温灭菌(121℃下灭菌15min),调节ph至5.6,得1/10tsa细菌培养基。
含抗生素添加方式等同于实施例1,其余等同于实施例1。
最终所得结果为:从油桐根(包括抗病油桐根、感病油桐根)获得500株以上细菌菌落,随机挑选100株鉴定,仅仅分离获得1株伯克氏菌;因随机挑选,以此类推其余400株存在伯克氏菌的几率小,且鉴定工作量极大,因此分离到伯克氏菌的效率和数量极低。
对比例2-1、将实施例1步骤2)中的“含抗生素的mea培养基”改成“含抗生素的martin培养基”;
含抗生素的martin培养基的制备方法为:向kh2po41g、mgso4·7h2o0.5g、蛋白胨5g、葡萄糖10g、琼脂20g中加蒸馏水定容至1l,灭菌(为常规的高温灭菌,121℃下灭菌15min),调节ph至5.6,再加入硫酸链霉素30.0mg、盐酸四环素30.0mg,得含抗生素的martin培养基。
其余等同于实施例1。
最终所得结果为:从抗病油桐根仅仅分离15株伯克氏菌,感病油桐根仅仅分离12株伯克氏菌。
对比例2-2、将实施例1步骤2)中的“含抗生素的mea培养基”改成“含抗生素的pda培养基”;
含抗生素的pda培养基的制备方法为:向马铃薯泥200克、葡萄糖20克、琼脂20克加蒸中馏水定容至1l,灭菌(为常规的高温灭菌,121℃下灭菌15min),调节ph至5.6,再加入硫酸链霉素30.0mg、盐酸四环素30.0mg,得含抗生素的pda培养基。
其余等同于实施例1。
最终所得结果为:从抗病油桐根仅仅分离32株伯克氏菌,感病油桐根仅仅分离26株伯克氏菌。
对比例3-1、仅仅将实施例1步骤1)植物根系的长度改成为1mm,其余等同于实施例1;最终所得结果为:真菌菌落过多,增加了伯克氏菌分离的难度,从抗病油桐根仅仅分离获得8株伯克氏菌,感病油桐根分离获得0株伯克氏菌。
对比例3-2、仅仅将实施例1步骤1)植物根系的长度改成为8mm,其余等同于实施例1;最终所得结果为:从抗病油桐根仅仅分离获得5株伯克氏菌,感病油桐根仅仅分离获得8株伯克氏菌。
对比例4、仅仅将实施例1步骤1)植物根系截断改成枝干茎截断,其余等同于实施例1;最终所得结果为:从抗病油桐根仅仅分离获得2株伯克氏菌,感病油桐根仅仅分离获得2株伯克氏菌。
上述实施例和对比例均进行了重复验证,所得结果的规律基本一致。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
序列表
<110>中国林业科学研究院亚热带林业研究所
<120>作为生防菌的伯克氏菌的筛选方法及所用的分离培养基
<160>2
<170>siposequencelisting1.0
<210>1
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>1
tgtcctgtagtgggggatagc21
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
ccgtcctccttgcggttaga20
- 还没有人留言评论。精彩留言会获得点赞!